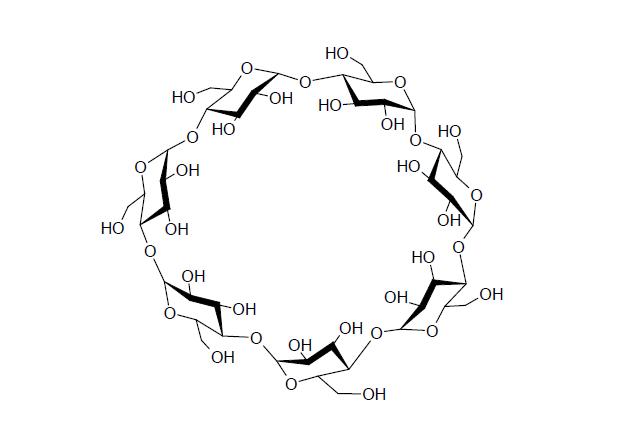
Plotki o alkoholu w proszku krążyły już od dawna, ale dopiero w ostatnich latach produkt tego typu pojawił się na międzynarodowym rynku. Czytający te doniesienia z pewnością zastanawiali się jakiej to nietypowej chemii musiano użyć, aby zatrzymać w sypkiej postaci tak lotny związek jak alkohol etylowy.
Związek jaki został tu użyty rzeczywiście jest ciekawy, ale równocześnie bardzo prosty - w zasadzie zwykła skrobia, tylko zawinięta w małe kółko...
Omawiałem już tu kiedyś nietypowe połączenia cząsteczek "połączonych acz nie powiązanych" gdzie geometria powodowała, że dwie osobne cząsteczki tworzyły nierozerwalny układ. Teraz zajmę się przypadkiem słabszego powiązania - związku inkluzyjnego, będącego formą kompleksów typu gość-gospodarz.
W połączeniu tego rodzaju cząsteczka większa, nazywana gospodarzem, tworzy "wnękę" której kształt i rozmiar pasują do mniejszej cząsteczki "gościa". Mniejsza cząsteczka wsuwa się w większą, zagłębia we wnękę a gdy już się tam dobrze umości oddziaływania między nią a cząsteczką gospodarza tworzą kompleks, w wielu przypadkach zaskakująco trwały. Wnęka gospodarza może też nie istnieć w związku samotnym, lecz powstaje wskutek przyjmowania odpowiedniej konformacji owijającej go wokół gościa. Brzmi to bardzo intymnie.
W przypadku inkluzji, cząsteczka gospodarza tworzy wnękę na tyle dużą, że goszcząca w niej molekuła jest niemal całkiem odizolowana od środowiska zewnętrznego. Powstałe połączenie często ma inne właściwości niż związki osobne - jeśli w normalnej sytuacji "gość" jest nierozpuszczalny w danym rozpuszczalniku, a "gospodarz" jest, to stworzony kompleks prawdopodobnie będzie się rozpuszczał.
Spośród różnych znanych układów, najbardziej popularnymi i najdłużej badanymi są cyklodekstryny. Są to fragmenty łańcucha skrobi, zamknięte w formę małych pierścieni, zawierających od 6 do ponad 30 członów glukozy połączonych wiązaniami glikozydowymi poprzez tlen.
Po raz pierwszy cyklodeksytryny opisano w 1891 roku jako substancję wytwarzaną przez bakterie z rodzaju Bacillus, gdy w latach 30. zorientowano się w ich pierścieniowej budowie, szybko zaczęto badać kompleksy tworzone z małymi cząsteczkami organicznymi. Po odkryciu, że bakterie Bacillus wytwarzają cyklodekstryny ze skrobi przy pomocy specjalnego enzymu cykloglukotransferazy, zaczęto produkować je na większą skalę, traktując skrobię lub dekstrynę tymże enzymem wyizolowanym z bakterii. Długie na kilkaset lub kilkadziesiąt członów - cząstek glukozy - łańcuchy skrobi są rozcinane na krótsze fragmenty i łączone w pierścienie. Zwykle izoluje się trzy najważniejsze frakcję - alfa składającą się z 6 glukoz, beta złożoną z 7 glukoz i gamma złożoną z ośmiu glukoz. Użycie enzymów z różnych gatunków bakterii pozwala na otrzymanie także większych pierścieni, do ok. 36 glukoz.
Cyklodekstryny przyjmują szczególną, nie płaską geometrię - płaszczyzny pierścieni glukozy budujących okrąg nachylają się ku sobie, przez co związek przyjmuje formę zbliżoną do ściętego stożka, lub też, jak to się często określa, do kubka z obciętym dnem. W takim układzie po stronie szerszego otworu zagęszczają się grupy hydroksylowe, przez co od tej strony cząsteczka jest hydrofilowa, natomiast po stronie otworu węższego, grupy hydroksylowe odginają się na zewnątrz, zaś okolice tego otworu i wnętrze nabierają charakteru hydrofobowego:
Dla zdolności kompleksowania ma to dość istotne znaczenie - cząsteczki organiczne na tyle małe aby zmieścić się we wnęce cyklodekstryny i mające właściwości hydrofobowe będą chętnie wnikać do środka. Duże cząsteczki hydrofilowe nie będą wnikały, ale mogą oddziaływać z zagęszczonymi grupami hydroksylowymi na obrzeżu. Cząsteczki mające fragmenty hydrofobowe i hydrofilowe będą częściowo wsuwać się a częściowo wystawać.
Alfa cyklodekstryna tworzy "kubek" o wysokości 0,78 nanometrów i średnicy wewnętrznej 0,57 nm; beta cyklodekstryna przy tej samej wysokości ma wnękę o średnicy 0,78 nm a gamma 0,95. Wielkości tych wnęk determinują rodzaj cząsteczek które mogą do nich wniknąć - zbyt duże się nie zmieszczą, zaś bardzo małe będą słabiej oddziaływały.
Jeśli chodzi o rodzaj sił wciągających cząsteczki do wnętrza cyklodekstryny, to oprócz sił van deer Walsa znaczenie ma tu też adsorbcja hydrofobowa. Cząsteczka hydrofobowa słabo oddziałuje z wodą i podobnymi do niej rozpuszczalnikami, efekty oddziaływań między cząsteczkami wody prowadzą do odpychania grupy hydrofobowej. W tej sytuacji cząsteczki hydrofobowe będą dążyły do utworzenia agregatów, zaś w naszym przypadku mała cząsteczka hydrofobowa będzie wpychana do mającego takie właściwości wnętrza cyklodekstryny.
Cząsteczki zawierające fragmenty z elektroujemnymi niemetalami mogą dodatkowo tworzyć wiązania wodorowe z grupami -OH na obrzeżu. Ponadto możliwe jest tworzenie kompleksów koordynacyjnych. Cyklodekstryny to jedne z nielicznych cząsteczek organicznych kompleksujących aniony. Gdy hydrofobowa cząsteczka jest dłuższa niż wynosi głębokość pierścienia, możliwe jest dołączenie drugiego. Tak powstały kompleks o stosunku 1:2 nazywa się molekularną kapsułką lub też niezupełnie poprawnie, mikrokapsułką.
Wykazano powstawanie kompleksów z bardzo dużą ilością cząsteczek organicznych i nieorganicznych, nieraz całkiem sporych, na przykład fullereny, i szybko zaczęto ten fakt wykorzystywać. Zamknięte w molekularnej kapsułce związki przechodzą do roztworu w wodzie oraz są w pewnym stopniu chronione przed zewnętrznymi wpływami, stąd chętne użycie cyklodekstryn jako nośnika substancji zapachowych i smakowych dodawanych do żywności. Sama cyklodekstryna ma na liście dodatków oznaczenie E459. Może być też używana do stabilizacji składników odżywczych i witamin, chroniąc je przed utlenieniem w żywności suchej. Udało się w ten sposób stworzyć rozpuszczalną formę kurkuminy, która w normalnych warunkach jest słabo rozpuszczalna.
Zastosowania medyczne
Jednym z ciekawszych przypadków takiego kompleksowania, który znalazł zastosowanie w medycynie, jest tworzenie połączeń z cholesterolem. Cząsteczka cholesterolu jest generalnie hydrofobowa i słabo rozpuszczalna w wodzie natomiast dobrze w tłuszczach. Jej rozmiar i kształt idealnie pasuje do alfa-cyklodekstryny. Po dodaniu cyklodekstryn do żywności duża część cholesterolu zostaje związana co utrudnia jego wchłanianie. W taki sposób produkuje się jedzenie niskocholesterolowe.
Obecnie testuje się pochodne cyklodekstryn jako lek na chorobę Niemanna-Picka typu C. Choroba ta, wywołana pewnymi mutacjami, powoduje zaburzenia w transporcie substancji do komórek, wywołując gromadzenie się cholesterolu w lizosomach i sfingolipidów w neuronach. Prowadzi to do zaburzeń czynności wątroby i trzustki, oraz objawów neurologicznych, w przypadku dzieci wywołujących niepełnosprawność i opóźnienie umysłowe, a w przypadku osób starszych szybko postępującą demencję, głuchotę, zaburzenia psychiczne, padaczki. Podobieństwo objawów powoduje, że czasem nazywa się ją "dziecięcym Alzheimerem".
W 2009 roku zezwolono na eksperymentalne użycie hydroksypropylowej pochodnej beta-cyklodekstryny do łagodzenia przebiegu choroby u sióstr bliźniaczek[1], gdyż usuwa cholesterol z lizosomów, co powinno ograniczyć postęp choroby. Potem zastosowano ją jeszcze u kilkunastu pacjentów ale nie ma jeszcze ostatecznych wniosków na ile jest to sposób skuteczny. Pewne niedawne badanie na kilku pacjentach sugeruje spowolnienie rozwoju choroby. [2] Substancja jest w takich zastosowaniu podawana w formie roztworu do płynu mózgowo-rdzeniowego.
Inny przykład to Sugammadeks, lek odwracający blokadę mięśniowo-nerwową u osób którym podano leki zwiotczające na przykład przy znieczuleniu ogólnym. Jest to cząsteczka gamma-cyklodekstryny zmodyfikowana przez dodanie grup sulfanylopropionowych. Rodzaj grup i ich długość dobrano tak, aby cząsteczka idealnie pasowała do środka zwiotczającego rokuronium. Początkowo miał to być nośnik leku ułatwiający rozpuszczanie w wodzie, ale po stwierdzeniu wyjątkowo dużej siły kompleksowania, zaczęto stosować zmodyfikowaną cyklodekstrynę do usuwania środka z ustroju. Po wstrzyknięciu do krwioobiegu, sugammadeks kompleksuje rokuronium, w związku z tym związek ten zaczyna być oddawany przez tkanki co znosi działanie zwiotczające.
A co z alkoholem?
Etanol jest małą cząsteczką organiczną z jednym końcem o pewnych właściwościach lipofilowych, i już dawno stwierdzono, że w odpowiednich warunkach możliwe jest stworzenie połączenia inkluzyjnego z cyklodeksytryną, które jednak rozpadało się pod wpływem wody. Pierwsze próby zastosowań spożywczych miały miejsce w latach 70. ale najwyraźniej nie były zbyt udane, dlatego dla przeciętnego konsumenta wynalazek zaistniał dopiero w ostatnich latach. Najczęściej spotykane użycie, to napoje typu "grzaniec" - te dostępne na polskim rynku zawierają enkapsulowany alkohol w ilości odpowiadającej stężeniu 0,5% w gotowym napoju (w zasadzie więc są to ilości dla aromatu).
W Europie dostępne są napoje w proszku o smaku szampana czy wina z dodatkiem alkoholu w ilości wystarczającej, aby się upić.
Proszek taki składa się z drobnych cząstek zawierających wewnątrz masę kompleksu cyklodekstryna-alkohol, otoczoną warstewką ochronną liniowych dekstryn, chroniących wnętrze przed parowaniem. Pył może zawierać do 30% alkoholu.
Cyklodekstryny spożyte doustnie nie wywołują szkodliwych skutków, są częściowo trawione tak samo jak zwykła skrobia. Ze względu na rozmiar cząsteczek nie są wchłaniane do organizmu. Testuje się je jako środek obniżający poziom cholesterolu, zażywany w dawkach kilkugramowych.[3]
---------
* https://en.wikipedia.org/wiki/Alcohol_powder
* https://en.wikipedia.org/wiki/Cyclodextrin
[1] http://addiandcassi.com/walgreens-support-twins-niemann-pick-type-receive-cyclodextrin-treatments-home/
[2] https://www.sciencedaily.com/releases/2017/08/170810192740.htm
[3] https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4941029/
poniedziałek, 23 października 2017
sobota, 14 października 2017
Chemiczne wieści (12.)
Zjonizowane białko najsilniejszym kwasem
Kwasami w ujęciu Brønsteda są substancje, które w reakcji z zasadą odszczepiają proton tworząc anion. Najbardziej znaną skalą określającą ich moc jest skala pH opierająca się o stężenie jonów hydroniowych, które powstają w wyniku reakcji kwasu z wodą. Im większe jest stężenie tych jonów, tym niższa jest cyfra określająca kwaśność roztworu (ujemna skala logarytmiczna). W szczególnych przypadkach dla bardzo silnych kwasów przyjmuje wartości ujemne.
Jak łatwo zauważyć po przeanalizowaniu definicji, skala ta w pewnych przypadkach staje się niewygodna czy wręcz niefizyczna. Trudno zastosować ją na przykład do ciekłych substancji pozbawionych wody jak na przykład 100% kwas siarkowy, bo brak w nich jonów hydroniowych. Jest też problematyczna w roztworach tak bardzo stężonych, że molowo jest w nich więcej kwasu niż wody. Dlatego do tych innych substancji stosuje się inne skale, oparte najczęściej o wartość pKa zależną od stężeń jonów, bądź o energię reakcji oderwania protonu. W ten sposób możemy porównywać kwasowość na przykład stałych, ciekłych i gazowych węglowodorów, stwierdzając, że acetylen jest kwaśniejszy od metanu i łatwiej będzie tworzył sole.
No i niedawno wykryto specyficzną substancję, dla której entalpia deprotonacji jest tak wysoka, że musi to być najsilniejszy kwas organiczny.
Cytochrom c to enzym stanowiący ważny element oddychania komórkowego, ma też udział w procesie apaptozy, dlatego jest intensywnie badany. Składa się on z białka złożonego ze 104 aminokwasów połączonych z cząsteczką hemu. Ostatnie odkrycie dotyczy jednak nie samego cytochromu lecz jego wersji silnie sprotonowanej. W odpowiednich warunkach można dodać cząsteczce dodatkowych atomów wodoru. Na przykład grupy aminowe białka mogą przyjąć wodór, zamieniając się w dodatnio naładowane grupy amoniowe. Tak nawodorowane cząsteczki będą też oczywiście chętnie oddawać nadmiarowe protony, aby przejść do stanu pierwotnego. Im mocniej uwodorniona jest cząsteczka, tym chętniej oddaje proton, to jest staje się coraz mocniejszym kwasem.
Zespół naukowców z Australii badał powstawanie jonów białkowych w spektrometrze mas. Roztwór białka został rozpylony w silnym polu elektrycznym wewnątrz komory. Ponieważ takie same ładunki odpychają się, małe kropelki rozdzielały się na jeszcze mniejsze, ż na koniec powstała chmura kropelek z pojedynczymi cząsteczkami białka. Ta technika nazywana elektrosprejem pozwala na otrzymanie widma mas całych cząsteczek.
Do roztworu dodano jednak pewien prekursor chętnie w takich warunkach oddający protony. W efekcie powstały cząsteczki uwodornione w ekstremalnym stopniu, zawierające nawet 30 dodatkowych wodorów i ładunek elektryczny 30+. Gdy otrzymamy już chmurę jonów, możemy próbować poddawać je reakcjom z różnymi związkami o znanej energii uwodornienia. Wykrycie kationów pochodnych od tych dodatkowych substancji, cięższych o jeden wodór, umożliwia wyznaczenie energii reakcji. W tym przypadku cząsteczka naładowana do 30+ oddawała proton z energią 130 kJ/mol. Jest to tak duża wartość, że zjonizowany cytochrom protonował azot, czy gazy szlachetne[1]
Najdłuższy acen
Aceny to węglowodory aromatyczne złożone z liniowo ułożonych sześciokątnych pierścieni, połączonych jednym bokiem. Najprostszy acen to naftalem złożony z dwóch pierścieni. Trzy zawiera antracen, cztery tetracen, pięć pentacen. Tych pierwszych kilka związków występuje naturalnie, i izolowano je głównie ze smoły pogazowej, niektóre znalazły zastosowanie jako składniki barwników, leków czy organicznych półprzewodników.
Od dawna trwały prace mające syntetycznie stworzyć jeszcze dłuższe cząsteczki. Heksacen po raz pierwszy wykryto w 1939 roku ale dopiero później wymyślono wydajne metody syntezy. Siedmiopierścieniowy heptacen otrzymano dopiero w 2006 roku, okta i nonacen w 2010 roku. W tym roku natomiast udało się otrzymać dziesięciopierścieniowy dekacen.[2] Zrobiono mu nawet "zdjęcie" przy pomocy mikroskopii tunelowej:
Długie aceny stają się nietrwałe. Rezonans orbitali na tak długiej cząsteczce powoduje pojawianie się reaktywnych struktur rodnikowych, dlatego zazwyczaj udawało się otrzymywać aceny odpowiednio podstawione.
Ultralekkie aluminium?
Badacze z Rosji donieśli ostatnio o możliwości stworzenia formy glinu o nietypowych właściwościach. Metastabilna, ultralekka forma tego metalu miałaby gęstość zaledwie 0,61 g/cm3, co oznacza, że pływałaby po wodzie i była niewiele cięższa od litu. Odkrycia dokonano metodami obliczeniowymi, więc jest to raczej możliwa struktura niż faktycznie otrzymanie takiego metalu fizycznie. Trudno powiedzieć czy rzeczywiście da się taką odmianę otrzymać.
W zaproponowanej strukturze cztery atomy glinu tworzą małe czworościany, trochę podobne do tych ze struktury białego fosforu, które łączyłyby się poprzez każdy z atomów z czterema innymi takimi czworościanami. Ze względu na geometrię czworościanów ich układ w komórce elementarnej odpowiadałby strukturze diamentu, co nadawałoby metalowi wytrzymałość. Niska gęstość wynika wówczas stąd, że w diamentopodobnej strukturze pojawiają się niewypełnione luki rozmiaru kilku atomów. [3]
-----
[1] William A. Donald et al. Highly Charged Protein Ions: The Strongest Organic Acids to Date, Angew. Chem. Int. Ed. Volume 56, Issue 29 July 10, 2017 Pages 8522–8526
[2] https://tu-dresden.de/tu-dresden/newsportal/news/wissenschaftler-der-tu-dresden-und-des-ciqus-entwickeln-decacen-das-laengste-acen-das-je-hergestellt-wurde?set_language=en
[3] Iliya V. Getmanskii, Vitaliy V. Koval, Ruslan M. Minyaev, Alexander I. Boldyrev, Vladimir Isaak Minkin. Supertetrahedral Aluminum - a New Allotropic Ultra-Light Crystalline Form of Aluminum. The Journal of Physical Chemistry C, 2017;
Kwasami w ujęciu Brønsteda są substancje, które w reakcji z zasadą odszczepiają proton tworząc anion. Najbardziej znaną skalą określającą ich moc jest skala pH opierająca się o stężenie jonów hydroniowych, które powstają w wyniku reakcji kwasu z wodą. Im większe jest stężenie tych jonów, tym niższa jest cyfra określająca kwaśność roztworu (ujemna skala logarytmiczna). W szczególnych przypadkach dla bardzo silnych kwasów przyjmuje wartości ujemne.
Jak łatwo zauważyć po przeanalizowaniu definicji, skala ta w pewnych przypadkach staje się niewygodna czy wręcz niefizyczna. Trudno zastosować ją na przykład do ciekłych substancji pozbawionych wody jak na przykład 100% kwas siarkowy, bo brak w nich jonów hydroniowych. Jest też problematyczna w roztworach tak bardzo stężonych, że molowo jest w nich więcej kwasu niż wody. Dlatego do tych innych substancji stosuje się inne skale, oparte najczęściej o wartość pKa zależną od stężeń jonów, bądź o energię reakcji oderwania protonu. W ten sposób możemy porównywać kwasowość na przykład stałych, ciekłych i gazowych węglowodorów, stwierdzając, że acetylen jest kwaśniejszy od metanu i łatwiej będzie tworzył sole.
No i niedawno wykryto specyficzną substancję, dla której entalpia deprotonacji jest tak wysoka, że musi to być najsilniejszy kwas organiczny.
Cytochrom c to enzym stanowiący ważny element oddychania komórkowego, ma też udział w procesie apaptozy, dlatego jest intensywnie badany. Składa się on z białka złożonego ze 104 aminokwasów połączonych z cząsteczką hemu. Ostatnie odkrycie dotyczy jednak nie samego cytochromu lecz jego wersji silnie sprotonowanej. W odpowiednich warunkach można dodać cząsteczce dodatkowych atomów wodoru. Na przykład grupy aminowe białka mogą przyjąć wodór, zamieniając się w dodatnio naładowane grupy amoniowe. Tak nawodorowane cząsteczki będą też oczywiście chętnie oddawać nadmiarowe protony, aby przejść do stanu pierwotnego. Im mocniej uwodorniona jest cząsteczka, tym chętniej oddaje proton, to jest staje się coraz mocniejszym kwasem.
Zespół naukowców z Australii badał powstawanie jonów białkowych w spektrometrze mas. Roztwór białka został rozpylony w silnym polu elektrycznym wewnątrz komory. Ponieważ takie same ładunki odpychają się, małe kropelki rozdzielały się na jeszcze mniejsze, ż na koniec powstała chmura kropelek z pojedynczymi cząsteczkami białka. Ta technika nazywana elektrosprejem pozwala na otrzymanie widma mas całych cząsteczek.
Do roztworu dodano jednak pewien prekursor chętnie w takich warunkach oddający protony. W efekcie powstały cząsteczki uwodornione w ekstremalnym stopniu, zawierające nawet 30 dodatkowych wodorów i ładunek elektryczny 30+. Gdy otrzymamy już chmurę jonów, możemy próbować poddawać je reakcjom z różnymi związkami o znanej energii uwodornienia. Wykrycie kationów pochodnych od tych dodatkowych substancji, cięższych o jeden wodór, umożliwia wyznaczenie energii reakcji. W tym przypadku cząsteczka naładowana do 30+ oddawała proton z energią 130 kJ/mol. Jest to tak duża wartość, że zjonizowany cytochrom protonował azot, czy gazy szlachetne[1]
Najdłuższy acen
Aceny to węglowodory aromatyczne złożone z liniowo ułożonych sześciokątnych pierścieni, połączonych jednym bokiem. Najprostszy acen to naftalem złożony z dwóch pierścieni. Trzy zawiera antracen, cztery tetracen, pięć pentacen. Tych pierwszych kilka związków występuje naturalnie, i izolowano je głównie ze smoły pogazowej, niektóre znalazły zastosowanie jako składniki barwników, leków czy organicznych półprzewodników.
Od dawna trwały prace mające syntetycznie stworzyć jeszcze dłuższe cząsteczki. Heksacen po raz pierwszy wykryto w 1939 roku ale dopiero później wymyślono wydajne metody syntezy. Siedmiopierścieniowy heptacen otrzymano dopiero w 2006 roku, okta i nonacen w 2010 roku. W tym roku natomiast udało się otrzymać dziesięciopierścieniowy dekacen.[2] Zrobiono mu nawet "zdjęcie" przy pomocy mikroskopii tunelowej:
 |
| @ TU Dresden |
Długie aceny stają się nietrwałe. Rezonans orbitali na tak długiej cząsteczce powoduje pojawianie się reaktywnych struktur rodnikowych, dlatego zazwyczaj udawało się otrzymywać aceny odpowiednio podstawione.
Ultralekkie aluminium?
Badacze z Rosji donieśli ostatnio o możliwości stworzenia formy glinu o nietypowych właściwościach. Metastabilna, ultralekka forma tego metalu miałaby gęstość zaledwie 0,61 g/cm3, co oznacza, że pływałaby po wodzie i była niewiele cięższa od litu. Odkrycia dokonano metodami obliczeniowymi, więc jest to raczej możliwa struktura niż faktycznie otrzymanie takiego metalu fizycznie. Trudno powiedzieć czy rzeczywiście da się taką odmianę otrzymać.
W zaproponowanej strukturze cztery atomy glinu tworzą małe czworościany, trochę podobne do tych ze struktury białego fosforu, które łączyłyby się poprzez każdy z atomów z czterema innymi takimi czworościanami. Ze względu na geometrię czworościanów ich układ w komórce elementarnej odpowiadałby strukturze diamentu, co nadawałoby metalowi wytrzymałość. Niska gęstość wynika wówczas stąd, że w diamentopodobnej strukturze pojawiają się niewypełnione luki rozmiaru kilku atomów. [3]
-----
[1] William A. Donald et al. Highly Charged Protein Ions: The Strongest Organic Acids to Date, Angew. Chem. Int. Ed. Volume 56, Issue 29 July 10, 2017 Pages 8522–8526
[2] https://tu-dresden.de/tu-dresden/newsportal/news/wissenschaftler-der-tu-dresden-und-des-ciqus-entwickeln-decacen-das-laengste-acen-das-je-hergestellt-wurde?set_language=en
[3] Iliya V. Getmanskii, Vitaliy V. Koval, Ruslan M. Minyaev, Alexander I. Boldyrev, Vladimir Isaak Minkin. Supertetrahedral Aluminum - a New Allotropic Ultra-Light Crystalline Form of Aluminum. The Journal of Physical Chemistry C, 2017;
piątek, 6 października 2017
Skąd ten akrylamid?
Co jakiś czas media donoszą o wykryciu tego związku chemicznego w różnych produktach, a to w chipsach, a to w prażonych orzeszkach a to znów w ciasteczkach czy solonych paluszkach. To silna trucizna o działaniu rakotwórczym. I wówczas może was zastanowić, skąd się właściwie w jedzeniu ten akrylamid wziął. Specjalnie go dodają? Czy może sam powstaje?
Chemicznie rzecz ujmując, akrylamid to amid kwasu akrylowego, związek nienasycony zawierający wiązanie podwójne, grupę karbonylową i aminową. Każda z tych grup składowych może wchodzić w różnorodne reakcje, toteż cząsteczka będąca najściślejszym z możliwych ich połączeniem musi być bardzo reaktywna. Na tyle, że po dostaniu się do organizmu reaguje z białkami, lipidami i DNA wywołując różnorodne rozproszone uszkodzenia. Podczas metabolizmu jest utleniany przez komórkowy cytochrom 450 do formy epoksydowej czyli glicydamidu, który jest cząsteczką jeszcze bardziej reaktywną.
Jako silny środek alkilujący działa mutagennie mogąc wywoływać nowotwory. W modelach zwierzęcych przewlekła ekspozycja na akrylamid w wysokich stężeniach, wywoływała nowotwory nadnerczy, tarczycy, płuc i jąder, oraz działała toksycznie na układ nerwowy.
Związek ten odkryto już bardzo dawno. Ze względu na skłonność do polimeryzacji zaczął być używany do produkcji tworzyw sztucznych o specjalnym przeznaczeniu. Polimeryzacja w roztworze wodnym tworzy twardy hydrożel o dużej przepuszczalności, będący jednym ze standardowych materiałów w elektroforezie białek i DNA. Ponadto używano go jako składnika różnych polimerów, substratu do produkcji pestycydów czy barwników. Przez długi czas wydawało się więc, że jedynym problemem toksykologicznym jest zanieczyszczenie środowiska przez zakłady które go używały, przenikał bowiem do ścieków a stamtąd do wody. Dlatego zaskoczeniem było odkrycie w 2002 roku, że w wyniku specyficznej reakcji może powstawać także w żywności.
Erytryjska badaczka Eden Tareke, zatrudniona na wydziale chemii żywności Uniwersytetu Sztokholmskiego, wprowadzała nową bardziej dokładną metodę badania żywności. Podczas testów z różnymi próbkami zauważyła niepokojący poziom akrylamidu w chipsach ziemniaczanych. Wydawał się zbyt duży aby wytłumaczyć to zanieczyszczeniami przemysłowymi. Wykonała więc prosty eksperyment - przygotowała chipsy z ziemniaków, które wcześniej przebadała pod kątem zawartości akrylamidu. Chipsy smażone w temperaturze przekraczającej 120 stopni nabierały wysokich poziomów akrylamidu, którego nie było w ziemniakach. A więc musiał on w jakiś sposób podczas smażenia powstawać. [1]
Kluczem okazała się znana od dawna reakcja Maillarda. W rzeczywistości jest to zespół reakcji o podobnym przebiegu, podczas których cukry redukujące reagują z aminami w podwyższonej temperaturze. Powstałe produkty ulegają izomeryzacji, dekarboksylacji, dehydratacji, kondensacji itp. w najrozmaitszych możliwych kombinacjach. 20 aminokwasów i jeden cukier redukujący tworzą setki produktów. W żywności zachodzą podczas każdej termicznej obróbki produktów zawierających białka i węglowodany, a więc podczas pieczenia, smażenia, duszenia czy wędzenia; podczas gotowania w mniejszym stopniu.
Powstałe wielkocząsteczkowe produkty kondensacji odpowiadają za brązowy kolor dobrze podpieczonego jedzenia, natomiast te mniejsze wpływają wyraźnie na smak i zapach. Większość składników aromatu pieczonego mięsa, pieczonego chleba czy prażonych ziaren kawy to właśnie produkty reakcji Mailarda, są więc niezbędne aby żywność nabrała pożądanych właściwości smakowych. Jak się jednak okazało, nie każde z możliwych reakcji są dobre.
W jednej z możliwych dróg grupa aminowa aminokwasu reaguje z grupą aldehydową cukru redukującego, a więc na przykład glukozy. Powstaje przejściowy produkt w którym dwie części połączone przez azot zawierają grupę karboksylowa i hydroksylową w pobliżu tego połączenia. W wysokiej temperaturze następuje odszczepienie cząsteczki wody i powstanie iminy w formie zasady Schiffa. Ta z kolei dekarboksyluje odszczepiając cząsteczkę dwutlenku węgla. Powstały nietrwały produkt bądź rozpada się z wytworzeniem podwójnego wiązania, bądź hydrolizuje. Jednym z produktów ostatecznych jest akrylamid. Ze względu na budowę najlepszym substratem do reakcji jest aminokwas asparagina, zaś cukrem redukującym jest najczęściej glukoza występująca w formie wolnej lub powstająca w wyniku rozpadu skrobi.[2]
W odpowiednio wysokich temperaturach możliwa jest też formacja bez cukrów, z gliceryny towarzyszącej tłuszczom. Gliceryna utlenia się do akroleiny, będącej aldehydem; ta reaguje z wolnymi aminami i w podobny sposób jak opisane wcześniej reakcje, zamienia się w akrylamid.
Reakcje te wymagają odpowiedniej temperatury, zaczynają ruszać w temperaturach powyżej 120 stopni i w większości produktów zachodzą najwydajniej około 140-150 stopni.
Największe stężenia wykrywa się w takich produktach jak frytki, chipsy ziemniaczane, mocno palona kawa, kawa rozpuszczalna, przypalone tosty, prażone orzechy. Ogółem są to zatem połączenia typu "skrobia + białko". Ważnym źródłem jest też dym papierosowy i dym ze spalania śmieci w niskich temperaturach.
Toksyczność
Jak już wspominałem, w badaniach na zwierzętach wykazano, że ekspozycja na akrylamid wywołuje różnego rodzaju nowotwory. Tymczasem w przypadku ludzi wpływy są najwyraźniej dużo subtelniejsze i trudne do precyzyjnego wyrażenia. Jak wracają uwagę krytycy, w badaniach na zwierzętach efekty kancerogenne pojawiały się przy stężeniach wielokrotnie większych niż spotykane w jedzeniu i ciężko jest je przełożyć na skutki dla ludzkiego organizmu. Zakładając liniową zależność prawdopodobieństwa dodatkowych nowotworów od stężenia, przy przeciętnej diecie wzrost ryzyka staje się tak mały, że mniejszy niż wpływ narażenia na dym.
Badania populacyjne osób narażonych na tą substancję w jedzeniu są niejednoznaczne. Chętnie spożywający chipsy i frytki mają zwiększoną częstość różnych chorób, ale ciężko przypisać to wyłącznie temu składnikowi a nie spożyciu tłuszczów, nadmiaru soli czy narażeniu na utlenione nienasycone kwasy tłuszczowe. Badania pracowników narażonych w pracy na akrylamid w większych niż w żywności stężeniach dawały różne wyniki, od większej częstości chorób po brak efektu. Ze względu na to, że stykamy się z nim od początków gatunku, gdy tylko zaczęliśmy piec mięso mamutów nad ogniskiem, możliwe że wykształciliśmy sobie jakiś sposób detoksyfikacji. Dlatego też formalnie składnik ten jest klasyfikowany jako substancja podejrzewana o rakotwórczość u ludzi.[3]
Przesadne są więc internetowe artykuły straszące szybkimi skutkami zdrowotnymi i wysoką toksycznością, czy opinie w rodzaju "zjadłem smażeninę, od razu rozbolała mnie głowa, to przez akrylamid". No nie, raczej od okazjonalnego zjadania czegoś mocno podpieczonego wiele się nam nie stanie, niemniej warto pamiętać o tym, że pewne trudne do określenia ryzyko faktycznie jest. I wobec tego może jednak trochę się ograniczyć ze spożywaniem czegoś przypalonego, podpieczonego do ciemnego brązu czy podprażonego.
Redukcja
Czy da się tak produkować żywność, aby z jednej strony nie utracić wartości smakowych a z drugiej zredukować poziomy akrylamidu do możliwie najniższych wartości? Da się, i to na kilka różnych sposobów. Zauważono na przykład, że reakcji w której powstaje sprzyjają sole amonowe, w związku z czym więcej jest go w ciasteczkach w których jako spulchniacza użyto amoniaczku (węglan amonu) niż proszku do pieczenia (wodorowęglan sodu), można więc zastąpić jeden spulchniacz innym i zauważalnie zmniejszyć zawartość niepożądanego składnika.
Innym czynnikiem hamującym są sole zawierające kationy dwudodatnie, w przypadku pieczywa możliwe jest więc wzbogacenie ciasta w sole wapnia. Kolejny inhibitor to aminokwas glicyna. Ma on najprostszą możliwą budowę, tylko dwa węgle w cząsteczce. Ulega reakcji Maillarda ale nie może zamienić się w akrylamid. Wzbogacenie glicyną pierwotnego produktu przed obróbką termiczną powoduje, że część wolnych cukrów redukujących łączy się z nią zamiast z innymi aminokwasami co zużywa niezbędny substrat. Ma to jednak tą wadę, że produkty reakcji z glicyną powodują dużo mocniejsze zbrązowienie oraz niekiedy niepożądany posmak, więc nie wszędzie da się ją zastosować.
Najbardziej oczywistym sposobem jest obniżenie temperatury tak aby nie przekraczała 120 stopni lub skrócenie czasu ogrzewania. (jeśli macie wrażenie, że w ostatnich latach ciastka kruche i herbatniki są jakby mało wypieczone, to możliwe że to jest tego przyczyną). W przypadku chipsów i frytek pewne znaczenie ma też branie do produkcji bulw krótko przechowywanych. Podczas przechowywania, w ziemniakach zachodzi proces rozpadu skrobi z powstaniem wolnej glukozy, będącej przecież cukrem redukującym. W skrajnych przypadkach długo przechowywane ziemniaki mogą się stać słodkawe w smaku.[4]
-------
* http://www.efsa.europa.eu/en/topics/topic/acrylamide
[1] Eden Tareke et. al., Analysis of Acrylamide, a Carcinogen Formed in Heated Foodstuffs,
. Agric. Food Chem., 2002, 50 (17), pp 4998–5006
[2] Maria D. Villagran et al. Acrylamide Formation Mechanism in Heated Foods, J. Agric. Food Chem. 2003, 51, 4782−4787
[3] https://www.cancer.gov/about-cancer/causes-prevention/risk/diet/acrylamide-fact-sheet
[4] Guidance on reducing acrylamide in food, FDE
Chemicznie rzecz ujmując, akrylamid to amid kwasu akrylowego, związek nienasycony zawierający wiązanie podwójne, grupę karbonylową i aminową. Każda z tych grup składowych może wchodzić w różnorodne reakcje, toteż cząsteczka będąca najściślejszym z możliwych ich połączeniem musi być bardzo reaktywna. Na tyle, że po dostaniu się do organizmu reaguje z białkami, lipidami i DNA wywołując różnorodne rozproszone uszkodzenia. Podczas metabolizmu jest utleniany przez komórkowy cytochrom 450 do formy epoksydowej czyli glicydamidu, który jest cząsteczką jeszcze bardziej reaktywną.
 |
| Glicydamid |
Związek ten odkryto już bardzo dawno. Ze względu na skłonność do polimeryzacji zaczął być używany do produkcji tworzyw sztucznych o specjalnym przeznaczeniu. Polimeryzacja w roztworze wodnym tworzy twardy hydrożel o dużej przepuszczalności, będący jednym ze standardowych materiałów w elektroforezie białek i DNA. Ponadto używano go jako składnika różnych polimerów, substratu do produkcji pestycydów czy barwników. Przez długi czas wydawało się więc, że jedynym problemem toksykologicznym jest zanieczyszczenie środowiska przez zakłady które go używały, przenikał bowiem do ścieków a stamtąd do wody. Dlatego zaskoczeniem było odkrycie w 2002 roku, że w wyniku specyficznej reakcji może powstawać także w żywności.
Erytryjska badaczka Eden Tareke, zatrudniona na wydziale chemii żywności Uniwersytetu Sztokholmskiego, wprowadzała nową bardziej dokładną metodę badania żywności. Podczas testów z różnymi próbkami zauważyła niepokojący poziom akrylamidu w chipsach ziemniaczanych. Wydawał się zbyt duży aby wytłumaczyć to zanieczyszczeniami przemysłowymi. Wykonała więc prosty eksperyment - przygotowała chipsy z ziemniaków, które wcześniej przebadała pod kątem zawartości akrylamidu. Chipsy smażone w temperaturze przekraczającej 120 stopni nabierały wysokich poziomów akrylamidu, którego nie było w ziemniakach. A więc musiał on w jakiś sposób podczas smażenia powstawać. [1]
Kluczem okazała się znana od dawna reakcja Maillarda. W rzeczywistości jest to zespół reakcji o podobnym przebiegu, podczas których cukry redukujące reagują z aminami w podwyższonej temperaturze. Powstałe produkty ulegają izomeryzacji, dekarboksylacji, dehydratacji, kondensacji itp. w najrozmaitszych możliwych kombinacjach. 20 aminokwasów i jeden cukier redukujący tworzą setki produktów. W żywności zachodzą podczas każdej termicznej obróbki produktów zawierających białka i węglowodany, a więc podczas pieczenia, smażenia, duszenia czy wędzenia; podczas gotowania w mniejszym stopniu.
Powstałe wielkocząsteczkowe produkty kondensacji odpowiadają za brązowy kolor dobrze podpieczonego jedzenia, natomiast te mniejsze wpływają wyraźnie na smak i zapach. Większość składników aromatu pieczonego mięsa, pieczonego chleba czy prażonych ziaren kawy to właśnie produkty reakcji Mailarda, są więc niezbędne aby żywność nabrała pożądanych właściwości smakowych. Jak się jednak okazało, nie każde z możliwych reakcji są dobre.
W jednej z możliwych dróg grupa aminowa aminokwasu reaguje z grupą aldehydową cukru redukującego, a więc na przykład glukozy. Powstaje przejściowy produkt w którym dwie części połączone przez azot zawierają grupę karboksylowa i hydroksylową w pobliżu tego połączenia. W wysokiej temperaturze następuje odszczepienie cząsteczki wody i powstanie iminy w formie zasady Schiffa. Ta z kolei dekarboksyluje odszczepiając cząsteczkę dwutlenku węgla. Powstały nietrwały produkt bądź rozpada się z wytworzeniem podwójnego wiązania, bądź hydrolizuje. Jednym z produktów ostatecznych jest akrylamid. Ze względu na budowę najlepszym substratem do reakcji jest aminokwas asparagina, zaś cukrem redukującym jest najczęściej glukoza występująca w formie wolnej lub powstająca w wyniku rozpadu skrobi.[2]
W odpowiednio wysokich temperaturach możliwa jest też formacja bez cukrów, z gliceryny towarzyszącej tłuszczom. Gliceryna utlenia się do akroleiny, będącej aldehydem; ta reaguje z wolnymi aminami i w podobny sposób jak opisane wcześniej reakcje, zamienia się w akrylamid.
Reakcje te wymagają odpowiedniej temperatury, zaczynają ruszać w temperaturach powyżej 120 stopni i w większości produktów zachodzą najwydajniej około 140-150 stopni.
Największe stężenia wykrywa się w takich produktach jak frytki, chipsy ziemniaczane, mocno palona kawa, kawa rozpuszczalna, przypalone tosty, prażone orzechy. Ogółem są to zatem połączenia typu "skrobia + białko". Ważnym źródłem jest też dym papierosowy i dym ze spalania śmieci w niskich temperaturach.
Toksyczność
Jak już wspominałem, w badaniach na zwierzętach wykazano, że ekspozycja na akrylamid wywołuje różnego rodzaju nowotwory. Tymczasem w przypadku ludzi wpływy są najwyraźniej dużo subtelniejsze i trudne do precyzyjnego wyrażenia. Jak wracają uwagę krytycy, w badaniach na zwierzętach efekty kancerogenne pojawiały się przy stężeniach wielokrotnie większych niż spotykane w jedzeniu i ciężko jest je przełożyć na skutki dla ludzkiego organizmu. Zakładając liniową zależność prawdopodobieństwa dodatkowych nowotworów od stężenia, przy przeciętnej diecie wzrost ryzyka staje się tak mały, że mniejszy niż wpływ narażenia na dym.
Badania populacyjne osób narażonych na tą substancję w jedzeniu są niejednoznaczne. Chętnie spożywający chipsy i frytki mają zwiększoną częstość różnych chorób, ale ciężko przypisać to wyłącznie temu składnikowi a nie spożyciu tłuszczów, nadmiaru soli czy narażeniu na utlenione nienasycone kwasy tłuszczowe. Badania pracowników narażonych w pracy na akrylamid w większych niż w żywności stężeniach dawały różne wyniki, od większej częstości chorób po brak efektu. Ze względu na to, że stykamy się z nim od początków gatunku, gdy tylko zaczęliśmy piec mięso mamutów nad ogniskiem, możliwe że wykształciliśmy sobie jakiś sposób detoksyfikacji. Dlatego też formalnie składnik ten jest klasyfikowany jako substancja podejrzewana o rakotwórczość u ludzi.[3]
Przesadne są więc internetowe artykuły straszące szybkimi skutkami zdrowotnymi i wysoką toksycznością, czy opinie w rodzaju "zjadłem smażeninę, od razu rozbolała mnie głowa, to przez akrylamid". No nie, raczej od okazjonalnego zjadania czegoś mocno podpieczonego wiele się nam nie stanie, niemniej warto pamiętać o tym, że pewne trudne do określenia ryzyko faktycznie jest. I wobec tego może jednak trochę się ograniczyć ze spożywaniem czegoś przypalonego, podpieczonego do ciemnego brązu czy podprażonego.
Redukcja
Czy da się tak produkować żywność, aby z jednej strony nie utracić wartości smakowych a z drugiej zredukować poziomy akrylamidu do możliwie najniższych wartości? Da się, i to na kilka różnych sposobów. Zauważono na przykład, że reakcji w której powstaje sprzyjają sole amonowe, w związku z czym więcej jest go w ciasteczkach w których jako spulchniacza użyto amoniaczku (węglan amonu) niż proszku do pieczenia (wodorowęglan sodu), można więc zastąpić jeden spulchniacz innym i zauważalnie zmniejszyć zawartość niepożądanego składnika.
Innym czynnikiem hamującym są sole zawierające kationy dwudodatnie, w przypadku pieczywa możliwe jest więc wzbogacenie ciasta w sole wapnia. Kolejny inhibitor to aminokwas glicyna. Ma on najprostszą możliwą budowę, tylko dwa węgle w cząsteczce. Ulega reakcji Maillarda ale nie może zamienić się w akrylamid. Wzbogacenie glicyną pierwotnego produktu przed obróbką termiczną powoduje, że część wolnych cukrów redukujących łączy się z nią zamiast z innymi aminokwasami co zużywa niezbędny substrat. Ma to jednak tą wadę, że produkty reakcji z glicyną powodują dużo mocniejsze zbrązowienie oraz niekiedy niepożądany posmak, więc nie wszędzie da się ją zastosować.
Najbardziej oczywistym sposobem jest obniżenie temperatury tak aby nie przekraczała 120 stopni lub skrócenie czasu ogrzewania. (jeśli macie wrażenie, że w ostatnich latach ciastka kruche i herbatniki są jakby mało wypieczone, to możliwe że to jest tego przyczyną). W przypadku chipsów i frytek pewne znaczenie ma też branie do produkcji bulw krótko przechowywanych. Podczas przechowywania, w ziemniakach zachodzi proces rozpadu skrobi z powstaniem wolnej glukozy, będącej przecież cukrem redukującym. W skrajnych przypadkach długo przechowywane ziemniaki mogą się stać słodkawe w smaku.[4]
-------
* http://www.efsa.europa.eu/en/topics/topic/acrylamide
[1] Eden Tareke et. al., Analysis of Acrylamide, a Carcinogen Formed in Heated Foodstuffs,
. Agric. Food Chem., 2002, 50 (17), pp 4998–5006
[2] Maria D. Villagran et al. Acrylamide Formation Mechanism in Heated Foods, J. Agric. Food Chem. 2003, 51, 4782−4787
[3] https://www.cancer.gov/about-cancer/causes-prevention/risk/diet/acrylamide-fact-sheet
[4] Guidance on reducing acrylamide in food, FDE