Media doniosły niedawno o dwóch tragicznych przypadkach zatrucia czymś, co zostało określone jako "opary trutki". Najpierw w Nowym Tomyślu rodzina zatruła się, przy czym trzyletnia dziewczynka zmarła w szpitalu. Trucizna została zaklejona w styropianie podczas budowy i dopiero teraz stężenie toksycznego gazu osiągnęło niebezpieczną wartość. Wkrótce po tym doniesiono o kolejnym zatrucia pięciu osób w Tomaszowie Lubelskim. Tam truciznę wysypano w piwnicy domu, a opary rozeszły się na cały budynek. Spośród zatrutych dwuletnie dziecko zmarło w szpitalu. Jeszcze w październiku donoszono o zatruciu dwójki dzieci koło Płońska, które zostały narażone na opary środka użytego w ogrodzie przeciwko nornicom.
Co to była za trutka? Bez nazwy mogę tylko spekulować, ale z informacji o wykryciu fosforowodoru wynika, że był to środek, który nie powinien być stosowany w domach, w których podczas jego używania mieszkają ludzie. Bo nie są to pierwsze znane zgony z tego powodu i zastosowanie tego środka jest zupełnie inne niż takiej "zwykłej trutki".
Zazwyczaj spotykamy się z zatrutym ziarnem lub granulkami, zawierającymi truciznę pokarmową. Współcześnie najczęściej są to antykoagulanty lub też uderzeniowa dawka witaminy D i sole wapnia. Trucizna działa tylko po połknięciu, powodując zaburzenia krzepnięcia, hiperkalcemię, zaburzenia rytmu serca, i zabija mysz czy szczura w ciągu kilku dni, dzięki czemu stado może nie skojarzyć padnięcia osobnika z ziarnem. Siłą rzeczy takie trucizny nie wydzielają żadnych gazów i dopóki nie zanieczyszczą nam przypadkiem ręki lub jedzenia albo zostaną połknięte przez małe dzieci, w zasadzie są bezpieczne do użytku nawet wewnątrz mieszkania. Podejrzewam, że wiele osób stosuje uproszczone, hasłowe rozumienie - jak coś nazywa się "trutka" to działa tak samo jak zatrute ziarno. No a skoro ludzie są pewni, że wiedzą jak to stosować, to nie czytają instrukcji na opakowaniu, bo po co?
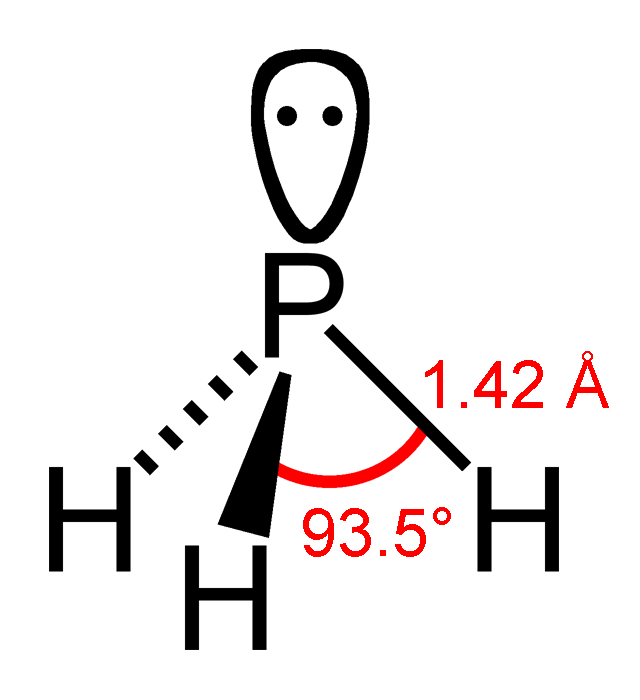
Trujące właściwości fosforu i niektórych jego związków są od dawna znane, w jednym z odcinków opowieści o słynnych zatruciach opisywałem otrucia białym fosforem (link). Związki fosforoorganiczne stosowane są jako pestycydy lub broń chemiczna. Tym razem chodzi o bardzo prosty związek nieorganiczny - połączenie wodoru z fosforem, czyli fosforowodór lub inaczej fosfinę.
Fosfor leży w 15 grupie układu okresowego i ma właściwości dość podobne do znajdującego się nad nim azotu. Na powłokach walencyjnych znajduje się pięć elektronów, które biorą udział w tworzeniu wiązań. Lepiej znane są jego związki z tlenem, na wyższych stopniach utlenienia, kwas fosforowy, fosforawy, różne tlenki. W reakcji z aktywnymi metalami tworzy fosforki, które reagują z kwasami lub wodą dając związki zredukowane, na bardzo niskim stopniu utlenienia. I trucizna, której najwyraźniej użyły rodziny ofiar, to właśnie stałe fosforki metali. Zwykle w takim celu używany jest fosforek wapnia Ca3P2 lub cynku Zn3P2 , lub glinu AlP . Związki te różnią się trochę szybkością reakcji z wilgocią, w mniejszym stopniu składem produktów rozkładu; ze względu na wyższą zawartość fosforu najszerzej stosowany jest ten ostatni.
Fosforki reagują powoli w wodą i dość szybko z kwasami, jak kwasy żołądkowe, wydzielając jako główny produkt fosfinę, bezbarwny gaz.
2 AlP + 6 H2O → Al2O3∙3 H2O + 2 PH3
Bardzo czysta monomeryczna fosfina ma słaby, trochę rybi a trochę czosnkowy zapach. Powoli reaguje z tlenem i wilgocią, utleniając się do tlenków i kwasów fosforowych. Może tworzyć mieszanki wybuchowe z powietrzem. Jest cięższa od powietrza więc w pomieszczeniach bez cyrkulacji może gromadzić się przy podłodze. Jej budowa przypomina mocno budowę lżejszego analogu, amoniaku NH3 . Ma jednak mniejszy moment dipolowy i mniejszą zasadowość, mniej chętnie tworzy sole z kwasami i słabo rozpuszcza się w wodzie.
Zwykle podczas powstawania towarzyszy jej domieszka dimeru, difosfiny P 2 H 4 , o wyraźnym, silnie czosnkowym zapachu, który zwykle stanowi ostrzeżenie. Dimer jest bardziej reaktywny, szybkiej reaguje z tlenem, w większych stężeniach samorzutnie zapala się na powietrzu. Więcej powstaje go z fosforku wapnia, dlatego ta forma jest rzadziej stosowana.
Zależnie od przyjętej formuły reaktywne fosforki mogą być więc trucizną pokarmową, w formie ziarna lub granulek zawierających niewielką domieszkę, które zaczynają działać na organizm gryzonia po spożyciu. Czosnkowy zapach zwykle odstrasza ludzi i większe zwierzęta, ale może być zachętą dla szczurów. Fosforek jest też sprzedawany jako składnik preparatu do wytwarzania gazu fosforowodoru, działającego jak trucizna wziewna. Zabieg napełniania pewnych przestrzeni toksycznym gazem dla usunięcia szkodników, jest nazywany fumigacją i obecnie jest to główne zastosowanie fosforków. Proszek lub pastylki, w których fosforek nie jest drobną domieszką, tylko stanowi główny składnik, bądź są wysypywane do otwartych pojemników i zostawiane w pomieszczeniach, aby powoli reagowały z wilgocią, albo też są mieszane z wodą dla szybszej produkcji gazu. Kapsułki z fosforkiem są też używane do tępienia kretów i nornic, wtedy są wpychane do kretowisk i odsłoniętych nor. Reakcja trwa kilka dni, do zupełnego rozkładu fosforku. Jeśli potrzebna jest większa szybkość i precyzja, fosfinę można także wypuszczać z butli.
Gaz rozchodzi się po pomieszczeniu, takim jak magazyn żywności, spichlerz, elewator, stodoła itd, i dociera w każdy zakamarek. Gaz fosfinowy jest śmiertelnie trujący nie tylko dla myszy, szczurów i innych gryzoni, ale także dla owadów, jak mole spożywcze czy strąkowiec grochowy. Fumigacji można poddać cały budynek, lub tylko jeden silos a nawet okryty szczelnie folią stos worków na palecie. Fosforowodór jest też stosowany przeciwko szkodnikom w drewnie, fumigacji poddaje się drewno przechowywane w magazynach, przedmioty zabytkowe, pomieszczenia a nawet, po zapakowaniu szczelnie w folię jak prezent, całe drewniane budynki.
Po upływie kilku dni wszystkie pomieszczenia, w których użyto preparatu, muszą być porządnie wywietrzone, resztki preparatu zutylizowane i wyniesione. Co jest rzeczą najzupełniej oczywistą, w tym czasie nie mogą tam przebywać ludzie. Niestety notuje się wiele przypadków zatrucia pracowników po niedostatecznie dobrym wietrzeniu, z pozostawieniem porcji gazu w opakowaniach czy zakamarkach, lub w wyniku nie przewidzianego przepływu gazu z pomieszczenia gazowanego do innego odległego pomieszczenia w budynku lub pobliżu. Jest to zupełnie inny sposób działania niż najczęściej stosowane trutki na myszy.
Zaletą użycia fosforowodoru, oprócz szybkiego czasu działania, jest brak odporności zwierząt na truciznę. Dlatego zarówno fumigacja jak i trutki pokarmowe z fosforkiem są najbardziej zalecane tam, gdzie szkodniki są uodpornione na inne stosowane trutki. Równocześnie za jednym zabiegiem tępi się gryzonie jak i owady, niewiele dopuszczonych do użytku trucizn działa na oba typy organizmów tak samo skutecznie. Drugą ważną zaletą jest to, że fosfina zwykle nie reaguje z materiałami i nie pozostawia szkodliwych, stałych pozostałości. Nawet jeśli wejdzie w reakcję z ziarnem czy drewnem, produkty nie będą toksyczne. A wchłonięta w pory materiału w ciągu kilku dni przereaguje z tlenem i wilgocią i zniknie.
Co oczywiste, z silnie działającą trucizną trzeba się ostrożnie obchodzić. Preparaty takie właściwie nie powinny być szeroko dostępne dla przypadkowego konsumenta. Rolnikom chcącym stosować fosforki zaleca się przeszkolenie, aby wiedzieli jak dobrać ilości i zachować bezpieczeństwo. [1] Wiele zanotowanych przypadków zatruć wynikało albo z nieprzestrzegania zasad, albo ze stosowania przez osobę nie wiedzącą, że ten rodzaj preparatu różni się od innych. Osoby sądziły, że granulki do fumigacji, to taka sama trucizna pokarmowa jak inne trutki, wiec wysypywały ją na talerzyk i kładły w kącie pomieszczenia, w miejscu gdzie dostęp będą miały do tego myszy, a potem było zaskoczenie że duże ilości gazu rozeszły się na cały dom i zaszkodziły osobom oddalonym od tego talerzyka. Upchanie pastylek do fumigacji w styropianie w ścianie to wyjątkowy przypadek, ale ostatecznie także i tak gaz może się przedostać do domu przez nieszczelności. Może ukryte przez długi czas w ścianie pakiety odsłoniła drążąca ocieplenie mysz i stąd opóźniona reakcja? Można teraz tylko spekulować.
W roku 2014 głośna była sprawa śmiertelnego zatrucia trzech osób w Hiszpanii. Ojciec rodziny zbierał metalowe zakrętki, które sprzedawał w punkcie skupu. W torbach, które przechowywane były też w łazience, znalazły się opakowania po preparacie z fosforkiem glinu. Reszki w opakowaniach zareagowały z wilgocią, a gaz rozszedł się na cały dom. Po kilku godzinach, gdy rodzina jedynie wietrzyła, nie mogąc zlokalizować źródła zapachu, wszyscy zaczęli się źle czuć. Pojawiły się wymioty, biegunka, problemy z oddychaniem i utrata przytomności. W szpitalu zmarł ojciec, matka i 14-letnia córka.[2]
W 2019 roku właściciel budynku wielorodzinnego w Timisoarze, w Rumunii, przeprowadził dezynsekcję z użyciem fosforku glinu w mieszkaniach, gdzie panowała inwazja pluskiew. Pomieszczenia nie zostały właściwie wywietrzone zanim pozwolono wrócić mieszkańcom, a gaz fosfinowy rozszedł się wentylacją także do mieszkań, które nie były objęte akcją. 32 osoby trafiły do szpitala a trzy zmarły. Firma użyła środka który nie był dopuszczony do użytku w mieszkaniach. [3]
Także w Polsce zdarzały się wcześniej takie przypadki. W roku 2020 rodzina z Kamienia Pomorskiego zatruła się oparami, przy czym najmłodsze dziecko zmarło. Właściciel kamienicy rozłożył w budynku trutkę kupioną bez opakowania i instrukcji od znajomego, najwyraźniej sądził, że to zwykła trutka pokarmowa. [4]
Narażenie na fosfinę lub spożycie fosforków metali, wywołuje objawy, które mogą nie być bardzo specyficzne i zostać początkowo wzięte za skutki zaczadzenia lub zatrucia pokarmowego. Zawroty głowy, zmęczenie, ucisk w piersi i duszności, wymioty i biegunki, osłabienie mięśni, zaburzenia koordynacji. Wzmożona przepuszczalność naczyń prowadzi do ciężkiego niedociśnienia, nie reagującego na leczenie dopaminą. Ostatecznie następuje zapaść związana z niewydolnością oddechową, zaburzeniami pracy serca i drgawkami. Późne objawy u odratowanych to żółtaczka, uszkodzenie wątroby i nerek.
Zapach fosfiny jest wykrywalny już przy stężeniu 0,3 ppm (części na milion części powietrza). Efekty toksyczne może wywołać już narażenie na stężenie 10 ppm działające przez kilka godzin. Niebezpieczne zatrucie, dające efekty natychmiast lub z opóźnieniem, może wywołać wdychanie przez chwilę powietrza zawierającego 50 ppm. Jeden z dostępnych na polskim rynku preparatów to tabletki fosforku o masie 3 gramów, które wydzielają 1g fosfiny. [5] Przy średniej gęstości powietrza 1,2 kg/m3 mieszkanie o powierzchni 40 m2 i wysokości 2,5 metra (czyli 100 m3) zawiera 120 kg powietrza. Szybki rozkład jednej takiej tabletki, na przykład po zalaniu wodą, przy słabej wentylacji i dobrym rozprowadzeniu gazu, da średnie stężenie 8,3 ppm. Potencjalnie więc już jedna lub dwie takie tabletki użyte w małym mieszkaniu mogą wytworzyć stężenie, które będzie niebezpieczne po kilku godzinach wdychania.
Wydaje się, że głównym mechanizmem toksyczności fosfiny jest zatrzymywanie procesów wytwarzania energii w mitochondriach, przez blokowanie kluczowego enzymu Cytochromu C; w mniejszym stopniu generowanie wolnych rodników. Być może znaczenie ma też neurotoksyczność związana z podwyższeniem poziomu acetylocholiny w mózgu, co częściowo można odwrócić Atropiną, ale nie znalazłem czy takie leczenie ma sens w już po narażeniu i rozwinięciu objawów. [6]
-------
Przypisy:
[1] https://www.topagrar.pl/articles/aktualnosci-branzowe-uprawa/tej-substancji-czynnej-nie-kazdy-moze-uzywac-potrzeba-specjalnego-szkolenia-2509431
[2] https://www.lavanguardia.com/local/sevilla/20140203/54400796210/la-familia-de-alcala-de-guadaira-murio-tras-inhalar-fosfina-de-unos-tapones.html
[3] https://evz.ro/evolutia-toxicitatii-in-apartamentele-de-pe-strada-miorita-vestea-buna.html
[4] https://uwaga.tvn.pl/reportaze/michalek-smiertelnie-sie-zatrul-oparami-srodka-na-szczury-w-sprawie-zapadl-wyrok-ls6739484
[5] https://sklepfarmera.pl/quickphos-tabletki-1kg-toksyczny-upl.html?rec_source=2&rec_scenario_id=0&prod_id=3366&vds_id=2820&rec_item_id=33607&utm_source=salesmanago&utm_medium=ramka_sm_farmera&utm_campaign=farmera_ramka_karta_produktu_pierwsza
[6] https://pmc.ncbi.nlm.nih.gov/articles/PMC3135219/