Reakcja w kroplach nad rozgrzaną blachą
Efekt Leidenfrosta jest jednym z tych ciekawych zjawisk fizycznych, jakie z pewnością każdy miał okazję obserwować, tylko nie specjalnie zastanawiał się nad jego przyczyną. Upuszczenie kropli wody na bardzo rozgrzaną blachę, kuchenkę elektryczną czy patelnię powoduje, że zamiast zwyczajnie odparować przez pewien czas szybko śmiga niczym mały poduszkowiec.
Odpowiednio duża różnica temperatur powoduje, że rozgrzewanie całej kropli jest wolniejsze niż odparowanie porcji najbliżej blachy. Powstająca para wodna ma ciśnienie wystarczające, aby unieść nad gorącą powierzchnię całą kroplę, która nie ma bezpośredniego kontaktu, spowalniając wyparowanie kropli wielokrotnie.
Zespół amerykańskich naukowców z Purdue University wykorzystał ten efekt, tworząc z kropelek mikroreaktory do przeprowadzenia reakcji. Wcześniej znany był już efekt przyspieszania reakcji w kropelkach powstających przy rozpryskiwania roztworów techniką elektrospreju. Prawdopodobnie na granicy faz następowała adsorpcja naładowanych reagentów, które wobec tego były tylko częściowo solwatowane przez rozpuszczalnik. Niecałkowita otoczka solwatacyjna obniżała energię aktywacji reakcji między składnikami roztworu. Ze względu na mikroskopijne rozmiary powstających kropelek, stosunek objętości do powierzchni był bardzo korzystny. Z drugiej strony efekt obserwowano w bardzo niewielkiej ilości mieszaniny reakcyjnej, przez co trudno bylo zjawisko w jakiś sposób zastosować.
Tutaj pomysł był podobny, tylko kropelki większe, bo otrzymywane przez efekt Leidenfrosta. Za modelową reakcję posłużyła kondensacja ketonu z pochodną hydrazyny. Reagenty rozpuszczono w rozpuszczalniku i upuszczono po kropli na rozgrzane szkiełko zegarkowe, utrzymując kropelkę przez dwie minuty w stanie lewitacji. Po zbadaniu roztworu stwierdzono, że reakcja zachodziła z nawet pięćdziesięciokrotnie większą szybkością. Tą metodą można poddawać reakcji miligramowe iloci reagentów, możliwe, że nawet większe jeśli udałoby się zbudować układ w którym krople mogłyby odpowiednio długo wędrować jedna za drugą. [1]
Najsilniejszy niefluorowy utleniacz
Utlenianie to w rozumieniu chemików reakcja polegająca na odebraniu reagującemu atomowi elektronów (dezelektronacja). Tlen i zawierające go związki są dość dobrymi utleniaczami, ale nie jedynymi, przykładowo gazowy chlor reagując z metalicznym sodem odbiera mu elektron, utleniając do kationu sodowego; sam redukuje się więc do anionu chlorkowego i tworzy związek chlorek sodu, czyli sól kuchenną.
W roli utleniacza zadziałać może też elektroda z przyłożonym odpowiednim napięciem. W procesie elektrolizy jedne składniki roztworu są utleniane a inne redukowane, lecz materiał elektrody nie ulega w tych procesach przemianom, jest jedynie przekaźnikiem elektronów które są przez potencjał elektryczny bądź wyciągane bądź wpychane w reagującą cząsteczkę. Oczywiście aby doszło do reakcji i aby elektron przeskoczył z miejsca na miejsce, należy użyć odpowiednio dużej energii, a w tym przypadku przyłożyć do elektrody odpowiednio duże napięcie, poniżej którego reakcja nie zajdzie.
Dzięki temu badając napięcie przy którym na elektrodzie następuje dana reakcja, można porównać związki i ich skłonności do oddawania lub przyjmowania elektronów, a tym samym moc różnych reduktorów lub utleniaczy. Zajście reakcji utlenienia przy pomocy danego utleniacza, to odpowiednik potencjału X woltów. Stąd biorą się tabele potencjałów standardowych, jakie zapewne widzieliście w podręcznikach. Z tego jaką wielkość mają potencjały dwóch substancji i jaka jest między nimi różnica, można zgadnąć czy zajdzie nimi reakcja redoks i w którą stronę. Ten który ma potencjał bardziej dodatni, będzie utleniaczem, ten który będzie miał potencjał bardziej ujemny będzie reduktorem. Im większy jest między nimi odstęp, tym energiczniej zachodzi reakcja, a więc tym chętniej.
Dla układów pośrodku skali potencjałów (standardowo za 0 przyjmuje się potencjał reakcji redukcji kationów wodorowych), substancje zależnie od tego z czym się spotkają mogą być utleniaczami lub reduktorami. Na dodatnich i ujemnych krańcach skali znajdują się związki i jony pierwiastków, które zwykle traktuje się po prostu jak utleniacze lub reduktory zawsze, bo na przykład osiągnęły maksymalną wartościowość której już nie zwiększą albo nie bardzo mają okazję przereagować z czymś silniejszym (ale czasem mają - nadtlenek wodoru, generalnie utleniacz, w reakcji z jonami srebra redukuje je do obojętnego metalu, a sam utlenia się do... tlenu).
Generalnie w takim ujęciu za utleniacze silne uznaje się już układy o potencjale standardowym powyżej +2 V. Utleniaczem silnym jest więc na przykład nadsiarczan sodu (E0= +2 V), od niego silniejszy jest pierwiastkowy fluor (E0= +2,8 V), kwas ksenonowy (+2,5 V), i różne układy oparte o fluor lub chlor. Do najsilniejszych należy rodnik fluorowy, który w reakcji z kationem wodoru utlenia go z potencjałem +3,87 V i difluorek kryptonu KrF2 o potencjale +3,27 V.
Fluor pojawia się tutaj nieprzypadkowo - pierwiastek ten ma wysoką elektroujemność, co oznacza że trudno go zjonizować, oraz ze chętnie przyciąga elektrony. Najsilniejsze znane utleniacze są więc związkami fluoru. Przynajmniej aż do teraz.
Grupa badaczy z Uniwersytetu Warszawskiego opublikowała niedawno wyniki eksperymentów z otrzymaniem bardzo silnego utleniacza, jakim okazały się kationy srebra II. Jest to dla srebra stan utleniania bardzo nietrwały, stąd duża energiczność reakcji dzięki której może przejść w bardziej trwały kation srebra I. W specyficznych warunkach stężonego oleum, które wpływają na przebieg reakcji, utlenienie przy pomocy srebra II osiąga potencjał standardowy +2,9 i jest najwyższą znaną wartością dla utleniaczy nie zawierających fluoru. Prawdopodobnie kationy metalu są solwatowane przez cztery cząsteczki kwasu, co ma duże znaczenie dla potencjału utleniania. Utleniacz o takiej sile mógłby być użyty do rozkładu niektórych trudnych do przetworzenia zanieczyszczeń.[2]
Niskotemperaturowa synteza amoniaku
Jednym z najbardziej znanych procesów przemysłowych, wykorzystywanym na gigantyczną skalę, jest synteza amoniaku z azotu, pozwalająca na otrzymanie związków azotowych, zużywanych potem głównie do produkcji nawozów sztucznych. Najpospoliciej stosowaną obecnie jest metoda Habera-Bosha, polegająca na reakcji wodoru i azotu pod ciśnieniem kilkuset atmosfer i temperaturze 500 stopni, z użyciem katalizatora żelazowego. Mimo tych ekstremalnych warunków metoda jest opłacalna. Wcześniej próbowano takich reakcji jak otrzymywanie azotku magnezu i rozpuszczanie go w kwasach, czy hydroliza cyjanamidu wapniowego (tzw. azotniak).
Jednak ostatnia praca chińskich badaczy z Dalian Institute of Chemical Physics pokazuje że potencjalnie możliwe jest przeprowadzenie tego procesu w bardziej łagodnych warunkach.
Zespół pierwotnie zajmował się badaniem materiałów do pochłaniania i przechowywania wodoru. Podczas cykli wygrzewania oprócz wodoru powstawały też pewne ilości amoniaku, wskutek niepożądanej reakcji ubocznej. Dość przypadkowo, podczas symulacji sprawdzających przebieg tej reakcji, badacze stwierdzili że proces uwodornienia azotu jest sam w sobie dość obiecujący. Zachodzące podczas syntezy procesy obejmują adsorpcję azotu na metalu, aktywizację cząsteczki, przyłączenie wodoru i dysocjację. Idealny katalizator powinien dobrze aktywować azot ale też słabo wiązać aktywowaną cząsteczkę. niestety w przypadku metali przejściowych dobre wiązanie i aktywizowanie azotu wiązało się też z trudnym odłączaniem zaktywizowanej formy. Właśnie konieczność odłączenia cząsteczki od katalizatora powodowała, że potrzebna była tak wysoka temperatura.
Pomysł Chińczyków był generalnie dość prosty - należy użyć dodatkowego katalizatora. Tym katalizatorem okazał się wodorek litu.
Centrum reakcyjne ma postać drobnych plamek wodorku litu na powierzchni katalizatora metalicznego. Cząsteczka azotu przyłącza się w pobliżu, w związku z utworzeniem wiązania azot-metal zostaje zaktywizowana. Pobliski wodorek litu jest reduktorem, oraz odszczepia bardzo reaktywny anion wodorkowy. W efekcie pobliska cząsteczka azotu zostaje zredukowana i odszczepiona, równocześnie z przyłączeniem wodoru. Powstający amidek litu reaguje z wodorem, odnawiając wodorek litu i odłączając amoniak.
Taki podwójnie katalizowany proces może być przeprowadzony w dużo łagodniejszych warunkach. Dla katalizatora żelaznego z domieszką wodorku litu proces zachodził wydajnie już w temperaturze 150 stopni Celsiusza. [3]
Rośliny oczyszczają domowe powietrze
Powietrze w domach i mieszkaniach różni się od tego napływającego z zewnątrz. Nie dość, że dostają się do niego związki wydzielane przez nas samych, uwalniane podczas gotowania czy codziennej toalety, to jeszcze swoje dokładają lotne składniki farb, materiałów budowlanych, mebli i elementów wystroju wnętrz. Niektóre z nich mogą mieć działanie szkodliwe, dlatego dobrze jest co jakiś czas wietrzyć mieszkanie. Zaleganie toksycznych oparów w pomieszczeniach, uwalnianych przez ściany i sprzęty domowe, jest niekiedy wiązane z "zespołem chorego budynku" powodującego różne, często trudne do określenia dolegliwości, jak bóle głowy, alergie, napady astmy, uczucie zmęczenia.
Do sposobów unikania tego zjawiska należy polepszenie wentylacji i napływu powietrza z zewnątrz lub stosowanie filtrów pochłaniających. Znane były też badania sugerujące, że pewne związki mogą pochłaniać z powietrza rośliny doniczkowe.
Zespół amerykańskich badaczy postanowił precyzyjniej porównać zdolności oczyszczania powietrza przez różne gatunki w tej samej przestrzeni. Wzięto pięć gatunków często używanych jako rośliny doniczkowe i sprawdzano jak ich obecnośc wpływa na stężenia lotnych związków w specjalnie przygotowanej komorze. Były to: zielistka, dracena, bromelia guzmania, grubosz (znany też jako drzewko szczęścia) i kaktus Consolea.
Przetestowano ich aktywność na ośmiu przykładowych związkach, stwierdzając że pewne gatunki mają wyjątkowo dużą skłonność do wchłaniania niektórych. Przykładowo dracena wchłaniała 90% acetonu obecnego w powietrzu. Najlepszą z badanych okazała się bromelia, która dla sześciu lotnych związków eliminowała 80% obecnej ilości.[4]
Prosta i tania metoda otrzymywania
Wiele substancji znajdujących ciekawe zastosowania bądź występuje w naturze zbyt rzadko aby możliwe było tanie ich pozyskanie, bądź nie występuje w niej w ogóle. Dlatego trzeba je otrzymywać przy pomocy metod syntetycznych. Jednak w przypadku niektórych skomplikowanych cząsteczek, synteza przestaje być tak dobrą alternatywą, jeśli jest złożona z wielu etapów w których zużywa się wiele różnorodnych reagentów, tym bardziej, że im więcej etapów pośrednich tym mniejsza wydajność końcowa. 10 etapów o wydajności 80% przekłada się na wydajność całkowitą 10%
Dlatego też chemicy szukają sprytnych sposobów aby konstruować cząsteczki w mniejszej ilości etapów, szybciej i z mniejszą ilością reagentów. Takimi prostymi skokami omijającymi parę etapów są reakcje wieloskładnikowe, gdy to reakcję przeprowadzamy na mieszaninie kilku składników, które w trakcie tego samego procesu reagują ze sobą w określonej konfiguracji; reakcje kaskadowe gdy odpowiednio skonstruowana cząsteczka ulega serii wewnętrznych przekształceń, oraz reakcje rednoreaktorowe (one pot) gdy kolejne etapy są dokonywane dolewając następne reagenty do mieszaniny po poprzedniej reakcji, bez często żmudnego procesu izolowania czystych produktów pośrednich.
Przykładem może być praca jaka wpadła mi w oko, opisująca nową metodę syntezy (-)-ambroksanu, terpenoidu będącego głównym składnikiem zapachowym naturalnej ambry. Ta naturalna jest rzadka i droga i nie sposób zwiększyć jej pozyskania*, dlatego główny pachnący związek otrzymuje się syntetycznie.
Związkiem wyjściowym jest sklareol, otrzymywany z olejku eterycznego szałwii muszkatołowej, bo to najtańsze źródło. Cząsteczka jest generalnie bardzo podobna do ambroksanu, należy jedynie zamknąć trzeci pierścień w formie eteru i odrzucić niepotrzebne dwa węgle, ale bez zmiany konfiguracji jednego centrum stereogenicznego:
Opisano kilka metod przeprowadzenia takiej reakcji, które są wykorzystywane w przemyśle, mają one jednak tą wadę, że są przeprowadzane w kilku etapach. Czyli substancja wyjściowa jest poddawana reakcji, po której półprodukt jest oddzielany i używany do następnego etapu. Każdy taki proces następuje ze skończoną wydajnością, sumą kilku procesów jest bardzo mała wydajność końcowa, do tego dochodzą koszty zużytych w każdym etapie odczynników. Dlatego nowa metoda w której używa się tylko dwóch odczynników a całą reakcję przeprowadza się w jednym etapie bez oddzielania związków pośrednich z pewnością wzbudzi zainteresowanie przemysłu.
Sklareol jest rozpuszczany w dioksanie, dodawany jest utleniacz czyli 30% nadtlenek wodoru i katalizator będący fosfomolibdenianem alkiloamoniowym, mieszanina jest ogrzewana najpierw przez dwie godziny w temperaturze 70 stopni a potem godzinę w 90 stopniach. I tyle. Wydajność to nieco ponad 20%, jest więc jedynie nieco wyższa niż w poprzednich metodach, ale być może da się to jeszcze usprawnić.
Reakcja przebiega prawdopodobnie poprzez utworzenie epoksydu, który cyklizuje i ulega przegrupowaniu.[5]
------
* Ambra to grudki masy będącej zastygniętymi wymiocinami kaszalota, który najadł się zbyt dużo kałamarnic olbrzymich żyjących w głębinach oceanów. Jak na razie nikomu nie udało się ich pod tym kątem tresować.
[1] Bain RM, Pulliam CJ, Thery F, Cooks RG. Accelerated Chemical Reactions and Organic Synthesis in Leidenfrost Droplets, Angew Chem Int Ed Engl. 2016 Aug 22;55(35):10478-82
[2] Połczyński P.,Jurczakowski R., Grochala W., Stabilization and strong oxidizing properties of Ag(II) in a fluorine-free solvent, Chem. Commun., 2013,49, 7480-7482
[3] Peikun Wang et al, Breaking scaling relations to achieve low-temperature ammonia synthesis through LiH-mediated nitrogen transfer and hydrogenation, Nature Chemistry (2016).
[4] https://www.acs.org/content/acs/en/pressroom/newsreleases/2016/august/selecting-the-right-house-plant-could-improve-indoor-air-animation.html
[5] Yang, S. et al. One-pot synthesis of (−)-Ambrox. Sci. Rep. 6, 32650; doi: 10.1038/srep32650 (2016).
informacje
Pokazywanie postów oznaczonych etykietą sole nieorganiczne. Pokaż wszystkie posty
Pokazywanie postów oznaczonych etykietą sole nieorganiczne. Pokaż wszystkie posty
wtorek, 13 września 2016
poniedziałek, 15 lutego 2016
Chemiczne wieści (4.)
Asfalt który sam się soli
Jak to po raz kolejny przekonaliśmy się w tym roku, drogowcy zawsze są zaskakiwani zimą. Niech tylko mocniej sypnie a okaże się, że pługosolarki gdzieś utknęły po drodze a powrót do domu staje się mocno utrudniony. Na ciekawy pomysł aby rozwiązać ten problem i przyspieszyć odladzanie dróg wpadli inżynierowie z Turcji - postanowili dodać sól do asfaltu.
Mrówczan potasu - sól stosowaną do odladzania w bardzo niskich temperaturach, uważany za substancję mniej szkodliwą dla środowiska od zwykłej soli - zmieszano z polimerem styrenowo-butadienowo-styrenowym, otrzymując żel w którym drobne cząstki soli zostały otoczone polimerem. Taki granulat połączono z masą bitumiczną będącą głównym składnikiem asfaltu drogowego. Następnie badano utrzymywanie się lodu i śniegu na powierzchni pokrytej testową mieszanką. Stwierdzono istotne opóźnienie pojawiania się oblodzenia i warstwy śliskiego śniegu, zarazem uwalnianie soli z materiału było dosyć niskie, rzędu 1-10% w ciągu 67 dni testu.[1]
Rozwiązanie to wydaje się jednak wiązać z problemami, podobnymi co solenie dróg z wierzchu - migracja uwalnianych soli wewnątrz mieszanki asfaltowej i krystalizacja w szczelinach może pogarszać wytrzymałość materiału. W dodatku sól będzie się zapewne uwalniała nie tylko w sezonie zimowym ale też podczas każdego deszczu, co spowoduje, że szybko wypłucze się cała i wzbogaci w sód glebę wokół drogi. Tak że niekoniecznie jest to udany pomysł.
Białkowe LEDy
Diody LED zrobiły w ostatnich latach wielką karierę w technice oświetleniowej. Będąc układami półprzewodników w których światło powstaje nie w wyniku żarzenia się jak w żarówkach, lecz podczas rekombinacji elektronów przewodnika z dziurami elektronowymi półprzewodnika typu p, osiągają większa sprawność energetyczną, i zużywają mniej prądu na wytworzenie tej samej ilości światła. Zarazem jednak są urządzeniami dosyć drogimi, na co składa się między innymi koszt wytworzenia dobrej jakości półprzewodników z tak egzotycznych materiałów jak domieszkowany arsenek galu. Tym bardziej, że jeden rodzaj półprzewodnika wytwarza światło w jednym kolorze, aby otrzymać światło białe zdatne do oświetlenia należy więc użyć przynajmniej trzech półprzewodników upakowanych jeden obok drugiego, tak aby ich zmieszane kolory tworzyły wrażenie światła białego. Podraża to koszty produkcji i zwiększa ilość pierwiastków zawartych w produkcie. Może się to jednak zmienić, jeśli do produkcji zostaną wprowadzone diody białkowe.
Zespół hiszpańsko-niemieckich technologów wykorzystał znane w biologii białka fluorescencyjne i zmieszał je z tworzywem sztucznym, tworząc masę o konsystencji gumy. Masa ta świeci na różne kolory pod wpływem niebieskiego światła. Wystarczy więc użyć we właściwej diodzie jedynie półprzewodnik świecący na niebiesko i dodać do niego warstwy białkowych gum zielonych i czerwonych, aby otrzymać białe światło.
Zmniejsza to zapotrzebowanie na rzadkie pierwiastki i potencjalnie zmniejsza koszty produkcji.[2]
Dobry chrom zamienia się w zły
Jak to już było na tym blogu wielokrotnie wspominane, ta sama substancja może być zarówno korzystna jak i trująca, przy czym zazwyczaj zależy to od dawki. Wiele metali w niewielkich ilościach jest potrzebnych dla organizmu, zaś w zbyt dużych stają się truciznami. Szczególnym przypadkiem jest chrom, którego oddziaływanie na organizm zależy też od stopnia utlenienia. Nisko utlenione sole na III stopniu utlenienia są przyswajane przez organizm i używane jako kofaktory wielu enzymów stanowiących ważne elementy metabolizmu.
Sole na VI stopniu utlenienia są natomiast toksyczne, od dawna wiadomo także, że mają działanie rakotwórcze. Jest to jedna z przyczyn przez które obecnie studenci na zajęciach chemii nie myją naczyń chromianką.
W związku z poszerzaniem się wiedzy o dobrych skutkach chromu III, a zwłaszcza o potencjalnym wpływie na masę ciała, producenci suplementów zaczęli produkować najrozmaitsze preparaty z solami chromu. Co rodziło dość oczywiste obawy, czy aby przypadkiem taki suplement nie będzie się gdzieś utleniał do toksycznej formy. Aby temu zaradzić suplemenciarze odpowiednio modyfikowali skład tabletek, chętnie używając organicznych soli i chelatów, które oprócz większej stabilności dodatkowo lepiej się wchłaniały. Ponieważ zaś w organizmie chrom nie utleniał się, wydawało się, że w takim razie suplementy te są całkiem bezpieczne.
Najnowsze badane międzynarodowego zespołu podważa jednak ten pogląd. Badacze potraktowali wyizolowane komórki tkanki tłuszczowej roztworami zawierającymi związki chromu III takie jak używane w suplementach, a więc na przykład octan, azotan lub kompleks z cysteiną, i przy pomocy spektroskopii fluorescecyjnej stwierdzili, że w komórkach zachodziło częściowe utlenienie do chromu VI.
Wybrano akurat adipocyty, to jest komórki tkanki tłuszczowej, z powodu znanej właściwości wydzielania nadtlenku wodoru w reakcji na insulinę. Nadtlenek jest silnym utleniaczem, zdolnym utlenić chrom III do chromu VI, co teraz udało się zaobserwować na żywych komórkach. To zaś oznaczałoby, że długotrwałe zażywanie dużych ilości suplementów chromu III niesie większe ryzyko zdrowotne, niż to dotychczas przypuszczano.[3]
Organiczny filtr na gazy bojowe.
Metal-Organic Frameworks czyli, jak to się tłumaczy metalo-organiczne szkielety (dokładniej byłoby tłumaczyć "kraty") to szczególny rodzaj materiałów który wywołuje coraz większe zainteresowanie. Jest to właściwie usieciowany, wielocentrowy kompleks zawierający rozgałęzione ligandy organiczne łączące się z wieloma jonami centralnymi. Struktura materiału jest na tyle regularna i dobrze zdefiniowana, że może on tworzyć kryształy. Pomiędzy częściami szkieletu powstają stosunkowo duże przestrzenie, otrzymana struktura jest zatem niezwykle porowata.
Ze względu na to, że tak usieciowane kompleksy mogą selektywnie pochłaniać inne substancje, a także wchodzić z nimi w reakcje, badania nad MOF-ami są dość intensywne, coraz pojawiają się nowe informacje o nowych zastosowaniach, a ja będę musiał poświęcić im osobny artykuł.
Na razie jednak nowinka - wynaleziono metalo-organiczny szkielet który mógłby został użyty do ochrony przed gazami bojowymi.
Szkieletowy kompleks cyrkonu z kwasem tereftalowym, w tym także wersje wzbogacone o tertbutanolan litu, okazały się być dobrymi katalizatorami które przy obecności śladów wody hydrolizują związki fosforoorganiczne, podobne do gazu musztardowego. Ponieważ związkiem tym można pokrywać włókna i materiały, dość oczywista jest przydatność nowo odkrytego związku w filtrach powietrza, mających neutralizować gazy bojowe.[4]
Cytryny i siarka do oczyszczania wody
Chemicy na świecie poszukują jak najprostszych metod produkcji przydatnych substancji, tak aby były one w miarę możliwości jak najtańsze. Tym tropem poszedł zespół chemików z Australii, którzy pokazali jak z siarki i składnika skórki cytrynowej stworzyć substancję oczyszczającą wodę z metali ciężkich.
D-Limonen to monoterpen będący główną substancją zapachową zawartą w skórce cytryny, jest częstym składnikiem mieszanej zapachowych i środków czystości. Ponieważ odzyskuje się go ze zmielonej skórki, której obtarcie jest jednym z etapów produkcji soku cytrynowego, przy dość dużej produkcji rocznej jest związkiem względnie tanim. Badacze szukający nowych materiałów chelatujących jony metali ciężkich zainteresowali się doniesieniami o tym, że limonen może utworzyć połączenia wielosiarczkowe. Wiadomym było, że liniowe wielosiarczki chętnie kompleksują jony metali, dlatego taka właściwość łatwej w otrzymaniu pochodnej taniego związku naturalnego byłaby bardzo korzystna.
Wzięto czystą siarkę i ogrzano do stopienia. W temperaturze 170 stopni, w której pękają pierścieniowe cząsteczki siarki, dodano do niej odpowiednią ilość limonenu. Z powstałej brunatnej masy oddzielono nieprzereagowaną siarkę, będący wynikiem utlenienia cymen i inne produkty uboczne, otrzymując czerwoną woskowatą substancję będącą cyklicznymi połączeniami dwóch cząsteczek limonenu, połączonych mostkami wielosiarczkowymi.
Jak się okazało substancja ta chętnie wychwytuje z wody jony metali ciężkich, w przypadku jonów rtęci II dodatkowo reagując wyraźną zmianą zabarwienia, co może mieć zastosowanie analityczne. [5]
---------
[1] D. Aydin et al.; Gelation-Stabilized Functional Composite-Modified Bitumen for Anti-icing Purposes, Ind. Eng. Chem. Res., 2015, 54 (50), pp 12587–12596
[2] Weber M. D.; Bioinspired Hybrid White Light-Emitting Diodes. Advanced Materials, 2015; 27 (37): 5493
[3] Wu L.E. et al.; Carcinogenic Chromium(VI) Compounds Formed by Intracellular Oxidation of Chromium(III) Dietary Supplements by Adipocytes, Angew. Chem. Int. Ed. Volume 55, Issue 5
Pages 1742–1745
[4] Subendu S.M., Hans-Jürgen H.; Breaking Down Chemical Weapons by Metal–Organic Frameworks, Angew. Chem. Int. Ed. Volume 55, Issue 1, Pages 42–44
[5] M.P. Crockett et. al, Sulfur-Limonene Polysulfide: A Material Synthesized Entirely from Industrial By-Products and Its Use in Removing Toxic Metals from Water and Soil, Angewandte Chemie International Edition, 55, 5 [Open Acces]
Jak to po raz kolejny przekonaliśmy się w tym roku, drogowcy zawsze są zaskakiwani zimą. Niech tylko mocniej sypnie a okaże się, że pługosolarki gdzieś utknęły po drodze a powrót do domu staje się mocno utrudniony. Na ciekawy pomysł aby rozwiązać ten problem i przyspieszyć odladzanie dróg wpadli inżynierowie z Turcji - postanowili dodać sól do asfaltu.
Mrówczan potasu - sól stosowaną do odladzania w bardzo niskich temperaturach, uważany za substancję mniej szkodliwą dla środowiska od zwykłej soli - zmieszano z polimerem styrenowo-butadienowo-styrenowym, otrzymując żel w którym drobne cząstki soli zostały otoczone polimerem. Taki granulat połączono z masą bitumiczną będącą głównym składnikiem asfaltu drogowego. Następnie badano utrzymywanie się lodu i śniegu na powierzchni pokrytej testową mieszanką. Stwierdzono istotne opóźnienie pojawiania się oblodzenia i warstwy śliskiego śniegu, zarazem uwalnianie soli z materiału było dosyć niskie, rzędu 1-10% w ciągu 67 dni testu.[1]
Rozwiązanie to wydaje się jednak wiązać z problemami, podobnymi co solenie dróg z wierzchu - migracja uwalnianych soli wewnątrz mieszanki asfaltowej i krystalizacja w szczelinach może pogarszać wytrzymałość materiału. W dodatku sól będzie się zapewne uwalniała nie tylko w sezonie zimowym ale też podczas każdego deszczu, co spowoduje, że szybko wypłucze się cała i wzbogaci w sód glebę wokół drogi. Tak że niekoniecznie jest to udany pomysł.
Białkowe LEDy
Diody LED zrobiły w ostatnich latach wielką karierę w technice oświetleniowej. Będąc układami półprzewodników w których światło powstaje nie w wyniku żarzenia się jak w żarówkach, lecz podczas rekombinacji elektronów przewodnika z dziurami elektronowymi półprzewodnika typu p, osiągają większa sprawność energetyczną, i zużywają mniej prądu na wytworzenie tej samej ilości światła. Zarazem jednak są urządzeniami dosyć drogimi, na co składa się między innymi koszt wytworzenia dobrej jakości półprzewodników z tak egzotycznych materiałów jak domieszkowany arsenek galu. Tym bardziej, że jeden rodzaj półprzewodnika wytwarza światło w jednym kolorze, aby otrzymać światło białe zdatne do oświetlenia należy więc użyć przynajmniej trzech półprzewodników upakowanych jeden obok drugiego, tak aby ich zmieszane kolory tworzyły wrażenie światła białego. Podraża to koszty produkcji i zwiększa ilość pierwiastków zawartych w produkcie. Może się to jednak zmienić, jeśli do produkcji zostaną wprowadzone diody białkowe.
| @ M. D. Weber/University of Erlangen-Nuremberg |
Zmniejsza to zapotrzebowanie na rzadkie pierwiastki i potencjalnie zmniejsza koszty produkcji.[2]
Dobry chrom zamienia się w zły
Jak to już było na tym blogu wielokrotnie wspominane, ta sama substancja może być zarówno korzystna jak i trująca, przy czym zazwyczaj zależy to od dawki. Wiele metali w niewielkich ilościach jest potrzebnych dla organizmu, zaś w zbyt dużych stają się truciznami. Szczególnym przypadkiem jest chrom, którego oddziaływanie na organizm zależy też od stopnia utlenienia. Nisko utlenione sole na III stopniu utlenienia są przyswajane przez organizm i używane jako kofaktory wielu enzymów stanowiących ważne elementy metabolizmu.
Sole na VI stopniu utlenienia są natomiast toksyczne, od dawna wiadomo także, że mają działanie rakotwórcze. Jest to jedna z przyczyn przez które obecnie studenci na zajęciach chemii nie myją naczyń chromianką.
W związku z poszerzaniem się wiedzy o dobrych skutkach chromu III, a zwłaszcza o potencjalnym wpływie na masę ciała, producenci suplementów zaczęli produkować najrozmaitsze preparaty z solami chromu. Co rodziło dość oczywiste obawy, czy aby przypadkiem taki suplement nie będzie się gdzieś utleniał do toksycznej formy. Aby temu zaradzić suplemenciarze odpowiednio modyfikowali skład tabletek, chętnie używając organicznych soli i chelatów, które oprócz większej stabilności dodatkowo lepiej się wchłaniały. Ponieważ zaś w organizmie chrom nie utleniał się, wydawało się, że w takim razie suplementy te są całkiem bezpieczne.
Najnowsze badane międzynarodowego zespołu podważa jednak ten pogląd. Badacze potraktowali wyizolowane komórki tkanki tłuszczowej roztworami zawierającymi związki chromu III takie jak używane w suplementach, a więc na przykład octan, azotan lub kompleks z cysteiną, i przy pomocy spektroskopii fluorescecyjnej stwierdzili, że w komórkach zachodziło częściowe utlenienie do chromu VI.
Wybrano akurat adipocyty, to jest komórki tkanki tłuszczowej, z powodu znanej właściwości wydzielania nadtlenku wodoru w reakcji na insulinę. Nadtlenek jest silnym utleniaczem, zdolnym utlenić chrom III do chromu VI, co teraz udało się zaobserwować na żywych komórkach. To zaś oznaczałoby, że długotrwałe zażywanie dużych ilości suplementów chromu III niesie większe ryzyko zdrowotne, niż to dotychczas przypuszczano.[3]
Organiczny filtr na gazy bojowe.
Metal-Organic Frameworks czyli, jak to się tłumaczy metalo-organiczne szkielety (dokładniej byłoby tłumaczyć "kraty") to szczególny rodzaj materiałów który wywołuje coraz większe zainteresowanie. Jest to właściwie usieciowany, wielocentrowy kompleks zawierający rozgałęzione ligandy organiczne łączące się z wieloma jonami centralnymi. Struktura materiału jest na tyle regularna i dobrze zdefiniowana, że może on tworzyć kryształy. Pomiędzy częściami szkieletu powstają stosunkowo duże przestrzenie, otrzymana struktura jest zatem niezwykle porowata.
Ze względu na to, że tak usieciowane kompleksy mogą selektywnie pochłaniać inne substancje, a także wchodzić z nimi w reakcje, badania nad MOF-ami są dość intensywne, coraz pojawiają się nowe informacje o nowych zastosowaniach, a ja będę musiał poświęcić im osobny artykuł.
Na razie jednak nowinka - wynaleziono metalo-organiczny szkielet który mógłby został użyty do ochrony przed gazami bojowymi.
Szkieletowy kompleks cyrkonu z kwasem tereftalowym, w tym także wersje wzbogacone o tertbutanolan litu, okazały się być dobrymi katalizatorami które przy obecności śladów wody hydrolizują związki fosforoorganiczne, podobne do gazu musztardowego. Ponieważ związkiem tym można pokrywać włókna i materiały, dość oczywista jest przydatność nowo odkrytego związku w filtrach powietrza, mających neutralizować gazy bojowe.[4]
Cytryny i siarka do oczyszczania wody
Chemicy na świecie poszukują jak najprostszych metod produkcji przydatnych substancji, tak aby były one w miarę możliwości jak najtańsze. Tym tropem poszedł zespół chemików z Australii, którzy pokazali jak z siarki i składnika skórki cytrynowej stworzyć substancję oczyszczającą wodę z metali ciężkich.
D-Limonen to monoterpen będący główną substancją zapachową zawartą w skórce cytryny, jest częstym składnikiem mieszanej zapachowych i środków czystości. Ponieważ odzyskuje się go ze zmielonej skórki, której obtarcie jest jednym z etapów produkcji soku cytrynowego, przy dość dużej produkcji rocznej jest związkiem względnie tanim. Badacze szukający nowych materiałów chelatujących jony metali ciężkich zainteresowali się doniesieniami o tym, że limonen może utworzyć połączenia wielosiarczkowe. Wiadomym było, że liniowe wielosiarczki chętnie kompleksują jony metali, dlatego taka właściwość łatwej w otrzymaniu pochodnej taniego związku naturalnego byłaby bardzo korzystna.
Wzięto czystą siarkę i ogrzano do stopienia. W temperaturze 170 stopni, w której pękają pierścieniowe cząsteczki siarki, dodano do niej odpowiednią ilość limonenu. Z powstałej brunatnej masy oddzielono nieprzereagowaną siarkę, będący wynikiem utlenienia cymen i inne produkty uboczne, otrzymując czerwoną woskowatą substancję będącą cyklicznymi połączeniami dwóch cząsteczek limonenu, połączonych mostkami wielosiarczkowymi.
Jak się okazało substancja ta chętnie wychwytuje z wody jony metali ciężkich, w przypadku jonów rtęci II dodatkowo reagując wyraźną zmianą zabarwienia, co może mieć zastosowanie analityczne. [5]
---------
[1] D. Aydin et al.; Gelation-Stabilized Functional Composite-Modified Bitumen for Anti-icing Purposes, Ind. Eng. Chem. Res., 2015, 54 (50), pp 12587–12596
[2] Weber M. D.; Bioinspired Hybrid White Light-Emitting Diodes. Advanced Materials, 2015; 27 (37): 5493
[3] Wu L.E. et al.; Carcinogenic Chromium(VI) Compounds Formed by Intracellular Oxidation of Chromium(III) Dietary Supplements by Adipocytes, Angew. Chem. Int. Ed. Volume 55, Issue 5
Pages 1742–1745
[4] Subendu S.M., Hans-Jürgen H.; Breaking Down Chemical Weapons by Metal–Organic Frameworks, Angew. Chem. Int. Ed. Volume 55, Issue 1, Pages 42–44
[5] M.P. Crockett et. al, Sulfur-Limonene Polysulfide: A Material Synthesized Entirely from Industrial By-Products and Its Use in Removing Toxic Metals from Water and Soil, Angewandte Chemie International Edition, 55, 5 [Open Acces]
wtorek, 29 grudnia 2015
Cała tablica Mendelejewa... w soli
To strasznie zabawne, że z jednej strony ludzie się chemii boją a z drugiej ich ona zachęca. I w obu przypadkach odbywa się to na tej samej zasadzie zupełnego braku rozumienia o co chodzi.
Zwrot "to zawiera całą tablicę Mendelejewa" utarł się jako określenie strasznego syfu, mieszanki najprzeróżniejszych chemikaliów. Ostatnio media informowały że "cała tablica" to skład dopalaczy, że jest w wodzie z Wisły, że krąży w powietrzu w Krakowie... I w zasadzie nie próbuje się traktować tego dosłownie.
Dlatego bawi mnie gdy widzę, że dosłownie "cała tablica" może być traktowana jak zaleta. A tak rzecz się ma w reklamach różowej soli himalajskiej.
Sól himalajska to zwykła nieoczyszczona sól kamienna, która za sprawą zanieczyszczenia związkami żelaza przybrała różowo-pomarańczowy kolor i która za sprawą marketingu jest uważana za lepszą i zdrowszą od zwykłej nieoczyszczonej soli kamiennej z innych części świata. W tym od różowej soli kłodawskiej, która nabrała swego koloru z tych samych przyczyn, i której złoża powstały w tym samym czasie. Duże bryły soli kłodawskiej są znane jako element lamp solnych.
Jednym z elementów marketingu na temat soli himalajskiej jest występowanie w niej niezwykle dużej ilości pierwiastków, tym samym ma ona lepiej uzupełniać niedobory mikroelementów. Ten piękny slogan zamienia się we własne przeciwieństwo, gdy spojrzymy na listę tychże pierwiastków zawartych w soli (link). Jest ich 84, w tym także pierwiastki promieniotwórcze i toksyczne. Reklamiarze sami sobie podstawiają nogę taką listą.
Zobaczmy jakie to "niezbędne pierwiastki " w "idealnej kompozycji" się tam znajdują: polon, uran, neptun, pluton, protaktyn, tor, aktyn, rad... wszystkie promieniotwórcze. Czy ktoś teraz powie "zaraz będziemy świecić"? Następnie mamy takie "mikroelementy" jak neurotoksyczna rtęć, trujący tal, ołów, bar, antymon, stront, całkiem sporo fluoru... I cała masa pierwiastków które nie mają żadnego wpływu na organizm, jak choćby wszystkie lantanowce.
Generalnie rzecz biorąc lista podaje wszystkie pierwiastki z wyjątkiem gazów szlachetnych, w dwóch przypadkach dla nietrwałego technetu i samaru podając, że wprawdzie są niestabilne ale nie zostały wykluczone (co oznacza, że ich nie wykryto ale dopisano do listy bo może są).
Jeśli jednak przyjrzymy się dokładniej stwierdzimy, że większość pierwiastków ma zawartość poniżej 0,001 ppm. 1 ppm to jedna część na milion, a więc miligram na kilogram, a tych pierwiastków ma być mniej niż tysiąc razy mniej, prawdopodobnie tak mało, że metoda nie potrafiła oznaczyć ilości. I prawdopodobnie też na granicy błędu aparaturowego. Doprawdy, jeśli wziąć wodę z dowolnego źródła mineralnego i przebadać jej skład z dokładnością do bilionowych części to jest spora szansa, że otrzymamy podobny wynik, ślady rzadkich pierwiastków mogą się bowiem pojawić wszędzie. Tak na prawdę większość tej listy nie ma żadnego znaczenia.
Lista ta budzi zresztą moje wątpliwości, mam bowiem wrażenie, że wyniki badań ponaciągano jak się dało byle poszerzyć listę. Najwięcej wątpliwości wzbudza podawany poziom fransu, którego wykryto rentgenowsko ok. 1 ppm. Frans to promieniotwórczy pierwiastek o bardzo małej trwałości. Czas połowicznego rozpadu to 22 minuty*, dlatego nawet gdyby złoże składało się pierwotnie z czystego chlorku fransu to po upływie milionów lat nie dotrwałoby z tego ani odrobinę. Wykrywa się go w śladowych ilościach w minerałach towarzyszących uranowi, powstaje bowiem jako produkt pośredni przy jego rozpadzie. Szacuje się, że w danym momencie na całej planecie jest niespełna kilkadziesiąt gramów tego pierwiastka.
Zawartość 1 ppm którą podaje ta tabela oznaczałaby, że w kilkunastu tonach soli znajduje się tyle fransu co na całej planecie co w sytuacji, gdy zarazem uranu z którego frans powstaje ma być w soli tysiąc razy mniej jest niemożliwe. Najprawdopodobniej 1 ppm było granicą oznaczalności urządzenia, zaś za sygnał od fransu uznano szumy. Podobnie mogło być z pozostałymi pierwiastkami o najniższej zawartości <0,001 ppm gdzie uznano, że skoro jest jakiś sygnał poniżej możliwości oznaczenia ilościowego to można podać wartość graniczną i uznać, że pierwiastek jest.
Generalnie różowa sól himalajska w większości składa się z chlorku sodu i mikroskopijne domieszki innych pierwiastków nie zmieniają jej właściwości aż tak bardzo, aby uznawać ją za nie tylko zdrowszą ale wręcz nieszkodliwą - niektóre teksty twierdzą, że nadciśnienie wywołuje tylko biała sól warzona a różowa nie... bo nie. Tymczasem przyczyną zwiększenia ciśnienia tętniczego jest sód niezależnie od źródła. Jeśli ktoś na prawdę chce zadbać o zdrowie niech sobie sprawi sól niskosodową, gdzie dużą część chlorku sodu zastąpiono chlorkami potasu, wapnia i magnezu.
Różnica między solą różową a solą kamienną tzw. "szarą" polega głównie na tym, że jest sprzedawana w grubych ziarnach dzięki czemu widać jej kolor.
Po zmieleniu na pył do rozmiaru ziarna takiego jak sól sprzedawana u nas, będzie wyglądała na białą z powodu rozpraszania światła, co widać na tym reklamowym obrazku soli himalajskiej różnej grubości:
No i oczywiście jest kilka razy droższa.
---------
* Czas połowicznego rozpadu to czas po którym rozpadowi ulega połowa masy pierwiastka. Zależy on od statystycznego prawdopodobieństwa. W przypadku Fransu z 1 kg czystego pierwiastka po 22 minutach zostaje pół kilo, po następnych 22 minutach zostaje ćwierć, po upływie 2,5 godziny z kilograma pierwiastka zostaje mniej niż 1% po upływie 6 godzin 0,4 mg... Frans jest tak silnie promieniotwórczy, że dotychczas nie otrzymano choćby kawałka w stanie czystym zwłaszcza, że pod wpływem własnej promieniotwórczości natychmiast by odparował.
Zwrot "to zawiera całą tablicę Mendelejewa" utarł się jako określenie strasznego syfu, mieszanki najprzeróżniejszych chemikaliów. Ostatnio media informowały że "cała tablica" to skład dopalaczy, że jest w wodzie z Wisły, że krąży w powietrzu w Krakowie... I w zasadzie nie próbuje się traktować tego dosłownie.
Dlatego bawi mnie gdy widzę, że dosłownie "cała tablica" może być traktowana jak zaleta. A tak rzecz się ma w reklamach różowej soli himalajskiej.
Sól himalajska to zwykła nieoczyszczona sól kamienna, która za sprawą zanieczyszczenia związkami żelaza przybrała różowo-pomarańczowy kolor i która za sprawą marketingu jest uważana za lepszą i zdrowszą od zwykłej nieoczyszczonej soli kamiennej z innych części świata. W tym od różowej soli kłodawskiej, która nabrała swego koloru z tych samych przyczyn, i której złoża powstały w tym samym czasie. Duże bryły soli kłodawskiej są znane jako element lamp solnych.
Jednym z elementów marketingu na temat soli himalajskiej jest występowanie w niej niezwykle dużej ilości pierwiastków, tym samym ma ona lepiej uzupełniać niedobory mikroelementów. Ten piękny slogan zamienia się we własne przeciwieństwo, gdy spojrzymy na listę tychże pierwiastków zawartych w soli (link). Jest ich 84, w tym także pierwiastki promieniotwórcze i toksyczne. Reklamiarze sami sobie podstawiają nogę taką listą.
Zobaczmy jakie to "niezbędne pierwiastki " w "idealnej kompozycji" się tam znajdują: polon, uran, neptun, pluton, protaktyn, tor, aktyn, rad... wszystkie promieniotwórcze. Czy ktoś teraz powie "zaraz będziemy świecić"? Następnie mamy takie "mikroelementy" jak neurotoksyczna rtęć, trujący tal, ołów, bar, antymon, stront, całkiem sporo fluoru... I cała masa pierwiastków które nie mają żadnego wpływu na organizm, jak choćby wszystkie lantanowce.
Generalnie rzecz biorąc lista podaje wszystkie pierwiastki z wyjątkiem gazów szlachetnych, w dwóch przypadkach dla nietrwałego technetu i samaru podając, że wprawdzie są niestabilne ale nie zostały wykluczone (co oznacza, że ich nie wykryto ale dopisano do listy bo może są).
Jeśli jednak przyjrzymy się dokładniej stwierdzimy, że większość pierwiastków ma zawartość poniżej 0,001 ppm. 1 ppm to jedna część na milion, a więc miligram na kilogram, a tych pierwiastków ma być mniej niż tysiąc razy mniej, prawdopodobnie tak mało, że metoda nie potrafiła oznaczyć ilości. I prawdopodobnie też na granicy błędu aparaturowego. Doprawdy, jeśli wziąć wodę z dowolnego źródła mineralnego i przebadać jej skład z dokładnością do bilionowych części to jest spora szansa, że otrzymamy podobny wynik, ślady rzadkich pierwiastków mogą się bowiem pojawić wszędzie. Tak na prawdę większość tej listy nie ma żadnego znaczenia.
| Sól różowa z kopalni w Kłodawie |
Lista ta budzi zresztą moje wątpliwości, mam bowiem wrażenie, że wyniki badań ponaciągano jak się dało byle poszerzyć listę. Najwięcej wątpliwości wzbudza podawany poziom fransu, którego wykryto rentgenowsko ok. 1 ppm. Frans to promieniotwórczy pierwiastek o bardzo małej trwałości. Czas połowicznego rozpadu to 22 minuty*, dlatego nawet gdyby złoże składało się pierwotnie z czystego chlorku fransu to po upływie milionów lat nie dotrwałoby z tego ani odrobinę. Wykrywa się go w śladowych ilościach w minerałach towarzyszących uranowi, powstaje bowiem jako produkt pośredni przy jego rozpadzie. Szacuje się, że w danym momencie na całej planecie jest niespełna kilkadziesiąt gramów tego pierwiastka.
Zawartość 1 ppm którą podaje ta tabela oznaczałaby, że w kilkunastu tonach soli znajduje się tyle fransu co na całej planecie co w sytuacji, gdy zarazem uranu z którego frans powstaje ma być w soli tysiąc razy mniej jest niemożliwe. Najprawdopodobniej 1 ppm było granicą oznaczalności urządzenia, zaś za sygnał od fransu uznano szumy. Podobnie mogło być z pozostałymi pierwiastkami o najniższej zawartości <0,001 ppm gdzie uznano, że skoro jest jakiś sygnał poniżej możliwości oznaczenia ilościowego to można podać wartość graniczną i uznać, że pierwiastek jest.
Generalnie różowa sól himalajska w większości składa się z chlorku sodu i mikroskopijne domieszki innych pierwiastków nie zmieniają jej właściwości aż tak bardzo, aby uznawać ją za nie tylko zdrowszą ale wręcz nieszkodliwą - niektóre teksty twierdzą, że nadciśnienie wywołuje tylko biała sól warzona a różowa nie... bo nie. Tymczasem przyczyną zwiększenia ciśnienia tętniczego jest sód niezależnie od źródła. Jeśli ktoś na prawdę chce zadbać o zdrowie niech sobie sprawi sól niskosodową, gdzie dużą część chlorku sodu zastąpiono chlorkami potasu, wapnia i magnezu.
Różnica między solą różową a solą kamienną tzw. "szarą" polega głównie na tym, że jest sprzedawana w grubych ziarnach dzięki czemu widać jej kolor.
Po zmieleniu na pył do rozmiaru ziarna takiego jak sól sprzedawana u nas, będzie wyglądała na białą z powodu rozpraszania światła, co widać na tym reklamowym obrazku soli himalajskiej różnej grubości:
No i oczywiście jest kilka razy droższa.
---------
* Czas połowicznego rozpadu to czas po którym rozpadowi ulega połowa masy pierwiastka. Zależy on od statystycznego prawdopodobieństwa. W przypadku Fransu z 1 kg czystego pierwiastka po 22 minutach zostaje pół kilo, po następnych 22 minutach zostaje ćwierć, po upływie 2,5 godziny z kilograma pierwiastka zostaje mniej niż 1% po upływie 6 godzin 0,4 mg... Frans jest tak silnie promieniotwórczy, że dotychczas nie otrzymano choćby kawałka w stanie czystym zwłaszcza, że pod wpływem własnej promieniotwórczości natychmiast by odparował.
sobota, 7 listopada 2015
Chemiczne wieści (3.)
Tlen na komecie
Misja Rosetta badająca kometę 67/P Churymov-Gerasimenko budzi dziś mniejsze zainteresowanie, zwłaszcza od czasu nieszczęśliwie przedwczesnego końca lądownika, niemniej instrumenty sondy wciąż wysyłają ciekawe dane. Najnowsza publikacja Nature donosi o wykryciu w gazach wytryskujących z powierzchni jądra kometarnego molekularnego tlenu.
Jednym z instrumentów badawczych sondy jest spektrometr masowy ROSINA-DFMS. Przyrząd ten jonizuje gazy i wykrywa masy składających się nań cząsteczek, wykorzystując skłonność jonów do ruchu w polu elektrycznym z prędkością zależną od stosunku masy do ładunku. Dzięki temu możliwa jest szybka identyfikacja składu.
Dzięki niemu wiadomo było, że większość składu gazów emitowanych przez jądro kometarne (do 95%) stanowiła para wodna oraz tlenek i dwutlenek węgla. Bardziej interesujące okazały się składniki stanowiące resztę. Głównym okazał się być cząsteczkowy tlen, po nim elementarna siarka i metanol, ponadto ślady tlenków azotu i hydrazyny.
Skąd jednak tlen na komecie?
Jego zawartość porównano ze stężeniem dwutlenku węgla, tlenku i pary wodnej, wykazując że tylko w tym trzecim przypadku zachodzi wyraźna korelacja stężeń. Jeśli stężenia tlenu są powiązane ze stężeniami wody, to widocznie gazy te uwalniane są razem. Najprawdopodobniej promieniowanie ultrafioletowe wywołuje radiolizę lodu wodnego na powierzchni komety, powodując powstanie tlenu, który miesza się z lodem i wraz z nim sublimuje. Zachodzenie takiej reakcji potwierdzono zresztą eksperymentalnie. [1]
Fraktalne trójkąty
Fraktale to struktury samopodobne. Matematycznie ujmując, strukturę opisuje pewien prosty algorytm, którego nieskończone iteracje tworzą coraz mniejsze elementy, zachowujące podobieństwo do całości. Ta prostota sprawiająca, że rozległy i wydawałoby się skomplikowany wzór da się wywieść z kilku powtarzanych wciąż reguł sprawia, że struktury fraktalne bardzo często pojawiają się w przyrodzie, jako podstawa dla na przykład organizacji kolonii, układu żyłkowania liści, rozkładu pierzastych listków paproci czy form krystalicznych.
Jednym z pierwszych opisanych matematycznie fraktali, jest trójkąt Sierpińskiego. Ten polski matematyk zaproponował w 1915 roku figurę, otrzymaną wedle następującego algorytmu:
- Weź trójkąt równoboczny i łącząc środki boków podziel go na cztery mniejsze trójkąty
- Usuń trójkąt w środku
- Podziel w taki sam sposób trójkąty które pozostały
- Usuń trójkąciki po środku
- Powtórz operację w nieskończoność.
Wydawałoby się że w takiej sytuacji nic na z tego trójkąta powinno nie pozostać, w rzeczywistości jednak, ponieważ operujemy tutaj matematycznie na figurach teoretycznych, po nieskończonych podziałach i usuwaniach trójkątów otrzymamy zbiór punktów matematycznych o charakterystycznym, stałym układzie, który powtarza się w kolejnych powiększeniach w dowolnym miejscu tego trójkąta. Pole takiej figury jest zerowe.
Później wymyślono jeszcze inne podobne figury, jak dywan Sierpińskiego oparty o kwadraty, czy też bardziej dziś znane drzewkowate fraktale używane do tworzenia pięknych grafik komputerowych.
Ale co to ma wspólnego z chemią? Otóż chemicy od dawna zastanawiali się nad produkcją materiałów o strukturze fraktalnej. Jednym z rozwiązań są dendrymery, czyli cząsteczki o wielu rozgałęzieniach, które rozgałęziają się na mniejsze rozgałęzienia a te na jeszcze mniejsze i tak dalej dopóki tylko atomy gałązek jeszcze się w kolejnej warstwie mieszczą. Cząsteczki takie mają formę kulek, których modele przypominają nieco skonfundowanego jeża. Ta oparta jest o etylenodiaminę i amid kwasu propanowego:
Dendrymery bada się obecnie intensywnie pod kątem użycia jako nośniki leków, zewnętrzna warstwa gałązek tworzy bowiem powłoczkę z małymi porami, lecz wewnątrz pojawiają się znaczne, puste przestrzenie w których umieścić można pewną ilość potrzebnej substancji, jaką należy przetransportować w organizmie w pewne określone miejsca.
Tym ciekawsze są próby stworzenia płaskiej cząsteczki o strukturze Trójkąta Sierpińskiego.
Pierwszym takim doniesieniem była obserwacja struktur w pewnym stopniu podobnych do tego fraktala w agregatach DNA na odpowiednim podłożu. Fragmenty DNA ukształtowane w formie molekularnych płytek łączyły się końcami tworząc wzór, który badano mikroskopem sił atomowych.[2]
W zeszłym roku dwaj badacze z UMCS przedstawili symulacje, pokazujące że struktury Trójkąta Sierpińskiego powinny powstawać w warstwach zawierających sztywne cząsteczki organiczne zgięte pod odpowiednim kątem i łączące się na obu końcach za pośrednictwem jonów metalu, jako wynik spontanicznej samoorganizacji.[3]
Pomysł ten okazał się chyba bardzo obiecujący, skoro wyraźnie opierają się na nim najnowsze doniesienia. Najpierw podano informację o tym, że kompleksy terpirydyny z jonami miedzi tworzą struktury stanowiące fragment trójkąta Sierpińskiego.[4] W marcu pojawiła się praca chińskich chemików opisujących tworzenie się rozległych płatów fraktalnego wzoru w wyniku osadzania na powierzchni srebra dwóch podstawowych "cegiełek" - pochodnej terfenylu, z trzema pierścieniami benzenowymi połączonymi wiązaniem w zagiętą cząsteczkę i dwoma atomami bromu na końcach; oraz pochodnej kwaterfenylu zawierającej jeden pierścień benzenu więcej. Cząsteczki te łączyły się ze sobą przez oddziaływania między bromem a wodorem.[5]
Najnowsza praca opisuje płaty kompleksów dwunitrylu terfenylu z niklem na powierzchni srebra, w których pojawiają się płaty wzoru Trójkąta Sierpińskiego. [6]
Barwnik z ery jurajskiej
Skamieniałości dawnych zwierząt i roślin w większości wyglądają jak specyficznie ukształtowana skała, są szare, białe, niekiedy opalizują jak perła. Dlatego zachowanie się pewnych barwników sprzed milionów lat stanowi ciekawy przypadek. Tak jest ze skamieniałościami wymarłych jurajskich alg Solenopora o wapiennych skorupkach, które tworzyły gąbczaste kolonie, z czasem kamieniejące, z przerastającymi rocznymi warstwami. W przypadku niektórych okazów daje się zauważyć wyraźne różowe zabarwienie, będące najwyraźniej pozostałościami pierwotnego pigmentu. W niedawno opublikowanej pracy zbadano właściwości tego barwnika, stwierdzając że to bardzo nietypowa substancja.
Barwnik otrzymany ze skamielin Solenopora jurassica sprzed około 150 milionów lat, składa się z dwóch fragmentów węglowodorowych, stanowiących najwyraźniej nie znaną pochodną antybiotyku klostrubiny A (clostrubin A) i połączonych przez atom boru ugrupowaniem spiroboranowym. Związki organiczne zawierające bor są w naturze ogółem dosyć rzadkie.
Klostrubina jest antybiotykiem wykazującym aktywność przeciwko wielu szczepom odpornych drobnoustrojów i dlatego wzbudza duże nadzieje. Jest substancją poznaną całkiem niedawno, wyizolowaną w zeszłym roku z bakterii z rodzaju Clostridium. Duże podobieństwo struktur nowego antybiotyku i cząsteczki skamieniałego barwnika, nazwanego borolitochromem (czyli dosłownie borowym barwnikiem kamieni) jest o tyle ciekawe, że dotyczy różnych grup organizmów. Najwyraźniej geny odpowiedzialne za syntezę od dawna krążą w ekosystemie, gdzieniegdzie ujawniając się wyraźnie.
[7]
Ile atomów tworzy metal?
Wraz z przyjęciem i potwierdzeniem atomowej teorii budowy materii, chemicy i fizycy o bardziej filozoficznym zacięciu zaczęli zastanawiać się nad w sumie dość oczywistym pytaniem - ile potrzeba atomów bądź cząsteczek, aby z materii utworzyć materiał? Pojedynczy atom węgla ma inne właściwości niż choćby najmniejszy diament, trudno jest jednak wskazać moment, gdy następuje to przejście. Jest to swoisty odpowiednik "paradoksu łysego" - dwa stany skrajne, to jest łysina i pełne owłosienie, są od siebie bardzo wyraźnie różne; zarazem jednak jeśli osobie o pełnym owłosieniu zaczną pojedynczo wypadać włosy, trudno będzie nam wyznaczyć dokładną granicę od kiedy można już mówić o łysinie a kiedy jeszcze jest to tylko przerzedzenie włosów.
Ostatnie badania klastrów atomów metali pokazują jednak, że granicę naszej niepewności można w dużym stopniu zawęzić.
Metale to substancje stałe charakteryzujące się obecnością swobodnych elektronów poruszających się po sieci krystalicznej i tworzących wspólną, dużą chmurę elektronową. Właśnie dlatego metale dobrze przewodzą ciepło i elektryczność oraz odbijają światło ze srebrzystym, metalicznym połyskiem. Odpowiednio duże skupiska atomów metali też będą tworzyły swoją chmurę elektronową ale już pozostałe właściwości metaliczne niekoniecznie mogą być realizowane. Bardzo małe klastry zachowują się jak cząsteczki jakiegoś związku, często wykazując dość nieoczekiwane właściwości, przykładowo klastry 13 atomów glinu zachowują się jakby były atomem halogenku, mogąc oddawać elektrony i tworzyć aniony.
Fińscy chemicy z Uniwersytetu Jyväskylä badali takie właśnie graniczne klastry atomów złota, sprawdzając w jaki sposób reagują ze światłem. Klastry małe, mniejsze niż 102 atomy, zachowywały się jak cząsteczki. Pod wpływem fotonów przybierały pewne stany energetyczne obejmujące cały klaster, a wypromieniowanie i rozproszenie energii następowało stosunkowo (jak na atomową skalę) wolno. Grupy powyżej 144 atomów zachowywały się tak jak makroskopowe kawałki metalu, to jest szybko rozpraszały energię padającego światła, odbijały je zgodnie z prawem odbicia od lustra i nie przyjmowały ogólnoklastrowych stanów energetycznych.
Różnica była dość drastyczna - klastry większe o 42 atomy rozpraszały energię fotonów 100 razy szybciej. Natomiast klastry o wielkościach pośrednich wykazywały pośrednie własności, szybko zmieniające się z dodawaniem kolejnych atomów.
Tym samym w pewnym stopniu możliwe staje się wyznaczenie granicy między światem praw kwantowych a światem zjawisk fizyki klasycznej.[8]
-------------------
Źródła:
[1] A Bieler et al, Nature, 2015, DOI: 10.1038/nature15707
[2] Paul W K Rothemund, Nick Papadakis, Erik Winfree; Algorithmic self-assembly of DNA Sierpinski triangles. PLoS Biol 2004 Dec 7;2(12):e424. Epub 2004 Dec 7. [Open Acces]
[3] D. Nieckarz, P. Szabelski; Simulation of the self-assembly of simple molecular bricks into Sierpiński triangle, Chem. Commun., 2014,50, 6843-6845
[4] Rajarshi S. et al.; One-step multicomponent self-assembly of a first-generation Sierpiński triangle: from fractal design to chemical reality. Angew Chem Int Ed Engl 2014 Nov 11;53(45):12182-5.
[5] Shang J. et al.; Assembling molecular Sierpiński triangle fractals, Nature Chemistry 7, 389–393
On-surface construction of a metal–organic Sierpiński triangle, Chem. Commun., 2015,51, 14164-14166
[7] Klaus Wolkenstein et al. Structure and Absolute Configuration of Jurassic Polyketide-Derived Spiroborate Pigments Obtained from Microgram Quantities, J. Am. Chem. Soc., 2015, 137 (42), pp 13460–13463 (2015).[Open Access]
[8] Mustalhi S. et al.; Molecule-like Photodynamics of Au102(pMBA)44 Nanocluster, ACS Nano, 2015, 9 (3), pp 2328–2335
Misja Rosetta badająca kometę 67/P Churymov-Gerasimenko budzi dziś mniejsze zainteresowanie, zwłaszcza od czasu nieszczęśliwie przedwczesnego końca lądownika, niemniej instrumenty sondy wciąż wysyłają ciekawe dane. Najnowsza publikacja Nature donosi o wykryciu w gazach wytryskujących z powierzchni jądra kometarnego molekularnego tlenu.
Jednym z instrumentów badawczych sondy jest spektrometr masowy ROSINA-DFMS. Przyrząd ten jonizuje gazy i wykrywa masy składających się nań cząsteczek, wykorzystując skłonność jonów do ruchu w polu elektrycznym z prędkością zależną od stosunku masy do ładunku. Dzięki temu możliwa jest szybka identyfikacja składu.
Dzięki niemu wiadomo było, że większość składu gazów emitowanych przez jądro kometarne (do 95%) stanowiła para wodna oraz tlenek i dwutlenek węgla. Bardziej interesujące okazały się składniki stanowiące resztę. Głównym okazał się być cząsteczkowy tlen, po nim elementarna siarka i metanol, ponadto ślady tlenków azotu i hydrazyny.
Skąd jednak tlen na komecie?
Jego zawartość porównano ze stężeniem dwutlenku węgla, tlenku i pary wodnej, wykazując że tylko w tym trzecim przypadku zachodzi wyraźna korelacja stężeń. Jeśli stężenia tlenu są powiązane ze stężeniami wody, to widocznie gazy te uwalniane są razem. Najprawdopodobniej promieniowanie ultrafioletowe wywołuje radiolizę lodu wodnego na powierzchni komety, powodując powstanie tlenu, który miesza się z lodem i wraz z nim sublimuje. Zachodzenie takiej reakcji potwierdzono zresztą eksperymentalnie. [1]
Fraktalne trójkąty
Fraktale to struktury samopodobne. Matematycznie ujmując, strukturę opisuje pewien prosty algorytm, którego nieskończone iteracje tworzą coraz mniejsze elementy, zachowujące podobieństwo do całości. Ta prostota sprawiająca, że rozległy i wydawałoby się skomplikowany wzór da się wywieść z kilku powtarzanych wciąż reguł sprawia, że struktury fraktalne bardzo często pojawiają się w przyrodzie, jako podstawa dla na przykład organizacji kolonii, układu żyłkowania liści, rozkładu pierzastych listków paproci czy form krystalicznych.
Jednym z pierwszych opisanych matematycznie fraktali, jest trójkąt Sierpińskiego. Ten polski matematyk zaproponował w 1915 roku figurę, otrzymaną wedle następującego algorytmu:
- Weź trójkąt równoboczny i łącząc środki boków podziel go na cztery mniejsze trójkąty
- Usuń trójkąt w środku
- Podziel w taki sam sposób trójkąty które pozostały
- Usuń trójkąciki po środku
- Powtórz operację w nieskończoność.
Wydawałoby się że w takiej sytuacji nic na z tego trójkąta powinno nie pozostać, w rzeczywistości jednak, ponieważ operujemy tutaj matematycznie na figurach teoretycznych, po nieskończonych podziałach i usuwaniach trójkątów otrzymamy zbiór punktów matematycznych o charakterystycznym, stałym układzie, który powtarza się w kolejnych powiększeniach w dowolnym miejscu tego trójkąta. Pole takiej figury jest zerowe.
Później wymyślono jeszcze inne podobne figury, jak dywan Sierpińskiego oparty o kwadraty, czy też bardziej dziś znane drzewkowate fraktale używane do tworzenia pięknych grafik komputerowych.
Ale co to ma wspólnego z chemią? Otóż chemicy od dawna zastanawiali się nad produkcją materiałów o strukturze fraktalnej. Jednym z rozwiązań są dendrymery, czyli cząsteczki o wielu rozgałęzieniach, które rozgałęziają się na mniejsze rozgałęzienia a te na jeszcze mniejsze i tak dalej dopóki tylko atomy gałązek jeszcze się w kolejnej warstwie mieszczą. Cząsteczki takie mają formę kulek, których modele przypominają nieco skonfundowanego jeża. Ta oparta jest o etylenodiaminę i amid kwasu propanowego:
Dendrymery bada się obecnie intensywnie pod kątem użycia jako nośniki leków, zewnętrzna warstwa gałązek tworzy bowiem powłoczkę z małymi porami, lecz wewnątrz pojawiają się znaczne, puste przestrzenie w których umieścić można pewną ilość potrzebnej substancji, jaką należy przetransportować w organizmie w pewne określone miejsca.
Tym ciekawsze są próby stworzenia płaskiej cząsteczki o strukturze Trójkąta Sierpińskiego.
Pierwszym takim doniesieniem była obserwacja struktur w pewnym stopniu podobnych do tego fraktala w agregatach DNA na odpowiednim podłożu. Fragmenty DNA ukształtowane w formie molekularnych płytek łączyły się końcami tworząc wzór, który badano mikroskopem sił atomowych.[2]
W zeszłym roku dwaj badacze z UMCS przedstawili symulacje, pokazujące że struktury Trójkąta Sierpińskiego powinny powstawać w warstwach zawierających sztywne cząsteczki organiczne zgięte pod odpowiednim kątem i łączące się na obu końcach za pośrednictwem jonów metalu, jako wynik spontanicznej samoorganizacji.[3]
Pomysł ten okazał się chyba bardzo obiecujący, skoro wyraźnie opierają się na nim najnowsze doniesienia. Najpierw podano informację o tym, że kompleksy terpirydyny z jonami miedzi tworzą struktury stanowiące fragment trójkąta Sierpińskiego.[4] W marcu pojawiła się praca chińskich chemików opisujących tworzenie się rozległych płatów fraktalnego wzoru w wyniku osadzania na powierzchni srebra dwóch podstawowych "cegiełek" - pochodnej terfenylu, z trzema pierścieniami benzenowymi połączonymi wiązaniem w zagiętą cząsteczkę i dwoma atomami bromu na końcach; oraz pochodnej kwaterfenylu zawierającej jeden pierścień benzenu więcej. Cząsteczki te łączyły się ze sobą przez oddziaływania między bromem a wodorem.[5]
Najnowsza praca opisuje płaty kompleksów dwunitrylu terfenylu z niklem na powierzchni srebra, w których pojawiają się płaty wzoru Trójkąta Sierpińskiego. [6]
Barwnik z ery jurajskiej
Skamieniałości dawnych zwierząt i roślin w większości wyglądają jak specyficznie ukształtowana skała, są szare, białe, niekiedy opalizują jak perła. Dlatego zachowanie się pewnych barwników sprzed milionów lat stanowi ciekawy przypadek. Tak jest ze skamieniałościami wymarłych jurajskich alg Solenopora o wapiennych skorupkach, które tworzyły gąbczaste kolonie, z czasem kamieniejące, z przerastającymi rocznymi warstwami. W przypadku niektórych okazów daje się zauważyć wyraźne różowe zabarwienie, będące najwyraźniej pozostałościami pierwotnego pigmentu. W niedawno opublikowanej pracy zbadano właściwości tego barwnika, stwierdzając że to bardzo nietypowa substancja.
Barwnik otrzymany ze skamielin Solenopora jurassica sprzed około 150 milionów lat, składa się z dwóch fragmentów węglowodorowych, stanowiących najwyraźniej nie znaną pochodną antybiotyku klostrubiny A (clostrubin A) i połączonych przez atom boru ugrupowaniem spiroboranowym. Związki organiczne zawierające bor są w naturze ogółem dosyć rzadkie.
Klostrubina jest antybiotykiem wykazującym aktywność przeciwko wielu szczepom odpornych drobnoustrojów i dlatego wzbudza duże nadzieje. Jest substancją poznaną całkiem niedawno, wyizolowaną w zeszłym roku z bakterii z rodzaju Clostridium. Duże podobieństwo struktur nowego antybiotyku i cząsteczki skamieniałego barwnika, nazwanego borolitochromem (czyli dosłownie borowym barwnikiem kamieni) jest o tyle ciekawe, że dotyczy różnych grup organizmów. Najwyraźniej geny odpowiedzialne za syntezę od dawna krążą w ekosystemie, gdzieniegdzie ujawniając się wyraźnie.
[7]
| Borolitochrom i skała z której go otrzymano. |
Ile atomów tworzy metal?
Wraz z przyjęciem i potwierdzeniem atomowej teorii budowy materii, chemicy i fizycy o bardziej filozoficznym zacięciu zaczęli zastanawiać się nad w sumie dość oczywistym pytaniem - ile potrzeba atomów bądź cząsteczek, aby z materii utworzyć materiał? Pojedynczy atom węgla ma inne właściwości niż choćby najmniejszy diament, trudno jest jednak wskazać moment, gdy następuje to przejście. Jest to swoisty odpowiednik "paradoksu łysego" - dwa stany skrajne, to jest łysina i pełne owłosienie, są od siebie bardzo wyraźnie różne; zarazem jednak jeśli osobie o pełnym owłosieniu zaczną pojedynczo wypadać włosy, trudno będzie nam wyznaczyć dokładną granicę od kiedy można już mówić o łysinie a kiedy jeszcze jest to tylko przerzedzenie włosów.
Ostatnie badania klastrów atomów metali pokazują jednak, że granicę naszej niepewności można w dużym stopniu zawęzić.
Metale to substancje stałe charakteryzujące się obecnością swobodnych elektronów poruszających się po sieci krystalicznej i tworzących wspólną, dużą chmurę elektronową. Właśnie dlatego metale dobrze przewodzą ciepło i elektryczność oraz odbijają światło ze srebrzystym, metalicznym połyskiem. Odpowiednio duże skupiska atomów metali też będą tworzyły swoją chmurę elektronową ale już pozostałe właściwości metaliczne niekoniecznie mogą być realizowane. Bardzo małe klastry zachowują się jak cząsteczki jakiegoś związku, często wykazując dość nieoczekiwane właściwości, przykładowo klastry 13 atomów glinu zachowują się jakby były atomem halogenku, mogąc oddawać elektrony i tworzyć aniony.
Fińscy chemicy z Uniwersytetu Jyväskylä badali takie właśnie graniczne klastry atomów złota, sprawdzając w jaki sposób reagują ze światłem. Klastry małe, mniejsze niż 102 atomy, zachowywały się jak cząsteczki. Pod wpływem fotonów przybierały pewne stany energetyczne obejmujące cały klaster, a wypromieniowanie i rozproszenie energii następowało stosunkowo (jak na atomową skalę) wolno. Grupy powyżej 144 atomów zachowywały się tak jak makroskopowe kawałki metalu, to jest szybko rozpraszały energię padającego światła, odbijały je zgodnie z prawem odbicia od lustra i nie przyjmowały ogólnoklastrowych stanów energetycznych.
Różnica była dość drastyczna - klastry większe o 42 atomy rozpraszały energię fotonów 100 razy szybciej. Natomiast klastry o wielkościach pośrednich wykazywały pośrednie własności, szybko zmieniające się z dodawaniem kolejnych atomów.
Tym samym w pewnym stopniu możliwe staje się wyznaczenie granicy między światem praw kwantowych a światem zjawisk fizyki klasycznej.[8]
-------------------
Źródła:
[1] A Bieler et al, Nature, 2015, DOI: 10.1038/nature15707
[2] Paul W K Rothemund, Nick Papadakis, Erik Winfree; Algorithmic self-assembly of DNA Sierpinski triangles. PLoS Biol 2004 Dec 7;2(12):e424. Epub 2004 Dec 7. [Open Acces]
[3] D. Nieckarz, P. Szabelski; Simulation of the self-assembly of simple molecular bricks into Sierpiński triangle, Chem. Commun., 2014,50, 6843-6845
[4] Rajarshi S. et al.; One-step multicomponent self-assembly of a first-generation Sierpiński triangle: from fractal design to chemical reality. Angew Chem Int Ed Engl 2014 Nov 11;53(45):12182-5.
[5] Shang J. et al.; Assembling molecular Sierpiński triangle fractals, Nature Chemistry 7, 389–393
On-surface construction of a metal–organic Sierpiński triangle, Chem. Commun., 2015,51, 14164-14166
[7] Klaus Wolkenstein et al. Structure and Absolute Configuration of Jurassic Polyketide-Derived Spiroborate Pigments Obtained from Microgram Quantities, J. Am. Chem. Soc., 2015, 137 (42), pp 13460–13463 (2015).[Open Access]
[8] Mustalhi S. et al.; Molecule-like Photodynamics of Au102(pMBA)44 Nanocluster, ACS Nano, 2015, 9 (3), pp 2328–2335
wtorek, 6 października 2015
Chemiczne wieści (2.)
Wysokociśnieniowy osm.
Zachowanie się materiałów pod ekstremalnie wysokim ciśnieniem to dość ciekawa sprawa Ciała stałe zasadniczo uznaje się za nieściśliwe, jednak w rzeczywistości mają pewną niewielką ściśliwość, zaś poddanie ich wysokiemu ciśnieniu powoduje zbliżenie budujących je atomów, czasem powodując przemianę do nowej formy uporządkowania lub ujawnienie się nietypowych cech.
Zespół naukowców pod kierunkiem niemieckiego uniwersytetu Bayreuth dokonał ostatnio dość szczególnego odkrycia. Przy pomocy nowej komory ciśnieniowej udało się im wytworzyć najwyższe dotąd otrzymane ciśnienie statyczne - nacisk 770 GPa, czyli ciśnienie dwa razy większe niż w jądrze Ziemi. Ciśnieniu temu poddano natomiast najbardziej gęsty metal - osm - znany też z bardzo niskiej ściśliwości.
Jeśli prawie najmniej ściśliwy materiał poddano najwyższemu ciśnieniu, to chyba powinno z tego coś wyniknąć? Wbrew oczekiwaniom osm nie przyjął żadnej nowej struktury krystalicznej, jedynie atomy nieco się do siebie przybliżyły, zachowując ten sam układ co w warunkach normalnych. Zaskoczeniem okazało się natomiast coś innego - pomiędzy atomami oprócz znanych już wiązań metalicznych, utworzonych przez elektrony walencyjne, zaczęły się także pojawiać oddziaływania utworzone przez elektrony wewnętrznych powłok elektronowych, które nigdy nie biorą udziału w tworzeniu wiązań. [1]
Wcześniej znane były wyliczenia teoretyczne sugerujące możliwość tworzenia wiązań między wewnętrznymi elektronami przy dużych ciśnieniach, ale teraz taka możliwość znalazła jakieś potwierdzenie w badaniach rentgenowskich rzeczywistego materiału.
Najtrudniej topliwy materiał
Tantal, metal przejściowy podobny do cyrkonu, jest znany z wysokotopliwego węgliku, który staje się płynny dopiero w temperaturze 3880*C, podobną temperaturę topnienia ma węglik hafnu. Połączenie tych substancji daje materiał o jeszcze większej odporności na temperaturę, dla składu Ta4HfC5 topiący się dopiero przy 3990 stopniach Celsiusza. Ale fizykochemicy nie poprzestają. Nowe wyliczenia jakie właśnie opublikowano sugerują możliwość stworzenia jeszcze trwalszego materiału. Wedle symulacji mieszany węglik-azotek hafnu o optymalnym składzie HfN0,38C0,51, osiągnąć może temperaturę topnienia nawet do 4400*C.[2]
Pozostaje teraz tylko poczekać na próby uzyskania nowego materiału.
Bateria z grzybów
W poprzednim odcinku wieści mówiłem już o otrzymywaniu kwantowych kropek ze zmiksowanej kapusty, dlatego baterie do telefonów ze zwęglonych grzybów nie będą chyba aż tak zaskakujące.
Jednym z głównych komponentów baterii litowych jest grafitowa anoda, zwykle wytwarzana z syntetycznego grafitu porowatego. Jego wytworzenie w ilościach przemysłowych jest jednak nieco skomplikowane i niezbyt ekologiczne, stąd liczne próby stworzenia dobrej alternatywy. Jedną z tych prób opisuje praca badaczy z University of California.
Wzięli oni cienki plaster wycięty z owocnika grzyba, akurat w tym przypadku była to pieczarka, po czym poddali go zwęgleniu w hydroreaktorze w wysokiej temperaturze. Otrzymany zwęglony plaster dodatkowo wyżarzono uzyskując porowaty materiał złożony ze splecionych węglowych włókien zachowujących strukturę strzępek grzyba i przewodzący prąd, będący dobrym zamiennikiem grafitu. Anoda wytworzona ze zwęglonego grzyba nie potrzebuje dodatkowych lepiszczy, dobrze przyjmuje płynny elektrolit i dobrze oddziałuje z jonami. Bardzo możliwe że ze względu na strukturę będzie wytrzymywała więcej cykli ładowania.[3]
Woda orto, woda para
Jądro atomu wodoru to proton, który jako samotna cząstka posiada szczególną właściwość jaką jest spin. W dużym uproszczeniu można przedstawić to jako wektor momentu pędu protonu, mogącego obracać się bądź w jedną lub w drugą stronę - opis kwantowy tego zjawiska jest dużo bardziej skomplikowany. Ponieważ proton jest cząstką naładowaną, jego spin powoduje powstanie małego jądrowego pola magnetycznego. W sytuacji gdy mamy cząsteczkę wodoru składającą się z dwóch atomów te jądrowe pola magnetyczne oddziałują ze sobą i możliwe stają się dwie sytuacje którym odpowiadają różne energie - wodór orto ma spiny skierowane w tą samą stronę, wodór para w przeciwną. Ta druga sytuacja jest minimalnie korzystniejsza energetycznie jednak różnica energii jest na tyle mała że w warunkach normalnych wodór posiada mieszankę cząsteczek z tych dwóch stanów z przewagą ortowodoru.
To zresztą ciekawa sytuacja - pod wpływem temperatury trwalszy parawodór przechodzi w ortowodór, natomiast przemiana w drugą stronę jest powolna bowiem utrudnia ją zabronione przejście kwantowe. W efekcie w wodorze gazowym przeważa mniej trwała energetycznie odmiana, co ma też przełożenie na skład wodoru ciekłego. W niskich temperaturach powolna przemiana ortowodoru w trwalszy parawodór ma istotne znaczenie dla przechowywania, bowiem przemiana ta przebiega z wydzielaniem ciepła. Aby więc ułatwić przechowywanie ciekłego wodoru, katalizuje się tą przemianę przy pomocy odpowiedniego dielektryka otrzymując przewagę trwalszej formy.
Wróćmy jednak do naszego newsa.
W cząsteczce wody dwa wodory znajdują się na tyle blisko siebie, że także i u nich powinna być możliwa izomeria spinowa, jednak dotychczas nie udało się tego wykryć. Cząsteczki wody oddziaływały ze sobą powodując ciągłą zmianę spinów, toteż trudno było uchwycić sygnał od populacji poszczególnych izomerów. Jak się jednak okazało, możliwe jest odizolowanie od siebie cząsteczek. Zespół badaczy z University of Suthampton otrzymał pochodną fullerenu C60 z pojedynczymi cząsteczkami wody wewnątrz węglowej kul. Tego typu połączenie stanowi kolejny przykład związków cząsteczek "połączonych acz nie związanych" jak omawiane tu kiedyś katenany.
Cząstki C60@H2O były wystarczająco odizolowane aby w niskich temperaturach możliwe było wykrycie czystych sygnałów izomerów spinowych wody i przemian jednego w drugi.
[4]
Paliwo z powietrza
Temat przeróbki dwutlenku węgla na paliwo jest aktualnie bardzo gorący, stąd też w ostatnich miesiącach ukazało się wiele doniesień dotyczących nowych sposobów takiej syntezy.
Wedle doniesień z początku sierpnia zespół z Argonne National Laboratory stworzył nowy katalizator do reakcji zamiany dwutlenku węgla i wody w metanol. Znane dotychczas katalizatory oparte o tlenki cynku i glinu zostały zmodyfikowane poprzez precyzyjne umieszczenie na powierzchni tlenku cynku klastrów czterech atomów miedzi, stanowiących centrum katalityczne do którego przyłącza się cząsteczka CO2. Materiał pozwala na przeprowadzanie reakcji w warunkach niższego ciśnienia i temperatury, co poprawia opłacalność całego procesu produkcyjnego. [5]
A co robić z metanolem? Można go użyć jako paliwa, ale można też poddać innym procesom. Pod koniec września pojawiła się praca zespołu z ETH w Zurychu na temat nowego katalizatora umożliwiający ekonomiczny proces konwersji metanol-olefina (MTO). Metanol lub eter dimetylowy pod odpowiednim ciśnieniem może ulegać przemianie na powierzchni tlenku cynku, z wytworzeniem etenu. [6]
Mniej toksyczne wydobycie złota
Jednym ze sposobów na uzyskanie złota ze złóż w których występuje w postaci rozproszonej, jest metoda rtęciowa, w której wykorzystuje się zdolność rtęci do rozpuszczania złota i tworzenie amalgamatu, od którego może być oddzielona przez destylację. Dziś już w zasadzie się od niej odchodzi z powodu wysokiej szkodliwości, mimo to wciąż używają jej małe kopalnie w biedniejszych rejonach świata, co jest źródłem zanieczyszczeń. Szacuje się że nawet 40% rocznych emisji rtęci do środowiska pochodzi z małych kopalni Indonezji i środkowej Afryki.
Oczywiście można próbować różnych zakazów, ale trudno jest je egzekwować, tym bardziej że praca w kopalniach stanowi często jedyne źródło utrzymania najbiedniejszych. Jest też jednak ich przekleństwem - pracownicy mieszający skałę z rtęcią, wyciskający amalgamat (nawet ręcznie) a zwłaszcza pracujący przy wypalaniu amalgamatu dla usunięcia rtęci po kilku latach zaczynają chorować. Skażenie wraz z zanieczyszczonym złotem przenosi się do miast gdzie na opary rtęci narażone są rodziny złotników przetapiających surowe złoto.
Jednym z ciekawych sposobów aby sprawić, że proces stanie się mniej groźny dla tych, którzy nie chcą z niego zrezygnować, jest dostarczenie wytwórcom tanich aparatów do bezpieczniejszej destylacji.
Geochemik Marcello Veiga z kanadyjskiego Uniwersytetu Inżynierii i Górnictwa opracował przyrząd podobny do blaszanej retorty, takiej jak używane przez dawnych alchemików. Zbiornik w którym wyżarzany jest amalgamat kończy się długą opadającą rurą, której wąski koniec kończy się w zbiorniku z zimną wodą. Opary rtęci zamiast trafiać do atmosfery są skraplane a krople metalu zbierane na dnie zbiornika, dzięki czemu może być użyty ponownie. W efekcie emisje rtęci spadają o 90%, mniej jej trafia do środowiska a pracownicy są mniej narażeni na toksyczne opary[7]
---------
[1] The most incompressible metal osmium at static pressures above 750 GPa;L. Dubrovinsky, N. Dubrovinskaia, E. Bykova, M. Bykov, V. Prakapenka, C. Prescher, K. Glazyrin, H.-P. Liermann, M. Hanfland, M. Ekholm, Q. Feng, L. V. Pourovskii, M. I. Katsnelson, J. M. Wills, and I. A. Abrikosov; Nature (2015); DOI: 10.1038/nature14681
[2] Prediction of the material with highest known melting point fromab initiomolecular dynamics calculations. Qi-Jun Hong, Axel van de Walle. Physical Review B, 2015; 92 (2) DOI: 10.1103/PhysRevB.92.020104
[3] Bio-Derived, Binderless, Hierarchically Porous Carbon Anodes for Li-ion Batteries. Brennan Campbell, Robert Ionescu, Zachary Favors, Cengiz S. Ozkan, Mihrimah Ozkan. Scientific Reports, 2015; 5: 14575 DOI: 10.1038/srep14575
[4] Electrical detection of ortho–para conversion in fullerene-encapsulated water. Benno Meier, Salvatore Mamone, Maria Concistrè, Javier Alonso-Valdesueiro, Andrea Krachmalnicoff, Richard J. Whitby, Malcolm H. Levitt. Nature Communications, 2015; 6: 8112 DOI: 10.1038/ncomms9112
[5] Carbon Dioxide Conversion to Methanol over Size-Selected Cu4Clusters at Low Pressures. Cong Liu, Bing Yang, Eric Tyo, Soenke Seifert, Janae DeBartolo, Bernd von Issendorff, Peter Zapol, Stefan Vajda, Larry A. Curtiss. Journal of the American Chemical Society, 2015; 137 (27): 8676 DOI: 10.1021/jacs.5b03668
[6] Cooperativity between Al Sites Promotes Hydrogen Transfer and Carbon–Carbon Bond Formation upon Dimethyl Ether Activation on Alumina, Aleix Comas-Vives, Maxence Valla, Christophe Copéret, Philippe Sautet.. ACS Central Science , 2015 r.; 150807151553006 DOI: 10,1021 / acscentsci.5b00226
[7] http://www.rsc.org/chemistryworld/2015/08/chemistry-saves-thousands-gold-miners-mercury-poisoning
Zachowanie się materiałów pod ekstremalnie wysokim ciśnieniem to dość ciekawa sprawa Ciała stałe zasadniczo uznaje się za nieściśliwe, jednak w rzeczywistości mają pewną niewielką ściśliwość, zaś poddanie ich wysokiemu ciśnieniu powoduje zbliżenie budujących je atomów, czasem powodując przemianę do nowej formy uporządkowania lub ujawnienie się nietypowych cech.
Zespół naukowców pod kierunkiem niemieckiego uniwersytetu Bayreuth dokonał ostatnio dość szczególnego odkrycia. Przy pomocy nowej komory ciśnieniowej udało się im wytworzyć najwyższe dotąd otrzymane ciśnienie statyczne - nacisk 770 GPa, czyli ciśnienie dwa razy większe niż w jądrze Ziemi. Ciśnieniu temu poddano natomiast najbardziej gęsty metal - osm - znany też z bardzo niskiej ściśliwości.
Jeśli prawie najmniej ściśliwy materiał poddano najwyższemu ciśnieniu, to chyba powinno z tego coś wyniknąć? Wbrew oczekiwaniom osm nie przyjął żadnej nowej struktury krystalicznej, jedynie atomy nieco się do siebie przybliżyły, zachowując ten sam układ co w warunkach normalnych. Zaskoczeniem okazało się natomiast coś innego - pomiędzy atomami oprócz znanych już wiązań metalicznych, utworzonych przez elektrony walencyjne, zaczęły się także pojawiać oddziaływania utworzone przez elektrony wewnętrznych powłok elektronowych, które nigdy nie biorą udziału w tworzeniu wiązań. [1]
Wcześniej znane były wyliczenia teoretyczne sugerujące możliwość tworzenia wiązań między wewnętrznymi elektronami przy dużych ciśnieniach, ale teraz taka możliwość znalazła jakieś potwierdzenie w badaniach rentgenowskich rzeczywistego materiału.
Najtrudniej topliwy materiał
Tantal, metal przejściowy podobny do cyrkonu, jest znany z wysokotopliwego węgliku, który staje się płynny dopiero w temperaturze 3880*C, podobną temperaturę topnienia ma węglik hafnu. Połączenie tych substancji daje materiał o jeszcze większej odporności na temperaturę, dla składu Ta4HfC5 topiący się dopiero przy 3990 stopniach Celsiusza. Ale fizykochemicy nie poprzestają. Nowe wyliczenia jakie właśnie opublikowano sugerują możliwość stworzenia jeszcze trwalszego materiału. Wedle symulacji mieszany węglik-azotek hafnu o optymalnym składzie HfN0,38C0,51, osiągnąć może temperaturę topnienia nawet do 4400*C.[2]
Pozostaje teraz tylko poczekać na próby uzyskania nowego materiału.
Bateria z grzybów
W poprzednim odcinku wieści mówiłem już o otrzymywaniu kwantowych kropek ze zmiksowanej kapusty, dlatego baterie do telefonów ze zwęglonych grzybów nie będą chyba aż tak zaskakujące.
| Wszystko co trzeba o metodzie. Udostępnione przez University of California |
Jednym z głównych komponentów baterii litowych jest grafitowa anoda, zwykle wytwarzana z syntetycznego grafitu porowatego. Jego wytworzenie w ilościach przemysłowych jest jednak nieco skomplikowane i niezbyt ekologiczne, stąd liczne próby stworzenia dobrej alternatywy. Jedną z tych prób opisuje praca badaczy z University of California.
Wzięli oni cienki plaster wycięty z owocnika grzyba, akurat w tym przypadku była to pieczarka, po czym poddali go zwęgleniu w hydroreaktorze w wysokiej temperaturze. Otrzymany zwęglony plaster dodatkowo wyżarzono uzyskując porowaty materiał złożony ze splecionych węglowych włókien zachowujących strukturę strzępek grzyba i przewodzący prąd, będący dobrym zamiennikiem grafitu. Anoda wytworzona ze zwęglonego grzyba nie potrzebuje dodatkowych lepiszczy, dobrze przyjmuje płynny elektrolit i dobrze oddziałuje z jonami. Bardzo możliwe że ze względu na strukturę będzie wytrzymywała więcej cykli ładowania.[3]
Woda orto, woda para
Jądro atomu wodoru to proton, który jako samotna cząstka posiada szczególną właściwość jaką jest spin. W dużym uproszczeniu można przedstawić to jako wektor momentu pędu protonu, mogącego obracać się bądź w jedną lub w drugą stronę - opis kwantowy tego zjawiska jest dużo bardziej skomplikowany. Ponieważ proton jest cząstką naładowaną, jego spin powoduje powstanie małego jądrowego pola magnetycznego. W sytuacji gdy mamy cząsteczkę wodoru składającą się z dwóch atomów te jądrowe pola magnetyczne oddziałują ze sobą i możliwe stają się dwie sytuacje którym odpowiadają różne energie - wodór orto ma spiny skierowane w tą samą stronę, wodór para w przeciwną. Ta druga sytuacja jest minimalnie korzystniejsza energetycznie jednak różnica energii jest na tyle mała że w warunkach normalnych wodór posiada mieszankę cząsteczek z tych dwóch stanów z przewagą ortowodoru.
To zresztą ciekawa sytuacja - pod wpływem temperatury trwalszy parawodór przechodzi w ortowodór, natomiast przemiana w drugą stronę jest powolna bowiem utrudnia ją zabronione przejście kwantowe. W efekcie w wodorze gazowym przeważa mniej trwała energetycznie odmiana, co ma też przełożenie na skład wodoru ciekłego. W niskich temperaturach powolna przemiana ortowodoru w trwalszy parawodór ma istotne znaczenie dla przechowywania, bowiem przemiana ta przebiega z wydzielaniem ciepła. Aby więc ułatwić przechowywanie ciekłego wodoru, katalizuje się tą przemianę przy pomocy odpowiedniego dielektryka otrzymując przewagę trwalszej formy.
Wróćmy jednak do naszego newsa.
W cząsteczce wody dwa wodory znajdują się na tyle blisko siebie, że także i u nich powinna być możliwa izomeria spinowa, jednak dotychczas nie udało się tego wykryć. Cząsteczki wody oddziaływały ze sobą powodując ciągłą zmianę spinów, toteż trudno było uchwycić sygnał od populacji poszczególnych izomerów. Jak się jednak okazało, możliwe jest odizolowanie od siebie cząsteczek. Zespół badaczy z University of Suthampton otrzymał pochodną fullerenu C60 z pojedynczymi cząsteczkami wody wewnątrz węglowej kul. Tego typu połączenie stanowi kolejny przykład związków cząsteczek "połączonych acz nie związanych" jak omawiane tu kiedyś katenany.
Cząstki C60@H2O były wystarczająco odizolowane aby w niskich temperaturach możliwe było wykrycie czystych sygnałów izomerów spinowych wody i przemian jednego w drugi.
[4]
Paliwo z powietrza
Temat przeróbki dwutlenku węgla na paliwo jest aktualnie bardzo gorący, stąd też w ostatnich miesiącach ukazało się wiele doniesień dotyczących nowych sposobów takiej syntezy.
Wedle doniesień z początku sierpnia zespół z Argonne National Laboratory stworzył nowy katalizator do reakcji zamiany dwutlenku węgla i wody w metanol. Znane dotychczas katalizatory oparte o tlenki cynku i glinu zostały zmodyfikowane poprzez precyzyjne umieszczenie na powierzchni tlenku cynku klastrów czterech atomów miedzi, stanowiących centrum katalityczne do którego przyłącza się cząsteczka CO2. Materiał pozwala na przeprowadzanie reakcji w warunkach niższego ciśnienia i temperatury, co poprawia opłacalność całego procesu produkcyjnego. [5]
A co robić z metanolem? Można go użyć jako paliwa, ale można też poddać innym procesom. Pod koniec września pojawiła się praca zespołu z ETH w Zurychu na temat nowego katalizatora umożliwiający ekonomiczny proces konwersji metanol-olefina (MTO). Metanol lub eter dimetylowy pod odpowiednim ciśnieniem może ulegać przemianie na powierzchni tlenku cynku, z wytworzeniem etenu. [6]
Mniej toksyczne wydobycie złota
Jednym ze sposobów na uzyskanie złota ze złóż w których występuje w postaci rozproszonej, jest metoda rtęciowa, w której wykorzystuje się zdolność rtęci do rozpuszczania złota i tworzenie amalgamatu, od którego może być oddzielona przez destylację. Dziś już w zasadzie się od niej odchodzi z powodu wysokiej szkodliwości, mimo to wciąż używają jej małe kopalnie w biedniejszych rejonach świata, co jest źródłem zanieczyszczeń. Szacuje się że nawet 40% rocznych emisji rtęci do środowiska pochodzi z małych kopalni Indonezji i środkowej Afryki.
Oczywiście można próbować różnych zakazów, ale trudno jest je egzekwować, tym bardziej że praca w kopalniach stanowi często jedyne źródło utrzymania najbiedniejszych. Jest też jednak ich przekleństwem - pracownicy mieszający skałę z rtęcią, wyciskający amalgamat (nawet ręcznie) a zwłaszcza pracujący przy wypalaniu amalgamatu dla usunięcia rtęci po kilku latach zaczynają chorować. Skażenie wraz z zanieczyszczonym złotem przenosi się do miast gdzie na opary rtęci narażone są rodziny złotników przetapiających surowe złoto.
Jednym z ciekawych sposobów aby sprawić, że proces stanie się mniej groźny dla tych, którzy nie chcą z niego zrezygnować, jest dostarczenie wytwórcom tanich aparatów do bezpieczniejszej destylacji.
Geochemik Marcello Veiga z kanadyjskiego Uniwersytetu Inżynierii i Górnictwa opracował przyrząd podobny do blaszanej retorty, takiej jak używane przez dawnych alchemików. Zbiornik w którym wyżarzany jest amalgamat kończy się długą opadającą rurą, której wąski koniec kończy się w zbiorniku z zimną wodą. Opary rtęci zamiast trafiać do atmosfery są skraplane a krople metalu zbierane na dnie zbiornika, dzięki czemu może być użyty ponownie. W efekcie emisje rtęci spadają o 90%, mniej jej trafia do środowiska a pracownicy są mniej narażeni na toksyczne opary[7]
---------
[1] The most incompressible metal osmium at static pressures above 750 GPa;L. Dubrovinsky, N. Dubrovinskaia, E. Bykova, M. Bykov, V. Prakapenka, C. Prescher, K. Glazyrin, H.-P. Liermann, M. Hanfland, M. Ekholm, Q. Feng, L. V. Pourovskii, M. I. Katsnelson, J. M. Wills, and I. A. Abrikosov; Nature (2015); DOI: 10.1038/nature14681
[2] Prediction of the material with highest known melting point fromab initiomolecular dynamics calculations. Qi-Jun Hong, Axel van de Walle. Physical Review B, 2015; 92 (2) DOI: 10.1103/PhysRevB.92.020104
[3] Bio-Derived, Binderless, Hierarchically Porous Carbon Anodes for Li-ion Batteries. Brennan Campbell, Robert Ionescu, Zachary Favors, Cengiz S. Ozkan, Mihrimah Ozkan. Scientific Reports, 2015; 5: 14575 DOI: 10.1038/srep14575
[4] Electrical detection of ortho–para conversion in fullerene-encapsulated water. Benno Meier, Salvatore Mamone, Maria Concistrè, Javier Alonso-Valdesueiro, Andrea Krachmalnicoff, Richard J. Whitby, Malcolm H. Levitt. Nature Communications, 2015; 6: 8112 DOI: 10.1038/ncomms9112
[5] Carbon Dioxide Conversion to Methanol over Size-Selected Cu4Clusters at Low Pressures. Cong Liu, Bing Yang, Eric Tyo, Soenke Seifert, Janae DeBartolo, Bernd von Issendorff, Peter Zapol, Stefan Vajda, Larry A. Curtiss. Journal of the American Chemical Society, 2015; 137 (27): 8676 DOI: 10.1021/jacs.5b03668
[6] Cooperativity between Al Sites Promotes Hydrogen Transfer and Carbon–Carbon Bond Formation upon Dimethyl Ether Activation on Alumina, Aleix Comas-Vives, Maxence Valla, Christophe Copéret, Philippe Sautet.. ACS Central Science , 2015 r.; 150807151553006 DOI: 10,1021 / acscentsci.5b00226
[7] http://www.rsc.org/chemistryworld/2015/08/chemistry-saves-thousands-gold-miners-mercury-poisoning
czwartek, 27 sierpnia 2015
Chemiczne wieści (1.)
Postanowiłem stworzyć jeszcze jeden cykl wpisów - krótkie doniesienia ze świata chemii, jakie ostatnio wpadły mi w oko i które uznałem za najciekawsze.
Rozdzielanie światłem
Rozdział lantanowców nie jest procesem łatwym. Pierwiastki te mają bardzo podobne właściwości fizyczne i chemiczne, zbliżoną rozpuszczalność soli i powinowactwo, a na dodatek występują w mieszaninie w jednym minerale - monacycie. Zwykle rozdziela się je bądź przez wieloetapową ekstrakcję w rozpuszczalnikach organicznych, lub przez stosowanie żywic jonowymiennych. Niedawna praca pokazuje jednak jeszcze jeden ciekawy, prosty i wymagający zdecydowanie mniejszej ilości energii proces.
Badacze skupili się na rozdziale europu od itru, dwóch rzadkich pierwiastków stosowanych w elektronice, w tym w telewizorach i w świetlówkach. Itr stanowi składnik czerwonego luminoforu czyli substancji emitującej światło po naświetleniu wiązką elektronów, często domieszkowany jest europem dla zwiększenia czułości. Ich odzysk ze zużytego sprzętu jest kłopotliwy, właśnie z powodu trudnego rozdziału. Dotychczas chętnie wykorzystywano skłonność europu do redukowania się do wartościowości II, w której tworzy nierozpuszczalny siarczan, co jednak wymagało bardzo kwaśnych warunków i użycia toksycznych reduktorów.
Technika opracowana przez belgijskich badaczy jest dość prosta i nie wymaga użycia specjalnych chemikaliów. Pierwiastki mogą mieć podobne właściwości chemiczne, ale powinny mieć różne właściwości kwantowe. Elektrony na powłokach tych pierwiastków przyjmują różne stany energetyczne, co objawia się różnym widmem absorpcyjnym, pozwalającym na rozróżnienie. Te różnice powodują też, różne zachowanie się w stanie wzbudzonym.W tym konkretnym przypadku różnica dotyczyła zachowania się akwakompleksów, czyli związków kompleksowych jonów metali z cząsteczkami wody
Badacze wykonali wodny roztwór mieszaniny azotanów itru III i europu III, po czym naświetlili ultrafioletem o tak dobranym zakresie, że był on pochłaniany przez akwakompleks jonów europu. Energia pochłonięta była na tyle duża, że jedna z przyłączonych cząsteczek wody rozpadała się z wydzieleniem rodnika hydroksylowego, zaś europ III ulegał redukcji do europu II.
Kwantowe kropki z kapusty
Nietypowa substancja z nietypowego źródła.
Kwantowe kropki to jedno z najciekawszych osiągnięć nanotechnologii, które w dodatku znajduje coraz powszechniejsze zastosowanie. Stanowią szczególny przypadek stosunkowo dużego, wieloatomowego obiektu, do którego mają zastosowania prawa fizyki kwantowej.
Fizyka kwantowa traktuje cząstki elementarne, jak obiekty o dwojakiej naturze - zarazem są punktowymi, twardymi cząstkami jak i wykazują własności rozmytej fali. Im mniejszy i mniej masywny jest obiekt, tym wyraźniejsza jest ta falowość. Dla elektronów ta druga strona jego natury jest już tak wyraźna, że wygodniej jest opisywać ich zachowanie funkcjami fali, zupełnie jakby szło o opis światła czy dźwięku.
Jednym z modeli teoretycznych falo-cząstki, dość podstawowym, jest model "cząstki w pudle potencjału" czyli ograniczonej pewnymi przedziałami czy to energetycznymi czy to przestrzennymi. To ograniczenie dla ruchu elektronu, jeśli tylko ma rozmiary porównywalne z wielkością jego "fali", wpływa na to jaką może on przybierać energię. Podobnie jak dla dźwięków w rezonatorach instrumentów, pewne częstotliwości są wzmacniane, dlatego fala elektronu w takim "pudle" przebiera pewne określone stany o różnej energii.
Kropka kwantowa to po prostu bryłka materii o rozmiarach tak małych, że niewiele większych od wielkości fali elektronowej, która ponieważ elektrony nie mogą z niej wyjść, staje się dla nich trójwymiarowym pudłem potencjału. Elektrony atomów w tym materiale mogą przyjmować pewne określone stany energetyczne, całość zatem zachowuje się podobnie jak mocno powiększony atom. Mają własne widmo absorpcyjne, po naświetleniu mogą wykazywać fluorescencję, i to w bardzo dużym zakresie barw:
Na zdjęciu widzicie fiolki z zawiesinami kwantowych kropek oświetlonych ultrafioletem. Materiał z którego są zrobione nie świeci w normalnych warunkach. We wszystkich fiolkach kropki zrobiono z tego samego materiału, różnią się tylko wielkością cząstki.
Gdy tylko nauczono się robić takie cząstki w większych ilościach, technolodzy zaczęli się prześcigać w wyszukiwaniu nowych ciekawych zastosowań. Już mówi się, że lampy oparte na kropkach mogą wyprzeć w przyszłości diody LED. Ponieważ mogą przenikać do żywych organizmów, wydają się ciekawym narzędziem służącym na przykład do lokalizowania ognisk chorobowych.
Większość takich kropek tworzona jest z materiałów półprzewodnikowych, soli nieorganicznych lub metali. Dlatego też ciekawa jest praca opisująca, że możliwe jest wytwarzanie ich w dużych ilościach, za surowiec wykorzystując zieloną kapustę.
Kapusta została rozdrobniona w czystej wodzie i dokładnie zmiksowana blenderem. Otrzymana zawiesina była przetwarzana w reaktorze hydrotermalnym w temperaturze 140 stopni. Otrzymana brązowa zawiesina została poddana odwirowaniu, dzięki czemu usunięto przeszkadzające duże cząstki. To co pozostało można było oddzielić w ultrawirówce na frakcje, które fluoryzowały na różne kolory.
Właściwe kropki kwantowe to nanometrowe fragmenty komórek, ziaren skrobi czy agregatów białkowych, które podczas przetwarzania uległy częściowemu zwęgleniu, z powstaniem cząstek o charakterze węgla grafitowego.
Wydajność produkcji oceniono na 7%.[3]
Antybakteryjny kasztan
To całkiem świeże odkrycie dobrze pokazuje, że tradycyjna medycyna ludowa może mieć pewien rzeczywisty sens, o ile zostanie wsparta nowoczesną technologią.
Casanra Quave jest etnobotanikiem, a więc poszukuje związków między tradycyjną kulturą a właściwościami roślin. Stara się na podstawie przekazów ludowych zweryfikować doniesienia o leczniczych właściwościach roślin. W trakcie zbierania informacji często natykała się na doniesienia o używaniu naparu w liści kasztana jadalnego w zapaleniach skóry. Ponieważ zaś często zapalenia skóry są wywoływane zakażeniami gronkowcem, rozsądne wydawało się przetestowanie wyciągu na zakażonej skórze. Jak się okazało, choć wyciąg nie zabijał bakterii, powodował znaczące zmniejszenie uszkodzenia tkanek i podrażnień. Substancje zawarte w liściach kasztana powodowały wyłączenie systemu quorum sensing (brak jeszcze polskiego odpowiednika, ale rozsądnym byłoby "wyczuwanie zagęszczenia"), który zazwyczaj w przypadku ognisk zapalnych powoduje, że zagęszczone bakterie zaczynają wytwarzać toksyny, będące głównym czynnikiem szkodliwym. W efekcie bakterie przestały wywoływać uszkodzenia tkanek.
Efekt ten zaobserwowano nawet w przypadku najbardziej zjadliwych szczepów, także tych lekoodpornych gronkowców MRSA. Oznacza to, że choć wyciąg nie niszczy bakterie, może spowodować że zakażenie nie będzie aż tak szkodliwe, bakterie bowiem nie będą wytwarzać toksyn.
Co jednak wywoływało ten nietypowy efekt?
Tego dokładnie nie wiadomo. Technikami chromatograficznymi uzyskano z liści aktywną frakcję zawierającą około 90 związków o charakterze saponin steroidowych, spośród których najbardziej aktywne wydawały się pochodne 12-ursenu i oleanenu. Trwają badania czy za efekt odpowiada konkretny związek, czy może cała grupa.[4]
Najcieplejszy nadprzewodnik
Najnowsze odkrycie niemieckich naukowców jest dość zaskakujące. Otóż odkryli oni, że dość pospolity gaz siarkowodór, o zapachu zgniłych jaj, po zamrożeniu może stać się nadprzewodnikiem w wyjątkowo wysokiej jak na takie ciała temperaturze -70 *C (203,5 K). Dotychczasowy rekord dotyczył pewnych tlenowych związków miedzi, które stawały się nadprzewodnikami w temperaturze -135 *C, a zatem do ich chłodzenia potrzebne było skroplone powietrze. Do schładzania nowo odkrytego nadprzewodnika wystarczałby już tylko suchy lód, tańszy i łatwiej dostępny.
Jednak w odkryciu tkwi pewien haczyk - siarkowodór nabiera tak obiecujących właściwości dopiero pod dużym ciśnieniem około 200 GPa, w związku z czym raczej w najbliższym czasie nie znajdzie zastosowania.
Badanie wykazały że przy dużych ciśnieniach powyżej 90 GPa cząsteczki H2S łączą się zamieniając się w cząsteczki H3S, a zestalony gaz staje się przewodnikiem metalicznym. Odpowiednie obniżenie temperatury zamienia go w nadprzewodnik. [5]
-------
Źródła:
[1] Bart Van den Bogaert, Daphné Havaux, Koen Binnemans and Tom Van Gerven ; Photochemical recycling of europium from Eu/Y mixtures in red lamp phosphor waste stream, Green Chem., 2015,17, 2180-2187 DOI: 10.1039/C4GC02140A
[2] http://www.scriptiebank.be/sites/default/files/webform/scriptie/Masterthesis%20DH.pdf
[3] Al-Mahmnur Alam, Byung-Yong Park, Zafar Khan Ghouri, Mira Park and Hak-Yong Kim , Synthesis of Carbon Quantum Dot from Cabbage with Down- and Up-Conversion, Green Chem., 2015,17, 3791-3797
[4] Cassandra L. Quave, James T. Lyles, Jeffery S. Kavanaugh, Kate Nelson, Corey P. Parlet, Heidi A. Crosby, Kristopher P. Heilmann, Alexander R. Horswill. Castanea sativa (European Chestnut) Leaf Extracts Rich in Ursene and Oleanene Derivatives Block Staphylococcus aureus Virulence and Pathogenesis without Detectable Resistance. PLOS ONE, 2015; 10 (8) e0136486
[5] http://www.nature.com/nature/journal/vaop/ncurrent/full/nature14964.html A. P. Drozdov, M. I. Eremets, I. A. Troyan, V. Ksenofontov & S. I. Shylin, Conventional superconductivity at 203 kelvin at high pressures in the sulfur hydride system, Nature (2015) doi:10.1038/nature14964
Rozdzielanie światłem
Rozdział lantanowców nie jest procesem łatwym. Pierwiastki te mają bardzo podobne właściwości fizyczne i chemiczne, zbliżoną rozpuszczalność soli i powinowactwo, a na dodatek występują w mieszaninie w jednym minerale - monacycie. Zwykle rozdziela się je bądź przez wieloetapową ekstrakcję w rozpuszczalnikach organicznych, lub przez stosowanie żywic jonowymiennych. Niedawna praca pokazuje jednak jeszcze jeden ciekawy, prosty i wymagający zdecydowanie mniejszej ilości energii proces.
Badacze skupili się na rozdziale europu od itru, dwóch rzadkich pierwiastków stosowanych w elektronice, w tym w telewizorach i w świetlówkach. Itr stanowi składnik czerwonego luminoforu czyli substancji emitującej światło po naświetleniu wiązką elektronów, często domieszkowany jest europem dla zwiększenia czułości. Ich odzysk ze zużytego sprzętu jest kłopotliwy, właśnie z powodu trudnego rozdziału. Dotychczas chętnie wykorzystywano skłonność europu do redukowania się do wartościowości II, w której tworzy nierozpuszczalny siarczan, co jednak wymagało bardzo kwaśnych warunków i użycia toksycznych reduktorów.
Technika opracowana przez belgijskich badaczy jest dość prosta i nie wymaga użycia specjalnych chemikaliów. Pierwiastki mogą mieć podobne właściwości chemiczne, ale powinny mieć różne właściwości kwantowe. Elektrony na powłokach tych pierwiastków przyjmują różne stany energetyczne, co objawia się różnym widmem absorpcyjnym, pozwalającym na rozróżnienie. Te różnice powodują też, różne zachowanie się w stanie wzbudzonym.W tym konkretnym przypadku różnica dotyczyła zachowania się akwakompleksów, czyli związków kompleksowych jonów metali z cząsteczkami wody
Badacze wykonali wodny roztwór mieszaniny azotanów itru III i europu III, po czym naświetlili ultrafioletem o tak dobranym zakresie, że był on pochłaniany przez akwakompleks jonów europu. Energia pochłonięta była na tyle duża, że jedna z przyłączonych cząsteczek wody rozpadała się z wydzieleniem rodnika hydroksylowego, zaś europ III ulegał redukcji do europu II.
[Eu(H2O)n]3+ + hν → [Eu(H2O)n-1]2+ + H+ + OH*
Po naświetleniu, do mieszaniny wprowadzono aniony siarczanowe. Siarczan europu II jest trudno rozpuszczalny, natomiast siarczan itru III rozpuszczał się. Po odwirowaniu i oddzieleniu osadu, otrzymano sól europu oddzieloną od drugiego pierwiastka, o czystości do 98,5%. [1][2] Kwantowe kropki z kapusty
Nietypowa substancja z nietypowego źródła.
Kwantowe kropki to jedno z najciekawszych osiągnięć nanotechnologii, które w dodatku znajduje coraz powszechniejsze zastosowanie. Stanowią szczególny przypadek stosunkowo dużego, wieloatomowego obiektu, do którego mają zastosowania prawa fizyki kwantowej.
Fizyka kwantowa traktuje cząstki elementarne, jak obiekty o dwojakiej naturze - zarazem są punktowymi, twardymi cząstkami jak i wykazują własności rozmytej fali. Im mniejszy i mniej masywny jest obiekt, tym wyraźniejsza jest ta falowość. Dla elektronów ta druga strona jego natury jest już tak wyraźna, że wygodniej jest opisywać ich zachowanie funkcjami fali, zupełnie jakby szło o opis światła czy dźwięku.
Jednym z modeli teoretycznych falo-cząstki, dość podstawowym, jest model "cząstki w pudle potencjału" czyli ograniczonej pewnymi przedziałami czy to energetycznymi czy to przestrzennymi. To ograniczenie dla ruchu elektronu, jeśli tylko ma rozmiary porównywalne z wielkością jego "fali", wpływa na to jaką może on przybierać energię. Podobnie jak dla dźwięków w rezonatorach instrumentów, pewne częstotliwości są wzmacniane, dlatego fala elektronu w takim "pudle" przebiera pewne określone stany o różnej energii.
Kropka kwantowa to po prostu bryłka materii o rozmiarach tak małych, że niewiele większych od wielkości fali elektronowej, która ponieważ elektrony nie mogą z niej wyjść, staje się dla nich trójwymiarowym pudłem potencjału. Elektrony atomów w tym materiale mogą przyjmować pewne określone stany energetyczne, całość zatem zachowuje się podobnie jak mocno powiększony atom. Mają własne widmo absorpcyjne, po naświetleniu mogą wykazywać fluorescencję, i to w bardzo dużym zakresie barw:
| Kwantowe kropki z mieszanego siarczku kadmu i cynku z domieszką selenu. @ Signa Aldrich |
Gdy tylko nauczono się robić takie cząstki w większych ilościach, technolodzy zaczęli się prześcigać w wyszukiwaniu nowych ciekawych zastosowań. Już mówi się, że lampy oparte na kropkach mogą wyprzeć w przyszłości diody LED. Ponieważ mogą przenikać do żywych organizmów, wydają się ciekawym narzędziem służącym na przykład do lokalizowania ognisk chorobowych.
Większość takich kropek tworzona jest z materiałów półprzewodnikowych, soli nieorganicznych lub metali. Dlatego też ciekawa jest praca opisująca, że możliwe jest wytwarzanie ich w dużych ilościach, za surowiec wykorzystując zieloną kapustę.
Kapusta została rozdrobniona w czystej wodzie i dokładnie zmiksowana blenderem. Otrzymana zawiesina była przetwarzana w reaktorze hydrotermalnym w temperaturze 140 stopni. Otrzymana brązowa zawiesina została poddana odwirowaniu, dzięki czemu usunięto przeszkadzające duże cząstki. To co pozostało można było oddzielić w ultrawirówce na frakcje, które fluoryzowały na różne kolory.
Właściwe kropki kwantowe to nanometrowe fragmenty komórek, ziaren skrobi czy agregatów białkowych, które podczas przetwarzania uległy częściowemu zwęgleniu, z powstaniem cząstek o charakterze węgla grafitowego.
Wydajność produkcji oceniono na 7%.[3]
Antybakteryjny kasztan
To całkiem świeże odkrycie dobrze pokazuje, że tradycyjna medycyna ludowa może mieć pewien rzeczywisty sens, o ile zostanie wsparta nowoczesną technologią.
Casanra Quave jest etnobotanikiem, a więc poszukuje związków między tradycyjną kulturą a właściwościami roślin. Stara się na podstawie przekazów ludowych zweryfikować doniesienia o leczniczych właściwościach roślin. W trakcie zbierania informacji często natykała się na doniesienia o używaniu naparu w liści kasztana jadalnego w zapaleniach skóry. Ponieważ zaś często zapalenia skóry są wywoływane zakażeniami gronkowcem, rozsądne wydawało się przetestowanie wyciągu na zakażonej skórze. Jak się okazało, choć wyciąg nie zabijał bakterii, powodował znaczące zmniejszenie uszkodzenia tkanek i podrażnień. Substancje zawarte w liściach kasztana powodowały wyłączenie systemu quorum sensing (brak jeszcze polskiego odpowiednika, ale rozsądnym byłoby "wyczuwanie zagęszczenia"), który zazwyczaj w przypadku ognisk zapalnych powoduje, że zagęszczone bakterie zaczynają wytwarzać toksyny, będące głównym czynnikiem szkodliwym. W efekcie bakterie przestały wywoływać uszkodzenia tkanek.
Efekt ten zaobserwowano nawet w przypadku najbardziej zjadliwych szczepów, także tych lekoodpornych gronkowców MRSA. Oznacza to, że choć wyciąg nie niszczy bakterie, może spowodować że zakażenie nie będzie aż tak szkodliwe, bakterie bowiem nie będą wytwarzać toksyn.
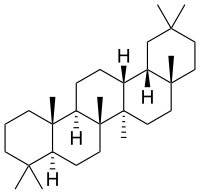 |
| Oleanen |
Tego dokładnie nie wiadomo. Technikami chromatograficznymi uzyskano z liści aktywną frakcję zawierającą około 90 związków o charakterze saponin steroidowych, spośród których najbardziej aktywne wydawały się pochodne 12-ursenu i oleanenu. Trwają badania czy za efekt odpowiada konkretny związek, czy może cała grupa.[4]
Najcieplejszy nadprzewodnik
Najnowsze odkrycie niemieckich naukowców jest dość zaskakujące. Otóż odkryli oni, że dość pospolity gaz siarkowodór, o zapachu zgniłych jaj, po zamrożeniu może stać się nadprzewodnikiem w wyjątkowo wysokiej jak na takie ciała temperaturze -70 *C (203,5 K). Dotychczasowy rekord dotyczył pewnych tlenowych związków miedzi, które stawały się nadprzewodnikami w temperaturze -135 *C, a zatem do ich chłodzenia potrzebne było skroplone powietrze. Do schładzania nowo odkrytego nadprzewodnika wystarczałby już tylko suchy lód, tańszy i łatwiej dostępny.
Jednak w odkryciu tkwi pewien haczyk - siarkowodór nabiera tak obiecujących właściwości dopiero pod dużym ciśnieniem około 200 GPa, w związku z czym raczej w najbliższym czasie nie znajdzie zastosowania.
Badanie wykazały że przy dużych ciśnieniach powyżej 90 GPa cząsteczki H2S łączą się zamieniając się w cząsteczki H3S, a zestalony gaz staje się przewodnikiem metalicznym. Odpowiednie obniżenie temperatury zamienia go w nadprzewodnik. [5]
-------
Źródła:
[1] Bart Van den Bogaert, Daphné Havaux, Koen Binnemans and Tom Van Gerven ; Photochemical recycling of europium from Eu/Y mixtures in red lamp phosphor waste stream, Green Chem., 2015,17, 2180-2187 DOI: 10.1039/C4GC02140A
[2] http://www.scriptiebank.be/sites/default/files/webform/scriptie/Masterthesis%20DH.pdf
[3] Al-Mahmnur Alam, Byung-Yong Park, Zafar Khan Ghouri, Mira Park and Hak-Yong Kim , Synthesis of Carbon Quantum Dot from Cabbage with Down- and Up-Conversion, Green Chem., 2015,17, 3791-3797
[4] Cassandra L. Quave, James T. Lyles, Jeffery S. Kavanaugh, Kate Nelson, Corey P. Parlet, Heidi A. Crosby, Kristopher P. Heilmann, Alexander R. Horswill. Castanea sativa (European Chestnut) Leaf Extracts Rich in Ursene and Oleanene Derivatives Block Staphylococcus aureus Virulence and Pathogenesis without Detectable Resistance. PLOS ONE, 2015; 10 (8) e0136486
[5] http://www.nature.com/nature/journal/vaop/ncurrent/full/nature14964.html A. P. Drozdov, M. I. Eremets, I. A. Troyan, V. Ksenofontov & S. I. Shylin, Conventional superconductivity at 203 kelvin at high pressures in the sulfur hydride system, Nature (2015) doi:10.1038/nature14964
poniedziałek, 15 czerwca 2015
Pytania czytelników
Od czasu do czasu dostaję pytania od czytelników bloga. Część pojawia się w komentarzach, i tam staram się na nie odpowiadać co można zobaczyć pod popularnymi postami. Część osób woli jednak drogę bardziej bezpośrednią, używając maila kontaktowego, jaki można znaleźć w opisie profilu, i odpowiedzi na te pytania nie są już powszechnie dostępne. Ponieważ zaś część pytań się powtarza, a niektóre są przecież dość ciekawe, uznałem że warto zebrać je w jednym miejscu, abym nie musiał się powtarzać
Aluminium w glinkach kosmetycznych
O tą rzecz pytano mnie już kilka razy, dlatego warto chyba odpowiedzieć publicznie.
Glina to formalnie rzecz biorąc, skała osadowa. Bardzo miękka a w stanie wilgotnym dająca się formować w rękach, ale skała. Aby osad mógł być zaliczony do glin, musi zawierać odpowiednio dużą ilość minerałów ilastych, przemieszanych z drobnym pyłem kwarcowym i skaleniowym. Tlenki żelaza i manganu nadają glinom kolor od żółtawego, przez rdzawoczerwony, brunatny, szary do ziemisto-zielonego. Glinki z małą ilością metali mogą być też białe.
Minerały ilaste, uwalniane ze skał podczas wietrzenia, wypłukiwane w formie najdrobniejszego mułu czy wywiewane przez wiatr jako kurz, stanowią grupę krzemianów warstwowych, składających się z warstw połączonych tetraedrów tlenku krzemu SiO4 i tlenku glinu AlO4. Tlenek glinu jest izomorficzny z tlenkiem krzemu i może go naśladować, włączając się w krzemianową strukturę bez zmian. Poszczególne warstwy glinokrzemianowe są połączone wiązaniami wodorowymi, częściowo jonowymi, i potrafią wchłaniać między siebie inne substancje organiczne i nieorganiczne. Duży stopień uwodnienia powoduje, że warstwy mogą się względem siebie przesuwać, przez co glina staje się plastyczna. Właśnie zawartość tego pierwiastka w glinie stała się podstawą do zastąpienia w polskiej nomenklaturze łacińskiego aluminium nazwą glin.
Struktura warstwy kaolinu:
Wśród krzemianów warstwowych, najczęściej spotykamy się z talkiem, kaolinem będącym głównym składnikiem porcelany i montmorylonitem będącym głównym składnikiem bentonitu. Gliny zawierają mieszankę różnych glinokrzemianów ale niektóre posiadają przewagę jednego, konkretnego, stąd wyróżnia się białą glinkę kaolinową, glinkę pałygorskitową i inne.
A jak jest z tym aluminium?
Aby glin mógł być uwalniany z gliny, powinien być rozpuszczalny w wodzie. A gliny nie są. Nie dość, że zupełnie nierozpuszczalny w wodzie jest tlenek glinu, to w glinokrzemianach dodatkowo stabilizuje go włączenie w sieć krzemianową
Kwestia ta była zresztą szczegółowo badana, zwłaszcza z uwagi na używanie ceramiki jako naczyń kuchennych, oraz używanie glinokrzemianów jako dodatków do żywności. Wydaje się, że w warunkach odczynu obojętnego uwalnianie glinu nie zachodzi. Dopiero warunki kwaśne są w stanie uwolnić część jonów. W pewnym badaniu stwierdzono dla kwasowości pH 3 (sok pomarańczowy) minerały uwalniały dość niskie poziomy aluminium, ale tylko z bardzo cienkiej (3,5 mikrometra) warstwy powierzchniowej, co sugeruje, że w przypadku naczyń ceramicznych po pewnym czasie powstanie wypłukana warstewka powstrzymująca dalsze uwalnianie. Najsłabsze wymywanie stwierdzono dla kaolinu i montmorylonitu[1]. Uwolnienie ilości mających jakieś znaczenie toksykologiczne, zachodzi dopiero pod wpływem mocniejszych kwasów.
Glinki kosmetyczne nie mają tak kwaśnego odczynu, więc uwalniania aluminium nie ma co się obawiać.W dodatku czyste glinki, przepłukane dla wymycia zanieczyszczeń, jak to zwykle jest z glinkami kosmetycznymi, mają raczej skłonność do pochłaniania rozpuszczalnych jonów glinu niż do uwalniania.
W obszernym raporcie na temat bezpieczeństwa glinokrzemianów i tlenków glinu używanych w kosmetyce, nie stwierdzono negatywnych skutków dla minerałów ilastych. [2]
Podobne pytanie dotyczyło spożywania glinek na odtruwanie - tutaj także nie ma niebezpieczeństwa, kwasy żołądkowe są bowiem dosyć rozcieńczone. Jedynym istotnym wpływem jaki stwierdzono, jest zmniejszone wchłanianie żelaza u osób zażywających glinę, bowiem absorbowała żelazo z treści żołądkowej.
Aluminium w szczepionkach
Ze względu na popularny post o ałunie jestem chyba brany za eksperta od aluminium, skoro dotyczy tego koleje pytanie zadawane mi dwa razy.
Jak wiadomo, w niektórych szczepionkach dziecięcych pojawiają się związki aluminium. Podobno zawartość w jednej nie przekracza norm bezpieczeństwa. A co jakby zsumować zawartość we wszystkich - czy wtedy mogłoby zajść jakieś niebezpieczeństwo?
Wodorotlenek glinu pojawia się w szczepionkach jako nośnik białek lub polisacharydów mających wywołać reakcję organizmu. Normy z reguły uważają za najwyższą dopuszczalną dawkę glinu 60 mg/ kg. masy ciała dziennie. Z badań na zwierzętach wynika też, że najniższe dawki mające negatywny wpływ na płody i rozwijające się młode (u szczurów) to 45 mg/kg masy ciała dziennie.
Spośród szczepionek w kalendarzu szczepień, glin zawierają:
- EUVAX B 0,25 mg w jednej dawce lub ENGERIX B też 0,25 mg w jednej dawce (stosowane wymiennie)
- DTP 0,7 mg na dawkę
-IPV 0,5 mg na dawkę
Jak łatwo zauważyć, całkowita zawartość w jednej dawce jest kilkadziesiąt razy mniejsza od najniższych dawek toksycznych. Nawet gdyby wstrzyknąć wszystkie wymienione w ciągu jednego dnia, to nie doszłoby do przekroczenia choćby dziesiątej części toksycznej dawki.
Toksyczność ałunu
Czytelnik pytał o bezpieczeństwo ałunu dla dzieci. Chodziło mu o sytuację gdyby dziecko znalazło kawałek ałunu z pękniętego sztyftu i polizało lub połknęło.
Ałun potasowy i amonowy mają działanie drażniące na błony śluzowe, dlatego pierwszą reakcją w razie połknięcia będą zapewne wymioty. Po polizaniu dziecko pewnie straci ochotę na kolejny liz, ałun ma bowiem bardzo cierpki, nieprzyjemny smak i działanie ściągające. W razie połknięcia najlepiej dać dziecku dużo wody do wypicia i skontaktować się z lekarzem. W razie polizania też dać wody, ale lekarz pewnie nie będzie potrzebny.
Toksyczność ostra związku jest niska - dawka śmiertelna to 6 g/kg masy ciała
Co takiego rozpuszcza DMSO?
Pewien dociekliwy czytelnik zainteresowany medycznymi zastosowaniami DMSO dopytywał mnie o kwestie tego co się w tym rozpuszcza, a co nie i czy ma on zastosowania medyczne.
Dimetylosulfotlenek, czyli w skrócie DMSO to cenny rozpuszczalnik, używany w medycynie i chemii organicznej. Wykazuje dużą skłonność do wnikania w tkanki organizmu, na tyle, że trzeba uważać przy pracy z nim bo po wchłonięciu metabolizuje do związków o zapachu czosnku. Ponieważ rozluźnia strukturę lipidową skóry, może ułatwiać wchłonięcie przezskórnie różnych substancji, w tym wielu leków, dlatego czyni się próby z wykorzystaniem do terapii bez konieczności zastrzyków. Sam w sobie ma zresztą działanie przeciwzapalne.
Bywa rozpuszczalnikiem środków na grzybicę stóp, które zwykle dość słabo przenikają przez zrogowaciały naskórek na podeszwach, może być też składnikiem maści przeciwbólowych do działania miejscowego, może rozmiękczać skórę przy twardzinie i przerastających bliznach. Robiono na ten temat badania [3]
Drugie pytanie dotyczyło możliwości rozpuszczania chondroityny przez DMSO i smarowania tym stawów jako alternatywy dla suplementacji doustnej.
Chondroityna to mukopolisacharyd będący składnikiem chrząstek stawowych i w formie siarczanu stanowiący wraz z glukozaminą jeden z czynników zapewniających lepszy poślizg. W związku z tym powstał pomysł, że jeśli zbyt mała ilość mazi stawowej i mała elastyczność chrząstek stawu powodują bóle, to zażywanie chondroityny i dostarczanie jej do organizmu, powinno leczyć bądź powstrzymywać rozwój schorzeń stawów poprzez dostarczenie organizmowi składnika do wytworzenia większej ilości mazi. Na tym też opiera się potężna gałąź przemysłu suplemenciarskiego.
Niestety w niedawno opublikowanej potężnej metaanalizie wielu badań wykazano, że w porównaniu z placebo zażywanie chondroityny lub glukozaminy lub obu tych środków razem, nie zmniejsza bólów ani innych objawów[4]
Wygląda na to, że samo dostarczenie organizmowi składników potrzebnych do wytworzenia czegośtam w którymś organie, wcale nie musi go pobudzać aby tą substancję jednak wytworzyć, zwłaszcza że niedostateczne wydzielanie tej substancji wcale nie musi być wynikiem niedoboru podstawowego składnika, może być skutkiem innych czynników, w tym genetycznych. Dlatego jeśli przyjrzycie się emitowanym obecnie reklamom takich pigułek, zauważycie że wcale nie stwierdzają one wprost, iż zażycie tego składnika powstrzyma chorobę. Zamiast tego zawierają ogólniki, typu "glukozamina jest składnikiem chrząstki stawowej" i "maź stawowa ma decydujące znaczenie w zapewnieniu elastyczności stawu" i na koniec, że ich pigułka zawiera podwójną czy potrójną dawkę, zaś konstrukcję logiczną "skoro to jest składnikiem chrząstki a chrząstka jest potrzebna w stawach, to pomoże mi na stawy" widz musi sam sobie przeprowadzać, w czym udanie pomaga mu sugestia pokazywanego w reklamie pana którego bolą stawy, który bierze ich tabletki a potem wygląda na mniej cierpiącego.
Ale wróćmy do pytania - czy chondroityna rozpuszcza się w DMSO? Cóż - wedle obszernego podsumowania rozpuszczalności różnych substancji w tym rozpuszczalniku, chondroityna jest nie rozpuszczalna. Słabo rozpuszcza się chlorowodorek glukozaminy, natomiast bardzo dobrze przeciwbólowy Ibuprofen.[5]
Tak że raczej nie tędy droga.
Gdzie zbadać wodę?
Miałem też pytania o to gdzie można samemu zbadać wodę ze studni, źródła czy ujęcia.
Z tego co się orientuję, takie badania oferują jednostki Sanepidu, zbadają one zawartość metali ciężkich, czystość bakteriologiczną i własności fizyczne, jak zamulenie, obecność kwasów humusowych, zażelazienie itp. Oczywiście są to badania płatne.
Próbkę wody może pobrać wysłany pracownik, ale można ją też pobrać samemu. Warszawska stacja podaje na swojej stronie specyfikację sposobu pobierania próbek, aby nadawały się do badania.[6]
Dezodorant z podbiałem
Świadoma konsumentka zadała mi pytanie w sprawie używanego dezodorantu, który zawierał w swoim składzie podbiał pospolity. Chcąc dowiedzieć się czegoś o tym składniku, dowiedziała się że roślina zawiera uszkadzające wątrobę alkaloidy. I stąd powstało pytanie, czy taki alkaloid może wchłaniać się przez skórę?
Podbiał to cenne zioło lecznicze, lecz dopiero w ostatnich latach zorientowano się, że może zawierać alkaloidy pirolizydynowe, o działaniu hepatotoksycznym, które w wyniku zażywania dłuższym niż dwa miesiące mogą powodować toksyczną niewydolność wątroby. Ich zawartość w surowcach zbieranych w Europie jest jednak bardzo niska - w polskim badaniu stwierdzono poziomy rzędu 0,0013%[7]
W jednym badaniu na szczurach stwierdzono minimalne wchłanianie przezskórne alkaloidów żywokostu, w ilości 20 razy mniejszej niż przy podaniu doustnym. Stwierdzono też, że przy chłonięciu przeskórnym, nie dochodzi do zamiany nietoksycznego N-tlenku w toksyczną formę zredukowaną, co zwykle następowało w jelitach po spożyciu.[8] Zatem wydaje się, że kosmetyków z roślin zawierających te alkaloidy można używać bezpiecznie.
Czy to cyjanek?
Dwa lata temu czytelnik przesłał mi zdjęcie białego proszku, z pytaniem czy to cyjanek potasu. Cóż mogłem odpowiedzieć... Spektroskopu w oczach nie mam. Odpisałem, że może to być cyjanek albo soda, albo sól morska, albo cokolwiek innego bo bardzo wiele soli tak wygląda. Nie wiem o co chodziło.
----------
[1] http://www.clays.org/journal/archive/volume%2026/26-6-434.pdf
[2] http://www.ncbi.nlm.nih.gov/pubmed/12851164
[3] http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3460663/
[4] http://www.bmj.com/content/341/bmj.c4675
[5] http://www.gaylordchemical.com/uploads/images/pdfs/literature/102B_english.pdf
[6] http://www.wsse.waw.pl/PageContent.aspx?SubMenuID=100
[7] https://depot.ceon.pl/bitstream/handle/123456789/1121/hp%2058%204%202012%2062.pdf?sequence=1&isAllowed=y
[8] http://www.ncbi.nlm.nih.gov/pubmed/7128756?dopt=Abstract
Aluminium w glinkach kosmetycznych
O tą rzecz pytano mnie już kilka razy, dlatego warto chyba odpowiedzieć publicznie.
Glina to formalnie rzecz biorąc, skała osadowa. Bardzo miękka a w stanie wilgotnym dająca się formować w rękach, ale skała. Aby osad mógł być zaliczony do glin, musi zawierać odpowiednio dużą ilość minerałów ilastych, przemieszanych z drobnym pyłem kwarcowym i skaleniowym. Tlenki żelaza i manganu nadają glinom kolor od żółtawego, przez rdzawoczerwony, brunatny, szary do ziemisto-zielonego. Glinki z małą ilością metali mogą być też białe.
Minerały ilaste, uwalniane ze skał podczas wietrzenia, wypłukiwane w formie najdrobniejszego mułu czy wywiewane przez wiatr jako kurz, stanowią grupę krzemianów warstwowych, składających się z warstw połączonych tetraedrów tlenku krzemu SiO4 i tlenku glinu AlO4. Tlenek glinu jest izomorficzny z tlenkiem krzemu i może go naśladować, włączając się w krzemianową strukturę bez zmian. Poszczególne warstwy glinokrzemianowe są połączone wiązaniami wodorowymi, częściowo jonowymi, i potrafią wchłaniać między siebie inne substancje organiczne i nieorganiczne. Duży stopień uwodnienia powoduje, że warstwy mogą się względem siebie przesuwać, przez co glina staje się plastyczna. Właśnie zawartość tego pierwiastka w glinie stała się podstawą do zastąpienia w polskiej nomenklaturze łacińskiego aluminium nazwą glin.
Struktura warstwy kaolinu:
Wśród krzemianów warstwowych, najczęściej spotykamy się z talkiem, kaolinem będącym głównym składnikiem porcelany i montmorylonitem będącym głównym składnikiem bentonitu. Gliny zawierają mieszankę różnych glinokrzemianów ale niektóre posiadają przewagę jednego, konkretnego, stąd wyróżnia się białą glinkę kaolinową, glinkę pałygorskitową i inne.
A jak jest z tym aluminium?
Aby glin mógł być uwalniany z gliny, powinien być rozpuszczalny w wodzie. A gliny nie są. Nie dość, że zupełnie nierozpuszczalny w wodzie jest tlenek glinu, to w glinokrzemianach dodatkowo stabilizuje go włączenie w sieć krzemianową
Kwestia ta była zresztą szczegółowo badana, zwłaszcza z uwagi na używanie ceramiki jako naczyń kuchennych, oraz używanie glinokrzemianów jako dodatków do żywności. Wydaje się, że w warunkach odczynu obojętnego uwalnianie glinu nie zachodzi. Dopiero warunki kwaśne są w stanie uwolnić część jonów. W pewnym badaniu stwierdzono dla kwasowości pH 3 (sok pomarańczowy) minerały uwalniały dość niskie poziomy aluminium, ale tylko z bardzo cienkiej (3,5 mikrometra) warstwy powierzchniowej, co sugeruje, że w przypadku naczyń ceramicznych po pewnym czasie powstanie wypłukana warstewka powstrzymująca dalsze uwalnianie. Najsłabsze wymywanie stwierdzono dla kaolinu i montmorylonitu[1]. Uwolnienie ilości mających jakieś znaczenie toksykologiczne, zachodzi dopiero pod wpływem mocniejszych kwasów.
Glinki kosmetyczne nie mają tak kwaśnego odczynu, więc uwalniania aluminium nie ma co się obawiać.W dodatku czyste glinki, przepłukane dla wymycia zanieczyszczeń, jak to zwykle jest z glinkami kosmetycznymi, mają raczej skłonność do pochłaniania rozpuszczalnych jonów glinu niż do uwalniania.
W obszernym raporcie na temat bezpieczeństwa glinokrzemianów i tlenków glinu używanych w kosmetyce, nie stwierdzono negatywnych skutków dla minerałów ilastych. [2]
Podobne pytanie dotyczyło spożywania glinek na odtruwanie - tutaj także nie ma niebezpieczeństwa, kwasy żołądkowe są bowiem dosyć rozcieńczone. Jedynym istotnym wpływem jaki stwierdzono, jest zmniejszone wchłanianie żelaza u osób zażywających glinę, bowiem absorbowała żelazo z treści żołądkowej.
Aluminium w szczepionkach
Ze względu na popularny post o ałunie jestem chyba brany za eksperta od aluminium, skoro dotyczy tego koleje pytanie zadawane mi dwa razy.
Jak wiadomo, w niektórych szczepionkach dziecięcych pojawiają się związki aluminium. Podobno zawartość w jednej nie przekracza norm bezpieczeństwa. A co jakby zsumować zawartość we wszystkich - czy wtedy mogłoby zajść jakieś niebezpieczeństwo?
Wodorotlenek glinu pojawia się w szczepionkach jako nośnik białek lub polisacharydów mających wywołać reakcję organizmu. Normy z reguły uważają za najwyższą dopuszczalną dawkę glinu 60 mg/ kg. masy ciała dziennie. Z badań na zwierzętach wynika też, że najniższe dawki mające negatywny wpływ na płody i rozwijające się młode (u szczurów) to 45 mg/kg masy ciała dziennie.
Spośród szczepionek w kalendarzu szczepień, glin zawierają:
- EUVAX B 0,25 mg w jednej dawce lub ENGERIX B też 0,25 mg w jednej dawce (stosowane wymiennie)
- DTP 0,7 mg na dawkę
-IPV 0,5 mg na dawkę
Jak łatwo zauważyć, całkowita zawartość w jednej dawce jest kilkadziesiąt razy mniejsza od najniższych dawek toksycznych. Nawet gdyby wstrzyknąć wszystkie wymienione w ciągu jednego dnia, to nie doszłoby do przekroczenia choćby dziesiątej części toksycznej dawki.
Toksyczność ałunu
Czytelnik pytał o bezpieczeństwo ałunu dla dzieci. Chodziło mu o sytuację gdyby dziecko znalazło kawałek ałunu z pękniętego sztyftu i polizało lub połknęło.
Ałun potasowy i amonowy mają działanie drażniące na błony śluzowe, dlatego pierwszą reakcją w razie połknięcia będą zapewne wymioty. Po polizaniu dziecko pewnie straci ochotę na kolejny liz, ałun ma bowiem bardzo cierpki, nieprzyjemny smak i działanie ściągające. W razie połknięcia najlepiej dać dziecku dużo wody do wypicia i skontaktować się z lekarzem. W razie polizania też dać wody, ale lekarz pewnie nie będzie potrzebny.
Toksyczność ostra związku jest niska - dawka śmiertelna to 6 g/kg masy ciała
Co takiego rozpuszcza DMSO?
Pewien dociekliwy czytelnik zainteresowany medycznymi zastosowaniami DMSO dopytywał mnie o kwestie tego co się w tym rozpuszcza, a co nie i czy ma on zastosowania medyczne.
Dimetylosulfotlenek, czyli w skrócie DMSO to cenny rozpuszczalnik, używany w medycynie i chemii organicznej. Wykazuje dużą skłonność do wnikania w tkanki organizmu, na tyle, że trzeba uważać przy pracy z nim bo po wchłonięciu metabolizuje do związków o zapachu czosnku. Ponieważ rozluźnia strukturę lipidową skóry, może ułatwiać wchłonięcie przezskórnie różnych substancji, w tym wielu leków, dlatego czyni się próby z wykorzystaniem do terapii bez konieczności zastrzyków. Sam w sobie ma zresztą działanie przeciwzapalne.
Bywa rozpuszczalnikiem środków na grzybicę stóp, które zwykle dość słabo przenikają przez zrogowaciały naskórek na podeszwach, może być też składnikiem maści przeciwbólowych do działania miejscowego, może rozmiękczać skórę przy twardzinie i przerastających bliznach. Robiono na ten temat badania [3]
Drugie pytanie dotyczyło możliwości rozpuszczania chondroityny przez DMSO i smarowania tym stawów jako alternatywy dla suplementacji doustnej.
Chondroityna to mukopolisacharyd będący składnikiem chrząstek stawowych i w formie siarczanu stanowiący wraz z glukozaminą jeden z czynników zapewniających lepszy poślizg. W związku z tym powstał pomysł, że jeśli zbyt mała ilość mazi stawowej i mała elastyczność chrząstek stawu powodują bóle, to zażywanie chondroityny i dostarczanie jej do organizmu, powinno leczyć bądź powstrzymywać rozwój schorzeń stawów poprzez dostarczenie organizmowi składnika do wytworzenia większej ilości mazi. Na tym też opiera się potężna gałąź przemysłu suplemenciarskiego.
Niestety w niedawno opublikowanej potężnej metaanalizie wielu badań wykazano, że w porównaniu z placebo zażywanie chondroityny lub glukozaminy lub obu tych środków razem, nie zmniejsza bólów ani innych objawów[4]
Wygląda na to, że samo dostarczenie organizmowi składników potrzebnych do wytworzenia czegośtam w którymś organie, wcale nie musi go pobudzać aby tą substancję jednak wytworzyć, zwłaszcza że niedostateczne wydzielanie tej substancji wcale nie musi być wynikiem niedoboru podstawowego składnika, może być skutkiem innych czynników, w tym genetycznych. Dlatego jeśli przyjrzycie się emitowanym obecnie reklamom takich pigułek, zauważycie że wcale nie stwierdzają one wprost, iż zażycie tego składnika powstrzyma chorobę. Zamiast tego zawierają ogólniki, typu "glukozamina jest składnikiem chrząstki stawowej" i "maź stawowa ma decydujące znaczenie w zapewnieniu elastyczności stawu" i na koniec, że ich pigułka zawiera podwójną czy potrójną dawkę, zaś konstrukcję logiczną "skoro to jest składnikiem chrząstki a chrząstka jest potrzebna w stawach, to pomoże mi na stawy" widz musi sam sobie przeprowadzać, w czym udanie pomaga mu sugestia pokazywanego w reklamie pana którego bolą stawy, który bierze ich tabletki a potem wygląda na mniej cierpiącego.
Ale wróćmy do pytania - czy chondroityna rozpuszcza się w DMSO? Cóż - wedle obszernego podsumowania rozpuszczalności różnych substancji w tym rozpuszczalniku, chondroityna jest nie rozpuszczalna. Słabo rozpuszcza się chlorowodorek glukozaminy, natomiast bardzo dobrze przeciwbólowy Ibuprofen.[5]
Tak że raczej nie tędy droga.
Gdzie zbadać wodę?
Miałem też pytania o to gdzie można samemu zbadać wodę ze studni, źródła czy ujęcia.
Z tego co się orientuję, takie badania oferują jednostki Sanepidu, zbadają one zawartość metali ciężkich, czystość bakteriologiczną i własności fizyczne, jak zamulenie, obecność kwasów humusowych, zażelazienie itp. Oczywiście są to badania płatne.
Próbkę wody może pobrać wysłany pracownik, ale można ją też pobrać samemu. Warszawska stacja podaje na swojej stronie specyfikację sposobu pobierania próbek, aby nadawały się do badania.[6]
Dezodorant z podbiałem
Świadoma konsumentka zadała mi pytanie w sprawie używanego dezodorantu, który zawierał w swoim składzie podbiał pospolity. Chcąc dowiedzieć się czegoś o tym składniku, dowiedziała się że roślina zawiera uszkadzające wątrobę alkaloidy. I stąd powstało pytanie, czy taki alkaloid może wchłaniać się przez skórę?
Podbiał to cenne zioło lecznicze, lecz dopiero w ostatnich latach zorientowano się, że może zawierać alkaloidy pirolizydynowe, o działaniu hepatotoksycznym, które w wyniku zażywania dłuższym niż dwa miesiące mogą powodować toksyczną niewydolność wątroby. Ich zawartość w surowcach zbieranych w Europie jest jednak bardzo niska - w polskim badaniu stwierdzono poziomy rzędu 0,0013%[7]
W jednym badaniu na szczurach stwierdzono minimalne wchłanianie przezskórne alkaloidów żywokostu, w ilości 20 razy mniejszej niż przy podaniu doustnym. Stwierdzono też, że przy chłonięciu przeskórnym, nie dochodzi do zamiany nietoksycznego N-tlenku w toksyczną formę zredukowaną, co zwykle następowało w jelitach po spożyciu.[8] Zatem wydaje się, że kosmetyków z roślin zawierających te alkaloidy można używać bezpiecznie.
Czy to cyjanek?
Dwa lata temu czytelnik przesłał mi zdjęcie białego proszku, z pytaniem czy to cyjanek potasu. Cóż mogłem odpowiedzieć... Spektroskopu w oczach nie mam. Odpisałem, że może to być cyjanek albo soda, albo sól morska, albo cokolwiek innego bo bardzo wiele soli tak wygląda. Nie wiem o co chodziło.
----------
[1] http://www.clays.org/journal/archive/volume%2026/26-6-434.pdf
[2] http://www.ncbi.nlm.nih.gov/pubmed/12851164
[3] http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3460663/
[4] http://www.bmj.com/content/341/bmj.c4675
[5] http://www.gaylordchemical.com/uploads/images/pdfs/literature/102B_english.pdf
[6] http://www.wsse.waw.pl/PageContent.aspx?SubMenuID=100
[7] https://depot.ceon.pl/bitstream/handle/123456789/1121/hp%2058%204%202012%2062.pdf?sequence=1&isAllowed=y
[8] http://www.ncbi.nlm.nih.gov/pubmed/7128756?dopt=Abstract
poniedziałek, 9 marca 2015
I grupa analityczna kationów
Podczas zajęć z chemii analitycznej starałem się robić zdjęcia każdej grupie i reakcji z każdym odczynnikiem. Różnej natury przyczyny sprawiły, że wszystkiego sfotografować się mi nie udało, ale coś tam zawsze można pokazać.
Klasyczna analiza nieorganicznych soli polega na przetestowaniu prostych reakcji dających osady o charakterystycznych właściwościach, tylko dla niektórych stosuje się dodatkowe odczynniki specyficzne. Rozpoznanie kationu opiera się na zgodności obserwowanych przemian z opisanymi w literaturze - musi powstać lub nie osad, o odpowiednim kolorze, rozpuszczający się lub nie w odpowiednim odczynniku.
Metody te mają znaczenie przede wszystkim dydaktyczne, bo w praktyce w analizie próbek na obecność metali używa się innych metod. Wymagają ona stosunkowo dużych ilości soli (aczkolwiek dużą ilość tych reakcji można przeprowadzać na pojedynczych kroplach, dzięki czemu możliwe staje się zbadanie pojedynczych okruchów).
Zależnie od tego jak sole reagują z pewnymi podstawowymi odczynnikami, pogrupowano je i podzielono. Dziś omówię grupę I, czyli jony metali, które dają osady po dodaniu kwasu solnego.
Ag, Hg(I),Pb(II)
+ Cl-
Po dodaniu odczynnika grupowego, czyli kwasu solnego lub roztworu chlorku sodu, wszystkie kationy wytrącają się w formie białych chlorków:
Powstające chlorki srebra, ołowiu i rtęci (I) to białe, nieco kłaczkowate osady. Chlorek srebra jest światłoczuły i po pewnym czasie ciemnieje, najpierw stając się szaro-fioletowy aż w końcu czarny. Zanim to jednak nastąpi, można go odróżnić od pozostałych za sprawą ciągu reakcji - po dodaniu roztworu amoniaku rozpuszcza się, tworząc kompleks chlorku aminasrebra, po dodaniu rozcieńczonego kwasu azotowego, osad chlorku pojawia się ponownie.
Zarówno chlorek srebra jak i ołowiu mogą rozpuścić się w nadmiarze odczynnika, dlatego powinno się używać raczej rozcieńczonego. Chlorek ołowiu rozpuszcza się na gorąco, przy ochłodzeniu tworząc białe igiełkowate kryształki.
+ NH3*H2O
Po dodaniu rozcieńczonego amoniaku do roztworów, wytrącają się różne osady:
Niestety ujawnia się tu złośliwość substancji - w próbówce prawej, zawierającej sól srebra, osad powstał podczas nalewania odczynnika i po chwili się rozpuścił. Szary osad tlenku srebra jest rozpuszczalny w nadmiarze i stąd takie efekty.
W próbówce po lewej wyraźny ciemnoszary osad, o skomplikowanym składzie. W reakcji z jonami amonowymi i hydroksylowymi zamiast oczekiwanego wodorotlenku, rtęć (I) tworzy sól aminortęciową oraz rtęć metaliczną, która zabarwia osad na szaro.
+ KJ (jodek potasu)
W tym przypadku pojawiają się osady o wyraźniejszych kolorach:
Od lewej: Hg22+, Pb2+, Ag+ . Osad jodku rtęci jest zielonkawy i dosyć ciemny, zawiera prawdopodobnie domieszki metalicznej rtęci. Nadmiar odczynnika powoduje rozpuszczenie jodku rtęci (I) z równoczesną dysproporcjonacją w wyniku której do roztworu przechodzi kompleks tetrajodku rtęci (II) a wytrąca się koloid metalicznej rtęci. Taki roztwór mógłby stanowić w zasadzie odczynnik Nesslera, używany do oznaczania jonów amonowych, ale zazwyczaj otrzymuje się go inną metodą..
Jodek ołowiu jest żółty. Rozpuszcza się w wodzie na gorąco, po ochłodzeniu wykrystalizowuje w formie żółtych blaszek o połysku podobnym do płatków złota, stąd też był kiedyś używany w żółtych farbach. Rozpuszcza się też w nadmiarze odczynnika.
Jodek srebra jest lekko żółtawy, z czasem ciemnieje od światła.
+ dichromian potasu
Intensywne kolory wywołuje także reakcja z dichromianem:
Chromian srebra jest czerwonym, drobnym osadem, rozpuszczalnym w amoniaku lub rozcieńczonym kwasie azotowym. Pośrodku widzicie intensywnie żółty chromian ołowiu, dawniej używany jako pigment malarski "żółcień ołowiana" obecnie rzadko używana ze względu na toksyczność. Chromian rtęci jest ciemnobrunatny, choć podobno podczas dłuższego gotowania zmienia się w czerwony.
+AKT
AKT to często stosowana, wygodniejsza w użyciu forma siarczków. Związek organiczny, amid kwasu tiooctowego, który w środowisku kwaśny i podczas ogrzewania ulega hydrolizie z wydzieleniem siarkowodoru. Strąca siarczki z roztworów soli metali
Z badanymi solami daje odpowiednie osady:
Osad siarczku srebra jest raczej szarawy i kłaczkowaty. Z nieznanych mi przyczyn czarny siarczek ołowiu się nie wytrącił, stąd pusta próbówka. W przypadku rtęci (I) zachodzi dysproporcjonacja, strąca się osad będący mieszanką metalicznej rtęci i siarczku rtęci (II).
Oprócz wymienionych podstawowych prób, istnieją też próby charakterystyczne, na przykład reakcja soli srebra z reduktorami może spowodować powstanie lustra na ściankach próbówki. Ołów reaguje z rodizonianem potasu dając ciemnofioletowy osad. Rtęć (I) tworzy z difenylokarbazydem charakterystyczny niebiesko-fioletowy kolor; reakcja jest bardzo czuła i wykorzystuje się ją do kolorymetrycznego oznaczania śladowych ilości rtęci.
----------
Klasyczna analiza nieorganicznych soli polega na przetestowaniu prostych reakcji dających osady o charakterystycznych właściwościach, tylko dla niektórych stosuje się dodatkowe odczynniki specyficzne. Rozpoznanie kationu opiera się na zgodności obserwowanych przemian z opisanymi w literaturze - musi powstać lub nie osad, o odpowiednim kolorze, rozpuszczający się lub nie w odpowiednim odczynniku.
Metody te mają znaczenie przede wszystkim dydaktyczne, bo w praktyce w analizie próbek na obecność metali używa się innych metod. Wymagają ona stosunkowo dużych ilości soli (aczkolwiek dużą ilość tych reakcji można przeprowadzać na pojedynczych kroplach, dzięki czemu możliwe staje się zbadanie pojedynczych okruchów).
Zależnie od tego jak sole reagują z pewnymi podstawowymi odczynnikami, pogrupowano je i podzielono. Dziś omówię grupę I, czyli jony metali, które dają osady po dodaniu kwasu solnego.
Ag, Hg(I),Pb(II)
+ Cl-
Po dodaniu odczynnika grupowego, czyli kwasu solnego lub roztworu chlorku sodu, wszystkie kationy wytrącają się w formie białych chlorków:
 |
| Od lewej Hg22+ ,Ag+ ,Pb2+ . |
Zarówno chlorek srebra jak i ołowiu mogą rozpuścić się w nadmiarze odczynnika, dlatego powinno się używać raczej rozcieńczonego. Chlorek ołowiu rozpuszcza się na gorąco, przy ochłodzeniu tworząc białe igiełkowate kryształki.
+ NH3*H2O
Po dodaniu rozcieńczonego amoniaku do roztworów, wytrącają się różne osady:
Niestety ujawnia się tu złośliwość substancji - w próbówce prawej, zawierającej sól srebra, osad powstał podczas nalewania odczynnika i po chwili się rozpuścił. Szary osad tlenku srebra jest rozpuszczalny w nadmiarze i stąd takie efekty.
W próbówce po lewej wyraźny ciemnoszary osad, o skomplikowanym składzie. W reakcji z jonami amonowymi i hydroksylowymi zamiast oczekiwanego wodorotlenku, rtęć (I) tworzy sól aminortęciową oraz rtęć metaliczną, która zabarwia osad na szaro.
+ KJ (jodek potasu)
W tym przypadku pojawiają się osady o wyraźniejszych kolorach:
Od lewej: Hg22+, Pb2+, Ag+ . Osad jodku rtęci jest zielonkawy i dosyć ciemny, zawiera prawdopodobnie domieszki metalicznej rtęci. Nadmiar odczynnika powoduje rozpuszczenie jodku rtęci (I) z równoczesną dysproporcjonacją w wyniku której do roztworu przechodzi kompleks tetrajodku rtęci (II) a wytrąca się koloid metalicznej rtęci. Taki roztwór mógłby stanowić w zasadzie odczynnik Nesslera, używany do oznaczania jonów amonowych, ale zazwyczaj otrzymuje się go inną metodą..
Jodek ołowiu jest żółty. Rozpuszcza się w wodzie na gorąco, po ochłodzeniu wykrystalizowuje w formie żółtych blaszek o połysku podobnym do płatków złota, stąd też był kiedyś używany w żółtych farbach. Rozpuszcza się też w nadmiarze odczynnika.
Jodek srebra jest lekko żółtawy, z czasem ciemnieje od światła.
+ dichromian potasu
Intensywne kolory wywołuje także reakcja z dichromianem:
Chromian srebra jest czerwonym, drobnym osadem, rozpuszczalnym w amoniaku lub rozcieńczonym kwasie azotowym. Pośrodku widzicie intensywnie żółty chromian ołowiu, dawniej używany jako pigment malarski "żółcień ołowiana" obecnie rzadko używana ze względu na toksyczność. Chromian rtęci jest ciemnobrunatny, choć podobno podczas dłuższego gotowania zmienia się w czerwony.
+AKT
AKT to często stosowana, wygodniejsza w użyciu forma siarczków. Związek organiczny, amid kwasu tiooctowego, który w środowisku kwaśny i podczas ogrzewania ulega hydrolizie z wydzieleniem siarkowodoru. Strąca siarczki z roztworów soli metali
Z badanymi solami daje odpowiednie osady:
Osad siarczku srebra jest raczej szarawy i kłaczkowaty. Z nieznanych mi przyczyn czarny siarczek ołowiu się nie wytrącił, stąd pusta próbówka. W przypadku rtęci (I) zachodzi dysproporcjonacja, strąca się osad będący mieszanką metalicznej rtęci i siarczku rtęci (II).
Oprócz wymienionych podstawowych prób, istnieją też próby charakterystyczne, na przykład reakcja soli srebra z reduktorami może spowodować powstanie lustra na ściankach próbówki. Ołów reaguje z rodizonianem potasu dając ciemnofioletowy osad. Rtęć (I) tworzy z difenylokarbazydem charakterystyczny niebiesko-fioletowy kolor; reakcja jest bardzo czuła i wykorzystuje się ją do kolorymetrycznego oznaczania śladowych ilości rtęci.
----------
Subskrybuj:
Posty (Atom)








