Czyli parę tajemnic, o jakich nie powiedzą wam w sklepikach ze zdrową i naturalną żywnością...
Na pomysł tego wpisu naprowadziły mnie pastylki na kaszel. Gdy przeglądałem dostępne w aptece znalazłem też takie, które chwaliły się że nie zawierają cukru. Zajrzałem więc na skład gdzie jako główny środek słodzący wymieniono ksylitol. To, samo w sobie, nie było jeszcze zaskakujące, jednak producent uznał za potrzebne uspokojenie klienta, tak aby nie zaniepokoił się tą trudną nazwą i w nawiasie wyjaśnił "ekstrakt z kory brzozy". I w tym problem, że składnik ten jest akurat takim ekstraktem, jak wódka sokiem...
Zacznijmy może od najbardziej podstawowej rzeczy - ksylitol nie jest cukrem. Więc pisanie wszędzie, we wszystkich reklamach, że to "cukier brzozowy" jest błędem. Na właściwy trop powinna naprowadzać nas już nazwa - końcówka -ol jest właściwa dla alkoholi, i faktycznie, ksylitol należy do grupy alkoholi cukrowych.
Typowy cukier to cząsteczka nasycona będąca łańcuchem węglowodorowym w którym każdy (lub prawie dla cukrów deoksy) węgiel jest przyłączony z grupą -OH, stąd wzór ogólny Cx(H2O)y i nazwa węglowodany, wydaje się bowiem sądząc po tym wzorze, jakby składały się z węgla i wody. Tym co odróżnia je od alkoholi wielohydroksylowych jest obecność grupy aldehydowej lub ketonowej, a więc z podwójnym wiązaniem węgiel-tlen C=O. Grupa ta wpływa na ich reaktywność oraz umożliwia im występowanie w formie pierścieniowej po utworzeniu hemiacetalu.
Jeśli teraz zredukujemy cukier tak, aby także tą grupę aldehydową lub ketonową zamienić w kolejną grupę -OH otrzymamy alkohol polihydroksylowy. Ze zredukowania glukozy powstaje sorbitol, także znany jako środek słodzący, ze zredukowanej mannozy mannitol. Możliwe jest też selektywne redukowanie wielocukrów. Ogółem różnym alkoholom cukrowym poświęcę jakiś osobny wpis, ale teraz zajmę się tym jednym. Natomiast ksylitol to produkt zredukowania ksylozy.
Ksyloza to cukier prosty zawierający pięć atomów węgla; glukoza i fruktoza zawierają ich sześć. W przyrodzie rzadko występuje swobodnie, najczęściej jest składnikiem hemiceluloz, będących budulcem ścian komórkowych roślin. Wiele połączonych cząsteczek ksylozy, czasem też arabinozy, tworzy łańcuchy nie tak długie i silnie połączone jak celuloza, stanowiące raczej spoiwo. Głównym wyróżnikiem jest łatwa rozpuszczalność w rozcieńczonych zasadach, dzięki czemu można je oddzielić od celulozy.
Hemicelulozy są w świecie roślinnym wszechobecne, spotykamy je w tkankach, szczególnie dużo w tych łykowatych i drewniejących. Są też obecne w drewnie zwłaszcza młodych drzew, przy czym im ich więcej tym bardziej jest miękkie i skłonne do pęcznienia, najwięcej bo do 30% zawiera ich drewno brzozy i buka. Aby otrzymać z tkanek ksylozę, najpierw trzeba oddzielić od nich hemicelulozy.
Rozdrobione tkanki roślinne traktuje się rozcieńczonymi zasadami, w których dobrze się rozpuszczają. Następnie zakwasza i poddaje hydrolizie bądź w warunkach silnie kwaśnych, bądź enzymatycznej. Po oczyszczeniu i wykrystalizowaniu otrzymujemy ksylozę. W czasie wojny Finowie pozbawieni dobrych źródeł cukru stosowali jako zamiennik właśnie ksylozę, która wprawdzie nie jest tak bardzo słodka jak cukier stołowy, ale w kraju gdzie burak cukrowy nie urośnie było to zawsze coś.
W Europie zwykle produkuje się ksylozę z drewna, mamy bowiem dość dobre źródła, natomiast na świecie są to łykowate części roślin, zwłaszcza łodygi kukurydzy, ale także wytłoki trzciny cukrowej, słoma z owsa lub ryżu a nawet łuski nasion bawełny. Często ksyloza jest spotykana pod nazwą cukru drzewnego, ale niekoniecznie brzozowego.
No dobra. Mamy już ksylozę. Co zrobić aby otrzymać z niej ksylitol? A no zredukować.
W przemyśle stosuje się głównie uwodornianie na katalizatorze niklowym [1] Robi się też próby z redukcją mikrobiologiczną przy pomocy pewnych gatunków drożdży lub pleśni, ale te nie mają takiego znaczenia.
Jako zamiennik cukru ksylitol ma zbliżoną słodkość do sacharozy i nie ma nieprzyjemnego posmaku, co zaś najważniejsze ma bardzo niski indeks glikemiczny a więc w bardzo małym stopniu przyczynia się do uwalniania insuliny i może być użyty w żywności dla diabetyków.
U niektórych zwierząt wykazuje wręcz przeciwne działanie - podany psom wywołuje na tyle silne wydzielenie insuliny, że może im grozić śmierć z powodu hipoglikemii; wystarczy już dawka rzędu 100 mg/kg psa. Było to dawniej przyczyną problemów z wprowadzeniem na rynek, ale dopiero potem badania pokazały że u ludzi ma zupełnie odmienny metabolizm i nie jest dla nich szkodliwy.
Jest dość wolno wchłaniany z jelita i większość jest przetwarzana przez bakterie jelitowe do krótkołańcuchowych kwasów tłuszczowych. W takiej formie metabolity ksylitolu mogą być wchłaniane i zużywane, w związku z czym wbrew temu co piszą niektóre strony nie jest to związek "bez kalorii"; wartość energetyczna to około 70% kaloryczności glukozy. Słabe wchłanianie w jelitach ma też swoje złe strony, może bowiem w zbyt dużych ilościach wywołać biegunkę osmotyczną, związaną z wydalaniem wody do treści jelit dla wyrównania stężenia, jednak organizm stopniowo adaptuje się do wchłaniania dzięki czemu po pewnym czasie można spożyć nawet kilkadziesiąt gramów bez złych skutków. Ponadto bakterie jelitowe mogą przetwarzać go nazbyt ochoczo doprowadzając do wzdęć.
Jak wykazują badania ze względu na to że nie jest metabolizowany przez bakterie w jamie ustnej nie przyczynia się do rozwoju próchnicy a nawet w pewnym stopniu ją hamuje wpływając na mineralizację szkliwa.
Czym więc nie jest ksylitol? Na pewno nie jest "ekstraktem z kory brzozy" - w tym przypadku producent pojechał po bandzie. Problematyczne są też reklamy opisujące, że jest otrzymywany z brzozy bez uściślenia w jaki sposób. W efekcie wielu ludzi wyobraża sobie, że występuje w drewnie, liściach lub soku i stamtąd jest po prostu wymywany, parę razy widziałem domysły, że krystalizuje się go z soku brzozowego w związku z czym sok taki propaguje się przypisując mu jego właściwości, a nawet domysły, że to po prostu wysuszony sok z brzozy (w rzeczywistości sok brzozy zawiera głownie sacharozę i glukozę[2]). W dodatku producenci skrzętnie omijają w reklamach inne źródła, jak wspomniane łodygi kukurydzy czy słoma owsiana, bo brzoza budzi lepsze skojarzenia, brzmi bardziej dziko i naturalnie.
Inny problem to reklamy opisujące że ksylitol jest składnikiem "występującym w naturze" czy wręcz "naturalnym" - faktycznie, występuje w naturze, szczególnie dużo (ok. 1%) jest go w owocach jagodowych i niektórych warzywach, ale nie stamtąd się go otrzymuje. A akurat ten sprzedawany z sklepach jest otrzymywany z drewna które go nie zawiera po dwuetapowym procesie, więc w najlepszym razie jest produktem półsyntetycznym. Niestety kult naturalności i przekonanie że wszystko co sztuczne musi być złe powodują, że dla większych zysków producenci starają się mniej lub bardziej oszukać klientów.
Jako ciekawostkę dodam na koniec, że po znitrowaniu można z ksylitolu zrobić całkiem niezły materiał wybuchowy. To tak a'propos argumentacji "to musi być złe bo ma złe zastosowania".
-------------
Źródła:
* https://en.wikipedia.org/wiki/Xylitol
* https://www.dcnutrition.com/miscellaneous/Detail.CFM?RecordNumber=695
* http://www.danisco.com/fileadmin/user_upload/danisco/documents/products/2e_XIVIA_White_Paper.pdf
[1] http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0104-66322003000300006
[2] http://luczaj.com/publikacje/2014%20Luczaj%20Bilek%20Stawarczyk.pdf
Polecam obszerny artykuł na temat ksylitolu, nie znalazłem go gdy szukałem informacji do swojego a dużo uzupełnia:
http://pinkcake.blox.pl/2015/02/Ksylitol-bialy-oczyszczony-nienaturalny.html
informacje
czwartek, 2 czerwca 2016
czwartek, 19 maja 2016
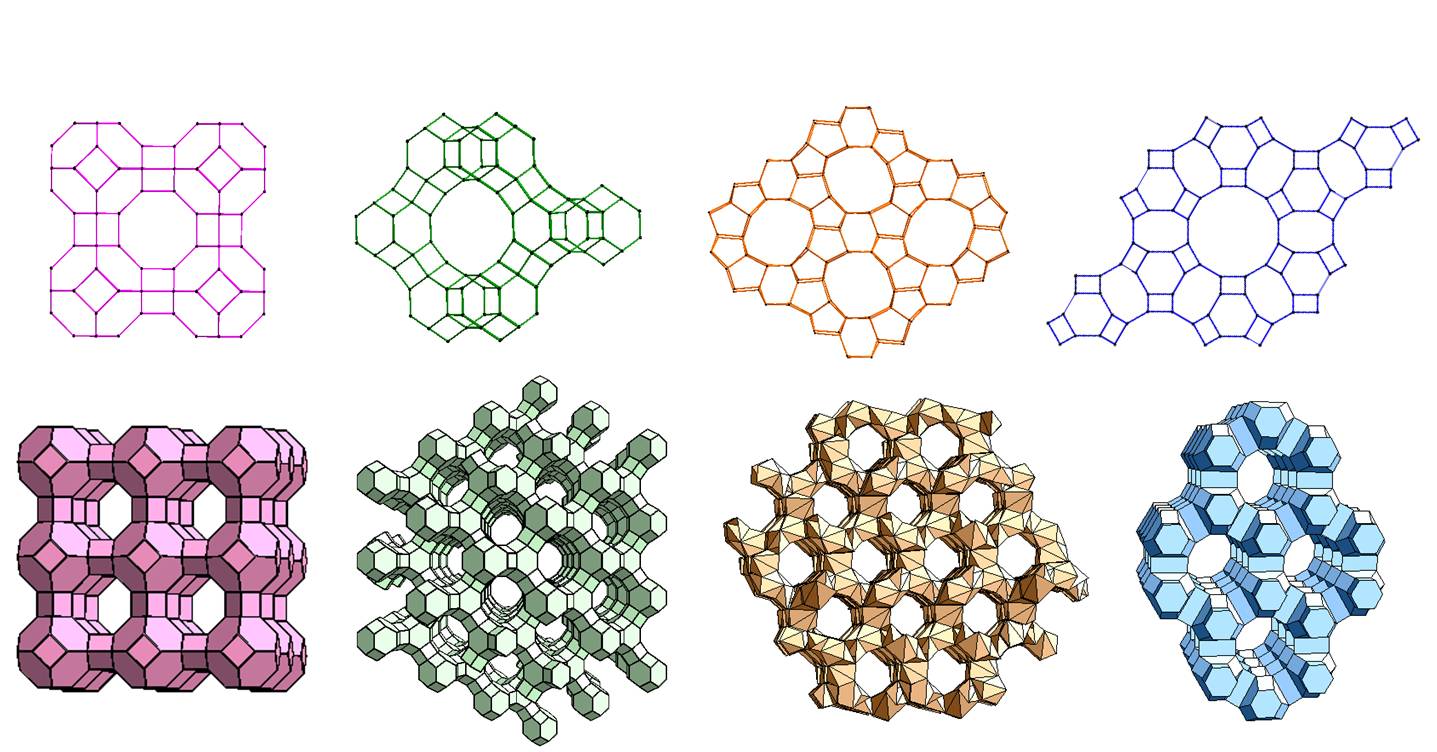
Sita molekularne
Z sitami molekularnymi student chemii zwykle spotyka się na pierwszych pracowniach laboratoryjnych, gdzie zawsze przy ogrzewaniu cieczy do wrzenia upomina się go "ale najpierw wrzuć do kolby sita molekularne" mające postać małych, twardych kuleczek. I bardzo możliwe, że aż do końca studiów będzie znał tylko takie ich zastosowanie. Niemniej co niektórych może jednak zastanowić, czym też są i czemu nazywa się je sitami, skoro wyglądają raczej jak małe granulki jakiejś masy ceramicznej?
Sita molekularne to granulki o tak dobranym składzie i metodzie produkcji, że są bardzo porowate, zaś te pory mają określoną wielkość pozwalającą wnikać wgłąb materiału cząsteczkom odpowiednio małym, zatrzymując cząsteczki za duże. Po prostu tylko cząsteczki mniejsze niż średnica poru będą w niego wchodzić i tym samym będą "odsiewane" od większych. Z tego też powodu najczęściej używa się sit do oddzielania niepożądanych, małocząsteczkowych zanieczyszczeń od cieczy i gazów.
Materiałem budującym sito molekularne są najczęściej syntetyczne minerały podobne do zeolitów posiadające w strukturze pory i kanały o dobrze zdefiniowanej wielkości. Najściślejsze mają pory o średnicy 3,4 i 5 Angstremów, czyli odpowiednio 0,3; 0,4 i 0,5 nanometra. Większe pory mają sita z porowatego szkła od 10 Å w górę. Sita o porach od 20 do 500 Angstremów mogą być stworzone z krzemionki koloidalnej, a te o jeszcze większych z krzemionki mezoporowatej. Ponadto w podobnym celu użyty może być węgiel aktywowany i niektóre porowate tworzywa sztuczne.
Generalnie więc w większości są to materiały niereaktywne, o dobrej wytrzymałości chemicznej i termicznej.
Jakie jest główne zastosowanie? Osuszanie.
Cząsteczka wody jest bardzo mała, szerokość na jaką odsunięte są atomy tlenu to 1,6 A, dlatego dość łatwo wchodzi w kanały porowatego materiału. Dodatkowo glinokrzemiany dość chętnie wiążą wodę czy to wiązaniami wodorowymi w grupach Si-H czy to przez przyciąganie do jonów. Dzięki temu po dodaniu sit do materiału normalnie słabo adsorbowanego, jak olej mineralny czy gaz ziemny, woda jest skutecznie odciągana.
Najdrobniejsze sita 3A mogą odciągać wodę od alkoholu i rozpuszczalników, których cząsteczki są zbyt duże aby wnikać w ich strukturę. Jest to jeden ze stosunkowo prostych sposobów uzyskania bezwodnego alkoholu - zwykle sprzedawany 95% alkohol zasypuje się odpowiednią ilością sit (pochłaniają wodę do 15-20% masy własnej) i zostawia w szczelnym pojemniku na kilkanaście godzin, potem odsącza lub destyluje aby oddzielić od pojawiającej się mineralnej zawiesiny.
Większe sita 4A i 5A mogą też wchłaniać alkohol etylowy, etan, eten i bywają używane do oddzielenia ich śladów z wielkocząsteczkowych rozpuszczalników. Chętnie korzysta z nich przemysł rafineryjny. Służą do usuwania z gazu ziemnego wody, kwasu mrówkowego, tlenków siarki, siarkowodoru a w odpowiednich warunkach też dwutlenku węgla. Jest to o tyle ważne, że nawet niewielkie ilości wody mogą zapychać instalacje podczas przetaczania gazu skroplonego, oraz wpływają korozyjnie na gazociągi.
Odmiany o porach 10-15 A mogą oddzielać węglowodory aromatyczne od ciekłych węglowodorów, a także służyć do rozdziału gazów. Odmiany mezoporowe, powyżej 100 A, mogą być użyte do rozdziału biomolekuł i krótkich peptydów.
Sita o odpowiednio dobranym składzie działają też jako wymieniacze jonowe, mogą pochłaniać z wody i ścieków metale ciężkie, chętnie też chłoną amoniak i jony amonowe.
Obok granulek żelu krzemionkowego sita molekularne są też jednymi z najczęściej używanych pochłaniaczy wilgoci w opakowaniach leków, żywności i elektroniki.
Jako materiał dla wytwarzania sit molekularnych najczęściej używa się zeolitów, bądź to naturalnych bądź otrzymywanych sztucznie. Sama nazwa "zeolit" znaczy dosłownie "wrzący kamień" i wywodzi się z ciekawej właściwości zbitych form. Aby z uwodnionego zeolitu usunąć wodę musimy go ogrzewać do odpowiednio dużej temperatury przez pewien czas. Jak zauważył pod koniec XIX wieku szwedzki mineralog Axel Frederik Cronstedt, proces odwrotny po polaniu wodą dobrze wysuszonego minerału przebiegał z wydzieleniem na tyle dużej ilości ciepła, że powstawała para a woda którą go polano zapieniła się.
Zeolity powstają najczęściej w skałach wulkanicznych i piroklastycznych w wyniku reakcji roztworów bogatych w krzem, glin i kationy alkaliczne z zasadami, często w warunkach hydrotermalnych. Krystalizują w pustkach skalnych i kanałach tworząc skupienia włókniste, szczotkowate lub kuliste. Mogą też powstawać jako spoiwo między ziarnami osadów zagrzebanych na dużej głębokości. Obecnie najwięcej zeolitów wydobywa się w Chinach, Korei Południowej i Japonii, w Europie najwięcej wydobywa ich Słowacja.
Jednak naturalne zeolity nie nadają się do niektórych zastosowań, głównie z powodu obecności zanieczyszczeń, stąd też zaczęto produkować je syntetycznie.
Produkcja generalnie rzecz biorąc jest dość prosta - strukturalnie są to klatkowe glinokrzemiany z domieszką kationów metali alkalicznych. Do syntezy bierze się więc żel wodny zawierający tlenek glinu i łączy ze szkłem wodnym czyli rozpuszczalnym w wodzie krzemianem sodu. Mieszaninę alkalizuje się wodorotlenkiem sodu lub potasu aby spolimeryzować powstające glinokrzemiany. Wielkość i układ porów zależy od rodzaju kationu alkalicznego, stającego się "rusztowaniem" dla pierścienia glinokrzemianowego odpowiedniej wielkości, toteż mieszanina domieszkowana jest odpowiednimi kationami, w tym także organicznymi jak tetraetyloamoniowy.
Teraz gęstniejący żel jest mieszany i ogrzewany w odpowiednich warunkach. Przy czym te "odpowiednie warunki" to w istocie klucz do sukcesu. Proces nie może przebiegać zbyt szybko bo powstaną nam po prostu zbite kryształy. Zależnie od stosunku krzemu do glinu, obecności metali alkalicznych, odczynu mieszaniny, rodzaju kationu stanowiącego wzorzec, szybkości procesowania, temperatury i innych czynników otrzymujemy zeolity o różnych strukturach. Jak na razie opisano ponad 250 struktur zeolitowych a wciąż nie jest to koniec.
Atomy podczas krystalizacji organizują się w klatkowate "bloczki" z których układana jest sieć. Połączone wielościany o strukturze sodalitu tworzą pomiędzy sobą kanały złożone z pierścieni. Rodzaj struktury determinuje wielkość pierścieni a co za tym idzie wielkość porów.
Po przeprowadzeniu procesu w "odpowiednich" warunkach otrzymujemy wilgotną masę drobnych cząstek zeolitu, która następnie jest granulowana lub wyciskana do formy pręcików i suszona.
Oprócz usuwania wody i innych małocząsteczkowych zanieczyszczeń zeolity znalazły szerokie zastosowanie w zmiękczaniu wody, mogą bowiem pochłaniać i wiązać jony wapnia i magnezu. Akwaryści powinni kojarzyć zeolity w takim zastosowaniu. Znaleźć je możemy w ekologicznych proszkach do prania, gdzie zastępują używane zwykle do zmiękczania fosforany, które trafiając do ścieków wywoływały przenawożenie wód i zakwity glonów. Granulki sit molekularnych są też używane do wzbogacania podłoża, długo bowiem trzymają wilgoć oraz mogą stopniowo uwalniać wchłonięte nawozy.
Inne zastosowanie to katalizatory zwłaszcza w krakingu ropy naftowej. Podejmowane są też próby użycia jako nośniki leków. Ze względu na wysoką energię hydratacji i możliwość zregenerowania wilgotnych sit, zaczęto używać ich także do długotrwałego przechowywania ciepła - sita są suszone przy pomocy ciepła na przykład z kolektorów słonecznych. Zamknięte w szczelnym opakowaniu nie tracą mogą być przechowywane dość długo, a pod wpływem wody ponownie wydzielają ciepło.
Jak jednak mają się te właściwości do zastosowania sit w laboratoriach podczas ogrzewania cieczy?
Stan wrzenia to sytuacja gdy ciecz pod wpływem wysokiej temperatury jest w stanie przechodzić w parę w całej objętości, wytwarzając bąble gazu. W praktyce jednak powstanie pęcherzyka ot tak wewnątrz cieczy jest mało prawdopodobne. Najpierw cząsteczki cieczy muszą zostać rozepchane na boki, gdy utworzy się faza gazowa na pęcherzyk działa zarówno ciśnienie hydrostatyczne jak i napięcie powierzchniowe. W efekcie bardzo małe pęcherzyki odczuwają ciśnienie większe od atmosferycznego, to hamuje parowanie wody do wnętrza pęcherzyka a ten może zaniknąć zanim nie stanie się na tyle duży aby wypłynąć na powierzchnię.
Sytuacja zostaje bardzo ułatwiona gdy podgrzana woda zetknie się z nierówną, chropowatą powierzchnią, wtedy ciśnienie działa na powstający przylegający pęcherzyk tylko od jednej strony, dzięki czemu łatwiej jest mu urosnąć. Analogiczna sytuacja dotyczy wydzielania się gazu z wody mineralnej - pęcherzyki powstają na ściankach i wybiegają stale z pewnych sprzyjających punktów.
Inną sytuacją która bardzo ułatwia wrzenie są bąbelki powietrza, stanowiące "zarodek" bąbelków pary. W przypadku materiałów porowatych mogą być to zarówno bąbelki przyczepione do nierównej powierzchni jak i zawarte wewnątrz materiału, stąd właśnie użycie różnych porowatych materiałów w charakterze "kamyków wrzennych". Mogą być to kawałki porcelany (na pracowni magisterskiej używałem drobnych okruchów rozbitej filiżanki), mogą to być granulki ceramiczne i mogą to być też sita molekularne, które zawsze gdzieś tam stoją na pracowni.
A dlaczego w takim razie musimy ułatwiać wrzenie?
Cóż, to utrudnienie powstawania pierwszych pęcherzyków powoduje, że gdy podgrzewana ciecz jest bardzo czysta i ogrzewamy ją w gładkim naczyniu, możliwe staje się jej przegrzanie powyżej temperatury normalnego wrzenia. Wodę można w ten sposób ogrzać do temperatury 120-130 *C, w sprzyjających warunkach i przy szybkim ogrzewaniu aż do 160 stopni.
W takiej sytuacji drobne zaburzenie, w rodzaju pierwszego pęcherzyka, zamieszania czy wibracji może spowodować dość gwałtowne zawrzenie, często połączone ze spienieniem się i wychlapaniem naszej cieczy. Pół biedy gdy ogrzewana mieszanina pójdzie chłodnicą, ale równie dobrze może prysnąć na rękę eksperymentatora. Problem ten upowszechnił się w ostatnim czasie wraz z mikrofalówkami - wiele osób używa ich do podgrzewania wody na herbatę. Jeśli użyją do tego czystej wody i wstawią wodę w gładkiej szklance, woda może nie zawrzeć mimo, że będzie bardzo gorąca. Wrzucenie do niej teraz herbaty i cukru może spowodować wytryśnięcie z kubka i poparzenia.
Bez kamyków wrzennych ciecze wrą nieregularnie, z uderzeniami gwałtowniejszych wrzeń co jakiś czas, i właśnie dlatego dla bezpieczeństwa i większej kontroli nad procesem należy wrzucać do kolby dwie-trzy granulki sit lub kawałki porcelany.
Sita molekularne to granulki o tak dobranym składzie i metodzie produkcji, że są bardzo porowate, zaś te pory mają określoną wielkość pozwalającą wnikać wgłąb materiału cząsteczkom odpowiednio małym, zatrzymując cząsteczki za duże. Po prostu tylko cząsteczki mniejsze niż średnica poru będą w niego wchodzić i tym samym będą "odsiewane" od większych. Z tego też powodu najczęściej używa się sit do oddzielania niepożądanych, małocząsteczkowych zanieczyszczeń od cieczy i gazów.
Materiałem budującym sito molekularne są najczęściej syntetyczne minerały podobne do zeolitów posiadające w strukturze pory i kanały o dobrze zdefiniowanej wielkości. Najściślejsze mają pory o średnicy 3,4 i 5 Angstremów, czyli odpowiednio 0,3; 0,4 i 0,5 nanometra. Większe pory mają sita z porowatego szkła od 10 Å w górę. Sita o porach od 20 do 500 Angstremów mogą być stworzone z krzemionki koloidalnej, a te o jeszcze większych z krzemionki mezoporowatej. Ponadto w podobnym celu użyty może być węgiel aktywowany i niektóre porowate tworzywa sztuczne.
Generalnie więc w większości są to materiały niereaktywne, o dobrej wytrzymałości chemicznej i termicznej.
Jakie jest główne zastosowanie? Osuszanie.
Cząsteczka wody jest bardzo mała, szerokość na jaką odsunięte są atomy tlenu to 1,6 A, dlatego dość łatwo wchodzi w kanały porowatego materiału. Dodatkowo glinokrzemiany dość chętnie wiążą wodę czy to wiązaniami wodorowymi w grupach Si-H czy to przez przyciąganie do jonów. Dzięki temu po dodaniu sit do materiału normalnie słabo adsorbowanego, jak olej mineralny czy gaz ziemny, woda jest skutecznie odciągana.
Najdrobniejsze sita 3A mogą odciągać wodę od alkoholu i rozpuszczalników, których cząsteczki są zbyt duże aby wnikać w ich strukturę. Jest to jeden ze stosunkowo prostych sposobów uzyskania bezwodnego alkoholu - zwykle sprzedawany 95% alkohol zasypuje się odpowiednią ilością sit (pochłaniają wodę do 15-20% masy własnej) i zostawia w szczelnym pojemniku na kilkanaście godzin, potem odsącza lub destyluje aby oddzielić od pojawiającej się mineralnej zawiesiny.
Większe sita 4A i 5A mogą też wchłaniać alkohol etylowy, etan, eten i bywają używane do oddzielenia ich śladów z wielkocząsteczkowych rozpuszczalników. Chętnie korzysta z nich przemysł rafineryjny. Służą do usuwania z gazu ziemnego wody, kwasu mrówkowego, tlenków siarki, siarkowodoru a w odpowiednich warunkach też dwutlenku węgla. Jest to o tyle ważne, że nawet niewielkie ilości wody mogą zapychać instalacje podczas przetaczania gazu skroplonego, oraz wpływają korozyjnie na gazociągi.
Odmiany o porach 10-15 A mogą oddzielać węglowodory aromatyczne od ciekłych węglowodorów, a także służyć do rozdziału gazów. Odmiany mezoporowe, powyżej 100 A, mogą być użyte do rozdziału biomolekuł i krótkich peptydów.
Sita o odpowiednio dobranym składzie działają też jako wymieniacze jonowe, mogą pochłaniać z wody i ścieków metale ciężkie, chętnie też chłoną amoniak i jony amonowe.
Obok granulek żelu krzemionkowego sita molekularne są też jednymi z najczęściej używanych pochłaniaczy wilgoci w opakowaniach leków, żywności i elektroniki.
Jako materiał dla wytwarzania sit molekularnych najczęściej używa się zeolitów, bądź to naturalnych bądź otrzymywanych sztucznie. Sama nazwa "zeolit" znaczy dosłownie "wrzący kamień" i wywodzi się z ciekawej właściwości zbitych form. Aby z uwodnionego zeolitu usunąć wodę musimy go ogrzewać do odpowiednio dużej temperatury przez pewien czas. Jak zauważył pod koniec XIX wieku szwedzki mineralog Axel Frederik Cronstedt, proces odwrotny po polaniu wodą dobrze wysuszonego minerału przebiegał z wydzieleniem na tyle dużej ilości ciepła, że powstawała para a woda którą go polano zapieniła się.
Zeolity powstają najczęściej w skałach wulkanicznych i piroklastycznych w wyniku reakcji roztworów bogatych w krzem, glin i kationy alkaliczne z zasadami, często w warunkach hydrotermalnych. Krystalizują w pustkach skalnych i kanałach tworząc skupienia włókniste, szczotkowate lub kuliste. Mogą też powstawać jako spoiwo między ziarnami osadów zagrzebanych na dużej głębokości. Obecnie najwięcej zeolitów wydobywa się w Chinach, Korei Południowej i Japonii, w Europie najwięcej wydobywa ich Słowacja.
Jednak naturalne zeolity nie nadają się do niektórych zastosowań, głównie z powodu obecności zanieczyszczeń, stąd też zaczęto produkować je syntetycznie.
Produkcja generalnie rzecz biorąc jest dość prosta - strukturalnie są to klatkowe glinokrzemiany z domieszką kationów metali alkalicznych. Do syntezy bierze się więc żel wodny zawierający tlenek glinu i łączy ze szkłem wodnym czyli rozpuszczalnym w wodzie krzemianem sodu. Mieszaninę alkalizuje się wodorotlenkiem sodu lub potasu aby spolimeryzować powstające glinokrzemiany. Wielkość i układ porów zależy od rodzaju kationu alkalicznego, stającego się "rusztowaniem" dla pierścienia glinokrzemianowego odpowiedniej wielkości, toteż mieszanina domieszkowana jest odpowiednimi kationami, w tym także organicznymi jak tetraetyloamoniowy.
Teraz gęstniejący żel jest mieszany i ogrzewany w odpowiednich warunkach. Przy czym te "odpowiednie warunki" to w istocie klucz do sukcesu. Proces nie może przebiegać zbyt szybko bo powstaną nam po prostu zbite kryształy. Zależnie od stosunku krzemu do glinu, obecności metali alkalicznych, odczynu mieszaniny, rodzaju kationu stanowiącego wzorzec, szybkości procesowania, temperatury i innych czynników otrzymujemy zeolity o różnych strukturach. Jak na razie opisano ponad 250 struktur zeolitowych a wciąż nie jest to koniec.
Atomy podczas krystalizacji organizują się w klatkowate "bloczki" z których układana jest sieć. Połączone wielościany o strukturze sodalitu tworzą pomiędzy sobą kanały złożone z pierścieni. Rodzaj struktury determinuje wielkość pierścieni a co za tym idzie wielkość porów.
Po przeprowadzeniu procesu w "odpowiednich" warunkach otrzymujemy wilgotną masę drobnych cząstek zeolitu, która następnie jest granulowana lub wyciskana do formy pręcików i suszona.
Oprócz usuwania wody i innych małocząsteczkowych zanieczyszczeń zeolity znalazły szerokie zastosowanie w zmiękczaniu wody, mogą bowiem pochłaniać i wiązać jony wapnia i magnezu. Akwaryści powinni kojarzyć zeolity w takim zastosowaniu. Znaleźć je możemy w ekologicznych proszkach do prania, gdzie zastępują używane zwykle do zmiękczania fosforany, które trafiając do ścieków wywoływały przenawożenie wód i zakwity glonów. Granulki sit molekularnych są też używane do wzbogacania podłoża, długo bowiem trzymają wilgoć oraz mogą stopniowo uwalniać wchłonięte nawozy.
Inne zastosowanie to katalizatory zwłaszcza w krakingu ropy naftowej. Podejmowane są też próby użycia jako nośniki leków. Ze względu na wysoką energię hydratacji i możliwość zregenerowania wilgotnych sit, zaczęto używać ich także do długotrwałego przechowywania ciepła - sita są suszone przy pomocy ciepła na przykład z kolektorów słonecznych. Zamknięte w szczelnym opakowaniu nie tracą mogą być przechowywane dość długo, a pod wpływem wody ponownie wydzielają ciepło.
Jak jednak mają się te właściwości do zastosowania sit w laboratoriach podczas ogrzewania cieczy?
Stan wrzenia to sytuacja gdy ciecz pod wpływem wysokiej temperatury jest w stanie przechodzić w parę w całej objętości, wytwarzając bąble gazu. W praktyce jednak powstanie pęcherzyka ot tak wewnątrz cieczy jest mało prawdopodobne. Najpierw cząsteczki cieczy muszą zostać rozepchane na boki, gdy utworzy się faza gazowa na pęcherzyk działa zarówno ciśnienie hydrostatyczne jak i napięcie powierzchniowe. W efekcie bardzo małe pęcherzyki odczuwają ciśnienie większe od atmosferycznego, to hamuje parowanie wody do wnętrza pęcherzyka a ten może zaniknąć zanim nie stanie się na tyle duży aby wypłynąć na powierzchnię.
Sytuacja zostaje bardzo ułatwiona gdy podgrzana woda zetknie się z nierówną, chropowatą powierzchnią, wtedy ciśnienie działa na powstający przylegający pęcherzyk tylko od jednej strony, dzięki czemu łatwiej jest mu urosnąć. Analogiczna sytuacja dotyczy wydzielania się gazu z wody mineralnej - pęcherzyki powstają na ściankach i wybiegają stale z pewnych sprzyjających punktów.
Inną sytuacją która bardzo ułatwia wrzenie są bąbelki powietrza, stanowiące "zarodek" bąbelków pary. W przypadku materiałów porowatych mogą być to zarówno bąbelki przyczepione do nierównej powierzchni jak i zawarte wewnątrz materiału, stąd właśnie użycie różnych porowatych materiałów w charakterze "kamyków wrzennych". Mogą być to kawałki porcelany (na pracowni magisterskiej używałem drobnych okruchów rozbitej filiżanki), mogą to być granulki ceramiczne i mogą to być też sita molekularne, które zawsze gdzieś tam stoją na pracowni.
A dlaczego w takim razie musimy ułatwiać wrzenie?
Cóż, to utrudnienie powstawania pierwszych pęcherzyków powoduje, że gdy podgrzewana ciecz jest bardzo czysta i ogrzewamy ją w gładkim naczyniu, możliwe staje się jej przegrzanie powyżej temperatury normalnego wrzenia. Wodę można w ten sposób ogrzać do temperatury 120-130 *C, w sprzyjających warunkach i przy szybkim ogrzewaniu aż do 160 stopni.
W takiej sytuacji drobne zaburzenie, w rodzaju pierwszego pęcherzyka, zamieszania czy wibracji może spowodować dość gwałtowne zawrzenie, często połączone ze spienieniem się i wychlapaniem naszej cieczy. Pół biedy gdy ogrzewana mieszanina pójdzie chłodnicą, ale równie dobrze może prysnąć na rękę eksperymentatora. Problem ten upowszechnił się w ostatnim czasie wraz z mikrofalówkami - wiele osób używa ich do podgrzewania wody na herbatę. Jeśli użyją do tego czystej wody i wstawią wodę w gładkiej szklance, woda może nie zawrzeć mimo, że będzie bardzo gorąca. Wrzucenie do niej teraz herbaty i cukru może spowodować wytryśnięcie z kubka i poparzenia.
Bez kamyków wrzennych ciecze wrą nieregularnie, z uderzeniami gwałtowniejszych wrzeń co jakiś czas, i właśnie dlatego dla bezpieczeństwa i większej kontroli nad procesem należy wrzucać do kolby dwie-trzy granulki sit lub kawałki porcelany.
sobota, 30 kwietnia 2016
Chemiczne wieści (6.)
Dzisiejszy odcinek wypadł bardziej kwantowo-fizyczny. Bo tak.
Czterowymiarowy kryształ?
Tlenki żelaza choć znane od wieków, wciąż budzą zainteresowanie technologów i fizyków i niekiedy nadal daje się odkryć nowe, ciekawe ich właściwości. W 2011 roku doniesiono o odkryciu, że mieszanina tleneku żelaza II i żelaza II/III (FeO+Fe3O4) poddany działaniu wysokiego ciśnienia zamienia się w unikalny tlenek Fe4O5. Faza ta wykazywała silne właściwości ferrimagnetyczne podobne do magnetytu.
Wiadomo było już, że magnetyt w niskich temperaturach ulega przejściu fazowemu II rodzaju, w wyniku którego atomy o różnym stopniu utlenienia tworzą równoległe struktury (Wervey phase). W typowym magnetycie atomy żelaza II i żelaza III są przemieszane statystycznie, nie tworząc regularnych struktur, zaś elektrony mogą przeskakiwać od jednego jonu do drugiego dzięki czemu materiał wykazuje przewodność elektryczną. Po przejściu fazowym następuje samoorganizacja - atomy o danym stopniu utlenienia tworzą w sieci krystalicznej struktury liniowe lub płaszczyzny.
W przypadku magnetytu wiązało się to z utrudnieniem ruchu elektronów i wzrostem oporu, ale w innych materiałach może to doprowadzać do pojawiania się nadprzewodnictwa, ferromagnetyczności lub gigantycznego magnetooporu stosowanego dziś w elektronicznych nośnikach danych.
Nic też dziwnego, że postanowiono sprawdzić czy w podobny sposób zachowa się nowy materiał. Rosyjski zespół stwierdził zachodzenie podobnej przemiany poniżej temperatury 150 K. Materiał zmieniał właściwości magnetyczne a opór elektryczny rósł o dwa rzędy wielkości. Problematyczne okazało się natomiast przypisanie mu określonej struktury. Zakładano, że mamy do czynienia z takim samym zjawiskiem organizacji stopni utlenienia, ale wyniki pomiarów nie dawały się złożyć w prosty model. Wyglądało na to, że struktury atomów o jednakowym stopniu utlenienia falują i statystycznie może się wydawać, że są rozmieszczone przypadkowo.
Porządek pojawił się dopiero gdy symulowano rozkład ładunków w przestrzeni czterowymiarowej. Z tego też powodu informacje o tym odkryciu często powtarzają że odkryto "czterowymiarowy kryształ". W tym przypadku chodzi jednak jedynie o matematyczny model rozkładu ładunków, opisywany funkcją nie dającą rozwiązania w normalnej przestrzeni.[1]
Kwantowa woda
Nietypowe zachowanie się wody zamkniętej w wąskich kapilarach odkryli właśnie amerykańscy badacze. Badali oni właściwości wody w kapilarnych kanałach struktury berylu, ważnego minerału magmowego, przy pomocy techniki rozpraszania neutronów. Średnica kanału na tyle ograniczała cząsteczki, że w przekroju mieściła się tylko jedna. Zamiast jednak struktur cząsteczek uzyskali nietypowe, heksagonalne pierścienie. Sygnał obecności atomu tlenu pojawiał się w sześciu miejscach, a każdego z dwóch wodorów także w sześciu. Ponieważ zaś sześć cząsteczek by się w przekroju kanału nie zmieściło, zaś dla tej jednej bariera energetyczna obrotu jest zbyt duża aby wynik wywoływało ustawianie się jej w różnych pozycjach w trakcie badania, jako wyjaśnienie tych obserwacji zaproponowali nietypowy model - jest to w istocie nadal jedna cząsteczka, tylko kwantowo interferująca sama ze sobą.[2]
Jedną z konsekwencji teorii kwantowej była hipoteza de Brogile'a, że każdej cząstce materialnej można przypisać właściwości falowe które wpływają na jej oddziaływania i zachowania. Za sprawą tych właściwości obserwujemy dyfrakcję cząstek na dwóch szczelinach lub siatkach dyfrakcyjnych, powodującą że prawdopodobieństwo znalezienia się cząstki z danym miejscu zależy od wzoru jej "fali materii". Przepuszczając odpowiednio dużo cząstek przez szczeliny i badając w jakie miejsce na detektorze uderzą, otrzymujemy w końcu wzór właściwy interferującym falom.
Jedną ze szczególnie interesujących konsekwencji tego zjawiska są kwantowe miraże, czyli wzory oddziaływań, jakie tworzy cząstka zamknięta w niewiele od niej większym ograniczeniu przestrzennym. Wewnątrz okręgu ułożonego z atomów na podłożu powstaje wzór podobny do fal na wodzie z centralną górką stanowiącą złudzenie istnienia tam jakiegoś atomu:
Po umieszczeniu atomu w jednym z ognisk elipsy, w drugim ognisku pojawia się jego słaby miraż:
Jak się wydaje w opisywanym przypadku zachodzi coś podobnego. Cząsteczka wody wewnątrz niewiele od niej większego, heksagonalnego kanału interferuje. Próby określenia położenia jej atomów kończą się więc stwierdzeniem sześciokątnego wzoru na który składają się zagęszczenia fal prawdopodobieństwa obecności atomu w tej niewielkiej przestrzeni. Poprzednio udało się zmierzyć podobny efekt dla atomów wodoru, ale woda to już zupełnie inna sprawa. Pory tych rozmiarów (4 A) występują w minerałach budujących skorupę ziemską, zatem kwantowy efekt może mieć znaczenie dla modelowania właściwości gleby i skał.
Nowy rodzaj wiązania?
Obliczenia kwantowomechaniczne dokonane przez badaczy z amerykańskiego Southern Methodist University w Dallas wskazują na istnienie jeszcze jednego rzadkiego rodzaju wiązania chemicznego - jest to odmiana wiązania wodorowego z oddziaływaniem między atomem wodoru połączonym z borem a układem aromatycznym. Znane były tego rodzaju połączenia dla układów w których wodór połączony był z węglem i azotem, mające pewne znaczenie w biologii molekularnej, jednak dotychczas wydawało się, że nie powinny zachodzić dla boranów. Bor ma mniejszą elektroujemność niż wodór, toteż wiązanie między nimi jest tak spolaryzowane, że na protonie pojawia się lekki ładunek ujemny. Bardziej naładowany elektronami wodór powinien być więc odpychany przez pełen elektronów pierścień aromatyczny.
Z drugiej strony związki boru są często połączeniami elektrono-deficytowymi, z pojawiającymi się wiązaniami trójcentrowymi a w takiej sytuacji na wodorze powinien pojawić się cząstkowy ładunek dodatni.
Wedle ostatnich wyliczeń diborany oraz karborany powinny na tej zasadzie tworzyć słabe wiązania B-H--Ar o długości 2,65-2,50 A . Pewnym potwierdzeniem tych przewidywań może być struktura pewnego kompleksu irydu, w którym między wodorem grupy karboranowej a pierścieniem z grupy trifenylometylowej występuje trudne do wytłumaczenia w inny sposób zbliżenie na zbliżoną odległość.[3]
---------
[1] Ovsyannikov V. S.; Charge-ordering transition in iron oxide Fe4O5 involving competing dimer and trimer formation. Nature Chemistry, 2016; DOI: 10.1038/NCHEM.2478
[2] Kolesnikov A.I. et al. Quantum Tunneling of Water in Beryl: A New State of the Water Molecule. Physical Review Letters, 2016; 116 (16) DOI: 10.1103/PhysRevLett.116.167802
[3] X Zhang et al, B–H···π Interaction: A New Type of Nonclassical Hydrogen Bonding
J. Am. Chem. Soc., 2016, DOI: 10.1021/jacs.6b01249
Czterowymiarowy kryształ?
Tlenki żelaza choć znane od wieków, wciąż budzą zainteresowanie technologów i fizyków i niekiedy nadal daje się odkryć nowe, ciekawe ich właściwości. W 2011 roku doniesiono o odkryciu, że mieszanina tleneku żelaza II i żelaza II/III (FeO+Fe3O4) poddany działaniu wysokiego ciśnienia zamienia się w unikalny tlenek Fe4O5. Faza ta wykazywała silne właściwości ferrimagnetyczne podobne do magnetytu.
Wiadomo było już, że magnetyt w niskich temperaturach ulega przejściu fazowemu II rodzaju, w wyniku którego atomy o różnym stopniu utlenienia tworzą równoległe struktury (Wervey phase). W typowym magnetycie atomy żelaza II i żelaza III są przemieszane statystycznie, nie tworząc regularnych struktur, zaś elektrony mogą przeskakiwać od jednego jonu do drugiego dzięki czemu materiał wykazuje przewodność elektryczną. Po przejściu fazowym następuje samoorganizacja - atomy o danym stopniu utlenienia tworzą w sieci krystalicznej struktury liniowe lub płaszczyzny.
W przypadku magnetytu wiązało się to z utrudnieniem ruchu elektronów i wzrostem oporu, ale w innych materiałach może to doprowadzać do pojawiania się nadprzewodnictwa, ferromagnetyczności lub gigantycznego magnetooporu stosowanego dziś w elektronicznych nośnikach danych.
Nic też dziwnego, że postanowiono sprawdzić czy w podobny sposób zachowa się nowy materiał. Rosyjski zespół stwierdził zachodzenie podobnej przemiany poniżej temperatury 150 K. Materiał zmieniał właściwości magnetyczne a opór elektryczny rósł o dwa rzędy wielkości. Problematyczne okazało się natomiast przypisanie mu określonej struktury. Zakładano, że mamy do czynienia z takim samym zjawiskiem organizacji stopni utlenienia, ale wyniki pomiarów nie dawały się złożyć w prosty model. Wyglądało na to, że struktury atomów o jednakowym stopniu utlenienia falują i statystycznie może się wydawać, że są rozmieszczone przypadkowo.
Porządek pojawił się dopiero gdy symulowano rozkład ładunków w przestrzeni czterowymiarowej. Z tego też powodu informacje o tym odkryciu często powtarzają że odkryto "czterowymiarowy kryształ". W tym przypadku chodzi jednak jedynie o matematyczny model rozkładu ładunków, opisywany funkcją nie dającą rozwiązania w normalnej przestrzeni.[1]
Kwantowa woda
Nietypowe zachowanie się wody zamkniętej w wąskich kapilarach odkryli właśnie amerykańscy badacze. Badali oni właściwości wody w kapilarnych kanałach struktury berylu, ważnego minerału magmowego, przy pomocy techniki rozpraszania neutronów. Średnica kanału na tyle ograniczała cząsteczki, że w przekroju mieściła się tylko jedna. Zamiast jednak struktur cząsteczek uzyskali nietypowe, heksagonalne pierścienie. Sygnał obecności atomu tlenu pojawiał się w sześciu miejscach, a każdego z dwóch wodorów także w sześciu. Ponieważ zaś sześć cząsteczek by się w przekroju kanału nie zmieściło, zaś dla tej jednej bariera energetyczna obrotu jest zbyt duża aby wynik wywoływało ustawianie się jej w różnych pozycjach w trakcie badania, jako wyjaśnienie tych obserwacji zaproponowali nietypowy model - jest to w istocie nadal jedna cząsteczka, tylko kwantowo interferująca sama ze sobą.[2]
Jedną z konsekwencji teorii kwantowej była hipoteza de Brogile'a, że każdej cząstce materialnej można przypisać właściwości falowe które wpływają na jej oddziaływania i zachowania. Za sprawą tych właściwości obserwujemy dyfrakcję cząstek na dwóch szczelinach lub siatkach dyfrakcyjnych, powodującą że prawdopodobieństwo znalezienia się cząstki z danym miejscu zależy od wzoru jej "fali materii". Przepuszczając odpowiednio dużo cząstek przez szczeliny i badając w jakie miejsce na detektorze uderzą, otrzymujemy w końcu wzór właściwy interferującym falom.
Jedną ze szczególnie interesujących konsekwencji tego zjawiska są kwantowe miraże, czyli wzory oddziaływań, jakie tworzy cząstka zamknięta w niewiele od niej większym ograniczeniu przestrzennym. Wewnątrz okręgu ułożonego z atomów na podłożu powstaje wzór podobny do fal na wodzie z centralną górką stanowiącą złudzenie istnienia tam jakiegoś atomu:
Po umieszczeniu atomu w jednym z ognisk elipsy, w drugim ognisku pojawia się jego słaby miraż:
Jak się wydaje w opisywanym przypadku zachodzi coś podobnego. Cząsteczka wody wewnątrz niewiele od niej większego, heksagonalnego kanału interferuje. Próby określenia położenia jej atomów kończą się więc stwierdzeniem sześciokątnego wzoru na który składają się zagęszczenia fal prawdopodobieństwa obecności atomu w tej niewielkiej przestrzeni. Poprzednio udało się zmierzyć podobny efekt dla atomów wodoru, ale woda to już zupełnie inna sprawa. Pory tych rozmiarów (4 A) występują w minerałach budujących skorupę ziemską, zatem kwantowy efekt może mieć znaczenie dla modelowania właściwości gleby i skał.
Nowy rodzaj wiązania?
Obliczenia kwantowomechaniczne dokonane przez badaczy z amerykańskiego Southern Methodist University w Dallas wskazują na istnienie jeszcze jednego rzadkiego rodzaju wiązania chemicznego - jest to odmiana wiązania wodorowego z oddziaływaniem między atomem wodoru połączonym z borem a układem aromatycznym. Znane były tego rodzaju połączenia dla układów w których wodór połączony był z węglem i azotem, mające pewne znaczenie w biologii molekularnej, jednak dotychczas wydawało się, że nie powinny zachodzić dla boranów. Bor ma mniejszą elektroujemność niż wodór, toteż wiązanie między nimi jest tak spolaryzowane, że na protonie pojawia się lekki ładunek ujemny. Bardziej naładowany elektronami wodór powinien być więc odpychany przez pełen elektronów pierścień aromatyczny.
Z drugiej strony związki boru są często połączeniami elektrono-deficytowymi, z pojawiającymi się wiązaniami trójcentrowymi a w takiej sytuacji na wodorze powinien pojawić się cząstkowy ładunek dodatni.
| @ American Chemical Society |
---------
[1] Ovsyannikov V. S.; Charge-ordering transition in iron oxide Fe4O5 involving competing dimer and trimer formation. Nature Chemistry, 2016; DOI: 10.1038/NCHEM.2478
[2] Kolesnikov A.I. et al. Quantum Tunneling of Water in Beryl: A New State of the Water Molecule. Physical Review Letters, 2016; 116 (16) DOI: 10.1103/PhysRevLett.116.167802
[3] X Zhang et al, B–H···π Interaction: A New Type of Nonclassical Hydrogen Bonding
J. Am. Chem. Soc., 2016, DOI: 10.1021/jacs.6b01249
piątek, 22 kwietnia 2016
Reakcja nie całkiem charakterystyczna
Czyli dłuższa anegdota o odkryciu pewnego związku.
Wraz z rozwojem przemysłu w XIX wiecznej Europie, w tym maszyn parowych i pieców hutniczych, duże znaczenie jako paliwo zaczął odgrywać węgiel kamienny. Dla pewnych zastosowań korzystniejszym niż surowe paliwem był koks, otrzymany przez ogrzewanie węgla bez dostępu powietrza tak, że ulatywała zeń woda i lotnie związki. Koks, o wyższej wartości opałowej, zużywano głównie do wytopu stali; gazy palne zużywano do oświetlania ulic w latarniach i jako gaz do kuchenek; wykraplana woda pogazowa zawierająca amoniak była zużywana do produkcji nawozów sztucznych.
Jedynym produktem ubocznym jaki nie dawał się wprost zastosować była smoła pogazowa, często po prostu wylewana albo po oddzieleniu najbardziej lotnych składników używana do impregnacji drewna. Szybko zainteresowali się nią chemicy świadomi, że jest mieszanką wielu interesujących substancji. Stwierdzili oni na przykład, że przez destylację surowej smoły można otrzymać frakcje o rozmaitych właściwościach. Z jednych odzyskiwano naftalen, z innych dawało się wyprodukować fenol, zaś najlżejsza i niskowrząca frakcja dawała się zastosować jako rozpuszczalnik i olej oświetleniowy. Frakcja ta stanowiła też zresztą uciążliwe zanieczyszczenie gazu koksowniczego używanego do oświetlenia, zauważalne zwłaszcza gdy doprowadzany gaz był jeszcze ciepły. Wykraplała się na chłodnych kloszach latarń i przemieszana z sadzą zbierała na dnie.
Tam też na lepkie zanieczyszczenie zwrócił uwagę w 1825 roku Michael Faraday, który będąc bardzo praktycznym człowiekiem podjął się jej destylacji, chcąc otrzymać palny olej. Przydatnym produktem okazała się jedna z frakcji, o temperaturze wrzenia 80°C. Była to rzadka, lekko żółtawa ciecz spalająca się bardzo kopcącym płomieniem i będąca dobrym rozpuszczalnikiem. W następnych dekadach nauczono się wyodrębniać ją na duża skalę ze smoły pogazowej, a ze względu na obfite występowanie w benzolu, cieczy absorbowanej z gazu koksowniczego na stałych pochłaniaczach, nazwano ją benzenem.
Benzen odegrał dużą rolę w rozwoju chemii organicznej. To od niego pewną grupę niereaktywnych związków, często posiadających charakterystyczny zapach, nazwano związkami aromatycznymi. W tym wczesnym okresie duży problem sprawiało chemikom określenie jego struktury cząsteczkowej. Całkiem niedawno przyjęło się uważać, że pierwiastki składają się z atomów, a związki ze złożeń tych atomów w drobne całostki, nazwane cząsteczkami, o określonej budowie i układzie połączonych atomów. Jedyną informację o przypuszczalnym składzie cząsteczki stanowiły stosunki ilościowe pierwiastków składowych. Wiedząc w jakich ilościach łączą się ze sobą atomy, należało domyśleć się jaką prawdopodobnie tworzyły ze sobą strukturę.
Chemikiem który włożył w tą dziedzinę najwięcej, był opisywany już tutaj August Friedrich Kekule. On to po raz pierwszy na podstawie swych badań ustalił, że węgiel w związkach organicznych łączy się z maksymalnie czterema innymi atomami. W późniejszym okresie zastanawiając się jak połączyć ze sobą budulcowe atomy, doszedł do wniosku, że atomy węgla w bardziej skomplikowanych związkach muszą łączyć się tworząc łańcuchy. Wedle opowiadanej przezeń po latach anegdoty, myśl tą podsunął mu sen w którym dostrzegł tańczące atomy, które w pewnym momencie zaczęły się bawić w lokomotywę.
Pomysł ten nie dawał się jednak zastosować do niektórych związków, czego przykładem był benzen, złożony z węgla i wodoru w stosunku 1:1, i zawierający najwyraźniej sześć węgli. Rozwiązanie podsunął mu kolejny sen, w którym tańczące atomy utworzyły węża, a ten w pewnym momencie uchwycił swój ogon i w takiej formie wirował mu przed oczami. No tak - załóżmy że atomy są połączone w pierścień i mają wolną możliwość przyłączenia jeszcze tylko po jednym, a skład będzie się zgadzał.
Po upływie kolejnych lat chemicy coraz śmielej poczynali sobie z tworzeniem nowych pochodnych tego związku, aż w roku 1879 słynny chemik Bayer, założyciel zakładu produkującego między innymi Aspirynę, zauważył bardzo specyficzną reakcję - gdy wytrząsnął benzen ze stężonym kwasem siarkowym i dodał izatyny, żółtopomarańczowej substancji otrzymywanej z indygo, powstawało wyraźne niebieskie zabarwienie, zauważalne nawet przy niewielkich ilościach substancji. Wyglądało zatem na to, że odkryto prostą i szybką reakcję charakterystyczną, pozwalającą wykrywać benzen.
Odkrycie szybko zostało uznane i niektórzy postępowi profesorowie chemii zaczęli uczyć o tej reakcji na uniwersytetach. Jednym z nich był profesor Wiliam Weith wykładający chemię na uniwersytecie w Zurychu. Miał on specjalny lektorat poświęcony związkom aromatycznym, podczas którego pokazywał najbardziej charakterystyczne reakcje. Niestety na początku 1882 roku zmarł, toteż zajęciami podczas wiosennego semestru zajął się jego bliski przyjaciel Viktor Meyer.
Gdy przygotowywał się do zajęć polecił swojemu asystentowi aby przygotował mu próbkę benzenu. Tylko miał być czysty, tak aby pokaz poszedł bez problemów.
W dniu wykładu asystent dostarczył odpowiednią ilość związku. Meyer omówił historię i strukturę benzenu, po czym przeszedł do omawiania reakcji. Można wyobrazić sobie jak mówi studentom, że gdy teraz wytrząsie benzen ze stężonym kwasem i doda izatyny, to zobaczymy piękny niebieski kolor. Następnie tak jak mówił wytrząsa w próbówce benzen i stężony kwas, dodaje izatynę i... nic się nie dzieje. Powtarza reakcję, bo może coś akurat źle zrobił, ale nic nie pomaga. No cóż, tak się czasem zdarza, powtórzymy na następnych zajęciach.
Po skończonym wykładzie zwrócił się zatem do asystenta z delikatnym zapytaniem, co on u licha mu na te zajęcia przygotował. Bo jeśli nie szyny i nie izatyna, to benzen był zły. Asystent, znany później Traugott Sandmeyer bronił się że ależ skąd, przygotował benzen czysty, jak profesor chciał, wszystko wedle przepisu z dekarboksylacji kwasu benzoesowego bo tylko wtedy dawało się otrzymać zupełnie czysty. To już było zastanawiające. Jeszcze tego samego dnia Meyer wziął komercyjnie dostępny benzen otrzymywany z powęglowego benzolu, wytrząsnął z kwasem, dodał izatyny i otrzymał zgodnie z opisem Bayera piękny niebieski barwnik, znany jako indofenina.
Nie wiedząc co z tym faktem począć, wziął większą ilość komercyjnego benzenu, wytrząsnął z kwasem, oddzieloną warstwę kwasową zobojętnił stwierdzając, że wydzieliła mu się rzadka, lekko żółtawa ciecz o charakterystycznym zapachu, która wydawała się identyczna z benzenem. Meyer sądził zatem, że benzen występuje w dwóch formach, jednej mało aktywnej i drugiej "zaktywizowanej" i wchodzącej w reakcję barwną. Powtórzenie reakcji z otrzymaną cieczą pozwoliło mu na wytworzenie większej ilości niebieskiego barwnika, który wysłał do zbadania Bayerowi. Ten orzekł, że faktycznie jest to indofenina, ale zarazem w analizie elementarnej wyszło mu, że związek zawiera siarkę, której nie było w izatynie. Dalsze testy "aktywizowanego benzenu" pokazały, że musi być to substancja różna od benzenu. W odróżnieniu od niego nie krystalizowała w lodzie, i wrzała w temperaturze 84 stopni, w porównaniu z 80 stopni dla benzenu zupełnie czystego. Wreszcie analiza chemiczna wykazała, że jest to związek zawierający jeden atom siarki, cztery atomy węgla i cztery wodoru.
I tak Meyer odkrył Tiofen.
Odkrycie tiofenu zelektryzowało ówczesnych chemików. Okazało się że przez kilka dekad nie zauważyli, że benzen ze smoły węglowej jest mieszanką dwóch związków, przy czym ten drugi, tiofen, stanowił w niektórych partiach do 10%
Tiofen należy do grupy pięciokątnych związków aromatycznych, w których aromatyczność nadaje im zdelokalizowany układ sześciu elektronów - dwóch pochodzących z wiązań podwójnych na części węglowej i jednej wolnej pary pożyczonej z heteroatomu. Pełnowęglowy odpowiednik czyli cyklopentadien nie jest aromatyczny, a dodatkowo efekty antyaromatyczne tylko zmniejszają jego trwałość. Dążąc do utrwalenia chętnie odszczepia jeden wodór tworząc karboanion cyklopentadienylowy który już jest aromatyczny.
Podstawienie jednego węgla w tym układzie heteroatomem posiadającym wolną parę elektronową tworzy aromatyczną cząsteczkę obojętną. Gdy tym atomem jest tlen, otrzymujemy furan, gdy azot jest to pirol. Udało się także otrzymać analogiczne cząsteczki z niektórymi metalami i półmetalami, takie jak silol z krzemem, arsol z arsenem, stannol z cyną a nawet tytanol z tytanem. Zachowują one częściową aromatyczność, ale znacznie osłabioną.
Dziś możemy już odpowiedzieć na pytanie co takiego zachodziło w próbówce Meyera i co właściwie wykrywała reakcja. Tiofen w odróżnieniu od benzenu jest bardziej reaktywny. Tyle samo bo sześć elektronów stłoczonych jest jednak na mniejszym bo pięcioatomowym pierścieniu. Większe zagęszczenie ładunku (oraz karboanionowe struktury mezomeryczne) powoduje, że chętniej reaguje z czynnikami elektrofilowymi. Takim czynnikiem może być też proton uwalniany przez odpowiednio silny kwas.
Podczas wytrząsania benzolu ze stężonym kwasem, tiofen ulegał protonowaniu i w formie jonowej przechodził do warstwy kwasowej. Dalsza reakcja z izatyną jest dość skomplikowana i nie zupełnie rozgryziona, zaczyna się prawdopodobnie od sprotonowania izatyny i wytworzenia formy z ładunkiem dodatnim, która jako elektrofil atakuje cząsteczkę tiofenu. Powstające połączenie dimeryzuje i ulega przegrupowaniu tworząc niebieski barwnik:
Indofenina występuje w kilku izomerach różniących się konformacją trans/cis na wiązaniach podwójnych, w zasadzie więc powstaje mieszanina izomerów. Reakcja ma dziś jeszcze zastosowanie do oznaczania niektórych mało podstawionych pochodnych tiofenu.
Jakie zastosowania ma tiofen?
Jednym które samo się narzuca jest produkcja barwników. Chętnie jest też używany w syntezach nowych leków. Może zastępować pierścień benzenowy bez utraty właściwości leku, a dzięki łatwiejszemu podstawieniu łatwiej jest wytworzyć różnorodne pochodne.
Najciekawszym zastosowaniem jest jednak wytwarzanie politiofenu, polimeru mogącego przewodzić prąd elektryczny.
Spolimeryzowany tiofen po utlenieniu staje się przewodnikiem typu metalicznego. Utleniony tylko częściowo stanowi natomiast organiczny półprzewodnik. Możliwe jest więc wytworzenie na przykład przezroczystej folii przewodzącej prąd, co powinno znaleźć zastosowanie w ogniwach słonecznych. Szersze zastosowanie znalazła dobrze rozpuszczalna pochodna poli(etylenodioksytiofenu) (PEDOT-PSS), która dzięki przewodnictwu jest używana w powłokach antystatycznych, nie pozwalających na elektryzowanie się powierzchni.
Sam poli(etylenodioksytiofen) jest słabo rozpuszczalny w rozpuszczalnikach organicznych. Folie i przewody wytworzone z tego materiału są używane w elastycznych wyświetlaczach OLED.
------------
* H. D. Hartough, The Chemistry of Heterocyclic Compounds, Thiophene and Its Derivatives,
* https://en.wikipedia.org/wiki/Thiophene
* https://en.wikipedia.org/wiki/Polythiophene
Wraz z rozwojem przemysłu w XIX wiecznej Europie, w tym maszyn parowych i pieców hutniczych, duże znaczenie jako paliwo zaczął odgrywać węgiel kamienny. Dla pewnych zastosowań korzystniejszym niż surowe paliwem był koks, otrzymany przez ogrzewanie węgla bez dostępu powietrza tak, że ulatywała zeń woda i lotnie związki. Koks, o wyższej wartości opałowej, zużywano głównie do wytopu stali; gazy palne zużywano do oświetlania ulic w latarniach i jako gaz do kuchenek; wykraplana woda pogazowa zawierająca amoniak była zużywana do produkcji nawozów sztucznych.
Jedynym produktem ubocznym jaki nie dawał się wprost zastosować była smoła pogazowa, często po prostu wylewana albo po oddzieleniu najbardziej lotnych składników używana do impregnacji drewna. Szybko zainteresowali się nią chemicy świadomi, że jest mieszanką wielu interesujących substancji. Stwierdzili oni na przykład, że przez destylację surowej smoły można otrzymać frakcje o rozmaitych właściwościach. Z jednych odzyskiwano naftalen, z innych dawało się wyprodukować fenol, zaś najlżejsza i niskowrząca frakcja dawała się zastosować jako rozpuszczalnik i olej oświetleniowy. Frakcja ta stanowiła też zresztą uciążliwe zanieczyszczenie gazu koksowniczego używanego do oświetlenia, zauważalne zwłaszcza gdy doprowadzany gaz był jeszcze ciepły. Wykraplała się na chłodnych kloszach latarń i przemieszana z sadzą zbierała na dnie.
Tam też na lepkie zanieczyszczenie zwrócił uwagę w 1825 roku Michael Faraday, który będąc bardzo praktycznym człowiekiem podjął się jej destylacji, chcąc otrzymać palny olej. Przydatnym produktem okazała się jedna z frakcji, o temperaturze wrzenia 80°C. Była to rzadka, lekko żółtawa ciecz spalająca się bardzo kopcącym płomieniem i będąca dobrym rozpuszczalnikiem. W następnych dekadach nauczono się wyodrębniać ją na duża skalę ze smoły pogazowej, a ze względu na obfite występowanie w benzolu, cieczy absorbowanej z gazu koksowniczego na stałych pochłaniaczach, nazwano ją benzenem.
Benzen odegrał dużą rolę w rozwoju chemii organicznej. To od niego pewną grupę niereaktywnych związków, często posiadających charakterystyczny zapach, nazwano związkami aromatycznymi. W tym wczesnym okresie duży problem sprawiało chemikom określenie jego struktury cząsteczkowej. Całkiem niedawno przyjęło się uważać, że pierwiastki składają się z atomów, a związki ze złożeń tych atomów w drobne całostki, nazwane cząsteczkami, o określonej budowie i układzie połączonych atomów. Jedyną informację o przypuszczalnym składzie cząsteczki stanowiły stosunki ilościowe pierwiastków składowych. Wiedząc w jakich ilościach łączą się ze sobą atomy, należało domyśleć się jaką prawdopodobnie tworzyły ze sobą strukturę.
Chemikiem który włożył w tą dziedzinę najwięcej, był opisywany już tutaj August Friedrich Kekule. On to po raz pierwszy na podstawie swych badań ustalił, że węgiel w związkach organicznych łączy się z maksymalnie czterema innymi atomami. W późniejszym okresie zastanawiając się jak połączyć ze sobą budulcowe atomy, doszedł do wniosku, że atomy węgla w bardziej skomplikowanych związkach muszą łączyć się tworząc łańcuchy. Wedle opowiadanej przezeń po latach anegdoty, myśl tą podsunął mu sen w którym dostrzegł tańczące atomy, które w pewnym momencie zaczęły się bawić w lokomotywę.
Pomysł ten nie dawał się jednak zastosować do niektórych związków, czego przykładem był benzen, złożony z węgla i wodoru w stosunku 1:1, i zawierający najwyraźniej sześć węgli. Rozwiązanie podsunął mu kolejny sen, w którym tańczące atomy utworzyły węża, a ten w pewnym momencie uchwycił swój ogon i w takiej formie wirował mu przed oczami. No tak - załóżmy że atomy są połączone w pierścień i mają wolną możliwość przyłączenia jeszcze tylko po jednym, a skład będzie się zgadzał.
Po upływie kolejnych lat chemicy coraz śmielej poczynali sobie z tworzeniem nowych pochodnych tego związku, aż w roku 1879 słynny chemik Bayer, założyciel zakładu produkującego między innymi Aspirynę, zauważył bardzo specyficzną reakcję - gdy wytrząsnął benzen ze stężonym kwasem siarkowym i dodał izatyny, żółtopomarańczowej substancji otrzymywanej z indygo, powstawało wyraźne niebieskie zabarwienie, zauważalne nawet przy niewielkich ilościach substancji. Wyglądało zatem na to, że odkryto prostą i szybką reakcję charakterystyczną, pozwalającą wykrywać benzen.
Odkrycie szybko zostało uznane i niektórzy postępowi profesorowie chemii zaczęli uczyć o tej reakcji na uniwersytetach. Jednym z nich był profesor Wiliam Weith wykładający chemię na uniwersytecie w Zurychu. Miał on specjalny lektorat poświęcony związkom aromatycznym, podczas którego pokazywał najbardziej charakterystyczne reakcje. Niestety na początku 1882 roku zmarł, toteż zajęciami podczas wiosennego semestru zajął się jego bliski przyjaciel Viktor Meyer.
Gdy przygotowywał się do zajęć polecił swojemu asystentowi aby przygotował mu próbkę benzenu. Tylko miał być czysty, tak aby pokaz poszedł bez problemów.
W dniu wykładu asystent dostarczył odpowiednią ilość związku. Meyer omówił historię i strukturę benzenu, po czym przeszedł do omawiania reakcji. Można wyobrazić sobie jak mówi studentom, że gdy teraz wytrząsie benzen ze stężonym kwasem i doda izatyny, to zobaczymy piękny niebieski kolor. Następnie tak jak mówił wytrząsa w próbówce benzen i stężony kwas, dodaje izatynę i... nic się nie dzieje. Powtarza reakcję, bo może coś akurat źle zrobił, ale nic nie pomaga. No cóż, tak się czasem zdarza, powtórzymy na następnych zajęciach.
Po skończonym wykładzie zwrócił się zatem do asystenta z delikatnym zapytaniem, co on u licha mu na te zajęcia przygotował. Bo jeśli nie szyny i nie izatyna, to benzen był zły. Asystent, znany później Traugott Sandmeyer bronił się że ależ skąd, przygotował benzen czysty, jak profesor chciał, wszystko wedle przepisu z dekarboksylacji kwasu benzoesowego bo tylko wtedy dawało się otrzymać zupełnie czysty. To już było zastanawiające. Jeszcze tego samego dnia Meyer wziął komercyjnie dostępny benzen otrzymywany z powęglowego benzolu, wytrząsnął z kwasem, dodał izatyny i otrzymał zgodnie z opisem Bayera piękny niebieski barwnik, znany jako indofenina.
Nie wiedząc co z tym faktem począć, wziął większą ilość komercyjnego benzenu, wytrząsnął z kwasem, oddzieloną warstwę kwasową zobojętnił stwierdzając, że wydzieliła mu się rzadka, lekko żółtawa ciecz o charakterystycznym zapachu, która wydawała się identyczna z benzenem. Meyer sądził zatem, że benzen występuje w dwóch formach, jednej mało aktywnej i drugiej "zaktywizowanej" i wchodzącej w reakcję barwną. Powtórzenie reakcji z otrzymaną cieczą pozwoliło mu na wytworzenie większej ilości niebieskiego barwnika, który wysłał do zbadania Bayerowi. Ten orzekł, że faktycznie jest to indofenina, ale zarazem w analizie elementarnej wyszło mu, że związek zawiera siarkę, której nie było w izatynie. Dalsze testy "aktywizowanego benzenu" pokazały, że musi być to substancja różna od benzenu. W odróżnieniu od niego nie krystalizowała w lodzie, i wrzała w temperaturze 84 stopni, w porównaniu z 80 stopni dla benzenu zupełnie czystego. Wreszcie analiza chemiczna wykazała, że jest to związek zawierający jeden atom siarki, cztery atomy węgla i cztery wodoru.
I tak Meyer odkrył Tiofen.
Odkrycie tiofenu zelektryzowało ówczesnych chemików. Okazało się że przez kilka dekad nie zauważyli, że benzen ze smoły węglowej jest mieszanką dwóch związków, przy czym ten drugi, tiofen, stanowił w niektórych partiach do 10%
Tiofen należy do grupy pięciokątnych związków aromatycznych, w których aromatyczność nadaje im zdelokalizowany układ sześciu elektronów - dwóch pochodzących z wiązań podwójnych na części węglowej i jednej wolnej pary pożyczonej z heteroatomu. Pełnowęglowy odpowiednik czyli cyklopentadien nie jest aromatyczny, a dodatkowo efekty antyaromatyczne tylko zmniejszają jego trwałość. Dążąc do utrwalenia chętnie odszczepia jeden wodór tworząc karboanion cyklopentadienylowy który już jest aromatyczny.
Podstawienie jednego węgla w tym układzie heteroatomem posiadającym wolną parę elektronową tworzy aromatyczną cząsteczkę obojętną. Gdy tym atomem jest tlen, otrzymujemy furan, gdy azot jest to pirol. Udało się także otrzymać analogiczne cząsteczki z niektórymi metalami i półmetalami, takie jak silol z krzemem, arsol z arsenem, stannol z cyną a nawet tytanol z tytanem. Zachowują one częściową aromatyczność, ale znacznie osłabioną.
Dziś możemy już odpowiedzieć na pytanie co takiego zachodziło w próbówce Meyera i co właściwie wykrywała reakcja. Tiofen w odróżnieniu od benzenu jest bardziej reaktywny. Tyle samo bo sześć elektronów stłoczonych jest jednak na mniejszym bo pięcioatomowym pierścieniu. Większe zagęszczenie ładunku (oraz karboanionowe struktury mezomeryczne) powoduje, że chętniej reaguje z czynnikami elektrofilowymi. Takim czynnikiem może być też proton uwalniany przez odpowiednio silny kwas.
Podczas wytrząsania benzolu ze stężonym kwasem, tiofen ulegał protonowaniu i w formie jonowej przechodził do warstwy kwasowej. Dalsza reakcja z izatyną jest dość skomplikowana i nie zupełnie rozgryziona, zaczyna się prawdopodobnie od sprotonowania izatyny i wytworzenia formy z ładunkiem dodatnim, która jako elektrofil atakuje cząsteczkę tiofenu. Powstające połączenie dimeryzuje i ulega przegrupowaniu tworząc niebieski barwnik:
Indofenina występuje w kilku izomerach różniących się konformacją trans/cis na wiązaniach podwójnych, w zasadzie więc powstaje mieszanina izomerów. Reakcja ma dziś jeszcze zastosowanie do oznaczania niektórych mało podstawionych pochodnych tiofenu.
Jakie zastosowania ma tiofen?
Jednym które samo się narzuca jest produkcja barwników. Chętnie jest też używany w syntezach nowych leków. Może zastępować pierścień benzenowy bez utraty właściwości leku, a dzięki łatwiejszemu podstawieniu łatwiej jest wytworzyć różnorodne pochodne.
Najciekawszym zastosowaniem jest jednak wytwarzanie politiofenu, polimeru mogącego przewodzić prąd elektryczny.
Spolimeryzowany tiofen po utlenieniu staje się przewodnikiem typu metalicznego. Utleniony tylko częściowo stanowi natomiast organiczny półprzewodnik. Możliwe jest więc wytworzenie na przykład przezroczystej folii przewodzącej prąd, co powinno znaleźć zastosowanie w ogniwach słonecznych. Szersze zastosowanie znalazła dobrze rozpuszczalna pochodna poli(etylenodioksytiofenu) (PEDOT-PSS), która dzięki przewodnictwu jest używana w powłokach antystatycznych, nie pozwalających na elektryzowanie się powierzchni.
Sam poli(etylenodioksytiofen) jest słabo rozpuszczalny w rozpuszczalnikach organicznych. Folie i przewody wytworzone z tego materiału są używane w elastycznych wyświetlaczach OLED.
------------
* H. D. Hartough, The Chemistry of Heterocyclic Compounds, Thiophene and Its Derivatives,
* https://en.wikipedia.org/wiki/Thiophene
* https://en.wikipedia.org/wiki/Polythiophene
Subskrybuj:
Posty (Atom)