Bateria z jajka
Każdy kto często spożywa jajecznicę wie, że skorupki są odpadem nieco kłopotliwym. Od wewnętrznej strony skorupka jest pokryta białkową błoną. Białko to chętnie gnije po wyrzuceniu do kosza i dorzuca do woni śmieci specyficzny, zgniłojajeczny aromat. Fakt ten jest też zresztą przeszkodą w przetwarzaniu odpadowych skorupek - zarówno przy przerabianiu na suplement diety jak i na dodatek wapnujący do gleby należy oddzielać błonkę, zwykle za pomocą odpowiednich chemikaliów.
Chemicy z Wayne State University w Detroit znaleźli natomiast sposób jak wykorzystać nieoczyszczoną skorupkę do syntezy materiału na elektrody do baterii litowych.
Metoda jest bardzo prosta - nie rozgniecioną skorupkę z jajka umieścili w naczyniu z roztworem wodorotlenku sodu, do środka skorupki dodali natomiast roztwór soli kobaltu. Skorupka posłużyła tu za porowatą, półprzepuszczalną przegrodę, przez którą powoli do wnętrza dyfundowały aniony hydroksylowe OH-. Na podściełającej skorupkę błonie wytrącała się warstewka amorficznego wodorotlenku kobaltu pokrywająca włókna białka.
Po czterech dniach skorupkę wyjęto i wysuszono, po czym już suchą poddano wyprażaniu bez dostępu powietrza w temperaturze 650 stopni. Włókna białkowe uległy wówczas zwęgleniu uwalniając siarkę, która reagowała z kobaltem, tworząc nanopręty siarczku kobaltu osadzone na włóknach węglowych.
Materiał ten może być potem przetworzony na porowatą elektrodę w pewnym typie baterii jonowych, chociaż nie znalazłem w pracy oryginalnej szczegółów na temat oddzielania włókien od skorupki.
Autorzy spekulują, że metoda mogłaby być zastosowana dla wykorzystania skorupek jaj rozbijanych maszynowo, gdzie jest to raczej odsysanie zawartości niż rozbicie, toteż po procesie zostają skorupki w dużym stopni całe.[a]
Imiona nowych pierwiastków
Zaledwie w styczniu oficjalnie uznano istnienie czterech nowych pierwiastków (o czym już pisałem) a już pojawiają się bardziej konkretne propozycje nazw. Grupy badaczy uznane za odkrywców mogą zgłosić własne propozycje nazw, które będą potem brane pod uwagę podczas podejmowania decyzji. Mogą być to nazwy odnoszące się do mitologii, do miejscowości lub minerałów, krajów lub regionów, charakterystycznej własciwosci pierwiastka lub honorujące jakiegoś znanego naukowca. Wedle tych zasad zespoły odkrywców zaproponowały:
- Zespół Riken z Japonii, uznany za odkrywców pierwiastka 113, proponuje nazwę "Nihonium" (Nh) od słowa "nihon" będącego jedną z dwóch nazw Japonii w języku japońskim.
- Zespół z Dubnej w Rosji który odkrył pierwiastek 115 proponuje nazwę "Moscovium) (Mv) od zlatynizowanej nazwy Moskwy.
- Ponieważ zarówno pierwiastek 115 i 117 odkryty został w ramach współpracy ośrodków w Dubnej w Rosji i w Oak Ridge w USA, dla tego drugiego zaproponowano nazwę Tennessine (Tn) od nazwy stanu w którym znajduje się kilka ośrodków badań jądrowych
- Pierwiastek 118 odkryto w ramach współpracy ośrodka w Dubnej i w Berkley, a jako nazwę zaproponowano Oganesson dla uczczenia profesora Jurija Oganessaja, pioniera badań nad poszukiwaniami transuranowców.
Jeśli nazwy zostałyby przyjęte przez IUPAC, to prawdopodobnie zostałyby spolszczone do "nihon", "moskow", "tennesyn" i "oganess". Nie brzmi to zbyt dobrze.[b]
Wystarczy jeden atom
Platyna od dawna znana jest ze swych świetnych właściwości katalitycznych i jest na dużą skalę używana w przemyśle, ale też na przykład jako składnik katalizatorów samochodowych. Poza łatwością zatruwania od pewnych domieszek ma platyna pewną istotną wadę - jest droga. Dlatego też chemicy od dawna starają się jak mogą zmniejszać jej ilość w katalizatorze przy zachowaniu zdolności do przyspieszania reakcji. W zasadzie nie używa się już czerni platynowej to jest jej bardzo drobnych cząstek, lecz raczej różnych materiałów porowatych pokrytych drobnymi ilościami platyny na powierzchni.
Ostatnia praca badaczy z Singapuru pokazuje, że można pójść jeszcze dalej.
Zastosowany przez nich katalizator składał się głownie z porowatego węgla na którego powierzchni osadzono klastry kwasu polifosforanomolibdenowego z przyłączonym jednym atomem platyny (PMo12O403−) Pt . Z jego użyciem możliwe było przeprowadzenie reakcji uwodorniania takich związków jak nitrobenzen, cykloheksanon czy styren, z nienajgorszymi wydajnościami (30-40%) przy stosunkach ilości platyny do substratu od 1:100 do 1:2000, a przy przedłużeniu czasu reakcji udało się nawet niemal całkowicie uwodornić substrakt przy stosunku 1:8000. [c]
------------
[a] X. Meng and Da Deng. Trash to Treasure: Waste Eggshells Used as Reactor and Template for Synthesis of Co9S8 Nanorod Arrays on Carbon Fibers for Energy Storage. Chem. Mater., 2016, 28 (11), pp 3897–3904 DOI: 10.1021/acs.chemmater.6b01142
[b] http://iupac.org/iupac-is-naming-the-four-new-elements-nihonium-moscovium-tennessine-and-oganesson/
[c] B. Zhang et.al. Stabilizing a Platinum1 Single-Atom Catalyst on Supported Phosphomolybdic Acid without Compromising Hydrogenation Activity, Angew. Chem. Int Ed. Volume 55, Issue 29
July 11, 2016 Pages 8319–8323
informacje
środa, 13 lipca 2016
czwartek, 16 czerwca 2016
Wczoraj w laboratorium (52.)
Wczoraj w laboratorium zająłem się destylacją tiofosgenu - strasznie śmierdzącego i trującego odczynnika.
Tiofosgen to formalnie rzecz biorąc podwójnie zchlorowana grupa tiokarbonylowa. Jego tlenowy analog fosgen był kiedyś używany jako bojowy gaz duszący, co daje już jakieś pojęcie o własnościach.
Zapach nie jest taki zły, jak oczekiwałem sądząc po obecności siarki. Jest ostry, drażniący a przede wszystkim duszący, podobny do innych prostych chlorków kwasowych.
Po co mi on? Do syntezy tiokarbonylodiimidazolu, a ten z kolei jest mi potrzebny do dalszych syntez. Po przeliczeniu wyszło mi, że taniej będzie otrzymać TCDI z tiofosgenu niż zamawiać gotowy. O ile uda się go w końcu zrobić bo już trzy razy próbowałem i powstawały różne dziwne produkty.
Tiofosgen to formalnie rzecz biorąc podwójnie zchlorowana grupa tiokarbonylowa. Jego tlenowy analog fosgen był kiedyś używany jako bojowy gaz duszący, co daje już jakieś pojęcie o własnościach.
Zapach nie jest taki zły, jak oczekiwałem sądząc po obecności siarki. Jest ostry, drażniący a przede wszystkim duszący, podobny do innych prostych chlorków kwasowych.
Po co mi on? Do syntezy tiokarbonylodiimidazolu, a ten z kolei jest mi potrzebny do dalszych syntez. Po przeliczeniu wyszło mi, że taniej będzie otrzymać TCDI z tiofosgenu niż zamawiać gotowy. O ile uda się go w końcu zrobić bo już trzy razy próbowałem i powstawały różne dziwne produkty.
czwartek, 2 czerwca 2016
Co to jest ksylitol?
Czyli parę tajemnic, o jakich nie powiedzą wam w sklepikach ze zdrową i naturalną żywnością...
Na pomysł tego wpisu naprowadziły mnie pastylki na kaszel. Gdy przeglądałem dostępne w aptece znalazłem też takie, które chwaliły się że nie zawierają cukru. Zajrzałem więc na skład gdzie jako główny środek słodzący wymieniono ksylitol. To, samo w sobie, nie było jeszcze zaskakujące, jednak producent uznał za potrzebne uspokojenie klienta, tak aby nie zaniepokoił się tą trudną nazwą i w nawiasie wyjaśnił "ekstrakt z kory brzozy". I w tym problem, że składnik ten jest akurat takim ekstraktem, jak wódka sokiem...
Zacznijmy może od najbardziej podstawowej rzeczy - ksylitol nie jest cukrem. Więc pisanie wszędzie, we wszystkich reklamach, że to "cukier brzozowy" jest błędem. Na właściwy trop powinna naprowadzać nas już nazwa - końcówka -ol jest właściwa dla alkoholi, i faktycznie, ksylitol należy do grupy alkoholi cukrowych.
Typowy cukier to cząsteczka nasycona będąca łańcuchem węglowodorowym w którym każdy (lub prawie dla cukrów deoksy) węgiel jest przyłączony z grupą -OH, stąd wzór ogólny Cx(H2O)y i nazwa węglowodany, wydaje się bowiem sądząc po tym wzorze, jakby składały się z węgla i wody. Tym co odróżnia je od alkoholi wielohydroksylowych jest obecność grupy aldehydowej lub ketonowej, a więc z podwójnym wiązaniem węgiel-tlen C=O. Grupa ta wpływa na ich reaktywność oraz umożliwia im występowanie w formie pierścieniowej po utworzeniu hemiacetalu.
Jeśli teraz zredukujemy cukier tak, aby także tą grupę aldehydową lub ketonową zamienić w kolejną grupę -OH otrzymamy alkohol polihydroksylowy. Ze zredukowania glukozy powstaje sorbitol, także znany jako środek słodzący, ze zredukowanej mannozy mannitol. Możliwe jest też selektywne redukowanie wielocukrów. Ogółem różnym alkoholom cukrowym poświęcę jakiś osobny wpis, ale teraz zajmę się tym jednym. Natomiast ksylitol to produkt zredukowania ksylozy.
Ksyloza to cukier prosty zawierający pięć atomów węgla; glukoza i fruktoza zawierają ich sześć. W przyrodzie rzadko występuje swobodnie, najczęściej jest składnikiem hemiceluloz, będących budulcem ścian komórkowych roślin. Wiele połączonych cząsteczek ksylozy, czasem też arabinozy, tworzy łańcuchy nie tak długie i silnie połączone jak celuloza, stanowiące raczej spoiwo. Głównym wyróżnikiem jest łatwa rozpuszczalność w rozcieńczonych zasadach, dzięki czemu można je oddzielić od celulozy.
Hemicelulozy są w świecie roślinnym wszechobecne, spotykamy je w tkankach, szczególnie dużo w tych łykowatych i drewniejących. Są też obecne w drewnie zwłaszcza młodych drzew, przy czym im ich więcej tym bardziej jest miękkie i skłonne do pęcznienia, najwięcej bo do 30% zawiera ich drewno brzozy i buka. Aby otrzymać z tkanek ksylozę, najpierw trzeba oddzielić od nich hemicelulozy.
Rozdrobione tkanki roślinne traktuje się rozcieńczonymi zasadami, w których dobrze się rozpuszczają. Następnie zakwasza i poddaje hydrolizie bądź w warunkach silnie kwaśnych, bądź enzymatycznej. Po oczyszczeniu i wykrystalizowaniu otrzymujemy ksylozę. W czasie wojny Finowie pozbawieni dobrych źródeł cukru stosowali jako zamiennik właśnie ksylozę, która wprawdzie nie jest tak bardzo słodka jak cukier stołowy, ale w kraju gdzie burak cukrowy nie urośnie było to zawsze coś.
W Europie zwykle produkuje się ksylozę z drewna, mamy bowiem dość dobre źródła, natomiast na świecie są to łykowate części roślin, zwłaszcza łodygi kukurydzy, ale także wytłoki trzciny cukrowej, słoma z owsa lub ryżu a nawet łuski nasion bawełny. Często ksyloza jest spotykana pod nazwą cukru drzewnego, ale niekoniecznie brzozowego.
No dobra. Mamy już ksylozę. Co zrobić aby otrzymać z niej ksylitol? A no zredukować.
W przemyśle stosuje się głównie uwodornianie na katalizatorze niklowym [1] Robi się też próby z redukcją mikrobiologiczną przy pomocy pewnych gatunków drożdży lub pleśni, ale te nie mają takiego znaczenia.
Jako zamiennik cukru ksylitol ma zbliżoną słodkość do sacharozy i nie ma nieprzyjemnego posmaku, co zaś najważniejsze ma bardzo niski indeks glikemiczny a więc w bardzo małym stopniu przyczynia się do uwalniania insuliny i może być użyty w żywności dla diabetyków.
U niektórych zwierząt wykazuje wręcz przeciwne działanie - podany psom wywołuje na tyle silne wydzielenie insuliny, że może im grozić śmierć z powodu hipoglikemii; wystarczy już dawka rzędu 100 mg/kg psa. Było to dawniej przyczyną problemów z wprowadzeniem na rynek, ale dopiero potem badania pokazały że u ludzi ma zupełnie odmienny metabolizm i nie jest dla nich szkodliwy.
Jest dość wolno wchłaniany z jelita i większość jest przetwarzana przez bakterie jelitowe do krótkołańcuchowych kwasów tłuszczowych. W takiej formie metabolity ksylitolu mogą być wchłaniane i zużywane, w związku z czym wbrew temu co piszą niektóre strony nie jest to związek "bez kalorii"; wartość energetyczna to około 70% kaloryczności glukozy. Słabe wchłanianie w jelitach ma też swoje złe strony, może bowiem w zbyt dużych ilościach wywołać biegunkę osmotyczną, związaną z wydalaniem wody do treści jelit dla wyrównania stężenia, jednak organizm stopniowo adaptuje się do wchłaniania dzięki czemu po pewnym czasie można spożyć nawet kilkadziesiąt gramów bez złych skutków. Ponadto bakterie jelitowe mogą przetwarzać go nazbyt ochoczo doprowadzając do wzdęć.
Jak wykazują badania ze względu na to że nie jest metabolizowany przez bakterie w jamie ustnej nie przyczynia się do rozwoju próchnicy a nawet w pewnym stopniu ją hamuje wpływając na mineralizację szkliwa.
Czym więc nie jest ksylitol? Na pewno nie jest "ekstraktem z kory brzozy" - w tym przypadku producent pojechał po bandzie. Problematyczne są też reklamy opisujące, że jest otrzymywany z brzozy bez uściślenia w jaki sposób. W efekcie wielu ludzi wyobraża sobie, że występuje w drewnie, liściach lub soku i stamtąd jest po prostu wymywany, parę razy widziałem domysły, że krystalizuje się go z soku brzozowego w związku z czym sok taki propaguje się przypisując mu jego właściwości, a nawet domysły, że to po prostu wysuszony sok z brzozy (w rzeczywistości sok brzozy zawiera głownie sacharozę i glukozę[2]). W dodatku producenci skrzętnie omijają w reklamach inne źródła, jak wspomniane łodygi kukurydzy czy słoma owsiana, bo brzoza budzi lepsze skojarzenia, brzmi bardziej dziko i naturalnie.
Inny problem to reklamy opisujące że ksylitol jest składnikiem "występującym w naturze" czy wręcz "naturalnym" - faktycznie, występuje w naturze, szczególnie dużo (ok. 1%) jest go w owocach jagodowych i niektórych warzywach, ale nie stamtąd się go otrzymuje. A akurat ten sprzedawany z sklepach jest otrzymywany z drewna które go nie zawiera po dwuetapowym procesie, więc w najlepszym razie jest produktem półsyntetycznym. Niestety kult naturalności i przekonanie że wszystko co sztuczne musi być złe powodują, że dla większych zysków producenci starają się mniej lub bardziej oszukać klientów.
Jako ciekawostkę dodam na koniec, że po znitrowaniu można z ksylitolu zrobić całkiem niezły materiał wybuchowy. To tak a'propos argumentacji "to musi być złe bo ma złe zastosowania".
-------------
Źródła:
* https://en.wikipedia.org/wiki/Xylitol
* https://www.dcnutrition.com/miscellaneous/Detail.CFM?RecordNumber=695
* http://www.danisco.com/fileadmin/user_upload/danisco/documents/products/2e_XIVIA_White_Paper.pdf
[1] http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0104-66322003000300006
[2] http://luczaj.com/publikacje/2014%20Luczaj%20Bilek%20Stawarczyk.pdf
Polecam obszerny artykuł na temat ksylitolu, nie znalazłem go gdy szukałem informacji do swojego a dużo uzupełnia:
http://pinkcake.blox.pl/2015/02/Ksylitol-bialy-oczyszczony-nienaturalny.html
Na pomysł tego wpisu naprowadziły mnie pastylki na kaszel. Gdy przeglądałem dostępne w aptece znalazłem też takie, które chwaliły się że nie zawierają cukru. Zajrzałem więc na skład gdzie jako główny środek słodzący wymieniono ksylitol. To, samo w sobie, nie było jeszcze zaskakujące, jednak producent uznał za potrzebne uspokojenie klienta, tak aby nie zaniepokoił się tą trudną nazwą i w nawiasie wyjaśnił "ekstrakt z kory brzozy". I w tym problem, że składnik ten jest akurat takim ekstraktem, jak wódka sokiem...
Zacznijmy może od najbardziej podstawowej rzeczy - ksylitol nie jest cukrem. Więc pisanie wszędzie, we wszystkich reklamach, że to "cukier brzozowy" jest błędem. Na właściwy trop powinna naprowadzać nas już nazwa - końcówka -ol jest właściwa dla alkoholi, i faktycznie, ksylitol należy do grupy alkoholi cukrowych.
Typowy cukier to cząsteczka nasycona będąca łańcuchem węglowodorowym w którym każdy (lub prawie dla cukrów deoksy) węgiel jest przyłączony z grupą -OH, stąd wzór ogólny Cx(H2O)y i nazwa węglowodany, wydaje się bowiem sądząc po tym wzorze, jakby składały się z węgla i wody. Tym co odróżnia je od alkoholi wielohydroksylowych jest obecność grupy aldehydowej lub ketonowej, a więc z podwójnym wiązaniem węgiel-tlen C=O. Grupa ta wpływa na ich reaktywność oraz umożliwia im występowanie w formie pierścieniowej po utworzeniu hemiacetalu.
Jeśli teraz zredukujemy cukier tak, aby także tą grupę aldehydową lub ketonową zamienić w kolejną grupę -OH otrzymamy alkohol polihydroksylowy. Ze zredukowania glukozy powstaje sorbitol, także znany jako środek słodzący, ze zredukowanej mannozy mannitol. Możliwe jest też selektywne redukowanie wielocukrów. Ogółem różnym alkoholom cukrowym poświęcę jakiś osobny wpis, ale teraz zajmę się tym jednym. Natomiast ksylitol to produkt zredukowania ksylozy.
Ksyloza to cukier prosty zawierający pięć atomów węgla; glukoza i fruktoza zawierają ich sześć. W przyrodzie rzadko występuje swobodnie, najczęściej jest składnikiem hemiceluloz, będących budulcem ścian komórkowych roślin. Wiele połączonych cząsteczek ksylozy, czasem też arabinozy, tworzy łańcuchy nie tak długie i silnie połączone jak celuloza, stanowiące raczej spoiwo. Głównym wyróżnikiem jest łatwa rozpuszczalność w rozcieńczonych zasadach, dzięki czemu można je oddzielić od celulozy.
Hemicelulozy są w świecie roślinnym wszechobecne, spotykamy je w tkankach, szczególnie dużo w tych łykowatych i drewniejących. Są też obecne w drewnie zwłaszcza młodych drzew, przy czym im ich więcej tym bardziej jest miękkie i skłonne do pęcznienia, najwięcej bo do 30% zawiera ich drewno brzozy i buka. Aby otrzymać z tkanek ksylozę, najpierw trzeba oddzielić od nich hemicelulozy.
Rozdrobione tkanki roślinne traktuje się rozcieńczonymi zasadami, w których dobrze się rozpuszczają. Następnie zakwasza i poddaje hydrolizie bądź w warunkach silnie kwaśnych, bądź enzymatycznej. Po oczyszczeniu i wykrystalizowaniu otrzymujemy ksylozę. W czasie wojny Finowie pozbawieni dobrych źródeł cukru stosowali jako zamiennik właśnie ksylozę, która wprawdzie nie jest tak bardzo słodka jak cukier stołowy, ale w kraju gdzie burak cukrowy nie urośnie było to zawsze coś.
W Europie zwykle produkuje się ksylozę z drewna, mamy bowiem dość dobre źródła, natomiast na świecie są to łykowate części roślin, zwłaszcza łodygi kukurydzy, ale także wytłoki trzciny cukrowej, słoma z owsa lub ryżu a nawet łuski nasion bawełny. Często ksyloza jest spotykana pod nazwą cukru drzewnego, ale niekoniecznie brzozowego.
No dobra. Mamy już ksylozę. Co zrobić aby otrzymać z niej ksylitol? A no zredukować.
W przemyśle stosuje się głównie uwodornianie na katalizatorze niklowym [1] Robi się też próby z redukcją mikrobiologiczną przy pomocy pewnych gatunków drożdży lub pleśni, ale te nie mają takiego znaczenia.
Jako zamiennik cukru ksylitol ma zbliżoną słodkość do sacharozy i nie ma nieprzyjemnego posmaku, co zaś najważniejsze ma bardzo niski indeks glikemiczny a więc w bardzo małym stopniu przyczynia się do uwalniania insuliny i może być użyty w żywności dla diabetyków.
U niektórych zwierząt wykazuje wręcz przeciwne działanie - podany psom wywołuje na tyle silne wydzielenie insuliny, że może im grozić śmierć z powodu hipoglikemii; wystarczy już dawka rzędu 100 mg/kg psa. Było to dawniej przyczyną problemów z wprowadzeniem na rynek, ale dopiero potem badania pokazały że u ludzi ma zupełnie odmienny metabolizm i nie jest dla nich szkodliwy.
Jest dość wolno wchłaniany z jelita i większość jest przetwarzana przez bakterie jelitowe do krótkołańcuchowych kwasów tłuszczowych. W takiej formie metabolity ksylitolu mogą być wchłaniane i zużywane, w związku z czym wbrew temu co piszą niektóre strony nie jest to związek "bez kalorii"; wartość energetyczna to około 70% kaloryczności glukozy. Słabe wchłanianie w jelitach ma też swoje złe strony, może bowiem w zbyt dużych ilościach wywołać biegunkę osmotyczną, związaną z wydalaniem wody do treści jelit dla wyrównania stężenia, jednak organizm stopniowo adaptuje się do wchłaniania dzięki czemu po pewnym czasie można spożyć nawet kilkadziesiąt gramów bez złych skutków. Ponadto bakterie jelitowe mogą przetwarzać go nazbyt ochoczo doprowadzając do wzdęć.
Jak wykazują badania ze względu na to że nie jest metabolizowany przez bakterie w jamie ustnej nie przyczynia się do rozwoju próchnicy a nawet w pewnym stopniu ją hamuje wpływając na mineralizację szkliwa.
Czym więc nie jest ksylitol? Na pewno nie jest "ekstraktem z kory brzozy" - w tym przypadku producent pojechał po bandzie. Problematyczne są też reklamy opisujące, że jest otrzymywany z brzozy bez uściślenia w jaki sposób. W efekcie wielu ludzi wyobraża sobie, że występuje w drewnie, liściach lub soku i stamtąd jest po prostu wymywany, parę razy widziałem domysły, że krystalizuje się go z soku brzozowego w związku z czym sok taki propaguje się przypisując mu jego właściwości, a nawet domysły, że to po prostu wysuszony sok z brzozy (w rzeczywistości sok brzozy zawiera głownie sacharozę i glukozę[2]). W dodatku producenci skrzętnie omijają w reklamach inne źródła, jak wspomniane łodygi kukurydzy czy słoma owsiana, bo brzoza budzi lepsze skojarzenia, brzmi bardziej dziko i naturalnie.
Inny problem to reklamy opisujące że ksylitol jest składnikiem "występującym w naturze" czy wręcz "naturalnym" - faktycznie, występuje w naturze, szczególnie dużo (ok. 1%) jest go w owocach jagodowych i niektórych warzywach, ale nie stamtąd się go otrzymuje. A akurat ten sprzedawany z sklepach jest otrzymywany z drewna które go nie zawiera po dwuetapowym procesie, więc w najlepszym razie jest produktem półsyntetycznym. Niestety kult naturalności i przekonanie że wszystko co sztuczne musi być złe powodują, że dla większych zysków producenci starają się mniej lub bardziej oszukać klientów.
Jako ciekawostkę dodam na koniec, że po znitrowaniu można z ksylitolu zrobić całkiem niezły materiał wybuchowy. To tak a'propos argumentacji "to musi być złe bo ma złe zastosowania".
-------------
Źródła:
* https://en.wikipedia.org/wiki/Xylitol
* https://www.dcnutrition.com/miscellaneous/Detail.CFM?RecordNumber=695
* http://www.danisco.com/fileadmin/user_upload/danisco/documents/products/2e_XIVIA_White_Paper.pdf
[1] http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0104-66322003000300006
[2] http://luczaj.com/publikacje/2014%20Luczaj%20Bilek%20Stawarczyk.pdf
Polecam obszerny artykuł na temat ksylitolu, nie znalazłem go gdy szukałem informacji do swojego a dużo uzupełnia:
http://pinkcake.blox.pl/2015/02/Ksylitol-bialy-oczyszczony-nienaturalny.html
czwartek, 19 maja 2016
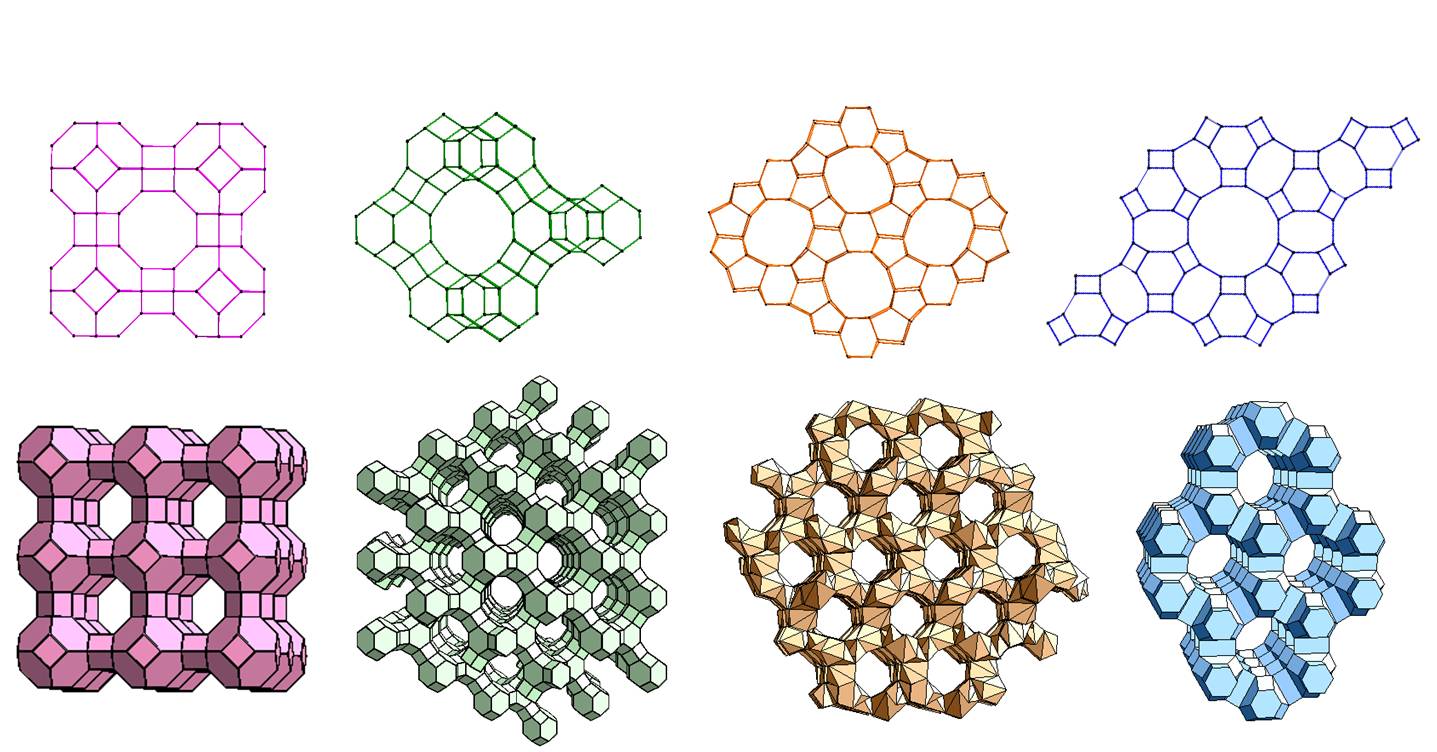
Sita molekularne
Z sitami molekularnymi student chemii zwykle spotyka się na pierwszych pracowniach laboratoryjnych, gdzie zawsze przy ogrzewaniu cieczy do wrzenia upomina się go "ale najpierw wrzuć do kolby sita molekularne" mające postać małych, twardych kuleczek. I bardzo możliwe, że aż do końca studiów będzie znał tylko takie ich zastosowanie. Niemniej co niektórych może jednak zastanowić, czym też są i czemu nazywa się je sitami, skoro wyglądają raczej jak małe granulki jakiejś masy ceramicznej?
Sita molekularne to granulki o tak dobranym składzie i metodzie produkcji, że są bardzo porowate, zaś te pory mają określoną wielkość pozwalającą wnikać wgłąb materiału cząsteczkom odpowiednio małym, zatrzymując cząsteczki za duże. Po prostu tylko cząsteczki mniejsze niż średnica poru będą w niego wchodzić i tym samym będą "odsiewane" od większych. Z tego też powodu najczęściej używa się sit do oddzielania niepożądanych, małocząsteczkowych zanieczyszczeń od cieczy i gazów.
Materiałem budującym sito molekularne są najczęściej syntetyczne minerały podobne do zeolitów posiadające w strukturze pory i kanały o dobrze zdefiniowanej wielkości. Najściślejsze mają pory o średnicy 3,4 i 5 Angstremów, czyli odpowiednio 0,3; 0,4 i 0,5 nanometra. Większe pory mają sita z porowatego szkła od 10 Å w górę. Sita o porach od 20 do 500 Angstremów mogą być stworzone z krzemionki koloidalnej, a te o jeszcze większych z krzemionki mezoporowatej. Ponadto w podobnym celu użyty może być węgiel aktywowany i niektóre porowate tworzywa sztuczne.
Generalnie więc w większości są to materiały niereaktywne, o dobrej wytrzymałości chemicznej i termicznej.
Jakie jest główne zastosowanie? Osuszanie.
Cząsteczka wody jest bardzo mała, szerokość na jaką odsunięte są atomy tlenu to 1,6 A, dlatego dość łatwo wchodzi w kanały porowatego materiału. Dodatkowo glinokrzemiany dość chętnie wiążą wodę czy to wiązaniami wodorowymi w grupach Si-H czy to przez przyciąganie do jonów. Dzięki temu po dodaniu sit do materiału normalnie słabo adsorbowanego, jak olej mineralny czy gaz ziemny, woda jest skutecznie odciągana.
Najdrobniejsze sita 3A mogą odciągać wodę od alkoholu i rozpuszczalników, których cząsteczki są zbyt duże aby wnikać w ich strukturę. Jest to jeden ze stosunkowo prostych sposobów uzyskania bezwodnego alkoholu - zwykle sprzedawany 95% alkohol zasypuje się odpowiednią ilością sit (pochłaniają wodę do 15-20% masy własnej) i zostawia w szczelnym pojemniku na kilkanaście godzin, potem odsącza lub destyluje aby oddzielić od pojawiającej się mineralnej zawiesiny.
Większe sita 4A i 5A mogą też wchłaniać alkohol etylowy, etan, eten i bywają używane do oddzielenia ich śladów z wielkocząsteczkowych rozpuszczalników. Chętnie korzysta z nich przemysł rafineryjny. Służą do usuwania z gazu ziemnego wody, kwasu mrówkowego, tlenków siarki, siarkowodoru a w odpowiednich warunkach też dwutlenku węgla. Jest to o tyle ważne, że nawet niewielkie ilości wody mogą zapychać instalacje podczas przetaczania gazu skroplonego, oraz wpływają korozyjnie na gazociągi.
Odmiany o porach 10-15 A mogą oddzielać węglowodory aromatyczne od ciekłych węglowodorów, a także służyć do rozdziału gazów. Odmiany mezoporowe, powyżej 100 A, mogą być użyte do rozdziału biomolekuł i krótkich peptydów.
Sita o odpowiednio dobranym składzie działają też jako wymieniacze jonowe, mogą pochłaniać z wody i ścieków metale ciężkie, chętnie też chłoną amoniak i jony amonowe.
Obok granulek żelu krzemionkowego sita molekularne są też jednymi z najczęściej używanych pochłaniaczy wilgoci w opakowaniach leków, żywności i elektroniki.
Jako materiał dla wytwarzania sit molekularnych najczęściej używa się zeolitów, bądź to naturalnych bądź otrzymywanych sztucznie. Sama nazwa "zeolit" znaczy dosłownie "wrzący kamień" i wywodzi się z ciekawej właściwości zbitych form. Aby z uwodnionego zeolitu usunąć wodę musimy go ogrzewać do odpowiednio dużej temperatury przez pewien czas. Jak zauważył pod koniec XIX wieku szwedzki mineralog Axel Frederik Cronstedt, proces odwrotny po polaniu wodą dobrze wysuszonego minerału przebiegał z wydzieleniem na tyle dużej ilości ciepła, że powstawała para a woda którą go polano zapieniła się.
Zeolity powstają najczęściej w skałach wulkanicznych i piroklastycznych w wyniku reakcji roztworów bogatych w krzem, glin i kationy alkaliczne z zasadami, często w warunkach hydrotermalnych. Krystalizują w pustkach skalnych i kanałach tworząc skupienia włókniste, szczotkowate lub kuliste. Mogą też powstawać jako spoiwo między ziarnami osadów zagrzebanych na dużej głębokości. Obecnie najwięcej zeolitów wydobywa się w Chinach, Korei Południowej i Japonii, w Europie najwięcej wydobywa ich Słowacja.
Jednak naturalne zeolity nie nadają się do niektórych zastosowań, głównie z powodu obecności zanieczyszczeń, stąd też zaczęto produkować je syntetycznie.
Produkcja generalnie rzecz biorąc jest dość prosta - strukturalnie są to klatkowe glinokrzemiany z domieszką kationów metali alkalicznych. Do syntezy bierze się więc żel wodny zawierający tlenek glinu i łączy ze szkłem wodnym czyli rozpuszczalnym w wodzie krzemianem sodu. Mieszaninę alkalizuje się wodorotlenkiem sodu lub potasu aby spolimeryzować powstające glinokrzemiany. Wielkość i układ porów zależy od rodzaju kationu alkalicznego, stającego się "rusztowaniem" dla pierścienia glinokrzemianowego odpowiedniej wielkości, toteż mieszanina domieszkowana jest odpowiednimi kationami, w tym także organicznymi jak tetraetyloamoniowy.
Teraz gęstniejący żel jest mieszany i ogrzewany w odpowiednich warunkach. Przy czym te "odpowiednie warunki" to w istocie klucz do sukcesu. Proces nie może przebiegać zbyt szybko bo powstaną nam po prostu zbite kryształy. Zależnie od stosunku krzemu do glinu, obecności metali alkalicznych, odczynu mieszaniny, rodzaju kationu stanowiącego wzorzec, szybkości procesowania, temperatury i innych czynników otrzymujemy zeolity o różnych strukturach. Jak na razie opisano ponad 250 struktur zeolitowych a wciąż nie jest to koniec.
Atomy podczas krystalizacji organizują się w klatkowate "bloczki" z których układana jest sieć. Połączone wielościany o strukturze sodalitu tworzą pomiędzy sobą kanały złożone z pierścieni. Rodzaj struktury determinuje wielkość pierścieni a co za tym idzie wielkość porów.
Po przeprowadzeniu procesu w "odpowiednich" warunkach otrzymujemy wilgotną masę drobnych cząstek zeolitu, która następnie jest granulowana lub wyciskana do formy pręcików i suszona.
Oprócz usuwania wody i innych małocząsteczkowych zanieczyszczeń zeolity znalazły szerokie zastosowanie w zmiękczaniu wody, mogą bowiem pochłaniać i wiązać jony wapnia i magnezu. Akwaryści powinni kojarzyć zeolity w takim zastosowaniu. Znaleźć je możemy w ekologicznych proszkach do prania, gdzie zastępują używane zwykle do zmiękczania fosforany, które trafiając do ścieków wywoływały przenawożenie wód i zakwity glonów. Granulki sit molekularnych są też używane do wzbogacania podłoża, długo bowiem trzymają wilgoć oraz mogą stopniowo uwalniać wchłonięte nawozy.
Inne zastosowanie to katalizatory zwłaszcza w krakingu ropy naftowej. Podejmowane są też próby użycia jako nośniki leków. Ze względu na wysoką energię hydratacji i możliwość zregenerowania wilgotnych sit, zaczęto używać ich także do długotrwałego przechowywania ciepła - sita są suszone przy pomocy ciepła na przykład z kolektorów słonecznych. Zamknięte w szczelnym opakowaniu nie tracą mogą być przechowywane dość długo, a pod wpływem wody ponownie wydzielają ciepło.
Jak jednak mają się te właściwości do zastosowania sit w laboratoriach podczas ogrzewania cieczy?
Stan wrzenia to sytuacja gdy ciecz pod wpływem wysokiej temperatury jest w stanie przechodzić w parę w całej objętości, wytwarzając bąble gazu. W praktyce jednak powstanie pęcherzyka ot tak wewnątrz cieczy jest mało prawdopodobne. Najpierw cząsteczki cieczy muszą zostać rozepchane na boki, gdy utworzy się faza gazowa na pęcherzyk działa zarówno ciśnienie hydrostatyczne jak i napięcie powierzchniowe. W efekcie bardzo małe pęcherzyki odczuwają ciśnienie większe od atmosferycznego, to hamuje parowanie wody do wnętrza pęcherzyka a ten może zaniknąć zanim nie stanie się na tyle duży aby wypłynąć na powierzchnię.
Sytuacja zostaje bardzo ułatwiona gdy podgrzana woda zetknie się z nierówną, chropowatą powierzchnią, wtedy ciśnienie działa na powstający przylegający pęcherzyk tylko od jednej strony, dzięki czemu łatwiej jest mu urosnąć. Analogiczna sytuacja dotyczy wydzielania się gazu z wody mineralnej - pęcherzyki powstają na ściankach i wybiegają stale z pewnych sprzyjających punktów.
Inną sytuacją która bardzo ułatwia wrzenie są bąbelki powietrza, stanowiące "zarodek" bąbelków pary. W przypadku materiałów porowatych mogą być to zarówno bąbelki przyczepione do nierównej powierzchni jak i zawarte wewnątrz materiału, stąd właśnie użycie różnych porowatych materiałów w charakterze "kamyków wrzennych". Mogą być to kawałki porcelany (na pracowni magisterskiej używałem drobnych okruchów rozbitej filiżanki), mogą to być granulki ceramiczne i mogą to być też sita molekularne, które zawsze gdzieś tam stoją na pracowni.
A dlaczego w takim razie musimy ułatwiać wrzenie?
Cóż, to utrudnienie powstawania pierwszych pęcherzyków powoduje, że gdy podgrzewana ciecz jest bardzo czysta i ogrzewamy ją w gładkim naczyniu, możliwe staje się jej przegrzanie powyżej temperatury normalnego wrzenia. Wodę można w ten sposób ogrzać do temperatury 120-130 *C, w sprzyjających warunkach i przy szybkim ogrzewaniu aż do 160 stopni.
W takiej sytuacji drobne zaburzenie, w rodzaju pierwszego pęcherzyka, zamieszania czy wibracji może spowodować dość gwałtowne zawrzenie, często połączone ze spienieniem się i wychlapaniem naszej cieczy. Pół biedy gdy ogrzewana mieszanina pójdzie chłodnicą, ale równie dobrze może prysnąć na rękę eksperymentatora. Problem ten upowszechnił się w ostatnim czasie wraz z mikrofalówkami - wiele osób używa ich do podgrzewania wody na herbatę. Jeśli użyją do tego czystej wody i wstawią wodę w gładkiej szklance, woda może nie zawrzeć mimo, że będzie bardzo gorąca. Wrzucenie do niej teraz herbaty i cukru może spowodować wytryśnięcie z kubka i poparzenia.
Bez kamyków wrzennych ciecze wrą nieregularnie, z uderzeniami gwałtowniejszych wrzeń co jakiś czas, i właśnie dlatego dla bezpieczeństwa i większej kontroli nad procesem należy wrzucać do kolby dwie-trzy granulki sit lub kawałki porcelany.
Sita molekularne to granulki o tak dobranym składzie i metodzie produkcji, że są bardzo porowate, zaś te pory mają określoną wielkość pozwalającą wnikać wgłąb materiału cząsteczkom odpowiednio małym, zatrzymując cząsteczki za duże. Po prostu tylko cząsteczki mniejsze niż średnica poru będą w niego wchodzić i tym samym będą "odsiewane" od większych. Z tego też powodu najczęściej używa się sit do oddzielania niepożądanych, małocząsteczkowych zanieczyszczeń od cieczy i gazów.
Materiałem budującym sito molekularne są najczęściej syntetyczne minerały podobne do zeolitów posiadające w strukturze pory i kanały o dobrze zdefiniowanej wielkości. Najściślejsze mają pory o średnicy 3,4 i 5 Angstremów, czyli odpowiednio 0,3; 0,4 i 0,5 nanometra. Większe pory mają sita z porowatego szkła od 10 Å w górę. Sita o porach od 20 do 500 Angstremów mogą być stworzone z krzemionki koloidalnej, a te o jeszcze większych z krzemionki mezoporowatej. Ponadto w podobnym celu użyty może być węgiel aktywowany i niektóre porowate tworzywa sztuczne.
Generalnie więc w większości są to materiały niereaktywne, o dobrej wytrzymałości chemicznej i termicznej.
Jakie jest główne zastosowanie? Osuszanie.
Cząsteczka wody jest bardzo mała, szerokość na jaką odsunięte są atomy tlenu to 1,6 A, dlatego dość łatwo wchodzi w kanały porowatego materiału. Dodatkowo glinokrzemiany dość chętnie wiążą wodę czy to wiązaniami wodorowymi w grupach Si-H czy to przez przyciąganie do jonów. Dzięki temu po dodaniu sit do materiału normalnie słabo adsorbowanego, jak olej mineralny czy gaz ziemny, woda jest skutecznie odciągana.
Najdrobniejsze sita 3A mogą odciągać wodę od alkoholu i rozpuszczalników, których cząsteczki są zbyt duże aby wnikać w ich strukturę. Jest to jeden ze stosunkowo prostych sposobów uzyskania bezwodnego alkoholu - zwykle sprzedawany 95% alkohol zasypuje się odpowiednią ilością sit (pochłaniają wodę do 15-20% masy własnej) i zostawia w szczelnym pojemniku na kilkanaście godzin, potem odsącza lub destyluje aby oddzielić od pojawiającej się mineralnej zawiesiny.
Większe sita 4A i 5A mogą też wchłaniać alkohol etylowy, etan, eten i bywają używane do oddzielenia ich śladów z wielkocząsteczkowych rozpuszczalników. Chętnie korzysta z nich przemysł rafineryjny. Służą do usuwania z gazu ziemnego wody, kwasu mrówkowego, tlenków siarki, siarkowodoru a w odpowiednich warunkach też dwutlenku węgla. Jest to o tyle ważne, że nawet niewielkie ilości wody mogą zapychać instalacje podczas przetaczania gazu skroplonego, oraz wpływają korozyjnie na gazociągi.
Odmiany o porach 10-15 A mogą oddzielać węglowodory aromatyczne od ciekłych węglowodorów, a także służyć do rozdziału gazów. Odmiany mezoporowe, powyżej 100 A, mogą być użyte do rozdziału biomolekuł i krótkich peptydów.
Sita o odpowiednio dobranym składzie działają też jako wymieniacze jonowe, mogą pochłaniać z wody i ścieków metale ciężkie, chętnie też chłoną amoniak i jony amonowe.
Obok granulek żelu krzemionkowego sita molekularne są też jednymi z najczęściej używanych pochłaniaczy wilgoci w opakowaniach leków, żywności i elektroniki.
Jako materiał dla wytwarzania sit molekularnych najczęściej używa się zeolitów, bądź to naturalnych bądź otrzymywanych sztucznie. Sama nazwa "zeolit" znaczy dosłownie "wrzący kamień" i wywodzi się z ciekawej właściwości zbitych form. Aby z uwodnionego zeolitu usunąć wodę musimy go ogrzewać do odpowiednio dużej temperatury przez pewien czas. Jak zauważył pod koniec XIX wieku szwedzki mineralog Axel Frederik Cronstedt, proces odwrotny po polaniu wodą dobrze wysuszonego minerału przebiegał z wydzieleniem na tyle dużej ilości ciepła, że powstawała para a woda którą go polano zapieniła się.
Zeolity powstają najczęściej w skałach wulkanicznych i piroklastycznych w wyniku reakcji roztworów bogatych w krzem, glin i kationy alkaliczne z zasadami, często w warunkach hydrotermalnych. Krystalizują w pustkach skalnych i kanałach tworząc skupienia włókniste, szczotkowate lub kuliste. Mogą też powstawać jako spoiwo między ziarnami osadów zagrzebanych na dużej głębokości. Obecnie najwięcej zeolitów wydobywa się w Chinach, Korei Południowej i Japonii, w Europie najwięcej wydobywa ich Słowacja.
Jednak naturalne zeolity nie nadają się do niektórych zastosowań, głównie z powodu obecności zanieczyszczeń, stąd też zaczęto produkować je syntetycznie.
Produkcja generalnie rzecz biorąc jest dość prosta - strukturalnie są to klatkowe glinokrzemiany z domieszką kationów metali alkalicznych. Do syntezy bierze się więc żel wodny zawierający tlenek glinu i łączy ze szkłem wodnym czyli rozpuszczalnym w wodzie krzemianem sodu. Mieszaninę alkalizuje się wodorotlenkiem sodu lub potasu aby spolimeryzować powstające glinokrzemiany. Wielkość i układ porów zależy od rodzaju kationu alkalicznego, stającego się "rusztowaniem" dla pierścienia glinokrzemianowego odpowiedniej wielkości, toteż mieszanina domieszkowana jest odpowiednimi kationami, w tym także organicznymi jak tetraetyloamoniowy.
Teraz gęstniejący żel jest mieszany i ogrzewany w odpowiednich warunkach. Przy czym te "odpowiednie warunki" to w istocie klucz do sukcesu. Proces nie może przebiegać zbyt szybko bo powstaną nam po prostu zbite kryształy. Zależnie od stosunku krzemu do glinu, obecności metali alkalicznych, odczynu mieszaniny, rodzaju kationu stanowiącego wzorzec, szybkości procesowania, temperatury i innych czynników otrzymujemy zeolity o różnych strukturach. Jak na razie opisano ponad 250 struktur zeolitowych a wciąż nie jest to koniec.
Atomy podczas krystalizacji organizują się w klatkowate "bloczki" z których układana jest sieć. Połączone wielościany o strukturze sodalitu tworzą pomiędzy sobą kanały złożone z pierścieni. Rodzaj struktury determinuje wielkość pierścieni a co za tym idzie wielkość porów.
Po przeprowadzeniu procesu w "odpowiednich" warunkach otrzymujemy wilgotną masę drobnych cząstek zeolitu, która następnie jest granulowana lub wyciskana do formy pręcików i suszona.
Oprócz usuwania wody i innych małocząsteczkowych zanieczyszczeń zeolity znalazły szerokie zastosowanie w zmiękczaniu wody, mogą bowiem pochłaniać i wiązać jony wapnia i magnezu. Akwaryści powinni kojarzyć zeolity w takim zastosowaniu. Znaleźć je możemy w ekologicznych proszkach do prania, gdzie zastępują używane zwykle do zmiękczania fosforany, które trafiając do ścieków wywoływały przenawożenie wód i zakwity glonów. Granulki sit molekularnych są też używane do wzbogacania podłoża, długo bowiem trzymają wilgoć oraz mogą stopniowo uwalniać wchłonięte nawozy.
Inne zastosowanie to katalizatory zwłaszcza w krakingu ropy naftowej. Podejmowane są też próby użycia jako nośniki leków. Ze względu na wysoką energię hydratacji i możliwość zregenerowania wilgotnych sit, zaczęto używać ich także do długotrwałego przechowywania ciepła - sita są suszone przy pomocy ciepła na przykład z kolektorów słonecznych. Zamknięte w szczelnym opakowaniu nie tracą mogą być przechowywane dość długo, a pod wpływem wody ponownie wydzielają ciepło.
Jak jednak mają się te właściwości do zastosowania sit w laboratoriach podczas ogrzewania cieczy?
Stan wrzenia to sytuacja gdy ciecz pod wpływem wysokiej temperatury jest w stanie przechodzić w parę w całej objętości, wytwarzając bąble gazu. W praktyce jednak powstanie pęcherzyka ot tak wewnątrz cieczy jest mało prawdopodobne. Najpierw cząsteczki cieczy muszą zostać rozepchane na boki, gdy utworzy się faza gazowa na pęcherzyk działa zarówno ciśnienie hydrostatyczne jak i napięcie powierzchniowe. W efekcie bardzo małe pęcherzyki odczuwają ciśnienie większe od atmosferycznego, to hamuje parowanie wody do wnętrza pęcherzyka a ten może zaniknąć zanim nie stanie się na tyle duży aby wypłynąć na powierzchnię.
Sytuacja zostaje bardzo ułatwiona gdy podgrzana woda zetknie się z nierówną, chropowatą powierzchnią, wtedy ciśnienie działa na powstający przylegający pęcherzyk tylko od jednej strony, dzięki czemu łatwiej jest mu urosnąć. Analogiczna sytuacja dotyczy wydzielania się gazu z wody mineralnej - pęcherzyki powstają na ściankach i wybiegają stale z pewnych sprzyjających punktów.
Inną sytuacją która bardzo ułatwia wrzenie są bąbelki powietrza, stanowiące "zarodek" bąbelków pary. W przypadku materiałów porowatych mogą być to zarówno bąbelki przyczepione do nierównej powierzchni jak i zawarte wewnątrz materiału, stąd właśnie użycie różnych porowatych materiałów w charakterze "kamyków wrzennych". Mogą być to kawałki porcelany (na pracowni magisterskiej używałem drobnych okruchów rozbitej filiżanki), mogą to być granulki ceramiczne i mogą to być też sita molekularne, które zawsze gdzieś tam stoją na pracowni.
A dlaczego w takim razie musimy ułatwiać wrzenie?
Cóż, to utrudnienie powstawania pierwszych pęcherzyków powoduje, że gdy podgrzewana ciecz jest bardzo czysta i ogrzewamy ją w gładkim naczyniu, możliwe staje się jej przegrzanie powyżej temperatury normalnego wrzenia. Wodę można w ten sposób ogrzać do temperatury 120-130 *C, w sprzyjających warunkach i przy szybkim ogrzewaniu aż do 160 stopni.
W takiej sytuacji drobne zaburzenie, w rodzaju pierwszego pęcherzyka, zamieszania czy wibracji może spowodować dość gwałtowne zawrzenie, często połączone ze spienieniem się i wychlapaniem naszej cieczy. Pół biedy gdy ogrzewana mieszanina pójdzie chłodnicą, ale równie dobrze może prysnąć na rękę eksperymentatora. Problem ten upowszechnił się w ostatnim czasie wraz z mikrofalówkami - wiele osób używa ich do podgrzewania wody na herbatę. Jeśli użyją do tego czystej wody i wstawią wodę w gładkiej szklance, woda może nie zawrzeć mimo, że będzie bardzo gorąca. Wrzucenie do niej teraz herbaty i cukru może spowodować wytryśnięcie z kubka i poparzenia.
Bez kamyków wrzennych ciecze wrą nieregularnie, z uderzeniami gwałtowniejszych wrzeń co jakiś czas, i właśnie dlatego dla bezpieczeństwa i większej kontroli nad procesem należy wrzucać do kolby dwie-trzy granulki sit lub kawałki porcelany.
Subskrybuj:
Posty (Atom)