Sharpless dostał Nobla drugi raz!
Tegoroczny laureat nagrody Nobla z chemii jest bez wątpienia godny ale jednak był trochę zaskakującym wyborem. Dostał nagrodę już drugi raz, poprzednio też za osiągnięcia chemiczne.
Wcześniej nagrodzono jego prace nad reakcjami utleniania związków organicznych. Asymetryczna epoksydacja Sharplessa to już klasyka reakcji prowadzących do produktów o kontrolowanej stereochemii. Z pewnością kiedyś ją szerzej opiszę. Nowsze dokonania są trochę mniej znaną dziedziną nazywaną "click chemistry" co jest ciężko sensownie przełożyć. Chodzi o podejście do syntezy oparte o łączenie cząsteczek, zawierających charakterystyczne grupy, które łatwo i wydajnie łączą się ze sobą z duża selektywnością. Po opracowaniu pewnej ilości par "selektywny zatrzask - selektywne wpięcie" stwierdzono, że można w ten sposób łączyć ze sobą niemal dowolne cząsteczki; jedynym warunkiem jest dodanie do nich grup łączących.
Podejście to miało naśladować procesy zachodzące podczas syntezy związków w organizmach, oraz być przydatne do badania organizmów. Odpowiednio dobierając substraty można tym sposobem wprowadzić do żyjącego organizmu sondę molekularną z odpowiednio dobranym "zastrzaskiem" który będzie się łączył z konkretnym ugrupowaniem występującym w jednym rodzaju tkanek.
Ftalany jednak wywołują mięśniaki
Badacze z amerykańskiego Northwestern Univerity znaleźli bezpośredni związek przyczynowy między obecnością flatanów w otoczeniu a ryzykiem mięśniaków macicy. Dotychczas znane były jedynie statystyczne korelacje zmian narażenia na plastyfikatory takie jak ftalany i zmiany częstości mięśniaków, ale korelacja to jeszcze nie przyczynowość i brakło dowodów, że nie jest to przypadkowe nałożenie się dwóch trendów o tym samym kierunku czasowym. Ftalany, a zwłaszcza badany w tym eksperymencie DEHP, okazują się aktywować receptor ARH, który reaguje na cząsteczki będące pochodnymi węglowodorów aromatycznych. Służy do szybkiego reagowania na wzrost stężenia ksenobiotyków. Reguluje on aktywnosć enzymów służących do metabolizmu, jak cytochrom P450.
Wpływa też na eksprecję genów jako czynnik transkrypcyjny. Aktywują go wielopierścieniowe węglowodory aromatyczne jak słynny benzo-a-piren. Może być też aktywowany przez metabolity tryptofanu w szlaku metabolicznym kinureninowym.
I tutaj właśnie działa ftalan. Aktywuje on ten szlak, zwiększając produkcję kinureniny, a ta pobudza receptor ARH. To zaś zwiększa przeżywalność komórek mięśniaka macicy, jeśli już w tkance pojawią się spontanicznie zalążki guza. A to promuje ostatecznie wyższą częstość pojawiania się wykrywalnych mięśniaków.
* https://www.pnas.org/doi/10.1073/pnas.2208886119
Rozwikłano szczegóły wpływu jodu na chmury i ozon
Jod z jodków wody morskiej w jakiś sposób dociera do wysokiej stratosfery, gdzie reaguje z ozonem warstwy ozonowej, zmniejszając jego ilość. Przez lata był to drobny, pomijalny efekt, część naturalnej samoregulacji układów chemicznych. Jednak w ostatnich dekadach ilość atmosferycznego jodu wzrosła i obecnie jest trzykrotnie wyższa niż 70 lat temu.
Dodatkowo, co wykazano stosunkowo niedawno, jod w formie kwasu jodowego może utworzyć jądra nukleacji dla kropelek wody, a więc sprzyja powstawaniu chmur. Nie było jednak pewne jak właściwie w atmosferze powstaje kwas jodowy, który jest związkiem dość nietrwałym. Zatem poznanie szczegółów jego chemii ma znaczenie, bo odgrywa on dwie ważne role w zjawiskach naturalnych.
Eksperymenty praktyczne i obliczeniowe przeprowadzono w komorze naśladującej warunki w stratosferze, w ramach prowadzonego przy CERN w Genewie projektu badawczego CLOUD testującego różne hipotezy na temat wpływu różnych czynników na powstawanie chmur i tym samym na klimat. Pierwotnie eksperyment miał testować hipotezę Henrika Svensmarka, że zmiany natężenia promieniowania kosmicznego wpływają na ilość chmur powstających dzięki promieniowaniu niczym w komorze Wilsona, co miałoby w wyraźnym stopniu wpływać na zmiany klimatyczne i dokładać się do procesów zaburzonych już przez człowieka lub je hamować.
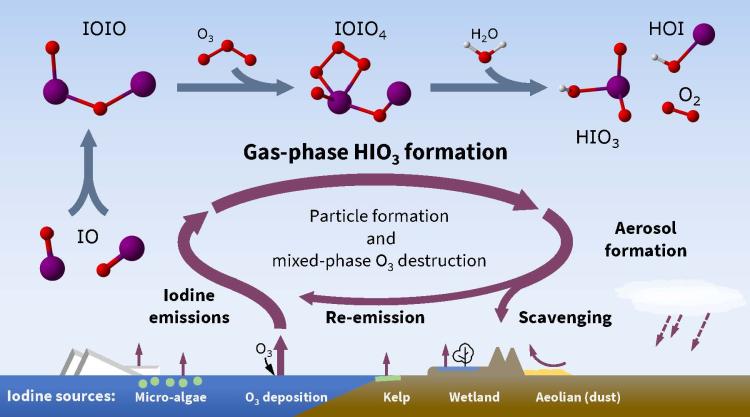
Cykl odkryty przez badaczy z University of Colorado zaczyna się od aerozolu jodków unoszącego się znad morza. Tutaj jodek zostaje utleniony w reakcji z przyziemnym ozonem. Na ilość tego ozonu wpływa w ostatnich dekadach smog fotochemiczny, powstający w reakcji utleniania składników spalin - i to jest ten ludzki czynnik wpływu. Powstający pierwiastkowy jod łatwo rozdziela się na rodniki i reaguje z tlenem tworząc najpierw gazowy tlenek IO, potem jego dimer IOIO i w takiej postaci
jako gaz rozchodzi się po atmosferze. W dalszej kolejności reaguje znów z ozonem tworząc ozonek IOI(O)4. Ten jest bardzo nietrwały i reaguje z wodą tworząc kwas jodowy HIO3, kwas podjodowy HIO i tlen singletowy. Kwas jodowy generuje aerozol atmosferyczny i spada później jako śladowa domieszka w deszczu.
Potencjalnie ten efekt może wpłynąć ochładzająco na klimat z powodu promowania powstawania chmur i może się to okazać dotychczas nie uwzględniany w modelowaniach klimatu czynnik. Reagując z ozonem troposferycznym jod powinien zmniejszać jego stężenie, łagodząc szkodliwy wpływ smogu, ale z drugiej strony część uwolnionego gazowego jodu wędruje do stratosfery i niszczy warstwę ozonową, więc ostateczny efekt jest niejednoznaczny.