Dwutlenek węgla jest bezbarwnym i w zasadzie bezwonnym gazem cięższym od powietrza, stanowiącym stale niewielki procent składu atmosfery. Został odkryty dosyć wcześnie - już w XVII wieku van Helmont zauważył, że jeśli masa popiołu po spaleniu węgla jest znacząco mniejsza od pierwotnej masy, to reszta musi ulegać zamianie w formę gazową. Ówcześni identyfikowali go z flogistonem - pierwiastkiem palności - i dalej się tą sprawą nie zajmowano. Dopiero w 1750 roku szkocki lekarz Joseph Black, znany też z badań nad ciepłem utajonym, poddał badaniom gaz powstający z potraktowania wapienia kwasem, stwierdzając, że jest różny od powietrza, ciężki i duszący, oraz że wytrąca osad z roztworu wapna gaszonego. Korzystając z tej ostatniej reakcji, stwierdził że występuje normalnie w powietrzu i w większych ilościach w tchnieniu zwierząt i ludzi. Późniejsi badacze doszli do tego, że gaz jest połączeniem tlenu i węgla i że reakcję czasem można odwrócić (przy spalaniu magnezu w dwutlenku węgla powstaje sadza), jednak dla nas istotniejsze jest odkrycie Josepha Priestly'a, trochę teologa a trochę przyrodnika-hobbysty, który badając przebieg fermentacji w miejscowym browarze, zainteresował się "zastałym powietrzem" - warstwą gazową nad fermentującą kadzią, uważaną za pracowników za niezdrową i od której zdychały myszy jeśli dostały się pod jej wpływ.
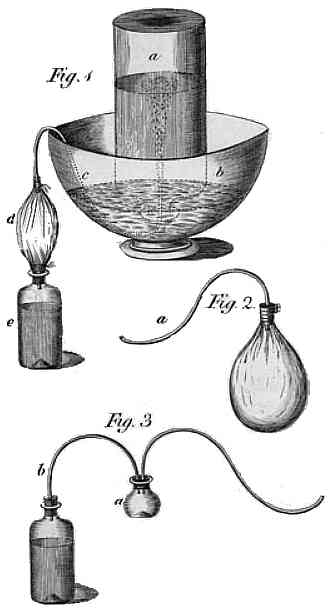
Wytwarzanie wody sodowej - rysunek Priestley'a z 1772 roku
Eksperymentując, umieścił nad kadzią miskę z wodą, chcąc sprawdzić rozpuszczalność tego gazu. Po zlaniu musującego roztworu stwierdził, że woda nabrała przyjemnego, lekko kwaśnego posmaku, a nawet dał go spróbować znajomym, twierdząc że to orzeźwiający napój bez alkoholu. Kilka lat później opisał go w artykule, dodając przepis na sztuczne otrzymanie - po zwilżeniu kredy kwasem siarkowym, powstający gaz przeprowadzał rurką do wody i po przepuszczeniu większej ilości otrzymywał napój, który uważał za bardzo podobny do naturalnych wód mineralnych i polecał na szkorbut. W zasadzie jednak nie traktował odkrycia inaczej jak ciekawostki i nie sądził, że znajdzie zastosowanie. Tymczasem producenci wód mineralnych powinni mu postawić pomnik - odkrycie, że zwykła woda staje się smacznym napojem po rozpuszczeniu w niej pospolitego gazu, do dziś przynosi im ogromne zyski.
Pierwszym, który wpadł na to, że jest to znakomity pomysł na interes, był niejako Jacob Schweppe, który w roku 1783 założył firmę Schweppes, istniejącą zresztą do dziś, produkując wody gazowane mające naśladować wody mineralne z naturalnych źródeł. Nieco później dla polepszenia smaku, do nagazowanej wody zaczęto dodawać nieco sody oczyszczonej, tworząc napój nazywany odtąd wodą sodową. I tak zaczął się przemysł napojów gazowanych.
Szybko jednak chemicy zaczęli się zastanawiać, dlaczego po rozpuszczeniu gazu, woda staje się kwaśna. Musi powstawać jakiś kwas - uznali - i nazwali go kwasem węglowym. W polskiej nomenklaturze dwutlenek węgla zaczął być z tego powodu nazywany niedokwasem węglowym. Taki też stan rzeczy trwał przez długi czas, aż zaczęły się problemy z wyizolowaniem czy choćby wykryciem tego kwasu w wodzie. Badania absorpcji w podczerwieni nie wykryły aby występował w choćby najbardziej nasyconych roztworach. W zamian za to wykrywano jony węglanowe i wodorowęglanowe, stąd też powstała koncepcja wedle której kwas węglowy nie istnieje. Jeszcze ja w technikum byłem upominany aby nie zapisywać jego cząsteczki w równaniu rozpuszczania dwutlenku węgla.
Jest to w pewnym stopniu podobna sytuacja jak z "wodorotlenkiem amonu". Rozpuszczenie amoniaku w wodzie da nam roztwór o zasadowym odczynie, toteż postulowano powstawanie w wodzie wodorotlenku amonu i przez długi czas zapisywano go w ten sposób. Dopiero potem dokładne badania wykazały, że cząsteczka taka nie powstaje - woda wymienia się protonem z amoniakiem, i tworzy się osobny jon wodorotlenkowy i osobny amonowy pozostające w równowadze. Wydawało się zatem, że tu jest podobnie - dwutlenek łączy się z wodą biorąc tlen i wodór do utworzenia jonu wodorowęglanowego, a pozostawiając wolny kation wodorowy; wodorowęglan dysocjuje dalej do anionu węglanowego, zaś kwas węglowy się nie tworzy. I wszystko było w porządku aż nie odkryto, że pogłoski o jego śmierci są mocno przesadzone.
Aby otrzymać czysty i stabilny kwas węglowy, należało zastosować dość specyficzne warunki - mieszaninę wody i dwutlenku węgla zamrożono i umieszczono pod niskim ciśnieniem, po czym napromieniowano - promieniowanie pozwoliło na połączenie dwóch różnych cząsteczek bez ogrzewania. Następnie zastosowano sublimację wody pod niskim ciśnieniem, otrzymując czysty, suchy związek.
Jak się okazało, bezwodny kwas węglowy jest dosyć trwały - obliczenia teoretyczne pokazały że czas połowicznego rozkładu to ponad sto tysięcy lat, ale śladowe ilości wody przyśpieszają ten rozkład gwałtownie, nawet milion razy[1].
Udało się także otrzymać gazowy kwas węglowy, trwały do temperatury -30 stopni, który w takiej fazie chętnie tworzy trwalszy dimer[2]
Skoro kwas ten istnieje, to jak jest z jego obecnością w wodzie mineralnej?
Gdy tylko zaczynamy nasycać wodę dwutlenkiem węgla, zaczyna on być hydratowany. W takiej formie każda cząsteczka tlenku zostaje otoczona cząsteczkami wody, lecz nie następuje pomiędzy nimi reakcja. Ilość rozpuszczającego się w ten sposób gazu zależy od ciśnienia - im wyższe, tym lepsza rozpuszczalność. W takiej formie występuje około 99% rozpuszczonego w wodzie związku.
Część jednak reaguje z wodą dając jako produkt przejściowy kwas węglowy:
CO2 + H2O → H2CO3
Jak wykazały badania, związek ten bardzo szybko i łatwo odszczepia jeden proton, przechodząc w jon wodorowęglanowy. Stała równowagi pokazuje, że kwas ten jest nawet mocniejszy od cytrynowego. Silne przesunięcie równowagi w stronę wodorowęglanów powoduje jednak, że niemal natychmiast prawie cały powstający kwas węglowy zamienia się w tą formę:
H2CO3  HCO3− + H+
HCO3− + H+
Jon wodorowęglanowy może ulegać dalszej dysocjacji, rozpadając się na jon węglanowy:
HCO3−  CO32− + H+
CO32− + H+
Jednak reakcja ta następuje powoli, i zaczyna nabierać znaczenia w warunkach silnie zasadowych.Wszystkie te procesy są procesami równowagowymi, toteż zachodzą równocześnie w obie strony, choć z różną szybkością, a obserwowany stan jest wypadkową różnie szybkich równoczesnych reakcji. Można to porównać do szeregu naczyń do których woda może wpływać i wypływać, aż zależnie od szybkości wypływu i dopływu stabilizuje się na pewnym poziomie.
Gdy zaczniemy wprowadzać dwutlenek węgla do wody, będzie to czynił niechętnie, jednak gdy się rozpuści większość będzie występować w formie zhydratowanej. Z tej ilości pewna część będzie zamieniać się w kwas węglowy. Ten ma dwie możliwe drogi rozpadu - albo zamieni się z powrotem w dwutlenek węgla, co czyni chętnie, albo w wodorowęglan, co czyni równie szybko. To że w ogóle występuje w roztworze jest wynikiem tego, że wszystkie procesy są pewnymi równowagami odwracalnych reakcji - większe ciśnienie gazu naprodukuje więcej kwasu węglowego który natychmiast rozpada się w wodorowęglan; obniżenie ciśnienia powoduje rozpad obecnego kwasu węglowego ale jest on odtwarzany z wodorowęglanów.
Pod ciśnieniem atmosferycznym w wodzie pozostającej w kontakcie z dwutlenkiem węgla, może się rozpuścić ok. 0,1 mmol, z czego 1% przechodzi w wodorowęglan a 0,01% w kwas węglowy. Jonów węglanowych powstają niewykrywalne ilości. Roztwór taki ma pH=5,6 zatem jest lekko kwaskowaty. Pod ciśnieniem ok. 1-2 atmosfer, jakie to ciśnienia są stosowane w butelkowanej wodzie mineralnej, rozpuszcza się 8,5 mmol gazu, z czego 1% ma postać wodorowęglanu i niemal tyle samo formę kwasu węglowego. Roztwór taki ma pH =3,5 a więc podobne do soku pomarańczowego.
Co więc z tego wynika ostatecznie? Większość rozpuszczonego dwutlenku węgla występuje w wodzie w formie zhydratowanej obojętnej cząsteczki, a z pozostałej części większość w formie wodorowęglanów. A kwas? Występuje ale jako dynamiczna faza przejściowa - nieustannie tworzy się i rozpada istniejąc w ilościach tak niewielkich, że nieistotnych dla określenia kwasowości i trudnych do wykrycia. Ale jest.
------
* http://en.wikipedia.org/wiki/Carbonic_acid
* http://de.wikipedia.org/wiki/Kohlens%C3%A4ure
* http://en.wikipedia.org/wiki/Carbonated_water
* http://en.wikipedia.org/wiki/Joseph_Priestley
[1] Thomas Loerting, Christofer Tautermann, Romano T. Kroemer, Ingrid Kohl , Andreas Hallbrucker , Erwin Mayer. and Klaus R. Liedl, On the Surprising Kinetic Stability of Carbonic Acid (H2CO3), Angewandte Chemie International Edition Volume 39, Issue 5, pages 891–894, March 3, 2000
[2] Hinrich Grothe et al., Spectroscopic Observation of Matrix-Isolated Carbonic Acid Trapped from the Gas Phase, Angewandte Chemie International Edition Volume 50, Issue 8, pages 1939–1943, February 18, 2011


O! Czyli jednak udało się go otrzymać w stanie wolnym!
OdpowiedzUsuńCzytam, czytam i miałam nadzieję, że napiszesz też coś o wpływie napojów gazowanych na zdrowie :).
OdpowiedzUsuńA może dopiszę. Z tego co znalazłem, zasadniczo wody gazowane poza wzdęciami i wpływem na wrzody nie są specjalnie szkodliwe. Mogą osłabiać szkliwo ale w takim samym stopniu co kwaśne soki owocowe.
UsuńA ja czytałam kiedyś wyniki badań klinicznych wg których spożycie napojów gazowanych zwiększa ryzyko nowotworu przełyku. Nie wiem dokładnie jak się taki napój zachowuje w przełyku, ale chyba drażni błonę śluzową, więc tak na szybko myśląc, logicznie, wydaje się być prawdopodobne, że może mieć taki wpływ na zdrowie.
Usuń