Rozdzielanie światłem
Rozdział lantanowców nie jest procesem łatwym. Pierwiastki te mają bardzo podobne właściwości fizyczne i chemiczne, zbliżoną rozpuszczalność soli i powinowactwo, a na dodatek występują w mieszaninie w jednym minerale - monacycie. Zwykle rozdziela się je bądź przez wieloetapową ekstrakcję w rozpuszczalnikach organicznych, lub przez stosowanie żywic jonowymiennych. Niedawna praca pokazuje jednak jeszcze jeden ciekawy, prosty i wymagający zdecydowanie mniejszej ilości energii proces.
Badacze skupili się na rozdziale europu od itru, dwóch rzadkich pierwiastków stosowanych w elektronice, w tym w telewizorach i w świetlówkach. Itr stanowi składnik czerwonego luminoforu czyli substancji emitującej światło po naświetleniu wiązką elektronów, często domieszkowany jest europem dla zwiększenia czułości. Ich odzysk ze zużytego sprzętu jest kłopotliwy, właśnie z powodu trudnego rozdziału. Dotychczas chętnie wykorzystywano skłonność europu do redukowania się do wartościowości II, w której tworzy nierozpuszczalny siarczan, co jednak wymagało bardzo kwaśnych warunków i użycia toksycznych reduktorów.
Technika opracowana przez belgijskich badaczy jest dość prosta i nie wymaga użycia specjalnych chemikaliów. Pierwiastki mogą mieć podobne właściwości chemiczne, ale powinny mieć różne właściwości kwantowe. Elektrony na powłokach tych pierwiastków przyjmują różne stany energetyczne, co objawia się różnym widmem absorpcyjnym, pozwalającym na rozróżnienie. Te różnice powodują też, różne zachowanie się w stanie wzbudzonym.W tym konkretnym przypadku różnica dotyczyła zachowania się akwakompleksów, czyli związków kompleksowych jonów metali z cząsteczkami wody
Badacze wykonali wodny roztwór mieszaniny azotanów itru III i europu III, po czym naświetlili ultrafioletem o tak dobranym zakresie, że był on pochłaniany przez akwakompleks jonów europu. Energia pochłonięta była na tyle duża, że jedna z przyłączonych cząsteczek wody rozpadała się z wydzieleniem rodnika hydroksylowego, zaś europ III ulegał redukcji do europu II.
[Eu(H2O)n]3+ + hν → [Eu(H2O)n-1]2+ + H+ + OH*
Po naświetleniu, do mieszaniny wprowadzono aniony siarczanowe. Siarczan europu II jest trudno rozpuszczalny, natomiast siarczan itru III rozpuszczał się. Po odwirowaniu i oddzieleniu osadu, otrzymano sól europu oddzieloną od drugiego pierwiastka, o czystości do 98,5%. [1][2] Kwantowe kropki z kapusty
Nietypowa substancja z nietypowego źródła.
Kwantowe kropki to jedno z najciekawszych osiągnięć nanotechnologii, które w dodatku znajduje coraz powszechniejsze zastosowanie. Stanowią szczególny przypadek stosunkowo dużego, wieloatomowego obiektu, do którego mają zastosowania prawa fizyki kwantowej.
Fizyka kwantowa traktuje cząstki elementarne, jak obiekty o dwojakiej naturze - zarazem są punktowymi, twardymi cząstkami jak i wykazują własności rozmytej fali. Im mniejszy i mniej masywny jest obiekt, tym wyraźniejsza jest ta falowość. Dla elektronów ta druga strona jego natury jest już tak wyraźna, że wygodniej jest opisywać ich zachowanie funkcjami fali, zupełnie jakby szło o opis światła czy dźwięku.
Jednym z modeli teoretycznych falo-cząstki, dość podstawowym, jest model "cząstki w pudle potencjału" czyli ograniczonej pewnymi przedziałami czy to energetycznymi czy to przestrzennymi. To ograniczenie dla ruchu elektronu, jeśli tylko ma rozmiary porównywalne z wielkością jego "fali", wpływa na to jaką może on przybierać energię. Podobnie jak dla dźwięków w rezonatorach instrumentów, pewne częstotliwości są wzmacniane, dlatego fala elektronu w takim "pudle" przebiera pewne określone stany o różnej energii.
Kropka kwantowa to po prostu bryłka materii o rozmiarach tak małych, że niewiele większych od wielkości fali elektronowej, która ponieważ elektrony nie mogą z niej wyjść, staje się dla nich trójwymiarowym pudłem potencjału. Elektrony atomów w tym materiale mogą przyjmować pewne określone stany energetyczne, całość zatem zachowuje się podobnie jak mocno powiększony atom. Mają własne widmo absorpcyjne, po naświetleniu mogą wykazywać fluorescencję, i to w bardzo dużym zakresie barw:
| Kwantowe kropki z mieszanego siarczku kadmu i cynku z domieszką selenu. @ Signa Aldrich |
Gdy tylko nauczono się robić takie cząstki w większych ilościach, technolodzy zaczęli się prześcigać w wyszukiwaniu nowych ciekawych zastosowań. Już mówi się, że lampy oparte na kropkach mogą wyprzeć w przyszłości diody LED. Ponieważ mogą przenikać do żywych organizmów, wydają się ciekawym narzędziem służącym na przykład do lokalizowania ognisk chorobowych.
Większość takich kropek tworzona jest z materiałów półprzewodnikowych, soli nieorganicznych lub metali. Dlatego też ciekawa jest praca opisująca, że możliwe jest wytwarzanie ich w dużych ilościach, za surowiec wykorzystując zieloną kapustę.
Kapusta została rozdrobniona w czystej wodzie i dokładnie zmiksowana blenderem. Otrzymana zawiesina była przetwarzana w reaktorze hydrotermalnym w temperaturze 140 stopni. Otrzymana brązowa zawiesina została poddana odwirowaniu, dzięki czemu usunięto przeszkadzające duże cząstki. To co pozostało można było oddzielić w ultrawirówce na frakcje, które fluoryzowały na różne kolory.
Właściwe kropki kwantowe to nanometrowe fragmenty komórek, ziaren skrobi czy agregatów białkowych, które podczas przetwarzania uległy częściowemu zwęgleniu, z powstaniem cząstek o charakterze węgla grafitowego.
Wydajność produkcji oceniono na 7%.[3]
Antybakteryjny kasztan
To całkiem świeże odkrycie dobrze pokazuje, że tradycyjna medycyna ludowa może mieć pewien rzeczywisty sens, o ile zostanie wsparta nowoczesną technologią.
Casanra Quave jest etnobotanikiem, a więc poszukuje związków między tradycyjną kulturą a właściwościami roślin. Stara się na podstawie przekazów ludowych zweryfikować doniesienia o leczniczych właściwościach roślin. W trakcie zbierania informacji często natykała się na doniesienia o używaniu naparu w liści kasztana jadalnego w zapaleniach skóry. Ponieważ zaś często zapalenia skóry są wywoływane zakażeniami gronkowcem, rozsądne wydawało się przetestowanie wyciągu na zakażonej skórze. Jak się okazało, choć wyciąg nie zabijał bakterii, powodował znaczące zmniejszenie uszkodzenia tkanek i podrażnień. Substancje zawarte w liściach kasztana powodowały wyłączenie systemu quorum sensing (brak jeszcze polskiego odpowiednika, ale rozsądnym byłoby "wyczuwanie zagęszczenia"), który zazwyczaj w przypadku ognisk zapalnych powoduje, że zagęszczone bakterie zaczynają wytwarzać toksyny, będące głównym czynnikiem szkodliwym. W efekcie bakterie przestały wywoływać uszkodzenia tkanek.
Efekt ten zaobserwowano nawet w przypadku najbardziej zjadliwych szczepów, także tych lekoodpornych gronkowców MRSA. Oznacza to, że choć wyciąg nie niszczy bakterie, może spowodować że zakażenie nie będzie aż tak szkodliwe, bakterie bowiem nie będą wytwarzać toksyn.
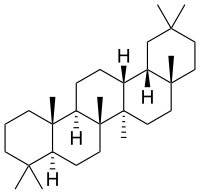 |
| Oleanen |
Tego dokładnie nie wiadomo. Technikami chromatograficznymi uzyskano z liści aktywną frakcję zawierającą około 90 związków o charakterze saponin steroidowych, spośród których najbardziej aktywne wydawały się pochodne 12-ursenu i oleanenu. Trwają badania czy za efekt odpowiada konkretny związek, czy może cała grupa.[4]
Najcieplejszy nadprzewodnik
Najnowsze odkrycie niemieckich naukowców jest dość zaskakujące. Otóż odkryli oni, że dość pospolity gaz siarkowodór, o zapachu zgniłych jaj, po zamrożeniu może stać się nadprzewodnikiem w wyjątkowo wysokiej jak na takie ciała temperaturze -70 *C (203,5 K). Dotychczasowy rekord dotyczył pewnych tlenowych związków miedzi, które stawały się nadprzewodnikami w temperaturze -135 *C, a zatem do ich chłodzenia potrzebne było skroplone powietrze. Do schładzania nowo odkrytego nadprzewodnika wystarczałby już tylko suchy lód, tańszy i łatwiej dostępny.
Jednak w odkryciu tkwi pewien haczyk - siarkowodór nabiera tak obiecujących właściwości dopiero pod dużym ciśnieniem około 200 GPa, w związku z czym raczej w najbliższym czasie nie znajdzie zastosowania.
Badanie wykazały że przy dużych ciśnieniach powyżej 90 GPa cząsteczki H2S łączą się zamieniając się w cząsteczki H3S, a zestalony gaz staje się przewodnikiem metalicznym. Odpowiednie obniżenie temperatury zamienia go w nadprzewodnik. [5]
-------
Źródła:
[1] Bart Van den Bogaert, Daphné Havaux, Koen Binnemans and Tom Van GervenPhotochemical recycling of europium from Eu/Y mixtures in red lamp phosphor waste stream, Green Chem., 2015,17, 2180-2187 DOI: 10.1039/C4GC02140A
[2] http://www.scriptiebank.be/sites/default/files/webform/scriptie/Masterthesis%20DH.pdf
[3] , Synthesis of Carbon Quantum Dot from Cabbage with Down- and Up-Conversion, Green Chem., 2015,17, 3791-3797
[4] Cassandra L. Quave, James T. Lyles, Jeffery S. Kavanaugh, Kate Nelson, Corey P. Parlet, Heidi A. Crosby, Kristopher P. Heilmann, Alexander R. Horswill. Castanea sativa (European Chestnut) Leaf Extracts Rich in Ursene and Oleanene Derivatives Block Staphylococcus aureus Virulence and Pathogenesis without Detectable Resistance. PLOS ONE, 2015; 10 (8) e0136486
[5] http://www.nature.com/nature/journal/vaop/ncurrent/full/nature14964.html A. P. Drozdov, M. I. Eremets, I. A. Troyan, V. Ksenofontov & S. I. Shylin, Conventional superconductivity at 203 kelvin at high pressures in the sulfur hydride system, Nature (2015) doi:10.1038/nature14964

Co do kapuścianych kropek kwantowych - nie jest to takie znowu nietypowe ich źródło. W związku z ostatnim boomem na nie, tak zwane węglowe nanokropki (Carbon NanoDots, CNDs) robi się praktycznie ze wszystkiego, zwłaszcza Chińczycy zwęglają co się da, by produkować coraz to nowe artykuły... eemmm, to znaczy materiały o nowych właściwościach ;) Jako surowiec służył już kwas cytrynowy, glukoza, odpadki biomasy i n innych rzeczy. Oprócz ultrawirowania do rozdziału daje się, o dziwo, zastosować też elektroforeza.
OdpowiedzUsuńCo do wydajności produktu, ważna też jest jego jakość, tzn. intensywność fluorescencji. Co z tego, że otrzymamy dużo produktu, który słabo świeci? ;) Najciekawsze moim zdaniem są raczej te badania, które wskazują na sposoby zwiększania wydajności emisji światła, jak domieszkowanie, stosowanie koloidów ochronnych, itp.
Mógłbyś napisać czy to prawda, że zieloną herbatę by zachowała prozdrowotne działanie, trzeba zalewać wodą około 85-92 stopni Celsjusza? I jeżeli to prawda/nieprawda to dlaczego?
OdpowiedzUsuńMogę poszukać, aczkolwiek wydaje mi się, że zalewanie herbaty wodą niezupełnie gorącą ma na celu raczej zachowanie aromatu i zmniejszenie stopnia wymywania najbardziej gorzkich garbników wielkocząsteczkowych.
UsuńSwego czasu napisałem o wpływie dodawania cytryny na właściwości herbaty.
O tym z cytryną, glinem i w ogóle to wiem, zastanawia mnie tylko czy to odczekiwanie ma wpływ na funkcjonalność, toksykologię, farmakokinetykę itd. bo mi akurat gorzki smak nie przeszkadza i jeżeli niepotrzebnie czekam te 15-20 minut przed zaparzeniem, to jak najszybciej chciałbym się dowiedzieć i zaprzestać :-P.
UsuńChyba znalazłem nieco materiałów na ten temat.
UsuńZatem czekam na wpis :-)).
UsuńTo jak już jesteśmy przy kuchni, to chciałam zapytać czy przy kawie też rzeczywiście musimy odczekać te kilka minut? I jak wytłumaczyć w naukowy sposób to, że nie powinniśmy trzymać warzyw w torebkach foliowych? Czy może nie ma to znaczenia?
Usuń