Nowe obserwacje pozwalają domknąć cykl obiegu zredukowanego azotu i wyjaśnić źródła soli amonowych na obszarach ubogich w materię.
Od dawna wiadomo, że związki azotu w morzach, niezbędne do syntezy białek, występują głównie w formach utlenionych - azotany i azotyny, i zredukowanych, jako amoniak i jony amonowe. Dość ważną formą pośrednią jest mocznik, syntezowany z amoniaku i dwutlenku węgla. Może powstawać w oceanie lub być spłukiwany z lądów, a wzrost jego stężenia koreluje z późniejszymi zakwitami glonów. [1] Jednym z głównych źródeł mocznika w morzach jest metabolizm bakterii, które przetwarzają na niego inne źródła azotu [2]
Jednak gdy badano przepływ azotu różnymi drogami, zawsze pojawiał się pewien mały procent niewyjaśnionego przepływu. W oceanach o małej produkcji biologicznej i oddalonych od lądu, jak ocean arktyczny, problem był dość wyraźny, bo tam mocznik stanowi nawet 50% rozpuszczonej formy azotu.[3] Wyglądało na to, że mocznik jest produkowany na przykład w osadach dennych po czym nieznane procesy wynoszą go na powierzchnię z takiej ilości jak obserwowana bez zużywania. Rozważano też transport w aerozolu kropelek wody unoszonych wiatrem, ale mierzymy średnie stężenie takich kropelek oraz znamy ogólny czas przebywania kropelki w powietrzu i cykl się nie domykał do końca, zostawało trochę azotu poza tymi strumieniami.
Badacze stosujący mobilny przyrząd FAAM Airborne Laboratory umieszczony w samolocie, gromadzili dane na temat składu aerozolu i ogólnie związków organicznych w powietrzu nad północnym Atlantykiem. I trochę nieoczekiwanie wykryli tam mocznik. Ale nie w kropelkach, lecz gazowy. Pary mocznika mogą być unoszone z wiatrem na większe odległości, zapewniając transport dodatkowych porcji nawet bez silnego wiatru. Teraz będzie trzeba to uwzględnić w modelach transportu a może i w modelach zmian klimatu. [4]
Czasopisma zmieniają wymagania co do analizy elementarnej
Ważna wiadomość dla wielu chemików. Wymagania dotyczące stopnia dokładności analizy elementarnej w publikacji naukowej, mogą zostać poluzowane.
Analiza elementarna to stara i ważna w historii chemii metoda badania składu pierwiastkowego związków organicznych. Związek jest odpowiednimi technikami spalany całkowicie a ze spalin wyłapywane są produkty utlenienia - dwutlenek węgla, para wodna, tlenki azotu i siarki itd. Jeśli pozostanie popiół, to on także jest badany. Końcowym wynikiem obliczeń ilości moli produktów jest wtedy wzór sumaryczny mówiący jaki jest stosunek wagowy pierwiastków w tym związku. Powinien się on zgadzać ze stosunkiem wyliczonym ze wzoru. Brak tej zgodności może oznaczać, że związek nie był dostatecznie czysty lub że to inny związek.
Nic więc dziwnego, że metoda zaczęła być wykorzystywana do rozstrzygania, czy chemik otrzymał to co zamierzał, i w czasach zanim zaczęto badać strukturę cząsteczek spektroskopowo, była w zasadzie podstawową metodą potwierdzenia tożsamości. Skoro tak, to czasopisma naukowe zaczęły wymagać dostarczenia wyników z takiej analizy przy zgłoszeniu o otrzymaniu nowego związku. Jeśli chemik otrzymał tą cząsteczkę jaką postuluje, to skład powinien się zgadzać z teoretycznym.
Ale w 2022 roku pojawiła się publikacja, w której autorzy podważają niektóre przyjęte w czasopismach standardy. Zwłaszcza dość częsty wymóg, aby odchylenie składu wyliczonego z analizy od teoretycznego nie było większe niż 0,4%. Co oznacza, że do analizy należy dawać próbkę o czystości 99,6% a w praktyce dużo większej ze względu na naturalne błędy dokładności metody analizy. Jedna wartość błędu dla wszystkich związków oznaczałaby też założenie, że wszystkie metody określenia produktów powinny być podobnego rzędu precyzyjne. A tak nie jest - dla części pierwiastków metody badania ich zawartości w spalinach są mniej dokładne ze względu na właściwości tego pierwiastka. Z drugiej strony dla niektórych pierwiastków błąd plus minus 0,4% jest całkiem spory.
I tutaj badacze zadali dość oczywiste pytanie - no a czemu błąd ma wynosić do 0,4%? Niby podstawowa sprawa, ale wypytanie redaktorów czasopism i przegląd literatury pokazał, że taką granicę błędu kiedyś przyjęto i tak zostało bez uzasadnienia. Chm... No to może po prostu to granica dokładności, którą wszyscy spełniają i dlatego jest tak wyśrubowana? Postanowiono to sprawdzić.
Podczas testu sprawdzającego jak z próbką tego samego związku zawierającego tylko proste pierwiastki C H N O o czystości 99,9% poradzą sobie różne laboratoria stwierdzono, że 10% wyników ma większe odchylenie niż przyjęty standard. Czyli to nie jest granica, którą łatwo przekroczyć i w rzeczywistości badacz mający ultraczysty związek może przypadkiem otrzymać wynik analityczny nie spełniający wymagań. Trochę słabo. A jeśli robił syntezę w małej skali i miał tego swojego związku miligramy, które w większości zużył podczas różnych analiz, to może się okazać, że musi powtarzać reakcję drugi raz, aby tym razem wynik był dobry. Wnioskiem badaczy było to, że przyjęte standardy nie mają uzasadnienia i powinny być zmienione na standard zależny od statystyk dokładności oznaczania dla różnych pierwiastków. [5]
Po roku od ukazania się tej publikacji niektóre czasopisma zaczęły zmieniać wymagania. Część magazynów z grupy wydawniczej Willey zaczęła wymagać po prostu "zadowalającej dokładności" a to czy ta akurat wystarczy ocenią zapewne recenzenci. Royal Society of Chemistry pracuje nad zmianą zaleceń idącą w podobnym kierunku. [6]
Starożytne rzymskie perfumy
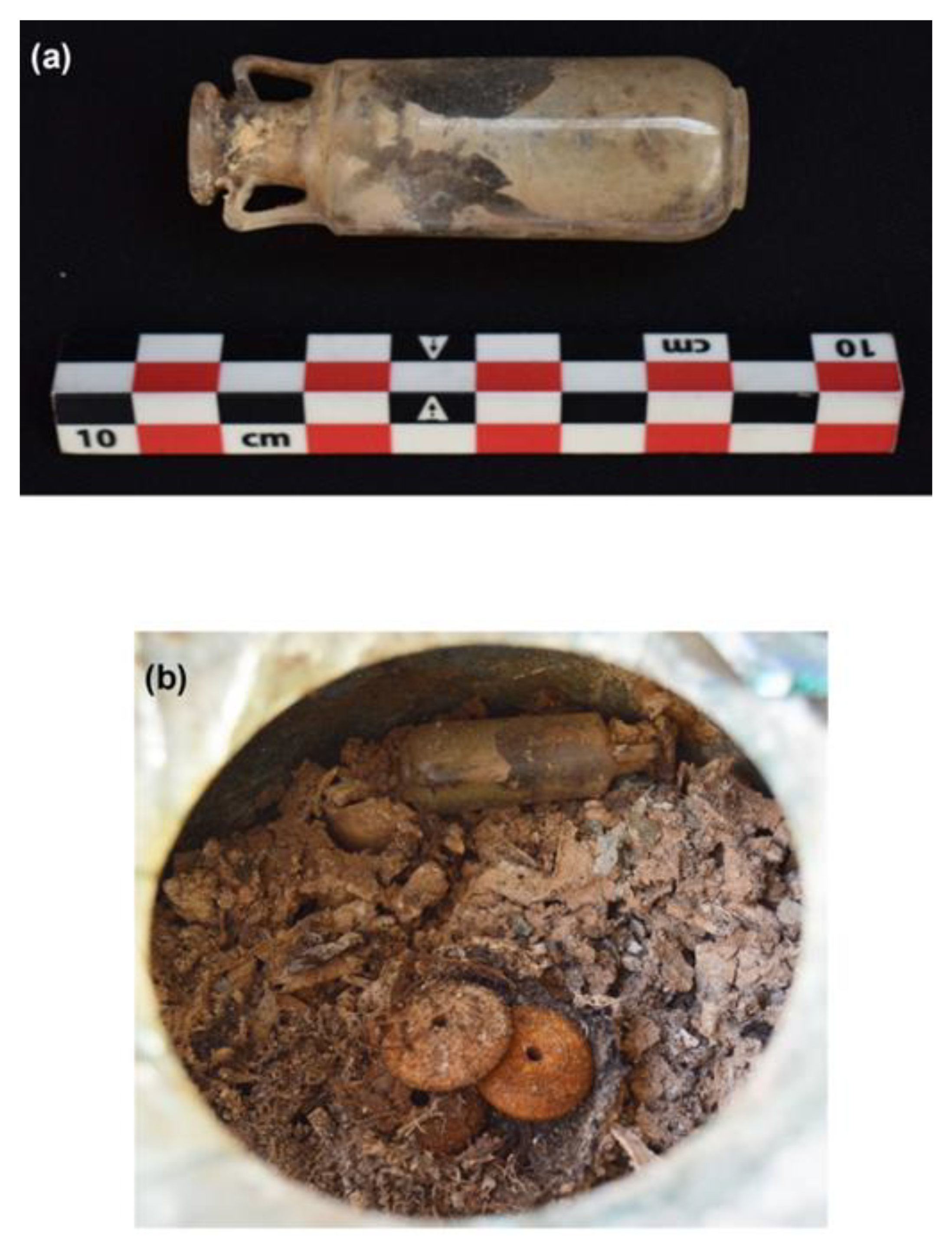
W roku 2019 podczas badań archeologicznych, w Carmonie pod Sewillą w Hiszpanii, znaleziono dobrze zachowane mauzoleum, z popiołami sześciu osób. Główna komora była niezwykle dobrze zachowana. W niszach stały jeszcze nie uszkodzone urny z popiołami i innymi darami grobowymi, których nie naruszyli rabusie. W jednej z nisz znajdowała się ołowiana skrzynka a w niej kwarcowe naczynie, zawierające spopielone szczątki oraz resztki płóciennego woreczka zawierającego bursztynowe paciorki i małą buteleczkę z dmuchanego szkła. Z jakąś zawartością. Na podstawie nielicznych podobnych buteleczek znanych z innych miejsc podejrzewano, że zawiera pachnidło na bazie oleju z pochłoniętym aromatem. Tego typu aromatyczne oliwki lub maści były znane w tym czasie, gdy jeszcze nie była znana destylacja olejków eterycznych; przykładowy opis pachnidła podawał Piliniusz.
Buteleczka wyglądała na porządnie zamkniętą dopasowanym koreczkiem, dzięki czemu nie docierała do niej wilgoć. Zawartość przez tysiąclecia zestaliła się do szarej masy. O ile tego typu naczynek znamy już z pochówków bardzo dużo, to te z oryginalnym zamknięciem są dość rzadkie. Często zatyczki ampułek, buteleczek i amfor wykonywano z korka lub drewna, które są materiałem nietrwałym. W innych przypadkach odkopane naczynie było pęknięte.
Analizy korka pokazały, że jest zrobiony z dolomitu, a więc trwałego materiału. Po jego wyjęciu stwierdzono na szyjce pozostałości jakiejś ciemnej substancji uszczelniającej. Okazało się, że był to bitumin, lepiszcze węglowodorowe, znane z literatury jako uszczelniacz do statków i amfor. Znalezienie go jako uszczelnienia zatyczki takiej buteleczki to zatem pierwszy taki przypadek.
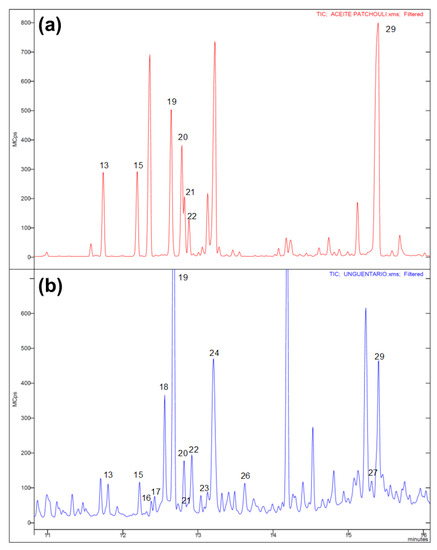
Oczywiście najbardziej interesujące były analizy zawartości. Metodami spektroskopii ramanowskiej, FT-IR i chromatografii gazowej z analizatorem mas wykazano, że do zawartości przeszła część bituminu z korka, ale poza tym skład substancji był zgodny z opisami Piliniusza - bazę stanowił olej roślinny, po którym pozostały kwasy tłuszczowe oleinowy, stearynowy i linolenowy oraz roślinne sterole. Nie dało się określić nic dokładniejszego, ale ogólne proporcje tych trzech kwasów pasują do oliwy z oliwek.
Po składniku aromatycznym pozostały niektóre terpeny i seskwiterpenoidy: seszelen, alfa-kopaen-8-ol, alloaromandren, kubenen i kariofilen, ale przede wszystkich charakterystyczne paczulenol i paczulen. Rzymianie nacierali więc więc olejem o zapachu paczuli!
Autorzy chcieli jednak sprawdzić, czy czasem za ten skład nie odpowiadają pozostałości po olejku nardowym, którego używanie opisywały starożytne źródła. W zasadzie to rzymscy autorzy opisywali dwa surowce - jeden był nazywany po prostu nardem, a drugi "liściem nardu" i mogło tu chodzić o jakąś inną roślinę. Wśród podejrzewanych przez historyków była także paczula, ale brakowało dowodów na to, że kontaktami handlowymi dotarła do Europy tak wcześnie. Kupili komercyjny olejek nardowy (jest drogi) i sprawdzili jego skład. Obawy o pomylenie tych dwóch surowców były słuszne, bo niektóre składniki się powtarzały - także paczulol, i kubeben. Były jednak pomniejszymi składnikami a zasadniczo w olejku dominował alfa-kopaen i kariofilen. Stosunek ilości najważniejszych składników nie pasował więc do resztek z buteleczki i pozostawała tylko pierwsza hipoteza - to była paczula, nic innego. [7]
Pierwszy związek z wiązaniem Beryl-Beryl
Beryl to czwarty pierwiastek w układzie okresowym, mający wiele ciekawych zastosować technicznych. Jego właściwości chemiczne także są badane i właśnie jednemu z zespołów chemików udała się sztuczka, która dotychczas była niemożliwa. Wczesne obliczenia wskazywały, że powinien być możliwy związek międzymetaliczny z wiązaniem między dwoma atomami berylu. Dla wielu innych pierwiastków się to udało, więc dlaczego beryl by był wyjątkiem?
Próby jednak nie wychodziły, a badania utrudniała toksyczność berylu.
Mówią w dużym skrócie, wykorzystano znany już wcześiej taki związek z pokrewnym berylowi magnezem. Był to dimagnezocen, związek kanapkowy, w której dwa przyciągane przez pierścienie aromatyczne atomy magnezu oddziaływały ze sobą. Poddano go reakcji z odpowiednio skonstruowanym organicznym związkiem berylu, który chętnie uwalniał metal. Nastąpiła reakcja wymiany i tak dwa magnezy zamieniły się w dwa beryle. A pomiędzy nimi pojawiło się zdefiniowane wiązanie chemiczne. I tak diberylocen stał się faktem. [8]
------
[1] https://www.int-res.com/abstracts/ame/v59/n1/p67-88/
[2] https://academic.oup.com/femsec/article/12/1/51/547804
[3] https://www.sciencedirect.com/science/article/abs/pii/0198014985900159
[4]
Emily Matthews et al, Airborne observations over the North
Atlantic Ocean reveal the importance of gas-phase urea in the
atmosphere, Proceedings of the National Academy of Sciences (2023). DOI: 10.1073/pnas.2218127120
[5] Rupert E. H. Kuevke et al, An International Study Evaluating Elemental Analysis, ACS Cent. Sci. 2022, 8, 7, 855–863
[6] https://www.chemistryworld.com/news/first-publisher-abandons-impractical-elemental-analysis-standard-as-journals-eye-next-move/4017596.article
[7] Cosano, D.; Román, J.M.; Lafont, F.; Ruiz Arrebola, J.R.
Archaeometric Identification of a Perfume from Roman Times. Heritage 2023, 6, 4472-4491.
https://doi.org/10.3390/heritage6060236
[8] https://www.science.org/doi/10.1126/science.adh4419

Hej Kuba. Zaglądam na Twojego bloga regularnie od lat. Dostarcza mi wiele ciekawostek ze świata chemii choć wcale z chemią moje życie zawodowe się nie wiąże, a jednak Twoje wpisy czytam z zaciekawieniem. Dziękuję Ci za czas który poświęcasz na dzielenie się wiedzą. :) Pozdrawiam
OdpowiedzUsuń