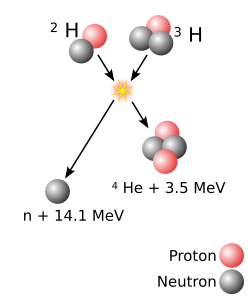
Kontrolowana fuzja jądrowa już od kilku dekad wzbudza nadzieję, jako technologia produkcji energii mogąca przebić elektrownie atomowe pod względem stosunku generowanej mocy do ilości zużytego paliwa. Tym bardziej, że paliwo to jest akurat łatwo dostępne - wodór to jeden z najpospolitszych pierwiastków. Cały problem leży natomiast w kontroli - zrobienie bomby termojądrowej nie było takie znów trudne, zrobienie reaktora, w którym reakcja będzie w powtarzalny sposób następować dostatecznie długo, aby wytworzyć energię większą niż włożona, to już kłopot.
Zbudowano już różnego typu tokomaki, stellatory i inne tego rodzaju urządzenia, i na razie ciężko jest zespołom badawczym wyjść poza etap "następnym razem na pewno nam wyjdzie, tylko musimy poprawić parę szczegółów". W zasadzie tylko jeden zespół badawczy doniósł o fuzji, która wyprodukowała nieco więcej energii, niż było jej potrzebne do zapoczątkowania reakcji - badacze z NIF skompresowali kapsułkę z mieszaniną trytu i deuteru przy pomocy 192 wiązek laserowych padających na ścianki kapsułki.[1]
Z tego też powodu zainteresowanie wzbudzają nawet te czysto badawcze urządzenia, w których fuzję daje się uzyskiwać choćby na małą skalę. Znanym przykładem jest fuzja piezoelektryczna, oparta o jonizowanie deuteru w silnym polu elektrycznym wytwarzanym przez kryształy piezoelektryczne - to jest elektryzujące się statycznie podczas szybkiego ogrzewania. Fuzję daje się też uzyskać w fuzorach, gdzie naładowane jony oscylują między dwoma sferycznymi siatkami, do których przyłożono dużą różnicę napięć. Urządzenia tego rodzaju mają jak na razie za niską wydajność i mogą być raczej użyte jako źródło neutronów niż energii.
Ostatnio natknąłem się na publikację opisującą układ fuzyjny może jeszcze nie stanowiący rozwiązania w otrzymywaniu energii, ale dużo prostszy w wykonaniu i użyciu. [2]
Zespół badaczy z Colorado State University opublikował wyniki prac nad zaskakująco prostą metodą otrzymywania fuzji jądrowej. Naświetlili oni przy pomocy femtosekundowego mocnego impulsu laserowego płytkę, pokrytą "lasem" nanowłókien z deuterowanego polietylenu. Mocny impuls laserowy w zasadzie odparował włókna, zamieniając każde w rozprzestrzeniający się obłoczek wysokoenergetycznej plazmy, zawierającej deuterony. Ponieważ włókna były ustawione równolegle, blisko względem siebie, deuterony z sąsiadujących włókien zderzały się ze sobą, z sumaryczną energią wystarczającą, aby doszło do fuzji jądrowej.
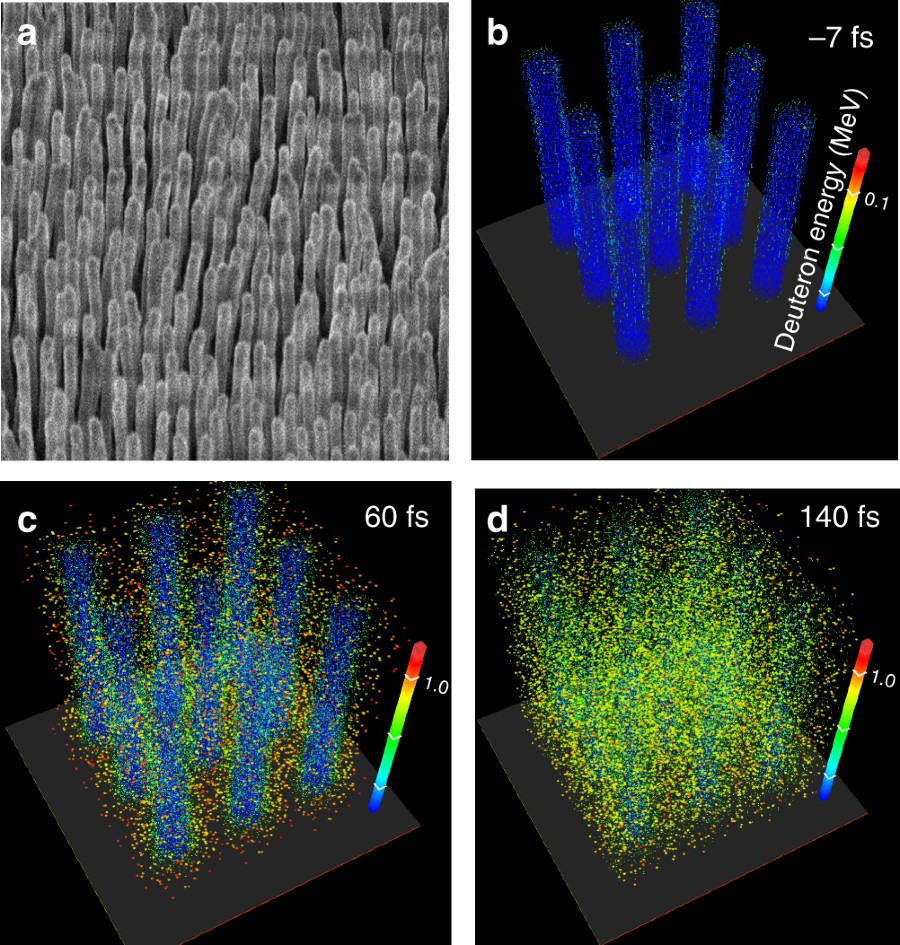 | ||
| Wygląd lasu nanowłókien oraz symulacja energii deuteronów. |
Zaobserwowano emisję strumieni wysokoenergetycznych neutronów, o gęstości kilkaset razy większej niż obserwowane dotychczas w innych eksperymentach. Impuls laserowy o energii jednego dżula wystarczał do wytworzenia wskutek fuzji około miliona neutronów. Cały układ eksperymentalny jest dość prosty, nie wymaga stosowania silnych elektromagnesów ani nawet próżni wysokiej jakości. Na razie nie wygląda na to, aby był to sposób na wytwarzanie energii termojądrowej, ale z pewnością jest to dużo tańszy i prostszy w wykonaniu układ do badań samego zjawiska fuzji. Możliwe, że znajdzie zastosowanie jako źródło strumieni wysokoenergetycznych neutronów, nie wymagające akceleatora.
W każdym razie, bardzo ciekawe odkrycie.
-------
[1] http://www.bbc.com/news/science-environment-24429621
[2] Alden Curtis, Chase Calvi, James Tinsley, Reed Hollinger, Vural Kaymak, Alexander Pukhov, Shoujun Wang, Alex Rockwood, Yong Wang, Vyacheslav N. Shlyaptsev & Jorge J, Rocca; Micro-scale fusion in dense relativistic nanowire array plasmas, Nature Communications volume 9, Article number: 1077 (2018)