DEET
N,N-dimetylo-m-toluamid to stosunkowo prosty związek chemiczny, będący najpopularniejszym i prawdopodobnie najdłużej działającym odstraszaczem komarów.
Wynaleziony w latach 40. z myślą o ochronie żołnierzy walczących w warunkach tropikalnych, wprowadzony do cywilnego obrotu w latach 50. Patenty na różne metody syntezy dawno wygasły, dlatego produkuje go wiele firm i stanowi podstawowy składnik wielu środków na odstraszanie komarów, moskitów, gzów i kleszczy, a nawet pcheł i innych owadów gryzących.
Mechanizm działania nie jest do końca jasny. W wysokich stężeniach działa jak środek owadobójczy, ale nie tłumaczy to odstraszania. Sądzono, że blokuje u komarów wyczuwanie dwutlenku węgla lub innych substancji zapachowych skóry, po których wyczuwają one swe ofiary. Wyniki eksperymentów na owadach są niespójne - w jednych stwierdzono, że DEET zmniejsza lotność skórnych substancji zapachowych, ale są też eksperymenty wskazujące na to, że u części gatunków komarów środek ten jest wyczuwany jako nieprzyjemnie, drażniąco pachnący, i skłania do odlatywania dalej od opryskanych miejsc. Część gatunków prawdopodobnie jest jedynie zniechęcana do żerowania podczas kontaktu z pokrytymi środkiem powierzchniami, a więc tracą ochotę na gryzienie gdy usiądą na opryskanym miejscu.
Niemniej eksperymenty potwierdzają, że DEET zapobiega ugryzieniom komarów i innych owadów niezależnie od mechanizmu. Czas ochrony zależy od warunków, rodzaju powierzchni i stężenia środka z preparacie. Przy stężeniach 50% i większych czas ochrony skóry to nawet 12 godzin, niższe skracają ten czas do około 3 godzin przy stężeniu 20%.
Jeśli chodzi o szkodliwość, to substancja jest stosunkowo bezpieczna. Wchłanianie przez skórę nie jest zbyt szybkie. Dawka wywołująca toksyczność ostrą LD50 to 1100 mg/kg m.c. w zasadzie więc poza przypadkami niezamierzonego lub celowego wypicia preparatu nie obserwuje się ciężkich zatruć. Efekty częstego narażenia na dawki typowe przy zwykłym zastosowaniu są bardziej subtelne i czasem trudno określić co właściwie jest ich przyczyną. Przykładem może być często cytowane badanie na temat pracowników Parku Narodowego Everglades, na bagiennych terenach Florydy, którzy stosując repelenty zawierające DEET codziennie podczas pracy, zgłaszali takie objawy jak senność, bóle głowy, podrażnienia skóry. Kwestią sporną jest w tym przypadku to, że repelenty zawierają jeszcze inne substancje, niż ta główna czynna i objawy równie dobrze mogą wynikać z innych przyczyn niż samo DEET. Częściej rejestruje się negatywne skutki przy niewłaściwym stosowaniu. Producenci odstraszaczy zwykle radzą aby napryskiwać preparat na dłonie i rozsmarowywać na odsłonięte części ciała. Pryskanie bezpośrednio na twarz lub opryskiwanie całego ciała w pomieszczeniach, narażają użytkowników na wdychanie aerozolu i lotnych rozpuszczalników.
Nie wykazano, żeby związek działał mutagennie czy rakotwórczo. Analiza związku wykrytego stężenia we krwi na czynniki zapalne nie wykazała wpływu.
https://pmc.ncbi.nlm.nih.gov/articles/PMC7410448/
Jedną z wad DEET jest też pozostawianie tłustej warstwy oraz działanie jak rozpuszczalnik niektórych tworzyw sztucznych. Zgłaszano już rozpuszczanie szkiełek zegarkowych, okularków pływackich, uszkadzanie lakierów czy przedmiotów z polistyrenu (sprzęt turystyczny, styropianowe opakowania na żywność). Zastosowany na odzież może osłabić materiał ze sztucznej wiskozy, stroje sportowe lycra/spandex. Jest to jednak problem, który pojawia się też u niektórych alternatyw, olejki eteryczne z cytrusów także dobrze rozpuszczają polistyren i różne lakiery.
Ikarydyna
Kolejny syntetyczny środek, stosunkowo nowy - wprowadzony na rynek europejski w 2001 roku, dlatego mniej popularny. W odróżnieniu od DEET ma dużo mniejsze wchłanianie przezskórne oraz słabsze działanie podrażniające, dlatego jest uważany za bezpieczniejszy przy użyciu bezpośrednio na ciało. Substancja prawdopodobnie blokuje u komarów odczuwanie zapachu, przez co nie może on namierzyć ofiar. Ma też pewien stopień odstraszania gzów, kleszczy.
IR3535
Pod względem chemicznym to bardzo prosta cząsteczka - butylo-acetylo-aminopropionian etylu
Jest to więc amina trzeciorzędowa, w której do atomu azotu podłączone są trzy grupy: czterowęglowa butylowa, acetylowa czyli reszta kwasu octowego i ester etylowy kwasu propionowego. Można go też traktować jak pochodną aminokwasu beta alaniny.
Złocień, pyretoidy i spirale
Znane wszystkim spiralne kadzidełka przeciwko komarom to wynalazek japoński, który co ciekawe często produkowany jest z roślin.
Eukaliptus cytrynowy
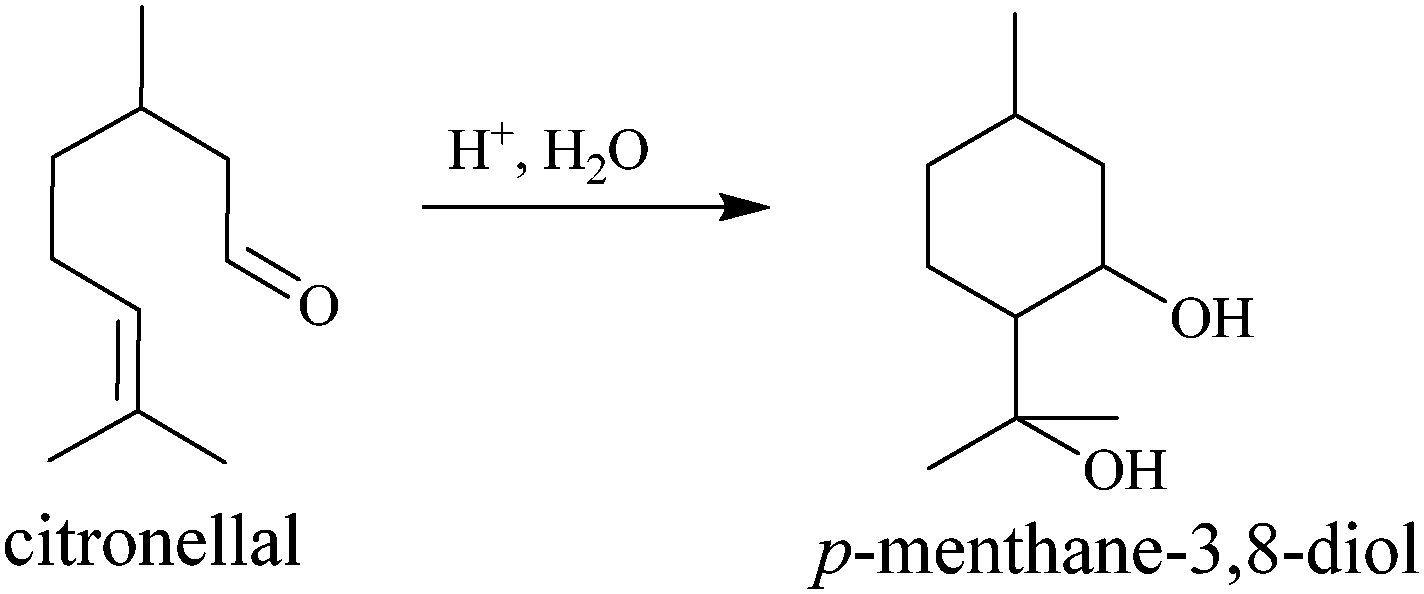
Olejek eteryczny z liści australijskiego drzewa Corymbia citrodora, nazywanego eukaliptusem cytrynowym, często wymieniany jest jako trzeci polecany środek, zaraz po wymienianych tu syntetykach. Jego skuteczność i trwałość jest dosyć wysoka. Olejek z liści jest bogaty w cytronellol, związek o zapachu cytrynowym, który już sam w sobie odstrasza komary. Odkryto jednak, że głównym składnikiem czynnym jest występujący w zaledwie kilku procentach para-mentano-3,8-diol czyli PMD (czasem stosowana jest nazwa dihydroksycytrol). W handlu dostępny jest olejek rafinowany o zawartości PMD do 70%. Czysta substancja czynna ma zapach miętowy.
Skuteczność odstraszania komarów jest wysoka. Przy stężeniach rzędu 20-30% chroni skórę przed większością gatunków komarów, zależnie od warunków i obecności w preparacie utrwalaczy zmniejszających lotność, nawet do 4 godzin.
Mechanizm działania nie jest jasny, w jakiś sposób PMD zniechęca komary do żerowania nawet jeśli usiądą na skórze, natomiast raczej nie odstrasza ich, co zresztą sam na sobie obserwowałem (gryzły tylko w miejsca nieposmarowane). Owady narażone na ten związek były mniej chętne żerować
https://www3.epa.gov/pesticides/chem_search/reg_actions/registration/fs_PC-011550_01-Apr-00.pdf
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6023277/
Czyli środki z PMD to zamienniki syntetycznych, i są preparatami zawierającymi w pełni naturalną substancję czynną? Cóż, trochę tu się przyczepię. Na opakowaniach preparatów można znaleźć dość skomplikowaną formułę, mówiącą o olejku eterycznym cyklizowanym, zgodnie ze zmienionym nazewnictwem. Jeśli coś zostało cyklizowane, to znaczy że coś bez pierścieni zamieniło się w coś z pierścieniami. A zatem została dokonana jakaś przemiana.
Rzecz w tym, że stanowiący główny składnik olejku cytronellol może w warunkach kwaśnych ulegać cyklizacji z wytworzeniem właśnie PMD. I taka reakcja następuje biochemicznie w eukaliptusie, gdzie jednak przemianie ulega tylko kilka procentów. Dlatego można olejek docyklizować dalej poddając go reakcji z jakimś kwasem. Powstały produkt jest więc przetworzony dla zwiększenia zawartości cennego składnika, ale nie został wcześniej oczyszczony. Olejek cyklizowany jest więc w najlepszym razie surowcem pół-syntetycznym.
P
Olejki i zioła
Witamina B.













_(17161279802).jpg)



.jpg/800px-Black_eye_(3).jpg)
















