Jaka woda mineralna zawiera najwięcej selenu, a jaka wapnia? I czy właściwie warto jest je pić?
Woda mineralna, wedle dziś uznawanej definicji, to woda wydobywana z ujęć podziemnych, która jest naturalnie czystsza od zwykłej wody pitnej, oraz ma określony, stabilny skład. Nie będzie więc wodą mineralną ta uzdatniana, która płynie w naszych kranach, choć niekiedy parametry obu wód są podobne. Dawniej, na potrzeby działalności zakładów wodoleczniczych stosowano definicję, uznającą za wodę mineralną tylko taką, która ma powyżej 1g/l składników rozpuszczonych. Zawężało to ilość wód mineralnych do około 30.
Dziś wodą mineralną może więc zostać w zasadzie każda woda głębinowa o niezmiennym składzie i czystości, stąd też namnożyło się ich nam na rynku na prawdę sporo (ponad 130), i trudno zdecydować jaką wybrać.
Czy wody mineralne mogą być potraktowane jako dobre suplementy składników mineralnych? Niespecjalnie. Mimo wszystko w popularnych wodach składników mineralnych nie jest zbyt wiele. Wprawdzie najbardziej nawapniona woda mineralna, zawiera w litrze 1/4 zalecanej dziennej dawki Ca, ale przy spożyciu doustnym wchłanialność soli wapnia wynosi do 30%. Biorąc pod uwagę znaczne rozcieńczenie, próba uzupełnienia dobowej dawki wodą mineralną może być trudna, oraz prowadzić może do zwiększonego wypłukania tychże minerałów z moczem. Wody mineralne są najwyżej jednym z dodatkowych źródeł, ale główne zapotrzebowanie powinna zaspokajać po prostu żywność dobrej jakości i odpowiednio zróżnicowana.
Na podstawie kilku różnych źródeł postanowiłem podsumować informacje o tym, jaka woda zawiera najwięcej różnych jonów.
Wapń
Pierwiastek dość rozpowszechniony i w praktycznie każdej wodzie mineralnej jest obecny. Najwięcej z tych, które znalazłem, jest go w trudnej do zdobycia litewskiej wodzie Vytatuas, bo ponad 500 mg/l. Jest to woda generalnie dość słona, zawierająca przede wszystkim chlorek sodu. Z wód krajowych, łatwiej dostępnych w sklepach, najwięcej wapnia jest w Muszynie Minerale (456 mg/l), Kryniczance (436 mg/l) i Galicjance (415 mg/l)
Sód
Najczęściej występuje jako chlorek i wodorowęglan, stąd najwięcej jest go w wodach bardzo słonych i alkalicznych. Najzasobniejsza jest woda uzdrowiskowa Magdalena, zawierająca 8g/l Na. Następne w kolejce są wody Zuber (6,1g/l), Szczawa II (5,1) Szczawa I (4,8) Franciszek (3,8); z łatwiej dostępnych Wysowianka (0,39 g/l) czy Słotwinka (0,29g/l)
Jeśli chodzi o wody niskosodowe, zwykle bardzo mało sodu mają wody źródlane, na przykład Górska Natura podaje na etykiecie tylko 1 mg/l co jest chyba najniższą jeszcze podawaną wartością, niewiele więcej podaje Dobrowianka (2 mg/l) i Primavera (2,4 mg/l)
Potas
Ma właściwości podobne do sodu i zwykle występuje wraz z nim w różnej proporcji, nie będzie więc zaskoczeniem, że najzasobniejsza w ten pierwiastek jest woda Zuber (288 mg/l). Następne w rankingu to Szczawa I (208 mg/l), Hanna (104), Franciszek (90), a z szerzej dostępnych, słodkich Wielka Pieniawa (64), Polanicka Zdrój (38).
Magnez
Ze względu na podobieństwo do wapnia i niekiedy występowanie z nim w skałach, zwykle towarzyszy mu w alkalicznych szczawach, jednak wodą zawierającą go najwięcej jest u nas Zuber, która po prostu zawiera najwięcej wszystkiego, przez co jest wodą uzdrowiskową trudną do przełknięcia. Zawiera 363 mg/l magnezu. Następna w kolejce to nie taka łatwa do znalezienia woda Muszyńskie Zdroje, zawierająca 292 mg/l, oraz pojawiająca się w sklepach
Słotwinka (244 mg/l). Z wód bardziej popularnych, obfitym źródłem jest Muszynianka (135 mg/l) i Galicjanka (90 mg/l).
Dla porównania wody rozprowadzane przez wodociągi są zwykle miękkie lub lekko twarde i nie zawierają zbyt wiele magnezu. Z kilku badań które przeglądałem, najbardziej w magnez obfitowała woda z ujęcia w Dąbrowie Górniczej, zawierająca 48 mg/l. [d]
Fluorki
Obecność w wodzie fluorków zwykle wiąże się ze złożami fluorytu i fluoroapatytu, ale może też wynikać z obecności niektórych turmalinów. Zwykle pojawiają się w ujęciach podgórskich, z uwagi na bliskie podchodzenie pod powierzchnię skał magmowych - i tutaj w badaniu z 2010 najwyższą zawartość fluorków miała Długopolanka (1,5 mg/l).
Fluorki mogą jednak pojawiać się na niżu w związku z obecnością w podłożu osadów polodowcowych z odseparowaną frakcją ciężkich minerałów, lub przenikaniem wód głębinowych. Chyba ta przyczyna spowodowała, że łatwo dostępną wodą mineralną o drugiej najwyższej zawartości fluorków, jest Augustowianka (1 mg/l - około 30% dziennej dawki). Jest to woda czerpana z dość dużej głębokości (450 m), lekko słonawa, zawierająca też chlorki sodu, wapnia i magnezu. Z innych łatwo dostępnych wód Polanica Zdrój zawiera o połowę mniej fluoru - 0,5 mg/l, podobnie Staropolanka i woda zdrojowa Henryk, kilkanaście wód zawiera 0,3-0,1 mg/l, a wiele innych w ogóle go nie wymienia.
Dla porównania są rejony, w których ze względu na minerały fluoru w glebie, zawartość fluorków w wodzie wodociągowej z ujęć lokalnych także osiąga spore wartości. W Toruniu dawniej czynne były ujęcia tzw. "studni kredowych" ujmujących wody z warstwy kredy, zawierające nawet 1,5 mg F w litrze; aktualnie toruńska kranówka zawiera 0,2-0,4 mg/l.[f] Wysokie poziomy fluoru związanego ze złożami osadów, notuje się w studniach na Żuławach. Wynika to zapewne z warstwy osadów z okresu Permu, w miejscu dawnej zatoki morskiej. Pomiędzy złożami soli i gipsu znaleziono skupiska fluorytu. W studniach głębinowych z okolic Malborka fluorków było nawet 3,5 mg/l.[g] Podwyższone poziomy notuje się też w Tczewie, Gdańsku, Sieradzu, i w okolicy Kalisza.
Siarczany
Obecność w wodzie siarczanów zwykle wiąże się ze złożami gipsu. Uzupełniają one nieorganiczną siarkę, ale ze względu na działanie osmotyczne, przy stężeniach przekraczających 1g/l zaczynają działać przeczyszczająco. Najwięcej zawiera ich litewska woda Vytatuas (989 mg/l), a z krajowych Solannova (472), czy MagneVita (192). Z szerzej dostępnych stosunkowo sporo zawiera ich Polanicka Zdrój (100 mg/l), Polaris (88 mg/l [p]) i Selenka (85 mg/l).
Lit
Pierwiastek ten ma właściwości podobne do innych metali alkalicznych, jak sód czy potas, toteż często im towarzyszy. Dlatego wodami mineralnymi o największej jego zawartości są zwykle wody silnie zmineralizowane, słone. Króluje tu wybitnie słona woda Zuber (18,5 mg/l), dalej Szczawa II (14,5), Szczawa I (11,6) i nieco bardziej znośna Franciszek (5,2). Z wód łatwo dostępnych, słodkich, stosunkowo dużo litu zawiera Piwniczanka (0,6 mg/l) i Galicjanka (0,2).
Nie ma zbyt wielu informacji o zawartości litu w wodach wodociągowych, z którymi można by porównać te wyniki. Zwykle się go nie bada.
Jod
Jod ma właściwości chemiczne podobne do chloru, więc często występuje w wodach słonych. Z tych, których skład sprawdzałem, najwięcej ma go woda Dziedzilla (4,4 mg/l) i Szczawa II (3,0 mg/l), nieco mniej Szczawa I i Hanna (2,5 mg/l), Franciszek (2,2 mg/l). Są to wody zdrojowe, czasami spotykane w sklepach w małych buteleczkach.
Selen
Selen jest pierwiastkiem rzadkim i potrzebnym organizmowi w śladowych ilościach. Chemicznie jest najbardziej podobny do siarki, stąd występuje w wodach siarczkowych i siarczanowych, często też żelazistych, wynikających z kontaktu ze złożami pirytu.
W analizie z 1999 roku stwierdzono, że najwięcej selenu zawierały wody Cristal (0,514 ug/l = 0,0005 mg/l), Krynica Zdrój niegazowana (0,5 ug/l), Nałęczowianka niegazowana (0,498) Muszynianka niegazowana (0,495), Multi Vita (0,460) i Kryniczanka (0,450). W wodach gazowanych zwykle było go mniej niż w niegazowanych, być może z powodu występowania części pierwiastka w lotnych formach. Podczas standardowych oznaczeń próbkę się odgazowuje, więc im więcej gazu miała woda, tym większe były różnice między wersją gazowaną i niegazowaną.[s]
Obecnością selenu chwali się woda z Wieńca Zdroju, o chwytliwej nazwie Selenka, choć trudno powiedzieć, czy jest w ten pierwiastek jakoś wyjątkowo zasobna. Podawana na etykiecie wartość <0,02 mg/l to tylko granica oznaczalności metody, pod nią mieszczą się wszystkie podane wcześniej wyniki zawartości, a także maksymalna dopuszczalna zawartość dla wód pitnych (0,01 mg/l). Miejsce w rankingu mogłyby ustalić dokładne wyniki analizy, ale tej nigdzie nie da się znaleźć.
Inne rzadkie
W teście popularnych wód na zlecenie UOKiK z 2012 roku[u] zbadano też niektóre rzadsze pierwiastki, w tym rad i radon.W żadnej z wód radioaktywność nie przekraczała norm, choć szczególnie duża była w Staropolance 2000 - całkowita dawka przy trwającym rok codziennym uzupełnianiu płynów tylko tą wodą wyniosłaby 0,175 mSv/r - przy czym producent zalecał dzienną dawkę wody 1l, co obniżało skumulowane narażenie do 0,088 mSv/r. Żadna z wód nie przekraczała też norm dla zawartości uranu ale największe stężenie wykazano dla Ustronianki (1,2 ug/l).
------
* http://www.wodamineralna.netmark.pl/ - ranking wód bazujący na informacjach z etykiet
* Łukasz J. Krzych i inni, CHARAKTERYSTYKA WÓD BUTELKOWANYCH DOSTĘPNYCH
W SPRZEDAŻY W WOJEWÓDZTWIE ŚLĄSKIM, ROCZN. PZH 2010, 61, Nr 1, 37 - 43
[d] D. Bodzek i inni, Zawartość wapnia i magnezu w wybranych wodach i osadach ściekowych Górnego Śląska, Ochrona Środowiska, 4(71) 1998
[f] http://www.wodociagi.torun.com.pl/index.php?lang=PL&m=faq
[g] Halina Łazarz i inni, Fluor w wodach podziemnych wschodniej części Żuław Wiślanych, Kwartalnik Geologiczny, I. 31, nr 1. 1987 r., Str. 69 - 82
[p] Anna Pasternakiewicz i inni, Badania zawartości wybranych anionów nieorganicznych
w wodach mineralnych i źródlanych – pod kątem bezpieczeństwa zdrowotnego wody, Probl Hig Epidemiol 2014, 95(3): 788-793
[s] Masłowska J., Ocena zawartości selenu w naturalnych wodach mineralnych dostępnych na rynku w Polsce, Żywność 3 (20) 1999
[u] https://www.bankier.pl/static/att/90000/2467072_Wybrwody.pdf
informacje
Pokazywanie postów oznaczonych etykietą woda. Pokaż wszystkie posty
Pokazywanie postów oznaczonych etykietą woda. Pokaż wszystkie posty
poniedziałek, 12 sierpnia 2019
niedziela, 9 lipca 2017
Chemiczne wieści (11.)
Dwie wody
Woda to jedna z najprostszych substancji na naszej planecie, złożona z jednych z najlżejszych pierwiastków - i paradoksalnie właśnie dlatego skomplikowana. Duża elektroujemność tlenu w połączeniu z faktem że wodór ma najmniejszy atom z wszystkich pierwiastków powodują, że po spolaryzowaniu wiązania atomy wodoru stają się bardzo skoncentrowanymi punktami dodatniego ładunku. Między nimi a pełnymi elektronów bardzo elektroujemnymi niemetalami mogą powstawać słabe oddziaływania elektrostatyczne, to jest wiązania wodorowe. Ze względu na budowę, cząsteczka wody może utworzyć aż cztery takie połączenia, z czego skwapliwie korzysta.
Tworzenie się takich oddziaływań między cząsteczkami wody, które w przeciętnych temperaturach mimo wszystko szybko się zrywają, na tyle "skleja" cząsteczki, że woda wykazuje anomalnie wysoką temperaturę wrzenia i krzepnięcia. W przypadku pozostałych niemetali obowiązuje prosta zasada - im lżejszy główny atom tym niższe są te graniczne temperatury. Siarczek wodoru, mający dwa razy cięższy atom centralny, jest już gazem o niskiej temperaturze wrzenia. Gdyby zasada obowiązywała do końca, woda byłaby gazem o temperaturze skraplania około -100 stopni.
Z faktu tworzenia takich wiązań wynika też kilka innych nietypowych własności, lecz szczegóły molekularne nie zostały jeszcze do końca poznane. Najnowsza publikacja dorzuca jedno ciekawe rozwiązanie, i zarazem nową zagadkę - otóż jak się okazuje pewne zachowania bardzo wyziębionej wody daje się wytłumaczyć przy założeniu, że tak na prawdę mamy do czynienia z mieszaniną dwóch różnych wód.
Oprócz kilkunastu odmian krystalicznych lodu, znamy też formy amorficzne, otrzymane przez bardzo szybkie schłodzenie wody, co nie pozwala cząsteczkom uporządkować się w kryształy. Zależnie od warunków przeprowadzenia procesu, można otrzymać dwie fazy szkliste różniące się gęstością, z różnym upakowaniem. Podczas badań przemian fazowych tych form stwierdzono, że podczas topnienia zamieniają się w ciecz, której właściwości zależą od tego z jakiej formy amorficznego lodu powstała.
Dla ciał szklistych, a więc nieuporządkowanych, nie ma właściwie klasycznego topnienia. Zwiększanie temperatury powoduje mięknięcie materiału następujące w pewnym przedziale, w wyniku którego najpierw otrzymuje się ciało bardzo plastyczne, mogące pod wpływem sił płynąć, a potem dopiero ciecz.
W przypadku amorficznego lodu stwierdzono, że na powierzchni ogrzewanych bryłek pojawia się faza płynna, mogąca występować w dwóch formach: wysokiej gęstości i niskiej gęstości. Fazy te są metastabilne w danych warunkach. Mowa o temperaturach rzędu 100 K czyli -170 C, znacznie poniżej temperatur zamarzania. W tak niskiej temperaturze powstająca ciecz pozostaje płynna, bo brakuje dodatkowej energii potrzebnej na uporządkowanie cząsteczek w krystaliczny lód.
Powstałe dwie fazy wody mogą przechodzić jedna w drugą ale istnieje pomiędzy nimi granica. W obserwowanym przypadku w cienkiej warstwie na powierzchni lodu szklistego istniały osobne domeny jednej z faz. Fazy różnią się gęstością i lepkością. Sądzi się, że może to wytłumaczyć niektóre nietypowe własności przechłodzonej wody - nieliniowa zmiana parametrów fizycznych to wynik powstawania wskutek fluktuacji obszarów zawierających w istocie dwie różne fazy ciekłe.[1]
Spirala hydratacyjna
Cząsteczki wody z powodu silnego momentu dipolowego zwykły otaczać rozpuszczane cząsteczki przylegającą powłoką hydratacyjną. Niedawne badania rentgenowskie cząsteczek DNA pokazały, że na łańcuchu powłoka ta przybiera ciekawą formę. Podstawowe domeny DNA to zasady purynowe, między którymi oddziaływania łączą nici, następnie cukier deoksyryboza i dalej reszta fosforanowa. Nici są skręcone w helisę, to jest formę przypominającą skręconą drabinę. Ponieważ cząstki deoksyrybozy są przestrzennie dość duże, w modelu DNA pojawiają się dwie szczeliny skręcone tak samo jak nici.
No i otóż jak stwierdzono, w wyniku hydratacji w tą szczelinę wchodzą cząsteczki wody tworząc spiralną strukturę, która podobnie jak samo DNA jest chiralna, ale zarazem na tyle trwałą że da się ją zaobserwować spektroskopowo.
Ma to o tyle znaczenie, że pewne leki (ale też toksyny) działają poprzez przyłączanie się do łańcucha DNA. Jeśli woda tworzy wyraźną strukturę w samym rowku helisy, to zbliżające się cząsteczki muszą ją wypychać. Uwzględniając ten efekt można zaprojektować cząsteczki łatwiej wpasowujące się w szczelinę.[2]
Oszacować czas zbrodni
Po opuszczeniu ciała, krew podlega różnego rodzaju przemianom chemicznym i fizycznym. Najpierw krzepnie i wysycha, następnie pod wpływem tlenu, światła i wilgoci pewne składniki mogą ulegać rozkładowi. Bardzo stara plama krwi może wyglądać jak złożona z brudu, mieć kolor brązowy, brudnożółty czy nawet zielonkawy. Jak niedawno odkryto powolne zachodzenie tego typu przemian można zbadać i na tej podstawie z całkiem niezłą dokładnością oszacować jak stara jest plama. Co z pewnością znajdzie zastosowanie w kryminalistyce.
Zastosowaną techniką była w tym przypadku spektroskopia Ramanowska. W tym typie bada się widmo światła rozproszonego przez próbkę. Jeśli oświetlimy ją światłem o pewnej konkretnej częstotliwości fali, w widmie światła rozproszonego pojawią się dodatkowe sygnały o innych częstotliwościach. Ich źródłem są drgające fragmenty cząsteczek, podlegające zmianom długości i położenia wiązań. W istocie technika ta bada podobne zjawiska jak w spektroskopii w podczerwieni.
Ze złożenia informacji o tym, że w badanej substancji znajdują się konkretne fragmenty dające konkretne przesunięte sygnały, można wywnioskować z czym mamy do czynienia.
W tym przypadku próbki krwi rozmazanej na powierzchniach poddano naturalnemu starzeniu przez okres do dwóch lat. Co pewien czas badano widmo próbek. W trakcie starzenia, pewne sygnały zanikały, zaś inne pojawiały się tam gdzie ich nie było, świadcząc o przemianach chemicznych w próbce. Na podstawie wielu porównań możliwe było określenie zmian w sygnałach pojawiających się już po upływie kilku godzin od pobrania krwi. Bazując na tak powstałej skali badacze byli w stanie określić przybliżony wiek plamy krwi z dokładnością do 70%. [3]
http://www.sciencedirect.com/science/article/pii/S2468170917300218
--------
[1] Anders Nilsson et al. Diffusive dynamics during the high-to-low density transition in amorphous ice. PNAS, June 26, 2017 DOI: 10.1073/pnas.1705303114
[2] 1. M L McDermott, H Vanselous, S A Corcelli and P B Petersen, ACS Centr. Sci., 2017, DOI: 10.1021/acscentsci.7b00100
Woda to jedna z najprostszych substancji na naszej planecie, złożona z jednych z najlżejszych pierwiastków - i paradoksalnie właśnie dlatego skomplikowana. Duża elektroujemność tlenu w połączeniu z faktem że wodór ma najmniejszy atom z wszystkich pierwiastków powodują, że po spolaryzowaniu wiązania atomy wodoru stają się bardzo skoncentrowanymi punktami dodatniego ładunku. Między nimi a pełnymi elektronów bardzo elektroujemnymi niemetalami mogą powstawać słabe oddziaływania elektrostatyczne, to jest wiązania wodorowe. Ze względu na budowę, cząsteczka wody może utworzyć aż cztery takie połączenia, z czego skwapliwie korzysta.
Tworzenie się takich oddziaływań między cząsteczkami wody, które w przeciętnych temperaturach mimo wszystko szybko się zrywają, na tyle "skleja" cząsteczki, że woda wykazuje anomalnie wysoką temperaturę wrzenia i krzepnięcia. W przypadku pozostałych niemetali obowiązuje prosta zasada - im lżejszy główny atom tym niższe są te graniczne temperatury. Siarczek wodoru, mający dwa razy cięższy atom centralny, jest już gazem o niskiej temperaturze wrzenia. Gdyby zasada obowiązywała do końca, woda byłaby gazem o temperaturze skraplania około -100 stopni.
Z faktu tworzenia takich wiązań wynika też kilka innych nietypowych własności, lecz szczegóły molekularne nie zostały jeszcze do końca poznane. Najnowsza publikacja dorzuca jedno ciekawe rozwiązanie, i zarazem nową zagadkę - otóż jak się okazuje pewne zachowania bardzo wyziębionej wody daje się wytłumaczyć przy założeniu, że tak na prawdę mamy do czynienia z mieszaniną dwóch różnych wód.
Oprócz kilkunastu odmian krystalicznych lodu, znamy też formy amorficzne, otrzymane przez bardzo szybkie schłodzenie wody, co nie pozwala cząsteczkom uporządkować się w kryształy. Zależnie od warunków przeprowadzenia procesu, można otrzymać dwie fazy szkliste różniące się gęstością, z różnym upakowaniem. Podczas badań przemian fazowych tych form stwierdzono, że podczas topnienia zamieniają się w ciecz, której właściwości zależą od tego z jakiej formy amorficznego lodu powstała.
Dla ciał szklistych, a więc nieuporządkowanych, nie ma właściwie klasycznego topnienia. Zwiększanie temperatury powoduje mięknięcie materiału następujące w pewnym przedziale, w wyniku którego najpierw otrzymuje się ciało bardzo plastyczne, mogące pod wpływem sił płynąć, a potem dopiero ciecz.
W przypadku amorficznego lodu stwierdzono, że na powierzchni ogrzewanych bryłek pojawia się faza płynna, mogąca występować w dwóch formach: wysokiej gęstości i niskiej gęstości. Fazy te są metastabilne w danych warunkach. Mowa o temperaturach rzędu 100 K czyli -170 C, znacznie poniżej temperatur zamarzania. W tak niskiej temperaturze powstająca ciecz pozostaje płynna, bo brakuje dodatkowej energii potrzebnej na uporządkowanie cząsteczek w krystaliczny lód.
Powstałe dwie fazy wody mogą przechodzić jedna w drugą ale istnieje pomiędzy nimi granica. W obserwowanym przypadku w cienkiej warstwie na powierzchni lodu szklistego istniały osobne domeny jednej z faz. Fazy różnią się gęstością i lepkością. Sądzi się, że może to wytłumaczyć niektóre nietypowe własności przechłodzonej wody - nieliniowa zmiana parametrów fizycznych to wynik powstawania wskutek fluktuacji obszarów zawierających w istocie dwie różne fazy ciekłe.[1]
Spirala hydratacyjna
Cząsteczki wody z powodu silnego momentu dipolowego zwykły otaczać rozpuszczane cząsteczki przylegającą powłoką hydratacyjną. Niedawne badania rentgenowskie cząsteczek DNA pokazały, że na łańcuchu powłoka ta przybiera ciekawą formę. Podstawowe domeny DNA to zasady purynowe, między którymi oddziaływania łączą nici, następnie cukier deoksyryboza i dalej reszta fosforanowa. Nici są skręcone w helisę, to jest formę przypominającą skręconą drabinę. Ponieważ cząstki deoksyrybozy są przestrzennie dość duże, w modelu DNA pojawiają się dwie szczeliny skręcone tak samo jak nici.
No i otóż jak stwierdzono, w wyniku hydratacji w tą szczelinę wchodzą cząsteczki wody tworząc spiralną strukturę, która podobnie jak samo DNA jest chiralna, ale zarazem na tyle trwałą że da się ją zaobserwować spektroskopowo.
Ma to o tyle znaczenie, że pewne leki (ale też toksyny) działają poprzez przyłączanie się do łańcucha DNA. Jeśli woda tworzy wyraźną strukturę w samym rowku helisy, to zbliżające się cząsteczki muszą ją wypychać. Uwzględniając ten efekt można zaprojektować cząsteczki łatwiej wpasowujące się w szczelinę.[2]
Oszacować czas zbrodni
Po opuszczeniu ciała, krew podlega różnego rodzaju przemianom chemicznym i fizycznym. Najpierw krzepnie i wysycha, następnie pod wpływem tlenu, światła i wilgoci pewne składniki mogą ulegać rozkładowi. Bardzo stara plama krwi może wyglądać jak złożona z brudu, mieć kolor brązowy, brudnożółty czy nawet zielonkawy. Jak niedawno odkryto powolne zachodzenie tego typu przemian można zbadać i na tej podstawie z całkiem niezłą dokładnością oszacować jak stara jest plama. Co z pewnością znajdzie zastosowanie w kryminalistyce.
Zastosowaną techniką była w tym przypadku spektroskopia Ramanowska. W tym typie bada się widmo światła rozproszonego przez próbkę. Jeśli oświetlimy ją światłem o pewnej konkretnej częstotliwości fali, w widmie światła rozproszonego pojawią się dodatkowe sygnały o innych częstotliwościach. Ich źródłem są drgające fragmenty cząsteczek, podlegające zmianom długości i położenia wiązań. W istocie technika ta bada podobne zjawiska jak w spektroskopii w podczerwieni.
Ze złożenia informacji o tym, że w badanej substancji znajdują się konkretne fragmenty dające konkretne przesunięte sygnały, można wywnioskować z czym mamy do czynienia.
W tym przypadku próbki krwi rozmazanej na powierzchniach poddano naturalnemu starzeniu przez okres do dwóch lat. Co pewien czas badano widmo próbek. W trakcie starzenia, pewne sygnały zanikały, zaś inne pojawiały się tam gdzie ich nie było, świadcząc o przemianach chemicznych w próbce. Na podstawie wielu porównań możliwe było określenie zmian w sygnałach pojawiających się już po upływie kilku godzin od pobrania krwi. Bazując na tak powstałej skali badacze byli w stanie określić przybliżony wiek plamy krwi z dokładnością do 70%. [3]
http://www.sciencedirect.com/science/article/pii/S2468170917300218
--------
[1] Anders Nilsson et al. Diffusive dynamics during the high-to-low density transition in amorphous ice. PNAS, June 26, 2017 DOI: 10.1073/pnas.1705303114
[2] 1. M L McDermott, H Vanselous, S A Corcelli and P B Petersen, ACS Centr. Sci., 2017, DOI: 10.1021/acscentsci.7b00100
[3] Kyle C. Doty, Claire K. Muro, Igor K. Lednev; Predicting the time of the crime: Bloodstain aging estimation for up to two years, Forensic Chemistry Volume 5, September 2017, Pages 1–7
Etykiety:
DNA,
spektroskopia,
wieści,
woda
czwartek, 19 maja 2016
Sita molekularne
Z sitami molekularnymi student chemii zwykle spotyka się na pierwszych pracowniach laboratoryjnych, gdzie zawsze przy ogrzewaniu cieczy do wrzenia upomina się go "ale najpierw wrzuć do kolby sita molekularne" mające postać małych, twardych kuleczek. I bardzo możliwe, że aż do końca studiów będzie znał tylko takie ich zastosowanie. Niemniej co niektórych może jednak zastanowić, czym też są i czemu nazywa się je sitami, skoro wyglądają raczej jak małe granulki jakiejś masy ceramicznej?
Sita molekularne to granulki o tak dobranym składzie i metodzie produkcji, że są bardzo porowate, zaś te pory mają określoną wielkość pozwalającą wnikać wgłąb materiału cząsteczkom odpowiednio małym, zatrzymując cząsteczki za duże. Po prostu tylko cząsteczki mniejsze niż średnica poru będą w niego wchodzić i tym samym będą "odsiewane" od większych. Z tego też powodu najczęściej używa się sit do oddzielania niepożądanych, małocząsteczkowych zanieczyszczeń od cieczy i gazów.
Materiałem budującym sito molekularne są najczęściej syntetyczne minerały podobne do zeolitów posiadające w strukturze pory i kanały o dobrze zdefiniowanej wielkości. Najściślejsze mają pory o średnicy 3,4 i 5 Angstremów, czyli odpowiednio 0,3; 0,4 i 0,5 nanometra. Większe pory mają sita z porowatego szkła od 10 Å w górę. Sita o porach od 20 do 500 Angstremów mogą być stworzone z krzemionki koloidalnej, a te o jeszcze większych z krzemionki mezoporowatej. Ponadto w podobnym celu użyty może być węgiel aktywowany i niektóre porowate tworzywa sztuczne.
Generalnie więc w większości są to materiały niereaktywne, o dobrej wytrzymałości chemicznej i termicznej.
Jakie jest główne zastosowanie? Osuszanie.
Cząsteczka wody jest bardzo mała, szerokość na jaką odsunięte są atomy tlenu to 1,6 A, dlatego dość łatwo wchodzi w kanały porowatego materiału. Dodatkowo glinokrzemiany dość chętnie wiążą wodę czy to wiązaniami wodorowymi w grupach Si-H czy to przez przyciąganie do jonów. Dzięki temu po dodaniu sit do materiału normalnie słabo adsorbowanego, jak olej mineralny czy gaz ziemny, woda jest skutecznie odciągana.
Najdrobniejsze sita 3A mogą odciągać wodę od alkoholu i rozpuszczalników, których cząsteczki są zbyt duże aby wnikać w ich strukturę. Jest to jeden ze stosunkowo prostych sposobów uzyskania bezwodnego alkoholu - zwykle sprzedawany 95% alkohol zasypuje się odpowiednią ilością sit (pochłaniają wodę do 15-20% masy własnej) i zostawia w szczelnym pojemniku na kilkanaście godzin, potem odsącza lub destyluje aby oddzielić od pojawiającej się mineralnej zawiesiny.
Większe sita 4A i 5A mogą też wchłaniać alkohol etylowy, etan, eten i bywają używane do oddzielenia ich śladów z wielkocząsteczkowych rozpuszczalników. Chętnie korzysta z nich przemysł rafineryjny. Służą do usuwania z gazu ziemnego wody, kwasu mrówkowego, tlenków siarki, siarkowodoru a w odpowiednich warunkach też dwutlenku węgla. Jest to o tyle ważne, że nawet niewielkie ilości wody mogą zapychać instalacje podczas przetaczania gazu skroplonego, oraz wpływają korozyjnie na gazociągi.
Odmiany o porach 10-15 A mogą oddzielać węglowodory aromatyczne od ciekłych węglowodorów, a także służyć do rozdziału gazów. Odmiany mezoporowe, powyżej 100 A, mogą być użyte do rozdziału biomolekuł i krótkich peptydów.
Sita o odpowiednio dobranym składzie działają też jako wymieniacze jonowe, mogą pochłaniać z wody i ścieków metale ciężkie, chętnie też chłoną amoniak i jony amonowe.
Obok granulek żelu krzemionkowego sita molekularne są też jednymi z najczęściej używanych pochłaniaczy wilgoci w opakowaniach leków, żywności i elektroniki.
Jako materiał dla wytwarzania sit molekularnych najczęściej używa się zeolitów, bądź to naturalnych bądź otrzymywanych sztucznie. Sama nazwa "zeolit" znaczy dosłownie "wrzący kamień" i wywodzi się z ciekawej właściwości zbitych form. Aby z uwodnionego zeolitu usunąć wodę musimy go ogrzewać do odpowiednio dużej temperatury przez pewien czas. Jak zauważył pod koniec XIX wieku szwedzki mineralog Axel Frederik Cronstedt, proces odwrotny po polaniu wodą dobrze wysuszonego minerału przebiegał z wydzieleniem na tyle dużej ilości ciepła, że powstawała para a woda którą go polano zapieniła się.
Zeolity powstają najczęściej w skałach wulkanicznych i piroklastycznych w wyniku reakcji roztworów bogatych w krzem, glin i kationy alkaliczne z zasadami, często w warunkach hydrotermalnych. Krystalizują w pustkach skalnych i kanałach tworząc skupienia włókniste, szczotkowate lub kuliste. Mogą też powstawać jako spoiwo między ziarnami osadów zagrzebanych na dużej głębokości. Obecnie najwięcej zeolitów wydobywa się w Chinach, Korei Południowej i Japonii, w Europie najwięcej wydobywa ich Słowacja.
Jednak naturalne zeolity nie nadają się do niektórych zastosowań, głównie z powodu obecności zanieczyszczeń, stąd też zaczęto produkować je syntetycznie.
Produkcja generalnie rzecz biorąc jest dość prosta - strukturalnie są to klatkowe glinokrzemiany z domieszką kationów metali alkalicznych. Do syntezy bierze się więc żel wodny zawierający tlenek glinu i łączy ze szkłem wodnym czyli rozpuszczalnym w wodzie krzemianem sodu. Mieszaninę alkalizuje się wodorotlenkiem sodu lub potasu aby spolimeryzować powstające glinokrzemiany. Wielkość i układ porów zależy od rodzaju kationu alkalicznego, stającego się "rusztowaniem" dla pierścienia glinokrzemianowego odpowiedniej wielkości, toteż mieszanina domieszkowana jest odpowiednimi kationami, w tym także organicznymi jak tetraetyloamoniowy.
Teraz gęstniejący żel jest mieszany i ogrzewany w odpowiednich warunkach. Przy czym te "odpowiednie warunki" to w istocie klucz do sukcesu. Proces nie może przebiegać zbyt szybko bo powstaną nam po prostu zbite kryształy. Zależnie od stosunku krzemu do glinu, obecności metali alkalicznych, odczynu mieszaniny, rodzaju kationu stanowiącego wzorzec, szybkości procesowania, temperatury i innych czynników otrzymujemy zeolity o różnych strukturach. Jak na razie opisano ponad 250 struktur zeolitowych a wciąż nie jest to koniec.
Atomy podczas krystalizacji organizują się w klatkowate "bloczki" z których układana jest sieć. Połączone wielościany o strukturze sodalitu tworzą pomiędzy sobą kanały złożone z pierścieni. Rodzaj struktury determinuje wielkość pierścieni a co za tym idzie wielkość porów.
Po przeprowadzeniu procesu w "odpowiednich" warunkach otrzymujemy wilgotną masę drobnych cząstek zeolitu, która następnie jest granulowana lub wyciskana do formy pręcików i suszona.
Oprócz usuwania wody i innych małocząsteczkowych zanieczyszczeń zeolity znalazły szerokie zastosowanie w zmiękczaniu wody, mogą bowiem pochłaniać i wiązać jony wapnia i magnezu. Akwaryści powinni kojarzyć zeolity w takim zastosowaniu. Znaleźć je możemy w ekologicznych proszkach do prania, gdzie zastępują używane zwykle do zmiękczania fosforany, które trafiając do ścieków wywoływały przenawożenie wód i zakwity glonów. Granulki sit molekularnych są też używane do wzbogacania podłoża, długo bowiem trzymają wilgoć oraz mogą stopniowo uwalniać wchłonięte nawozy.
Inne zastosowanie to katalizatory zwłaszcza w krakingu ropy naftowej. Podejmowane są też próby użycia jako nośniki leków. Ze względu na wysoką energię hydratacji i możliwość zregenerowania wilgotnych sit, zaczęto używać ich także do długotrwałego przechowywania ciepła - sita są suszone przy pomocy ciepła na przykład z kolektorów słonecznych. Zamknięte w szczelnym opakowaniu nie tracą mogą być przechowywane dość długo, a pod wpływem wody ponownie wydzielają ciepło.
Jak jednak mają się te właściwości do zastosowania sit w laboratoriach podczas ogrzewania cieczy?
Stan wrzenia to sytuacja gdy ciecz pod wpływem wysokiej temperatury jest w stanie przechodzić w parę w całej objętości, wytwarzając bąble gazu. W praktyce jednak powstanie pęcherzyka ot tak wewnątrz cieczy jest mało prawdopodobne. Najpierw cząsteczki cieczy muszą zostać rozepchane na boki, gdy utworzy się faza gazowa na pęcherzyk działa zarówno ciśnienie hydrostatyczne jak i napięcie powierzchniowe. W efekcie bardzo małe pęcherzyki odczuwają ciśnienie większe od atmosferycznego, to hamuje parowanie wody do wnętrza pęcherzyka a ten może zaniknąć zanim nie stanie się na tyle duży aby wypłynąć na powierzchnię.
Sytuacja zostaje bardzo ułatwiona gdy podgrzana woda zetknie się z nierówną, chropowatą powierzchnią, wtedy ciśnienie działa na powstający przylegający pęcherzyk tylko od jednej strony, dzięki czemu łatwiej jest mu urosnąć. Analogiczna sytuacja dotyczy wydzielania się gazu z wody mineralnej - pęcherzyki powstają na ściankach i wybiegają stale z pewnych sprzyjających punktów.
Inną sytuacją która bardzo ułatwia wrzenie są bąbelki powietrza, stanowiące "zarodek" bąbelków pary. W przypadku materiałów porowatych mogą być to zarówno bąbelki przyczepione do nierównej powierzchni jak i zawarte wewnątrz materiału, stąd właśnie użycie różnych porowatych materiałów w charakterze "kamyków wrzennych". Mogą być to kawałki porcelany (na pracowni magisterskiej używałem drobnych okruchów rozbitej filiżanki), mogą to być granulki ceramiczne i mogą to być też sita molekularne, które zawsze gdzieś tam stoją na pracowni.
A dlaczego w takim razie musimy ułatwiać wrzenie?
Cóż, to utrudnienie powstawania pierwszych pęcherzyków powoduje, że gdy podgrzewana ciecz jest bardzo czysta i ogrzewamy ją w gładkim naczyniu, możliwe staje się jej przegrzanie powyżej temperatury normalnego wrzenia. Wodę można w ten sposób ogrzać do temperatury 120-130 *C, w sprzyjających warunkach i przy szybkim ogrzewaniu aż do 160 stopni.
W takiej sytuacji drobne zaburzenie, w rodzaju pierwszego pęcherzyka, zamieszania czy wibracji może spowodować dość gwałtowne zawrzenie, często połączone ze spienieniem się i wychlapaniem naszej cieczy. Pół biedy gdy ogrzewana mieszanina pójdzie chłodnicą, ale równie dobrze może prysnąć na rękę eksperymentatora. Problem ten upowszechnił się w ostatnim czasie wraz z mikrofalówkami - wiele osób używa ich do podgrzewania wody na herbatę. Jeśli użyją do tego czystej wody i wstawią wodę w gładkiej szklance, woda może nie zawrzeć mimo, że będzie bardzo gorąca. Wrzucenie do niej teraz herbaty i cukru może spowodować wytryśnięcie z kubka i poparzenia.
Bez kamyków wrzennych ciecze wrą nieregularnie, z uderzeniami gwałtowniejszych wrzeń co jakiś czas, i właśnie dlatego dla bezpieczeństwa i większej kontroli nad procesem należy wrzucać do kolby dwie-trzy granulki sit lub kawałki porcelany.
Sita molekularne to granulki o tak dobranym składzie i metodzie produkcji, że są bardzo porowate, zaś te pory mają określoną wielkość pozwalającą wnikać wgłąb materiału cząsteczkom odpowiednio małym, zatrzymując cząsteczki za duże. Po prostu tylko cząsteczki mniejsze niż średnica poru będą w niego wchodzić i tym samym będą "odsiewane" od większych. Z tego też powodu najczęściej używa się sit do oddzielania niepożądanych, małocząsteczkowych zanieczyszczeń od cieczy i gazów.
Materiałem budującym sito molekularne są najczęściej syntetyczne minerały podobne do zeolitów posiadające w strukturze pory i kanały o dobrze zdefiniowanej wielkości. Najściślejsze mają pory o średnicy 3,4 i 5 Angstremów, czyli odpowiednio 0,3; 0,4 i 0,5 nanometra. Większe pory mają sita z porowatego szkła od 10 Å w górę. Sita o porach od 20 do 500 Angstremów mogą być stworzone z krzemionki koloidalnej, a te o jeszcze większych z krzemionki mezoporowatej. Ponadto w podobnym celu użyty może być węgiel aktywowany i niektóre porowate tworzywa sztuczne.
Generalnie więc w większości są to materiały niereaktywne, o dobrej wytrzymałości chemicznej i termicznej.
Jakie jest główne zastosowanie? Osuszanie.
Cząsteczka wody jest bardzo mała, szerokość na jaką odsunięte są atomy tlenu to 1,6 A, dlatego dość łatwo wchodzi w kanały porowatego materiału. Dodatkowo glinokrzemiany dość chętnie wiążą wodę czy to wiązaniami wodorowymi w grupach Si-H czy to przez przyciąganie do jonów. Dzięki temu po dodaniu sit do materiału normalnie słabo adsorbowanego, jak olej mineralny czy gaz ziemny, woda jest skutecznie odciągana.
Najdrobniejsze sita 3A mogą odciągać wodę od alkoholu i rozpuszczalników, których cząsteczki są zbyt duże aby wnikać w ich strukturę. Jest to jeden ze stosunkowo prostych sposobów uzyskania bezwodnego alkoholu - zwykle sprzedawany 95% alkohol zasypuje się odpowiednią ilością sit (pochłaniają wodę do 15-20% masy własnej) i zostawia w szczelnym pojemniku na kilkanaście godzin, potem odsącza lub destyluje aby oddzielić od pojawiającej się mineralnej zawiesiny.
Większe sita 4A i 5A mogą też wchłaniać alkohol etylowy, etan, eten i bywają używane do oddzielenia ich śladów z wielkocząsteczkowych rozpuszczalników. Chętnie korzysta z nich przemysł rafineryjny. Służą do usuwania z gazu ziemnego wody, kwasu mrówkowego, tlenków siarki, siarkowodoru a w odpowiednich warunkach też dwutlenku węgla. Jest to o tyle ważne, że nawet niewielkie ilości wody mogą zapychać instalacje podczas przetaczania gazu skroplonego, oraz wpływają korozyjnie na gazociągi.
Odmiany o porach 10-15 A mogą oddzielać węglowodory aromatyczne od ciekłych węglowodorów, a także służyć do rozdziału gazów. Odmiany mezoporowe, powyżej 100 A, mogą być użyte do rozdziału biomolekuł i krótkich peptydów.
Sita o odpowiednio dobranym składzie działają też jako wymieniacze jonowe, mogą pochłaniać z wody i ścieków metale ciężkie, chętnie też chłoną amoniak i jony amonowe.
Obok granulek żelu krzemionkowego sita molekularne są też jednymi z najczęściej używanych pochłaniaczy wilgoci w opakowaniach leków, żywności i elektroniki.
Jako materiał dla wytwarzania sit molekularnych najczęściej używa się zeolitów, bądź to naturalnych bądź otrzymywanych sztucznie. Sama nazwa "zeolit" znaczy dosłownie "wrzący kamień" i wywodzi się z ciekawej właściwości zbitych form. Aby z uwodnionego zeolitu usunąć wodę musimy go ogrzewać do odpowiednio dużej temperatury przez pewien czas. Jak zauważył pod koniec XIX wieku szwedzki mineralog Axel Frederik Cronstedt, proces odwrotny po polaniu wodą dobrze wysuszonego minerału przebiegał z wydzieleniem na tyle dużej ilości ciepła, że powstawała para a woda którą go polano zapieniła się.
Zeolity powstają najczęściej w skałach wulkanicznych i piroklastycznych w wyniku reakcji roztworów bogatych w krzem, glin i kationy alkaliczne z zasadami, często w warunkach hydrotermalnych. Krystalizują w pustkach skalnych i kanałach tworząc skupienia włókniste, szczotkowate lub kuliste. Mogą też powstawać jako spoiwo między ziarnami osadów zagrzebanych na dużej głębokości. Obecnie najwięcej zeolitów wydobywa się w Chinach, Korei Południowej i Japonii, w Europie najwięcej wydobywa ich Słowacja.
Jednak naturalne zeolity nie nadają się do niektórych zastosowań, głównie z powodu obecności zanieczyszczeń, stąd też zaczęto produkować je syntetycznie.
Produkcja generalnie rzecz biorąc jest dość prosta - strukturalnie są to klatkowe glinokrzemiany z domieszką kationów metali alkalicznych. Do syntezy bierze się więc żel wodny zawierający tlenek glinu i łączy ze szkłem wodnym czyli rozpuszczalnym w wodzie krzemianem sodu. Mieszaninę alkalizuje się wodorotlenkiem sodu lub potasu aby spolimeryzować powstające glinokrzemiany. Wielkość i układ porów zależy od rodzaju kationu alkalicznego, stającego się "rusztowaniem" dla pierścienia glinokrzemianowego odpowiedniej wielkości, toteż mieszanina domieszkowana jest odpowiednimi kationami, w tym także organicznymi jak tetraetyloamoniowy.
Teraz gęstniejący żel jest mieszany i ogrzewany w odpowiednich warunkach. Przy czym te "odpowiednie warunki" to w istocie klucz do sukcesu. Proces nie może przebiegać zbyt szybko bo powstaną nam po prostu zbite kryształy. Zależnie od stosunku krzemu do glinu, obecności metali alkalicznych, odczynu mieszaniny, rodzaju kationu stanowiącego wzorzec, szybkości procesowania, temperatury i innych czynników otrzymujemy zeolity o różnych strukturach. Jak na razie opisano ponad 250 struktur zeolitowych a wciąż nie jest to koniec.
Atomy podczas krystalizacji organizują się w klatkowate "bloczki" z których układana jest sieć. Połączone wielościany o strukturze sodalitu tworzą pomiędzy sobą kanały złożone z pierścieni. Rodzaj struktury determinuje wielkość pierścieni a co za tym idzie wielkość porów.
Po przeprowadzeniu procesu w "odpowiednich" warunkach otrzymujemy wilgotną masę drobnych cząstek zeolitu, która następnie jest granulowana lub wyciskana do formy pręcików i suszona.
Oprócz usuwania wody i innych małocząsteczkowych zanieczyszczeń zeolity znalazły szerokie zastosowanie w zmiękczaniu wody, mogą bowiem pochłaniać i wiązać jony wapnia i magnezu. Akwaryści powinni kojarzyć zeolity w takim zastosowaniu. Znaleźć je możemy w ekologicznych proszkach do prania, gdzie zastępują używane zwykle do zmiękczania fosforany, które trafiając do ścieków wywoływały przenawożenie wód i zakwity glonów. Granulki sit molekularnych są też używane do wzbogacania podłoża, długo bowiem trzymają wilgoć oraz mogą stopniowo uwalniać wchłonięte nawozy.
Inne zastosowanie to katalizatory zwłaszcza w krakingu ropy naftowej. Podejmowane są też próby użycia jako nośniki leków. Ze względu na wysoką energię hydratacji i możliwość zregenerowania wilgotnych sit, zaczęto używać ich także do długotrwałego przechowywania ciepła - sita są suszone przy pomocy ciepła na przykład z kolektorów słonecznych. Zamknięte w szczelnym opakowaniu nie tracą mogą być przechowywane dość długo, a pod wpływem wody ponownie wydzielają ciepło.
Jak jednak mają się te właściwości do zastosowania sit w laboratoriach podczas ogrzewania cieczy?
Stan wrzenia to sytuacja gdy ciecz pod wpływem wysokiej temperatury jest w stanie przechodzić w parę w całej objętości, wytwarzając bąble gazu. W praktyce jednak powstanie pęcherzyka ot tak wewnątrz cieczy jest mało prawdopodobne. Najpierw cząsteczki cieczy muszą zostać rozepchane na boki, gdy utworzy się faza gazowa na pęcherzyk działa zarówno ciśnienie hydrostatyczne jak i napięcie powierzchniowe. W efekcie bardzo małe pęcherzyki odczuwają ciśnienie większe od atmosferycznego, to hamuje parowanie wody do wnętrza pęcherzyka a ten może zaniknąć zanim nie stanie się na tyle duży aby wypłynąć na powierzchnię.
Sytuacja zostaje bardzo ułatwiona gdy podgrzana woda zetknie się z nierówną, chropowatą powierzchnią, wtedy ciśnienie działa na powstający przylegający pęcherzyk tylko od jednej strony, dzięki czemu łatwiej jest mu urosnąć. Analogiczna sytuacja dotyczy wydzielania się gazu z wody mineralnej - pęcherzyki powstają na ściankach i wybiegają stale z pewnych sprzyjających punktów.
Inną sytuacją która bardzo ułatwia wrzenie są bąbelki powietrza, stanowiące "zarodek" bąbelków pary. W przypadku materiałów porowatych mogą być to zarówno bąbelki przyczepione do nierównej powierzchni jak i zawarte wewnątrz materiału, stąd właśnie użycie różnych porowatych materiałów w charakterze "kamyków wrzennych". Mogą być to kawałki porcelany (na pracowni magisterskiej używałem drobnych okruchów rozbitej filiżanki), mogą to być granulki ceramiczne i mogą to być też sita molekularne, które zawsze gdzieś tam stoją na pracowni.
A dlaczego w takim razie musimy ułatwiać wrzenie?
Cóż, to utrudnienie powstawania pierwszych pęcherzyków powoduje, że gdy podgrzewana ciecz jest bardzo czysta i ogrzewamy ją w gładkim naczyniu, możliwe staje się jej przegrzanie powyżej temperatury normalnego wrzenia. Wodę można w ten sposób ogrzać do temperatury 120-130 *C, w sprzyjających warunkach i przy szybkim ogrzewaniu aż do 160 stopni.
W takiej sytuacji drobne zaburzenie, w rodzaju pierwszego pęcherzyka, zamieszania czy wibracji może spowodować dość gwałtowne zawrzenie, często połączone ze spienieniem się i wychlapaniem naszej cieczy. Pół biedy gdy ogrzewana mieszanina pójdzie chłodnicą, ale równie dobrze może prysnąć na rękę eksperymentatora. Problem ten upowszechnił się w ostatnim czasie wraz z mikrofalówkami - wiele osób używa ich do podgrzewania wody na herbatę. Jeśli użyją do tego czystej wody i wstawią wodę w gładkiej szklance, woda może nie zawrzeć mimo, że będzie bardzo gorąca. Wrzucenie do niej teraz herbaty i cukru może spowodować wytryśnięcie z kubka i poparzenia.
Bez kamyków wrzennych ciecze wrą nieregularnie, z uderzeniami gwałtowniejszych wrzeń co jakiś czas, i właśnie dlatego dla bezpieczeństwa i większej kontroli nad procesem należy wrzucać do kolby dwie-trzy granulki sit lub kawałki porcelany.
sobota, 30 kwietnia 2016
Chemiczne wieści (6.)
Dzisiejszy odcinek wypadł bardziej kwantowo-fizyczny. Bo tak.
Czterowymiarowy kryształ?
Tlenki żelaza choć znane od wieków, wciąż budzą zainteresowanie technologów i fizyków i niekiedy nadal daje się odkryć nowe, ciekawe ich właściwości. W 2011 roku doniesiono o odkryciu, że mieszanina tleneku żelaza II i żelaza II/III (FeO+Fe3O4) poddany działaniu wysokiego ciśnienia zamienia się w unikalny tlenek Fe4O5. Faza ta wykazywała silne właściwości ferrimagnetyczne podobne do magnetytu.
Wiadomo było już, że magnetyt w niskich temperaturach ulega przejściu fazowemu II rodzaju, w wyniku którego atomy o różnym stopniu utlenienia tworzą równoległe struktury (Wervey phase). W typowym magnetycie atomy żelaza II i żelaza III są przemieszane statystycznie, nie tworząc regularnych struktur, zaś elektrony mogą przeskakiwać od jednego jonu do drugiego dzięki czemu materiał wykazuje przewodność elektryczną. Po przejściu fazowym następuje samoorganizacja - atomy o danym stopniu utlenienia tworzą w sieci krystalicznej struktury liniowe lub płaszczyzny.
W przypadku magnetytu wiązało się to z utrudnieniem ruchu elektronów i wzrostem oporu, ale w innych materiałach może to doprowadzać do pojawiania się nadprzewodnictwa, ferromagnetyczności lub gigantycznego magnetooporu stosowanego dziś w elektronicznych nośnikach danych.
Nic też dziwnego, że postanowiono sprawdzić czy w podobny sposób zachowa się nowy materiał. Rosyjski zespół stwierdził zachodzenie podobnej przemiany poniżej temperatury 150 K. Materiał zmieniał właściwości magnetyczne a opór elektryczny rósł o dwa rzędy wielkości. Problematyczne okazało się natomiast przypisanie mu określonej struktury. Zakładano, że mamy do czynienia z takim samym zjawiskiem organizacji stopni utlenienia, ale wyniki pomiarów nie dawały się złożyć w prosty model. Wyglądało na to, że struktury atomów o jednakowym stopniu utlenienia falują i statystycznie może się wydawać, że są rozmieszczone przypadkowo.
Porządek pojawił się dopiero gdy symulowano rozkład ładunków w przestrzeni czterowymiarowej. Z tego też powodu informacje o tym odkryciu często powtarzają że odkryto "czterowymiarowy kryształ". W tym przypadku chodzi jednak jedynie o matematyczny model rozkładu ładunków, opisywany funkcją nie dającą rozwiązania w normalnej przestrzeni.[1]
Kwantowa woda
Nietypowe zachowanie się wody zamkniętej w wąskich kapilarach odkryli właśnie amerykańscy badacze. Badali oni właściwości wody w kapilarnych kanałach struktury berylu, ważnego minerału magmowego, przy pomocy techniki rozpraszania neutronów. Średnica kanału na tyle ograniczała cząsteczki, że w przekroju mieściła się tylko jedna. Zamiast jednak struktur cząsteczek uzyskali nietypowe, heksagonalne pierścienie. Sygnał obecności atomu tlenu pojawiał się w sześciu miejscach, a każdego z dwóch wodorów także w sześciu. Ponieważ zaś sześć cząsteczek by się w przekroju kanału nie zmieściło, zaś dla tej jednej bariera energetyczna obrotu jest zbyt duża aby wynik wywoływało ustawianie się jej w różnych pozycjach w trakcie badania, jako wyjaśnienie tych obserwacji zaproponowali nietypowy model - jest to w istocie nadal jedna cząsteczka, tylko kwantowo interferująca sama ze sobą.[2]
Jedną z konsekwencji teorii kwantowej była hipoteza de Brogile'a, że każdej cząstce materialnej można przypisać właściwości falowe które wpływają na jej oddziaływania i zachowania. Za sprawą tych właściwości obserwujemy dyfrakcję cząstek na dwóch szczelinach lub siatkach dyfrakcyjnych, powodującą że prawdopodobieństwo znalezienia się cząstki z danym miejscu zależy od wzoru jej "fali materii". Przepuszczając odpowiednio dużo cząstek przez szczeliny i badając w jakie miejsce na detektorze uderzą, otrzymujemy w końcu wzór właściwy interferującym falom.
Jedną ze szczególnie interesujących konsekwencji tego zjawiska są kwantowe miraże, czyli wzory oddziaływań, jakie tworzy cząstka zamknięta w niewiele od niej większym ograniczeniu przestrzennym. Wewnątrz okręgu ułożonego z atomów na podłożu powstaje wzór podobny do fal na wodzie z centralną górką stanowiącą złudzenie istnienia tam jakiegoś atomu:
Po umieszczeniu atomu w jednym z ognisk elipsy, w drugim ognisku pojawia się jego słaby miraż:
Jak się wydaje w opisywanym przypadku zachodzi coś podobnego. Cząsteczka wody wewnątrz niewiele od niej większego, heksagonalnego kanału interferuje. Próby określenia położenia jej atomów kończą się więc stwierdzeniem sześciokątnego wzoru na który składają się zagęszczenia fal prawdopodobieństwa obecności atomu w tej niewielkiej przestrzeni. Poprzednio udało się zmierzyć podobny efekt dla atomów wodoru, ale woda to już zupełnie inna sprawa. Pory tych rozmiarów (4 A) występują w minerałach budujących skorupę ziemską, zatem kwantowy efekt może mieć znaczenie dla modelowania właściwości gleby i skał.
Nowy rodzaj wiązania?
Obliczenia kwantowomechaniczne dokonane przez badaczy z amerykańskiego Southern Methodist University w Dallas wskazują na istnienie jeszcze jednego rzadkiego rodzaju wiązania chemicznego - jest to odmiana wiązania wodorowego z oddziaływaniem między atomem wodoru połączonym z borem a układem aromatycznym. Znane były tego rodzaju połączenia dla układów w których wodór połączony był z węglem i azotem, mające pewne znaczenie w biologii molekularnej, jednak dotychczas wydawało się, że nie powinny zachodzić dla boranów. Bor ma mniejszą elektroujemność niż wodór, toteż wiązanie między nimi jest tak spolaryzowane, że na protonie pojawia się lekki ładunek ujemny. Bardziej naładowany elektronami wodór powinien być więc odpychany przez pełen elektronów pierścień aromatyczny.
Z drugiej strony związki boru są często połączeniami elektrono-deficytowymi, z pojawiającymi się wiązaniami trójcentrowymi a w takiej sytuacji na wodorze powinien pojawić się cząstkowy ładunek dodatni.
Wedle ostatnich wyliczeń diborany oraz karborany powinny na tej zasadzie tworzyć słabe wiązania B-H--Ar o długości 2,65-2,50 A . Pewnym potwierdzeniem tych przewidywań może być struktura pewnego kompleksu irydu, w którym między wodorem grupy karboranowej a pierścieniem z grupy trifenylometylowej występuje trudne do wytłumaczenia w inny sposób zbliżenie na zbliżoną odległość.[3]
---------
[1] Ovsyannikov V. S.; Charge-ordering transition in iron oxide Fe4O5 involving competing dimer and trimer formation. Nature Chemistry, 2016; DOI: 10.1038/NCHEM.2478
[2] Kolesnikov A.I. et al. Quantum Tunneling of Water in Beryl: A New State of the Water Molecule. Physical Review Letters, 2016; 116 (16) DOI: 10.1103/PhysRevLett.116.167802
[3] X Zhang et al, B–H···π Interaction: A New Type of Nonclassical Hydrogen Bonding
J. Am. Chem. Soc., 2016, DOI: 10.1021/jacs.6b01249
Czterowymiarowy kryształ?
Tlenki żelaza choć znane od wieków, wciąż budzą zainteresowanie technologów i fizyków i niekiedy nadal daje się odkryć nowe, ciekawe ich właściwości. W 2011 roku doniesiono o odkryciu, że mieszanina tleneku żelaza II i żelaza II/III (FeO+Fe3O4) poddany działaniu wysokiego ciśnienia zamienia się w unikalny tlenek Fe4O5. Faza ta wykazywała silne właściwości ferrimagnetyczne podobne do magnetytu.
Wiadomo było już, że magnetyt w niskich temperaturach ulega przejściu fazowemu II rodzaju, w wyniku którego atomy o różnym stopniu utlenienia tworzą równoległe struktury (Wervey phase). W typowym magnetycie atomy żelaza II i żelaza III są przemieszane statystycznie, nie tworząc regularnych struktur, zaś elektrony mogą przeskakiwać od jednego jonu do drugiego dzięki czemu materiał wykazuje przewodność elektryczną. Po przejściu fazowym następuje samoorganizacja - atomy o danym stopniu utlenienia tworzą w sieci krystalicznej struktury liniowe lub płaszczyzny.
W przypadku magnetytu wiązało się to z utrudnieniem ruchu elektronów i wzrostem oporu, ale w innych materiałach może to doprowadzać do pojawiania się nadprzewodnictwa, ferromagnetyczności lub gigantycznego magnetooporu stosowanego dziś w elektronicznych nośnikach danych.
Nic też dziwnego, że postanowiono sprawdzić czy w podobny sposób zachowa się nowy materiał. Rosyjski zespół stwierdził zachodzenie podobnej przemiany poniżej temperatury 150 K. Materiał zmieniał właściwości magnetyczne a opór elektryczny rósł o dwa rzędy wielkości. Problematyczne okazało się natomiast przypisanie mu określonej struktury. Zakładano, że mamy do czynienia z takim samym zjawiskiem organizacji stopni utlenienia, ale wyniki pomiarów nie dawały się złożyć w prosty model. Wyglądało na to, że struktury atomów o jednakowym stopniu utlenienia falują i statystycznie może się wydawać, że są rozmieszczone przypadkowo.
Porządek pojawił się dopiero gdy symulowano rozkład ładunków w przestrzeni czterowymiarowej. Z tego też powodu informacje o tym odkryciu często powtarzają że odkryto "czterowymiarowy kryształ". W tym przypadku chodzi jednak jedynie o matematyczny model rozkładu ładunków, opisywany funkcją nie dającą rozwiązania w normalnej przestrzeni.[1]
Kwantowa woda
Nietypowe zachowanie się wody zamkniętej w wąskich kapilarach odkryli właśnie amerykańscy badacze. Badali oni właściwości wody w kapilarnych kanałach struktury berylu, ważnego minerału magmowego, przy pomocy techniki rozpraszania neutronów. Średnica kanału na tyle ograniczała cząsteczki, że w przekroju mieściła się tylko jedna. Zamiast jednak struktur cząsteczek uzyskali nietypowe, heksagonalne pierścienie. Sygnał obecności atomu tlenu pojawiał się w sześciu miejscach, a każdego z dwóch wodorów także w sześciu. Ponieważ zaś sześć cząsteczek by się w przekroju kanału nie zmieściło, zaś dla tej jednej bariera energetyczna obrotu jest zbyt duża aby wynik wywoływało ustawianie się jej w różnych pozycjach w trakcie badania, jako wyjaśnienie tych obserwacji zaproponowali nietypowy model - jest to w istocie nadal jedna cząsteczka, tylko kwantowo interferująca sama ze sobą.[2]
Jedną z konsekwencji teorii kwantowej była hipoteza de Brogile'a, że każdej cząstce materialnej można przypisać właściwości falowe które wpływają na jej oddziaływania i zachowania. Za sprawą tych właściwości obserwujemy dyfrakcję cząstek na dwóch szczelinach lub siatkach dyfrakcyjnych, powodującą że prawdopodobieństwo znalezienia się cząstki z danym miejscu zależy od wzoru jej "fali materii". Przepuszczając odpowiednio dużo cząstek przez szczeliny i badając w jakie miejsce na detektorze uderzą, otrzymujemy w końcu wzór właściwy interferującym falom.
Jedną ze szczególnie interesujących konsekwencji tego zjawiska są kwantowe miraże, czyli wzory oddziaływań, jakie tworzy cząstka zamknięta w niewiele od niej większym ograniczeniu przestrzennym. Wewnątrz okręgu ułożonego z atomów na podłożu powstaje wzór podobny do fal na wodzie z centralną górką stanowiącą złudzenie istnienia tam jakiegoś atomu:
Po umieszczeniu atomu w jednym z ognisk elipsy, w drugim ognisku pojawia się jego słaby miraż:
Jak się wydaje w opisywanym przypadku zachodzi coś podobnego. Cząsteczka wody wewnątrz niewiele od niej większego, heksagonalnego kanału interferuje. Próby określenia położenia jej atomów kończą się więc stwierdzeniem sześciokątnego wzoru na który składają się zagęszczenia fal prawdopodobieństwa obecności atomu w tej niewielkiej przestrzeni. Poprzednio udało się zmierzyć podobny efekt dla atomów wodoru, ale woda to już zupełnie inna sprawa. Pory tych rozmiarów (4 A) występują w minerałach budujących skorupę ziemską, zatem kwantowy efekt może mieć znaczenie dla modelowania właściwości gleby i skał.
Nowy rodzaj wiązania?
Obliczenia kwantowomechaniczne dokonane przez badaczy z amerykańskiego Southern Methodist University w Dallas wskazują na istnienie jeszcze jednego rzadkiego rodzaju wiązania chemicznego - jest to odmiana wiązania wodorowego z oddziaływaniem między atomem wodoru połączonym z borem a układem aromatycznym. Znane były tego rodzaju połączenia dla układów w których wodór połączony był z węglem i azotem, mające pewne znaczenie w biologii molekularnej, jednak dotychczas wydawało się, że nie powinny zachodzić dla boranów. Bor ma mniejszą elektroujemność niż wodór, toteż wiązanie między nimi jest tak spolaryzowane, że na protonie pojawia się lekki ładunek ujemny. Bardziej naładowany elektronami wodór powinien być więc odpychany przez pełen elektronów pierścień aromatyczny.
Z drugiej strony związki boru są często połączeniami elektrono-deficytowymi, z pojawiającymi się wiązaniami trójcentrowymi a w takiej sytuacji na wodorze powinien pojawić się cząstkowy ładunek dodatni.
 |
| @ American Chemical Society |
---------
[1] Ovsyannikov V. S.; Charge-ordering transition in iron oxide Fe4O5 involving competing dimer and trimer formation. Nature Chemistry, 2016; DOI: 10.1038/NCHEM.2478
[2] Kolesnikov A.I. et al. Quantum Tunneling of Water in Beryl: A New State of the Water Molecule. Physical Review Letters, 2016; 116 (16) DOI: 10.1103/PhysRevLett.116.167802
[3] X Zhang et al, B–H···π Interaction: A New Type of Nonclassical Hydrogen Bonding
J. Am. Chem. Soc., 2016, DOI: 10.1021/jacs.6b01249
środa, 9 marca 2016
Chemiczne wieści (5.)
Tlenek kryptonu możliwy
Jak to już kiedyś pisałem w artykule "Chemiczne mezalianse", wbrew powszechnemu mniemaniu gazy szlachetne są w stanie tworzyć związki chemiczne, poprzez tworzenie innych niż oktet struktur elektronowych. Są one oczywiście bardzo nietrwałe i niekiedy daje się je wytworzyć tylko w bardzo specyficznych warunkach. Dość dobrze poznana jest tu chemia ksenonu, tworzącego związek z silnym utleniaczem sześciofluorkiem platyny, oraz związki z tlenem w tym silnie utleniający kwas ksenonowy.
Chemia lżejszych gazów jest zdecydowanie uboższa, ze względu na obniżoną trwałość i rosnącą energię jonizacji. Znany jest jeden pełnoprawny związek argonu. W przypadku helu znane są pewne cząsteczki wzbudzone, ale wedle uznanej definicji za związek uznaje się cząsteczki w stanie podstawowym.
W przypadku kryptonu dość dobrze znany jest difluorek, pewne bardzo nietrwałe połączenia z cyjankami, trwały tylko pod bardzo wysokim ciśnieniem wodorek i kompleks z kwasem tellurofluorowym. Jak pokazały ostatnie symulacje polskich naukowców, do tej listy będzie trzeba niedługo dodać jeszcze tlenek.
Badacze z Instytutu Chemii Fizycznej PAN zaprezentowali wyniki obliczeń, wskazujące na możliwość wytworzenia stabilnego tlenku kryptonu przy użycia odpowiednio dużego, choć jak na warunki laboratoryjne, wcale nie tak gigantycznego ciśnienia. Pod naciskiem 3-5 milionów atmosfer, osiągalnym w kowadłach diamentowych, powinno być możliwe wytworzenie tlenku kryptonu (II), tworzącego w takich warunkach sieć krystaliczną z charakterystycznymi łańcuchami ...Kr-O-Kr-O... i będącego nieprzezroczystym izolatorem. Natomiast pod ciśnieniem 3,4 mln atmosfer powinno zachodzić formowanie się czterotlenku kryptonu, mającego być przewodnikiem o właściwościach metalicznych.
Związki te po otrzymaniu byłyby prawdopodobnie bardziej stabilne w niższych ciśnieniach, ale też zapewne i tak rozkładałyby się przy ciśnieniu normalnym, więc raczej nie dałoby się ich obejrzeć poza komorą wysokociśnieniową. W materiałach prasowych udostępnianych przez Instytut (IChF PAN jest jedną z nielicznych polskich instytucji naukowych, jakie regularnie przygotowują takie materiały dla dziennikarzy), badacze żartują, że wobec tego Superman nie ma się co obawiać, że tak otrzymany "niemal kryptonit" zdoła mu zaszkodzić. [1],[2]
Co mnie natomiast w tych materiałach nieco dziwi, to podkreślanie, że może to być "pierwszy trwały związek kryptonu". Może to być wynik niezgrabnego wytłumaczenia, że chodziło im o pierwszy związek tworzący jonową sieć krystaliczną, w odróżnieniu od wspomnianych cyjanków i fluorków, tworzących kryształ molekularny, z niepołączonymi cząsteczkami.
Są bowiem związki kryptonu, które zdecydowanie należałoby nazwać trwałymi. Difluorek kryptonu, który jest trwały w niskich temperaturach, jest w stanie utlenić złoto tworząc kompleks KrF[AuF6], który rozkłada się pod normalnym ciśnieniem dopiero w temperaturze 60 °C, toteż jest możliwe aby zobaczyć go w jakiejś próbówce. [3]
Tańszy i ekologiczny odzysk złota z elektroniki
Złoto bądź to w formie czystej, bądź to jako dodatek stopowy, jest chętnie używane w układach elektronicznych. Wprawdzie z oczywistych względów producenci starają się używać go jak najmniej, ale i tak na takie potrzeby zużywa się rocznie wiele ton. Z tego też powodu odzysk złota i innych cennych pierwiastków ze zużytej i uszkodzonej elektroniki, nadającej się już w zasadzie do wyrzucenia, stał się ważną i dość dochodową gałęzią przetwórstwa śmieci.
Oprócz specjalistycznych firm, takim odzyskiem zajmują się amatorsko różne prywatne osoby, mające dostęp do części elektronicznych, nie jest to jednak ani łatwe, ani bezpieczne. Układy elektroniczne składają się z części zawierających wiele różnorodnych materiałów, począwszy od tworzyw sztucznych, przez metale kolorowe jak miedź i cyna, metale ciężkie jak ołów, półmetale i ich związki jak metaliczny krzem, czy arsenek galu, a kończąc na szkle i materiałach ceramicznych. Usunięcie tego co niepotrzebne i pozostawienie tylko złota, srebra czy platyny nie jest proste, i często wymaga użycia dość agresywnych odczynników, jak kwasy utleniające czy ich mieszanki z silnymi utleniaczami, które roztwarzając metale wydzielają szkodliwe opary.
Nic więc dziwnego, że chemicy szukają metod pozwalających zrobić to samo prościej i bezpieczniej. Zespół badaczy z University of Saskatchewan, doniósł właśnie o odkryciu nowej techniki ekstrakcji złota z elektroniki. Uzyskany przez nich roztwór trawiący selektywnie roztwarza złoto, na oddzielenie tej samej ilości metalu potrzeba go mniejszą objętość niż takiej na przykład wody królewskiej, podczas procesu nie powstają szkodliwe opary a sam roztwór trawiący można regenerować.
Brzmi bardzo obiecująco. A jaki jest skład tej mieszanki?
Na razie nie ukazał się na ten temat artykuł naukowy, o wszystkim wiemy za sprawą materiałów przygotowanych dla mediów udostępnianych przez uniwersytet. Opis mieszanki trawiącej jest tam dość ogólny: czysty kwas octowy, drugi kwas i katalityczna ilość pewnego utleniacza. Uniwersytet stara się teraz o znalezienie inwestora który zastosowałby tą metodę na skalę przemysłową, więc zapewne metoda jest patentowana. Skoro informacja w ogóle się ukazała, procedura patentowa jest widocznie na tyle zaawansowana że już daje jakąś ochronę, ale najwyraźniej przed jej ukończeniem i ewentualnym wdrożeniem patentu nie chcą ujawniać szczegółów. Nic dziwnego - tańsza i bezpieczniejsza metoda odzysku może przynieść stosującej je firmie spore zyski, zaś udzielającemu patentu uniwersytetowi całkiem przyzwoite udziały.
Domyślać się możemy, że lodowaty kwas octowy jest tutaj rozpuszczalnikiem soli złota, że utleniacz utlenia złoto do soli, jaką tworzy ono z drugim kwasem. Ponieważ ilość utleniacza jest niewielka a on sam ma być regenerowalny, nie może to być utleniacz z którego podczas procesu powstają lotne tlenki. [4]
Nowa odmiana lodu?
Woda jest bardzo prostą ale zarazem niezwykle ciekawą substancją. Silne wiązania wodorowe modyfikują jej właściwości fizyczne, będąc przyczyną takich anomalii jak rozszerzanie się podczas krzepnięcia czy względnie, jak na tak lekką cząsteczkę, wysoka temperatura wrzenia.
Zamarzając tworzy lód o uporządkowanej strukturze krystalicznej. Jak jednak stwierdzono, lód ten może przybrać wiele form, różniących się sposobem upakowania cząsteczek.
 |
| Lód Ih powstający w zwykłych warunkach zamarzania |
Obecnie znanych jest 17 odmian polimorficznych lodu, często pojawiają się one tylko w wyjątkowo specyficznych warunkach. Ostatnia to stworzony w 2004 roku lód XVI, o bardzo niskiej gęstości, otrzymany przez utworzenie klatratu neonu a następnie usunięcie szlachetnego gazu. Pozostała klatkowa struktura składała się z pustych wielościanów i była trwała pod odpowiednio niskim ciśnieniem. Lód XVI miał gęstość 0,81 g/cm3 był zatem znacznie lżejszy od zwykłego lodu.
Najnowsze obliczenia zespołu ze Stanów Zjednoczonych wskazują na możliwość jeszcze jednej formy, o jeszcze niższej gęstości. W warunkach niskiego ciśnienia i odpowiedniej temperatury tworzyć się powinna klatkowa struktura lodu o gęstości 0,59 g/cm3 a więc prawie dwa razy mniejszej od gęstości wody. [5]
Teraz tylko pytanie czy uda się ją stworzyć.
Australijscy aborygeni i chemicy pracują nad supercienkimi kondomami
Ta wiadomość ma szansę na nagrodę Ig-Nobla z Chemii.
Australijscy badacze z The University of Queensland, pracujący nad wzmocnieniem już znanego lateksu, postanowili zwiększyć jego wytrzymałość przy pomocy niewielkiego dodatku nanocelulozy. Szukając dobrego źródła materiału nawiązali współpracę z aborygenami z plemiona Indjalandji-Dhidhanu, którzy wskazali im pewien lokalny gatunek trawy z rodzaju Spinifex.
Pierwsze próby wypadły bardzo obiecująco - błony z lateksu z dodatkiem nanocelulozy miały większą wytrzymałość na rozciąganie i wytrzymywały większe ciśnienia.
Zdaniem badaczy pozwoli to na otrzymanie jeszcze cieńszych i dających bardziej naturalne doznania prezerwatyw... albo delikatniejszych rękawiczek. [6]
--------------
Źródła:
[1] Patryk Zaleski-Ejgierd, Pawel M. Lata. Krypton oxides under pressure. Scientific Reports, 2016; 6:
[2] Informacja prasowa IChF PAN "Superman może zacząć się bać: mamy przepis na (prawie) kryptonit!"
[3] John H. Holloway and Gary J. Schrobilgen; Krypton fluoride chemistry; a route to AuF5, KrF+AuF6–, Xe2F3+AuF6–, and NO+AuF6–: the KrF+–XeOF4 system, J. Chem. Soc., Chem. Commun., 1975, 623-624
[4] https://www.sciencedaily.com/releases/2016/01/160128122901.htm
[5] Y. Huang et al. A new phase diagram of water under negative pressure: The rise of the lowest-density clathrate s-III; Science Advances Vol 2, No. 2
[6] http://phys.org/news/2016-02-native-grass-key-super-thin-condoms.html
czwartek, 7 sierpnia 2014
Kwas co ma gaz
W letnie, upalne dni, najchętniej nic byśmy nie robili, tylko leżeli w cieniu i popijali coś chłodnego. Na przykład wodę. Taką gazowaną, z bąbelkami i szczypiącym, kwaśnym posmaku. I być może czasem zastanowi nas, jaki to gaz i jaki kwas...
Dwutlenek węgla jest bezbarwnym i w zasadzie bezwonnym gazem cięższym od powietrza, stanowiącym stale niewielki procent składu atmosfery. Został odkryty dosyć wcześnie - już w XVII wieku van Helmont zauważył, że jeśli masa popiołu po spaleniu węgla jest znacząco mniejsza od pierwotnej masy, to reszta musi ulegać zamianie w formę gazową. Ówcześni identyfikowali go z flogistonem - pierwiastkiem palności - i dalej się tą sprawą nie zajmowano. Dopiero w 1750 roku szkocki lekarz Joseph Black, znany też z badań nad ciepłem utajonym, poddał badaniom gaz powstający z potraktowania wapienia kwasem, stwierdzając, że jest różny od powietrza, ciężki i duszący, oraz że wytrąca osad z roztworu wapna gaszonego. Korzystając z tej ostatniej reakcji, stwierdził że występuje normalnie w powietrzu i w większych ilościach w tchnieniu zwierząt i ludzi. Późniejsi badacze doszli do tego, że gaz jest połączeniem tlenu i węgla i że reakcję czasem można odwrócić (przy spalaniu magnezu w dwutlenku węgla powstaje sadza), jednak dla nas istotniejsze jest odkrycie Josepha Priestly'a, trochę teologa a trochę przyrodnika-hobbysty, który badając przebieg fermentacji w miejscowym browarze, zainteresował się "zastałym powietrzem" - warstwą gazową nad fermentującą kadzią, uważaną za pracowników za niezdrową i od której zdychały myszy jeśli dostały się pod jej wpływ.
Eksperymentując, umieścił nad kadzią miskę z wodą, chcąc sprawdzić rozpuszczalność tego gazu. Po zlaniu musującego roztworu stwierdził, że woda nabrała przyjemnego, lekko kwaśnego posmaku, a nawet dał go spróbować znajomym, twierdząc że to orzeźwiający napój bez alkoholu. Kilka lat później opisał go w artykule, dodając przepis na sztuczne otrzymanie - po zwilżeniu kredy kwasem siarkowym, powstający gaz przeprowadzał rurką do wody i po przepuszczeniu większej ilości otrzymywał napój, który uważał za bardzo podobny do naturalnych wód mineralnych i polecał na szkorbut. W zasadzie jednak nie traktował odkrycia inaczej jak ciekawostki i nie sądził, że znajdzie zastosowanie. Tymczasem producenci wód mineralnych powinni mu postawić pomnik - odkrycie, że zwykła woda staje się smacznym napojem po rozpuszczeniu w niej pospolitego gazu, do dziś przynosi im ogromne zyski.
Pierwszym, który wpadł na to, że jest to znakomity pomysł na interes, był niejako Jacob Schweppe, który w roku 1783 założył firmę Schweppes, istniejącą zresztą do dziś, produkując wody gazowane mające naśladować wody mineralne z naturalnych źródeł. Nieco później dla polepszenia smaku, do nagazowanej wody zaczęto dodawać nieco sody oczyszczonej, tworząc napój nazywany odtąd wodą sodową. I tak zaczął się przemysł napojów gazowanych.
Szybko jednak chemicy zaczęli się zastanawiać, dlaczego po rozpuszczeniu gazu, woda staje się kwaśna. Musi powstawać jakiś kwas - uznali - i nazwali go kwasem węglowym. W polskiej nomenklaturze dwutlenek węgla zaczął być z tego powodu nazywany niedokwasem węglowym. Taki też stan rzeczy trwał przez długi czas, aż zaczęły się problemy z wyizolowaniem czy choćby wykryciem tego kwasu w wodzie. Badania absorpcji w podczerwieni nie wykryły aby występował w choćby najbardziej nasyconych roztworach. W zamian za to wykrywano jony węglanowe i wodorowęglanowe, stąd też powstała koncepcja wedle której kwas węglowy nie istnieje. Jeszcze ja w technikum byłem upominany aby nie zapisywać jego cząsteczki w równaniu rozpuszczania dwutlenku węgla.
Jest to w pewnym stopniu podobna sytuacja jak z "wodorotlenkiem amonu". Rozpuszczenie amoniaku w wodzie da nam roztwór o zasadowym odczynie, toteż postulowano powstawanie w wodzie wodorotlenku amonu i przez długi czas zapisywano go w ten sposób. Dopiero potem dokładne badania wykazały, że cząsteczka taka nie powstaje - woda wymienia się protonem z amoniakiem, i tworzy się osobny jon wodorotlenkowy i osobny amonowy pozostające w równowadze. Wydawało się zatem, że tu jest podobnie - dwutlenek łączy się z wodą biorąc tlen i wodór do utworzenia jonu wodorowęglanowego, a pozostawiając wolny kation wodorowy; wodorowęglan dysocjuje dalej do anionu węglanowego, zaś kwas węglowy się nie tworzy. I wszystko było w porządku aż nie odkryto, że pogłoski o jego śmierci są mocno przesadzone.
Aby otrzymać czysty i stabilny kwas węglowy, należało zastosować dość specyficzne warunki - mieszaninę wody i dwutlenku węgla zamrożono i umieszczono pod niskim ciśnieniem, po czym napromieniowano - promieniowanie pozwoliło na połączenie dwóch różnych cząsteczek bez ogrzewania. Następnie zastosowano sublimację wody pod niskim ciśnieniem, otrzymując czysty, suchy związek.
Jak się okazało, bezwodny kwas węglowy jest dosyć trwały - obliczenia teoretyczne pokazały że czas połowicznego rozkładu to ponad sto tysięcy lat, ale śladowe ilości wody przyśpieszają ten rozkład gwałtownie, nawet milion razy[1].
Udało się także otrzymać gazowy kwas węglowy, trwały do temperatury -30 stopni, który w takiej fazie chętnie tworzy trwalszy dimer[2]
Skoro kwas ten istnieje, to jak jest z jego obecnością w wodzie mineralnej?
Gdy tylko zaczynamy nasycać wodę dwutlenkiem węgla, zaczyna on być hydratowany. W takiej formie każda cząsteczka tlenku zostaje otoczona cząsteczkami wody, lecz nie następuje pomiędzy nimi reakcja. Ilość rozpuszczającego się w ten sposób gazu zależy od ciśnienia - im wyższe, tym lepsza rozpuszczalność. W takiej formie występuje około 99% rozpuszczonego w wodzie związku.
Część jednak reaguje z wodą dając jako produkt przejściowy kwas węglowy:
Jon wodorowęglanowy może ulegać dalszej dysocjacji, rozpadając się na jon węglanowy:
Wszystkie te procesy są procesami równowagowymi, toteż zachodzą równocześnie w obie strony, choć z różną szybkością, a obserwowany stan jest wypadkową różnie szybkich równoczesnych reakcji. Można to porównać do szeregu naczyń do których woda może wpływać i wypływać, aż zależnie od szybkości wypływu i dopływu stabilizuje się na pewnym poziomie.
Gdy zaczniemy wprowadzać dwutlenek węgla do wody, będzie to czynił niechętnie, jednak gdy się rozpuści większość będzie występować w formie zhydratowanej. Z tej ilości pewna część będzie zamieniać się w kwas węglowy. Ten ma dwie możliwe drogi rozpadu - albo zamieni się z powrotem w dwutlenek węgla, co czyni chętnie, albo w wodorowęglan, co czyni równie szybko. To że w ogóle występuje w roztworze jest wynikiem tego, że wszystkie procesy są pewnymi równowagami odwracalnych reakcji - większe ciśnienie gazu naprodukuje więcej kwasu węglowego który natychmiast rozpada się w wodorowęglan; obniżenie ciśnienia powoduje rozpad obecnego kwasu węglowego ale jest on odtwarzany z wodorowęglanów.
Pod ciśnieniem atmosferycznym w wodzie pozostającej w kontakcie z dwutlenkiem węgla, może się rozpuścić ok. 0,1 mmol, z czego 1% przechodzi w wodorowęglan a 0,01% w kwas węglowy. Jonów węglanowych powstają niewykrywalne ilości. Roztwór taki ma pH=5,6 zatem jest lekko kwaskowaty. Pod ciśnieniem ok. 1-2 atmosfer, jakie to ciśnienia są stosowane w butelkowanej wodzie mineralnej, rozpuszcza się 8,5 mmol gazu, z czego 1% ma postać wodorowęglanu i niemal tyle samo formę kwasu węglowego. Roztwór taki ma pH =3,5 a więc podobne do soku pomarańczowego.
Co więc z tego wynika ostatecznie? Większość rozpuszczonego dwutlenku węgla występuje w wodzie w formie zhydratowanej obojętnej cząsteczki, a z pozostałej części większość w formie wodorowęglanów. A kwas? Występuje ale jako dynamiczna faza przejściowa - nieustannie tworzy się i rozpada istniejąc w ilościach tak niewielkich, że nieistotnych dla określenia kwasowości i trudnych do wykrycia. Ale jest.
------
* http://en.wikipedia.org/wiki/Carbonic_acid
* http://de.wikipedia.org/wiki/Kohlens%C3%A4ure
* http://en.wikipedia.org/wiki/Carbonated_water
* http://en.wikipedia.org/wiki/Joseph_Priestley
[1] Thomas Loerting, Christofer Tautermann, Romano T. Kroemer, Ingrid Kohl , Andreas Hallbrucker , Erwin Mayer. and Klaus R. Liedl, On the Surprising Kinetic Stability of Carbonic Acid (H2CO3), Angewandte Chemie International Edition Volume 39, Issue 5, pages 891–894, March 3, 2000
Dwutlenek węgla jest bezbarwnym i w zasadzie bezwonnym gazem cięższym od powietrza, stanowiącym stale niewielki procent składu atmosfery. Został odkryty dosyć wcześnie - już w XVII wieku van Helmont zauważył, że jeśli masa popiołu po spaleniu węgla jest znacząco mniejsza od pierwotnej masy, to reszta musi ulegać zamianie w formę gazową. Ówcześni identyfikowali go z flogistonem - pierwiastkiem palności - i dalej się tą sprawą nie zajmowano. Dopiero w 1750 roku szkocki lekarz Joseph Black, znany też z badań nad ciepłem utajonym, poddał badaniom gaz powstający z potraktowania wapienia kwasem, stwierdzając, że jest różny od powietrza, ciężki i duszący, oraz że wytrąca osad z roztworu wapna gaszonego. Korzystając z tej ostatniej reakcji, stwierdził że występuje normalnie w powietrzu i w większych ilościach w tchnieniu zwierząt i ludzi. Późniejsi badacze doszli do tego, że gaz jest połączeniem tlenu i węgla i że reakcję czasem można odwrócić (przy spalaniu magnezu w dwutlenku węgla powstaje sadza), jednak dla nas istotniejsze jest odkrycie Josepha Priestly'a, trochę teologa a trochę przyrodnika-hobbysty, który badając przebieg fermentacji w miejscowym browarze, zainteresował się "zastałym powietrzem" - warstwą gazową nad fermentującą kadzią, uważaną za pracowników za niezdrową i od której zdychały myszy jeśli dostały się pod jej wpływ.
Wytwarzanie wody sodowej - rysunek Priestley'a z 1772 roku
Eksperymentując, umieścił nad kadzią miskę z wodą, chcąc sprawdzić rozpuszczalność tego gazu. Po zlaniu musującego roztworu stwierdził, że woda nabrała przyjemnego, lekko kwaśnego posmaku, a nawet dał go spróbować znajomym, twierdząc że to orzeźwiający napój bez alkoholu. Kilka lat później opisał go w artykule, dodając przepis na sztuczne otrzymanie - po zwilżeniu kredy kwasem siarkowym, powstający gaz przeprowadzał rurką do wody i po przepuszczeniu większej ilości otrzymywał napój, który uważał za bardzo podobny do naturalnych wód mineralnych i polecał na szkorbut. W zasadzie jednak nie traktował odkrycia inaczej jak ciekawostki i nie sądził, że znajdzie zastosowanie. Tymczasem producenci wód mineralnych powinni mu postawić pomnik - odkrycie, że zwykła woda staje się smacznym napojem po rozpuszczeniu w niej pospolitego gazu, do dziś przynosi im ogromne zyski.
Pierwszym, który wpadł na to, że jest to znakomity pomysł na interes, był niejako Jacob Schweppe, który w roku 1783 założył firmę Schweppes, istniejącą zresztą do dziś, produkując wody gazowane mające naśladować wody mineralne z naturalnych źródeł. Nieco później dla polepszenia smaku, do nagazowanej wody zaczęto dodawać nieco sody oczyszczonej, tworząc napój nazywany odtąd wodą sodową. I tak zaczął się przemysł napojów gazowanych.
Szybko jednak chemicy zaczęli się zastanawiać, dlaczego po rozpuszczeniu gazu, woda staje się kwaśna. Musi powstawać jakiś kwas - uznali - i nazwali go kwasem węglowym. W polskiej nomenklaturze dwutlenek węgla zaczął być z tego powodu nazywany niedokwasem węglowym. Taki też stan rzeczy trwał przez długi czas, aż zaczęły się problemy z wyizolowaniem czy choćby wykryciem tego kwasu w wodzie. Badania absorpcji w podczerwieni nie wykryły aby występował w choćby najbardziej nasyconych roztworach. W zamian za to wykrywano jony węglanowe i wodorowęglanowe, stąd też powstała koncepcja wedle której kwas węglowy nie istnieje. Jeszcze ja w technikum byłem upominany aby nie zapisywać jego cząsteczki w równaniu rozpuszczania dwutlenku węgla.
Jest to w pewnym stopniu podobna sytuacja jak z "wodorotlenkiem amonu". Rozpuszczenie amoniaku w wodzie da nam roztwór o zasadowym odczynie, toteż postulowano powstawanie w wodzie wodorotlenku amonu i przez długi czas zapisywano go w ten sposób. Dopiero potem dokładne badania wykazały, że cząsteczka taka nie powstaje - woda wymienia się protonem z amoniakiem, i tworzy się osobny jon wodorotlenkowy i osobny amonowy pozostające w równowadze. Wydawało się zatem, że tu jest podobnie - dwutlenek łączy się z wodą biorąc tlen i wodór do utworzenia jonu wodorowęglanowego, a pozostawiając wolny kation wodorowy; wodorowęglan dysocjuje dalej do anionu węglanowego, zaś kwas węglowy się nie tworzy. I wszystko było w porządku aż nie odkryto, że pogłoski o jego śmierci są mocno przesadzone.
Aby otrzymać czysty i stabilny kwas węglowy, należało zastosować dość specyficzne warunki - mieszaninę wody i dwutlenku węgla zamrożono i umieszczono pod niskim ciśnieniem, po czym napromieniowano - promieniowanie pozwoliło na połączenie dwóch różnych cząsteczek bez ogrzewania. Następnie zastosowano sublimację wody pod niskim ciśnieniem, otrzymując czysty, suchy związek.
Jak się okazało, bezwodny kwas węglowy jest dosyć trwały - obliczenia teoretyczne pokazały że czas połowicznego rozkładu to ponad sto tysięcy lat, ale śladowe ilości wody przyśpieszają ten rozkład gwałtownie, nawet milion razy[1].
Udało się także otrzymać gazowy kwas węglowy, trwały do temperatury -30 stopni, który w takiej fazie chętnie tworzy trwalszy dimer[2]
Skoro kwas ten istnieje, to jak jest z jego obecnością w wodzie mineralnej?
Gdy tylko zaczynamy nasycać wodę dwutlenkiem węgla, zaczyna on być hydratowany. W takiej formie każda cząsteczka tlenku zostaje otoczona cząsteczkami wody, lecz nie następuje pomiędzy nimi reakcja. Ilość rozpuszczającego się w ten sposób gazu zależy od ciśnienia - im wyższe, tym lepsza rozpuszczalność. W takiej formie występuje około 99% rozpuszczonego w wodzie związku.
Część jednak reaguje z wodą dając jako produkt przejściowy kwas węglowy:
CO2 + H2O → H2CO3
Jak wykazały badania, związek ten bardzo szybko i łatwo odszczepia jeden proton, przechodząc w jon wodorowęglanowy. Stała równowagi pokazuje, że kwas ten jest nawet mocniejszy od cytrynowego. Silne przesunięcie równowagi w stronę wodorowęglanów powoduje jednak, że niemal natychmiast prawie cały powstający kwas węglowy zamienia się w tą formę:
H2CO3  HCO3− + H+
HCO3− + H+
Jon wodorowęglanowy może ulegać dalszej dysocjacji, rozpadając się na jon węglanowy:
HCO3−  CO32− + H+
CO32− + H+
Jednak reakcja ta następuje powoli, i zaczyna nabierać znaczenia w warunkach silnie zasadowych.Wszystkie te procesy są procesami równowagowymi, toteż zachodzą równocześnie w obie strony, choć z różną szybkością, a obserwowany stan jest wypadkową różnie szybkich równoczesnych reakcji. Można to porównać do szeregu naczyń do których woda może wpływać i wypływać, aż zależnie od szybkości wypływu i dopływu stabilizuje się na pewnym poziomie.
Gdy zaczniemy wprowadzać dwutlenek węgla do wody, będzie to czynił niechętnie, jednak gdy się rozpuści większość będzie występować w formie zhydratowanej. Z tej ilości pewna część będzie zamieniać się w kwas węglowy. Ten ma dwie możliwe drogi rozpadu - albo zamieni się z powrotem w dwutlenek węgla, co czyni chętnie, albo w wodorowęglan, co czyni równie szybko. To że w ogóle występuje w roztworze jest wynikiem tego, że wszystkie procesy są pewnymi równowagami odwracalnych reakcji - większe ciśnienie gazu naprodukuje więcej kwasu węglowego który natychmiast rozpada się w wodorowęglan; obniżenie ciśnienia powoduje rozpad obecnego kwasu węglowego ale jest on odtwarzany z wodorowęglanów.
Pod ciśnieniem atmosferycznym w wodzie pozostającej w kontakcie z dwutlenkiem węgla, może się rozpuścić ok. 0,1 mmol, z czego 1% przechodzi w wodorowęglan a 0,01% w kwas węglowy. Jonów węglanowych powstają niewykrywalne ilości. Roztwór taki ma pH=5,6 zatem jest lekko kwaskowaty. Pod ciśnieniem ok. 1-2 atmosfer, jakie to ciśnienia są stosowane w butelkowanej wodzie mineralnej, rozpuszcza się 8,5 mmol gazu, z czego 1% ma postać wodorowęglanu i niemal tyle samo formę kwasu węglowego. Roztwór taki ma pH =3,5 a więc podobne do soku pomarańczowego.
Co więc z tego wynika ostatecznie? Większość rozpuszczonego dwutlenku węgla występuje w wodzie w formie zhydratowanej obojętnej cząsteczki, a z pozostałej części większość w formie wodorowęglanów. A kwas? Występuje ale jako dynamiczna faza przejściowa - nieustannie tworzy się i rozpada istniejąc w ilościach tak niewielkich, że nieistotnych dla określenia kwasowości i trudnych do wykrycia. Ale jest.
------
* http://en.wikipedia.org/wiki/Carbonic_acid
* http://de.wikipedia.org/wiki/Kohlens%C3%A4ure
* http://en.wikipedia.org/wiki/Carbonated_water
* http://en.wikipedia.org/wiki/Joseph_Priestley
[1] Thomas Loerting, Christofer Tautermann, Romano T. Kroemer, Ingrid Kohl , Andreas Hallbrucker , Erwin Mayer. and Klaus R. Liedl, On the Surprising Kinetic Stability of Carbonic Acid (H2CO3), Angewandte Chemie International Edition Volume 39, Issue 5, pages 891–894, March 3, 2000
[2] Hinrich Grothe et al., Spectroscopic Observation of Matrix-Isolated Carbonic Acid Trapped from the Gas Phase, Angewandte Chemie International Edition Volume 50, Issue 8, pages 1939–1943, February 18, 2011
niedziela, 27 lipca 2014
Poison Story (6.) - Co za dużo, to nie zdrowo
Gdy w 2007 roku stacja radiowa KDND ogłosiła konkurs, w którym do wygrania była najnowsza konsola wideo, zgłosiło się wielu chętnych. Konsola Wii była bardzo popularna, ale najnowszego modelu, kosztującego 250 dolarów, praktycznie nie dało się kupić w amerykańskich sklepach, dlatego możliwość wygrania jej w śmiesznym konkursie była bardzo kusząca. Zgłosiło się kilkanaście osób, w tym 28-letnia Jennifer Strange, matka trójki dzieci, która jak mówiła przed konkursem, chce zdobyć tą konsolę dla nich.
Konkurs "Hold Your Wee of a Wii" był bardzo prosty - wygrywał ten, kto wypije jak najwięcej wody i się nie posika. W innych podobnych konkursach dawano zadania w rodzaju zjedzenia jak największej ilości pączków czy hamburgerów, więc to wydawało się prostym zadaniem. Przygotowano każdemu uczestnikowi małe, ćwierćlitrowe buteleczki wody. Mieli pić po jednej w odstępie dziesięciu minut oraz w każdej chwili mogli zrezygnować, jeśli uznali, że to dla nich zbyt dużo, ale nie mogli wychodzić do łazienki.
Konkurs rozpoczęto nad ranem, nadając relację na antenie. Było wesoło, a kolejne butelki znikały w szybkim tempie. Ktoś się wykruszył po pięciu, ktoś po ośmiu.
W trakcie trwania konkursu, do radia zadzwoniła pielęgniarka, stwierdzając że jego idea jest oburzająca i niebezpieczna, bo ktoś może umrzeć. Prezenter odpowiedział że wiedzą ale wszystko jest pod kontrolą, zresztą uczestnicy podpisali dokument że zgadzają się na ryzyko, więc nie ma się co czepiać. Gdy kolejny słuchacz zaniepokojony konkursem zadzwonił z ostrzeżeniem, rozbawiony prezenter wyjrzał na salę i zawołał "Czy ktoś tam może umiera?". Prezenter wyjaśnił też że ciało składa się w 90% z wody, więc można jej pić ile się chce.
Gdy minęła pierwsza godzina, uczestnikom dano większe, półlitrowe butelki. To wtedy zrezygnowało najwięcej osób. Niektórzy źle się czuli, ktoś zwymiotował do wiadra, ktoś inny stwierdził że jest mu zimno i zaczął drżeć. Jednak dwie zawodniczki okazały się bardzo wytrwałe. Jennifer wypiła już osiem małych butelek i dziesięć większych, łącznie mieszcząc w sobie ponad sześć litrów wody, gdy stwierdziła że brzuch już ją boli, i głowa. Zrezygnowała zajmując drugie miejsce i otrzymując w nagrodę bilety na koncert. Przebiła ją kobieta, która wypiła o pół butelki więcej.
Gdy konkurs się już skończył, DJ zażartował, że brzuch Jennifer wygląda jakby była w ciąży. Przed wręczeniem nagród zawodniczki poszły do łazienki gdzie wysikały się i zwymiotowały. Następnie gorąco je pożegnano i odesłano do domu. Po drodze Jennifer zadzwoniła do współpracownika aby opowiedzieć o konkursie. Skarżyła się wtedy na silny ból głowy. W domu ból głowy się nasilił. Do objawów doszły zapewne też nudności i osłabienie. Po południu zaniepokojona matka odnajduje ją martwą.
Wynik autopsji zaskoczył wszystkich - Jennifer Strange zmarła z powodu zatrucia wodą.
Setki lat temu, pewien przemądrzały lekarz nazywany Paracelsusem, stwierdził paradoksalnie, że wszystko jest trucizną i nie jest nią. Działanie zależy od dawki a w pewnym stopniu też sposobu podania. Wynika stąd wiosek, że o żadnej substancji nie można powiedzieć, że nie jest trująca, można je tylko dzielić na trujące silnie, słabo i bardzo niewiele, co odpowiada wielkości dawki wywołującej negatywne objawy. Niejednokrotnie substancja wywołująca szkodliwe skutki w dużych dawkach, w małych może wykazać własności lecznicze.
Toksyczność substancji określa się zwykle przy pomocy miary LD 50 - jest to dawka w gramach na kilogram masy ciała wywołująca 50% prawdopodobieństwo śmierci, co zwykle wyznacza się badając śmiertelność szczurów lub innych zwierząt. Pewne znaczenie ma też droga podania, substancje mogą wykazywać niską toksyczność podane doustnie a wysoką podane inhalacyjnie, przykładem metaliczna rtęć, która połknięta bardzo trudno się wchłania, natomiast bardzo szkodliwa jest wdychana w postaci par.
W niektórych przypadkach dawka śmiertelna może być skrajnie niska - dla jadu kiełbasianego podaje się dawki rzędu nanogramów, dla cyjanku potasu to ok. 5 mg/kg, a dla siarczanu miedzi to ok. 5 g/kg przez co jego przedawkowanie jest na prawdę trudne.
A woda? Prawdopodobnie jest jedną z najmniej toksycznych substancji, jakich właściwości przebadano, jej dawka śmiertelna to około 90g/kg. Nawet glukoza jest bardziej toksyczna.
Oznacza to że dla dorosłego ważącego 70 kg niebezpieczna jest dawka ok. 6 litrów, ale oczywiście wszystko zależy od sposobu i szybkości podawania.
Ale właściwie dlaczego woda może być niebezpieczna?
Jednym z warunków utrzymania przez nasz organizm homeostazy, jest równowaga między zawartością wody w komórkach i w przestrzeniach między nimi. Stężenie soli mineralnych w osoczu i w płynie wewnątrzkomórkowym musi mieścić się w określonych granicach, przy czym najważniejszą z tych soli jest chlorek sodu, a więc sól kuchenna.
Ogólne prawa fizyki mówią, że przy różnicy stężeń po dwóch stronach półprzepuszczalnej błony, rozpuszczalnik ma skłonność do migracji w miejsce o większym stężeniu. Po prostu po stronie z roztworem bardziej rozcieńczonym cząstki rozpuszczalnika częściej uderzają w błonę i mogą przez nią przeniknąć, niż od strony roztworu bardziej stężonego. To przenikanie trwa tak długo aż nie zahamuje go wytworzone ciśnienie, nazywane osmotycznym, mogące osiągać gigantyczne wartości. To dlatego wiśnie i miękkie owoce zamoczone w wodzie nabrzmiewają i pękają - zwykła woda ma mniejsze stężenie rozpuszczonych substancji niż sok w komórkach owoców, i wnika do wiśni zwiększając ciśnienie.
Wewnątrz organizmu stężenie soli w osoczu i w komórkach jest na różne sposoby regulowane. Najważniejszym mechanizmem jest wydalanie wody i soli mineralnych przez nerki, które z kolei jest regulowane wydzielaniem hormonów, znaczenie ma też transport jonów do i z wnętrza komórek. W normalnej sytuacji gdy wypijemy większą ilość wody, nerki zaczynają wydzielać większą ilość moczu, tak aby zachować równowagę, a sole mineralne w organizmie nieco się rozcieńczają.
Problem może pojawić się gdy ilość wypitej wody przekroczy zdolność wydalniczą nerek, a więc będzie większa niż ok. 1 litr na godzinę, lub też gdy nerki zmniejszą wydzielanie moczu. Osocze krwi się wówczas rozcieńcza a poziom sodu zaczyna opadać poniżej normalnego stężenia, co prowadzi do hiponatremii.
Spadek stężenia soli w osoczu powoduje wzmożone wchłanianie wody do tkanek, człowiek staje się więc obrzęknięty i ociężały. W przypadku większości tkanek mają one pewną swobodę miejsca, mogąc nabrzmiewać bez uszkodzeń. Mózg zamknięty wewnątrz sztywnej czaszki nie ma tak łatwo.
Przy silnej i szybkiej hiponatremii, następuje obrzęk mózgu, a wzrost ciśnienia wewnątrz czaszkowego wywołuje objawy neurologiczne - dreszcze, silne bóle głowy, wymioty, osłabienie, drgawki, zaburzenia oddychania i śpiączkę. Ostatecznie opuchnięcie pnia mózgu wywołuje porażenie ośrodka oddechowego i zatrzymanie oddechu.
Najszybszym sposobem leczenia jest podanie soli mineralnych, tak aby zwiększyć ich stężenie we krwi, oraz podawanie diuretyków zwiększających wydalanie wody.
Zatrucie wodne jest przypadkiem bardzo rzadkim, i najczęściej jest związane z przymusem lub zaburzeniami psychicznymi. W chorobach takich jak schizofrenia nadmierne pragnienie jest dosyć częste - hiponatremia z przewodnienia występuje nawet u 5% leczonych w szpitalach psychiatrycznych, stanowiąc przyczynę do 20% zgonów[1]. Innym przypadkiem są zaburzenia elektrolitowe podczas intensywnego wysiłku - ciało wydala sole mineralne wraz z potem, wypijanie w trakcie płynów nieizotonicznych, czyli mających zbyt mało soli, może doprowadzić do hiponatremii. W dodatku w warunkach dużego zmęczenia, organizm hamuje wydzielanie moczu przez nerki. Stan taki obserwuje się u około 10-15% maratończyków po zakończeniu biegu, i niekiedy może on przybrać niebezpieczne natężenie.
Kilka lat temu z tego powodu zmarł uczestnik maratonu w Londynie.[2] Wiadomość o tym wywołała duże zaskoczenie u biegaczy, którzy dotychczas bardziej obawiali się odwodnienia.
Innym znanym przypadkiem była śmierć rekruta podczas ćwiczeń wytrzymałościowych Sił Powietrznych w 1999 roku, gdzie przyczyną było połączenie udaru cieplnego i przewodnienia.
Niebezpieczne rozcieńczenie płynów może też nastąpić w wyniku tortur lub napojenia wymuszonego. Zanotowano już kilka przypadku śmierci dzieci, które opiekunowie w ramach kary zmusili do wypicia 1-2 litrów wody. W USA głośną sprawą była śmierć Matthewa Carringtona, który w ramach swoistych otrzęsin będących testem wstępnym do studenckiego bractwa Tau Chi był zmuszony do wypicia dużych ilości wody. Jeszcze inną okazją do przewodnienia może być nieprzemyślana dieta lub źle zaplanowane "oczyszczanie organizmu".
Od dawna po świecie krąży mit, iż każdego dnia należy pić 2 litry wody. Tak na prawdę rzecz wywodzi się z badań nad gospodarką wodną organizmu, z których wynikało, że przy przeciętnej aktywności fizycznej i temperaturach, człowiek wydala ok 2 litry wody dziennie, to wobec tego tyle samo powinien przyjmować. Tyle tylko że wlicza się tutaj także woda zawarta w jedzeniu. Jabłko zawiera ponad 80% wody, mięso 50-60%, chleb 10%. Łącznie z jedzeniem przyjmujemy około litra - półtora, co stanowi połowę zalecanego spożycia. Nikt nigdzie nie mówił że musi być to koniecznie taka właśnie ilość wody pitnej.
Niestety, źle zrozumiane wyniki badań poszły w świat w formie "musisz pić 8 szklanek wody dziennie" i to czystej wody a nie napojów, przez co poniektórzy wierząc kolorowym pismom wręcz wmuszali w siebie następne szklanki, bo tak przecież napisali.
Niektórzy "dietetycy" dla uzasadnienia tego mitu posuwają się nawet do twierdzenia, że woda spożyta w innej formie jak czysta, nie będzie się wchłaniała, toteż po zjedzeniu talerza wodnistej zupy i tak musisz wypić te dwa litry. Niestety ludzie dalej w to wierzą, a zwolennicy magicznego "oczyszczania z toksyn" wręcz zwiększają ten limit, pisząc o trzech czy czterech litrach. Przykładem może być pewien rodzaj diety oczyszczająco-odchudzającej, w której mało się je i wypija duże ilości wody. Pozwala bardzo szybko schudnąć, ale zanotowano już kilka zgonów z tego powodu.
Brytyjka Jaqueline Henson wypijała na diecie trzy litry czystej wody na dzień. Pewnego dnia zaczęła od wypicia jednego litra wody źródlanej, a potem siedząc przed telewizorem wypiła dwie półtoralitrowe butelki w ciągu trzech godzin. Nie przejmowała się bólem głowy, bo czytała że to może być objaw oczyszczania organizmu. Po południu zemdlała, dostała drgawek i zatrzymania krążenia.[3]
Inna Brytyjka za namową swej dietetyczki wypijała cztery litry wody dziennie aby "wypłukać toksyny". Gdy zaczęła się źle czuć, dietetyczka powiedziała że to objaw oczyszczania i powinna zwiększyć ilość do sześciu litrów. Po dwóch dniach kobieta straciła przytomność. Wprawdzie ją odratowano ale w wyniku obrzęku doszło do uszkodzenia mózgu[4]
W przypadku Jennifer Strange, na jej stan nałożyło się kilka czynników - była drobna, miała małą wagę, dlatego proporcja ilości wypitej wody była u niej większa niż u innych. Zwyciężczyni konkursu doznała tylko bólu głowy ale nie była hospitalizowana. W dodatku prawdopodobnie Jennifer po przyjściu do domu niczego nie jadła - gdyby zjadła coś bardzo słonego, jak czipsy lub solone frytki, to stężenie elektrolitów mogłoby się wyrównać a przynajmniej nie dojść do tak niebezpiecznie niskiego poziomu. Mąż zmarłej podał stację radiową do sądu. Sprawa ciągnęła się długo, bowiem z jednej strony uczestnicy podpisali dokument iż wiedzą o ryzyku, lecz z drugiej strony nikt im nie powiedział jakie jest to właściwie ryzyko. Ostatecznie w 2009 roku w ramach ugody stacja zapłaciła rodzinie zmarłej 16 mln dolarów.
Historia ta miała jednak chyba zbyt małe rozpowszechnienie, skoro w zeszłym roku brazylijska stacja radiowa ogłosiła podobny konkurs, gdzie nagrodę zdobywał zespół, który wypije najwięcej rozwodnionej yerba mate. W zwycięskim zespole składającym się z 10 osób, który wypił 56 litrów napoju, trzy osoby się rozchorowały a jedna zmarła.[5]
------
* http://en.wikipedia.org/wiki/Water_intoxication
* http://www.pnmedycznych.pl/spnm.php?ktory=138
* http://www.rbs2.com/KDND.pdf
* http://www.protectconsumerjustice.org/a-measure-of-justice-for-a-mother-who-met-a-tragic-end.html
[1] http://fpn.ipin.edu.pl/archiwum/2005/2/t21z2_7.pdf
[2] http://www.maratonypolskie.pl/mp_index.php?dzial=1&action=7&code=4888
[3] http://news.bbc.co.uk/2/hi/uk_news/england/bradford/7779079.stm
[4] http://www.dailymail.co.uk/femail/article-1038829/Water-detox-robbed-wife.html
[5] http://www.campograndenews.com.br/cidades/capital/mulher-de-21-anos-morre-depois-de-passar-mal-em-competicao-de-terere
Konkurs "Hold Your Wee of a Wii" był bardzo prosty - wygrywał ten, kto wypije jak najwięcej wody i się nie posika. W innych podobnych konkursach dawano zadania w rodzaju zjedzenia jak największej ilości pączków czy hamburgerów, więc to wydawało się prostym zadaniem. Przygotowano każdemu uczestnikowi małe, ćwierćlitrowe buteleczki wody. Mieli pić po jednej w odstępie dziesięciu minut oraz w każdej chwili mogli zrezygnować, jeśli uznali, że to dla nich zbyt dużo, ale nie mogli wychodzić do łazienki.
Konkurs rozpoczęto nad ranem, nadając relację na antenie. Było wesoło, a kolejne butelki znikały w szybkim tempie. Ktoś się wykruszył po pięciu, ktoś po ośmiu.
W trakcie trwania konkursu, do radia zadzwoniła pielęgniarka, stwierdzając że jego idea jest oburzająca i niebezpieczna, bo ktoś może umrzeć. Prezenter odpowiedział że wiedzą ale wszystko jest pod kontrolą, zresztą uczestnicy podpisali dokument że zgadzają się na ryzyko, więc nie ma się co czepiać. Gdy kolejny słuchacz zaniepokojony konkursem zadzwonił z ostrzeżeniem, rozbawiony prezenter wyjrzał na salę i zawołał "Czy ktoś tam może umiera?". Prezenter wyjaśnił też że ciało składa się w 90% z wody, więc można jej pić ile się chce.
Gdy minęła pierwsza godzina, uczestnikom dano większe, półlitrowe butelki. To wtedy zrezygnowało najwięcej osób. Niektórzy źle się czuli, ktoś zwymiotował do wiadra, ktoś inny stwierdził że jest mu zimno i zaczął drżeć. Jednak dwie zawodniczki okazały się bardzo wytrwałe. Jennifer wypiła już osiem małych butelek i dziesięć większych, łącznie mieszcząc w sobie ponad sześć litrów wody, gdy stwierdziła że brzuch już ją boli, i głowa. Zrezygnowała zajmując drugie miejsce i otrzymując w nagrodę bilety na koncert. Przebiła ją kobieta, która wypiła o pół butelki więcej.
Gdy konkurs się już skończył, DJ zażartował, że brzuch Jennifer wygląda jakby była w ciąży. Przed wręczeniem nagród zawodniczki poszły do łazienki gdzie wysikały się i zwymiotowały. Następnie gorąco je pożegnano i odesłano do domu. Po drodze Jennifer zadzwoniła do współpracownika aby opowiedzieć o konkursie. Skarżyła się wtedy na silny ból głowy. W domu ból głowy się nasilił. Do objawów doszły zapewne też nudności i osłabienie. Po południu zaniepokojona matka odnajduje ją martwą.
Wynik autopsji zaskoczył wszystkich - Jennifer Strange zmarła z powodu zatrucia wodą.
Setki lat temu, pewien przemądrzały lekarz nazywany Paracelsusem, stwierdził paradoksalnie, że wszystko jest trucizną i nie jest nią. Działanie zależy od dawki a w pewnym stopniu też sposobu podania. Wynika stąd wiosek, że o żadnej substancji nie można powiedzieć, że nie jest trująca, można je tylko dzielić na trujące silnie, słabo i bardzo niewiele, co odpowiada wielkości dawki wywołującej negatywne objawy. Niejednokrotnie substancja wywołująca szkodliwe skutki w dużych dawkach, w małych może wykazać własności lecznicze.
Toksyczność substancji określa się zwykle przy pomocy miary LD 50 - jest to dawka w gramach na kilogram masy ciała wywołująca 50% prawdopodobieństwo śmierci, co zwykle wyznacza się badając śmiertelność szczurów lub innych zwierząt. Pewne znaczenie ma też droga podania, substancje mogą wykazywać niską toksyczność podane doustnie a wysoką podane inhalacyjnie, przykładem metaliczna rtęć, która połknięta bardzo trudno się wchłania, natomiast bardzo szkodliwa jest wdychana w postaci par.
W niektórych przypadkach dawka śmiertelna może być skrajnie niska - dla jadu kiełbasianego podaje się dawki rzędu nanogramów, dla cyjanku potasu to ok. 5 mg/kg, a dla siarczanu miedzi to ok. 5 g/kg przez co jego przedawkowanie jest na prawdę trudne.
A woda? Prawdopodobnie jest jedną z najmniej toksycznych substancji, jakich właściwości przebadano, jej dawka śmiertelna to około 90g/kg. Nawet glukoza jest bardziej toksyczna.
Oznacza to że dla dorosłego ważącego 70 kg niebezpieczna jest dawka ok. 6 litrów, ale oczywiście wszystko zależy od sposobu i szybkości podawania.
Ale właściwie dlaczego woda może być niebezpieczna?
Jednym z warunków utrzymania przez nasz organizm homeostazy, jest równowaga między zawartością wody w komórkach i w przestrzeniach między nimi. Stężenie soli mineralnych w osoczu i w płynie wewnątrzkomórkowym musi mieścić się w określonych granicach, przy czym najważniejszą z tych soli jest chlorek sodu, a więc sól kuchenna.
Ogólne prawa fizyki mówią, że przy różnicy stężeń po dwóch stronach półprzepuszczalnej błony, rozpuszczalnik ma skłonność do migracji w miejsce o większym stężeniu. Po prostu po stronie z roztworem bardziej rozcieńczonym cząstki rozpuszczalnika częściej uderzają w błonę i mogą przez nią przeniknąć, niż od strony roztworu bardziej stężonego. To przenikanie trwa tak długo aż nie zahamuje go wytworzone ciśnienie, nazywane osmotycznym, mogące osiągać gigantyczne wartości. To dlatego wiśnie i miękkie owoce zamoczone w wodzie nabrzmiewają i pękają - zwykła woda ma mniejsze stężenie rozpuszczonych substancji niż sok w komórkach owoców, i wnika do wiśni zwiększając ciśnienie.
Wewnątrz organizmu stężenie soli w osoczu i w komórkach jest na różne sposoby regulowane. Najważniejszym mechanizmem jest wydalanie wody i soli mineralnych przez nerki, które z kolei jest regulowane wydzielaniem hormonów, znaczenie ma też transport jonów do i z wnętrza komórek. W normalnej sytuacji gdy wypijemy większą ilość wody, nerki zaczynają wydzielać większą ilość moczu, tak aby zachować równowagę, a sole mineralne w organizmie nieco się rozcieńczają.
Problem może pojawić się gdy ilość wypitej wody przekroczy zdolność wydalniczą nerek, a więc będzie większa niż ok. 1 litr na godzinę, lub też gdy nerki zmniejszą wydzielanie moczu. Osocze krwi się wówczas rozcieńcza a poziom sodu zaczyna opadać poniżej normalnego stężenia, co prowadzi do hiponatremii.
Spadek stężenia soli w osoczu powoduje wzmożone wchłanianie wody do tkanek, człowiek staje się więc obrzęknięty i ociężały. W przypadku większości tkanek mają one pewną swobodę miejsca, mogąc nabrzmiewać bez uszkodzeń. Mózg zamknięty wewnątrz sztywnej czaszki nie ma tak łatwo.
Przy silnej i szybkiej hiponatremii, następuje obrzęk mózgu, a wzrost ciśnienia wewnątrz czaszkowego wywołuje objawy neurologiczne - dreszcze, silne bóle głowy, wymioty, osłabienie, drgawki, zaburzenia oddychania i śpiączkę. Ostatecznie opuchnięcie pnia mózgu wywołuje porażenie ośrodka oddechowego i zatrzymanie oddechu.
Najszybszym sposobem leczenia jest podanie soli mineralnych, tak aby zwiększyć ich stężenie we krwi, oraz podawanie diuretyków zwiększających wydalanie wody.
Zatrucie wodne jest przypadkiem bardzo rzadkim, i najczęściej jest związane z przymusem lub zaburzeniami psychicznymi. W chorobach takich jak schizofrenia nadmierne pragnienie jest dosyć częste - hiponatremia z przewodnienia występuje nawet u 5% leczonych w szpitalach psychiatrycznych, stanowiąc przyczynę do 20% zgonów[1]. Innym przypadkiem są zaburzenia elektrolitowe podczas intensywnego wysiłku - ciało wydala sole mineralne wraz z potem, wypijanie w trakcie płynów nieizotonicznych, czyli mających zbyt mało soli, może doprowadzić do hiponatremii. W dodatku w warunkach dużego zmęczenia, organizm hamuje wydzielanie moczu przez nerki. Stan taki obserwuje się u około 10-15% maratończyków po zakończeniu biegu, i niekiedy może on przybrać niebezpieczne natężenie.
Kilka lat temu z tego powodu zmarł uczestnik maratonu w Londynie.[2] Wiadomość o tym wywołała duże zaskoczenie u biegaczy, którzy dotychczas bardziej obawiali się odwodnienia.
Innym znanym przypadkiem była śmierć rekruta podczas ćwiczeń wytrzymałościowych Sił Powietrznych w 1999 roku, gdzie przyczyną było połączenie udaru cieplnego i przewodnienia.
Niebezpieczne rozcieńczenie płynów może też nastąpić w wyniku tortur lub napojenia wymuszonego. Zanotowano już kilka przypadku śmierci dzieci, które opiekunowie w ramach kary zmusili do wypicia 1-2 litrów wody. W USA głośną sprawą była śmierć Matthewa Carringtona, który w ramach swoistych otrzęsin będących testem wstępnym do studenckiego bractwa Tau Chi był zmuszony do wypicia dużych ilości wody. Jeszcze inną okazją do przewodnienia może być nieprzemyślana dieta lub źle zaplanowane "oczyszczanie organizmu".
Od dawna po świecie krąży mit, iż każdego dnia należy pić 2 litry wody. Tak na prawdę rzecz wywodzi się z badań nad gospodarką wodną organizmu, z których wynikało, że przy przeciętnej aktywności fizycznej i temperaturach, człowiek wydala ok 2 litry wody dziennie, to wobec tego tyle samo powinien przyjmować. Tyle tylko że wlicza się tutaj także woda zawarta w jedzeniu. Jabłko zawiera ponad 80% wody, mięso 50-60%, chleb 10%. Łącznie z jedzeniem przyjmujemy około litra - półtora, co stanowi połowę zalecanego spożycia. Nikt nigdzie nie mówił że musi być to koniecznie taka właśnie ilość wody pitnej.
Niestety, źle zrozumiane wyniki badań poszły w świat w formie "musisz pić 8 szklanek wody dziennie" i to czystej wody a nie napojów, przez co poniektórzy wierząc kolorowym pismom wręcz wmuszali w siebie następne szklanki, bo tak przecież napisali.
Niektórzy "dietetycy" dla uzasadnienia tego mitu posuwają się nawet do twierdzenia, że woda spożyta w innej formie jak czysta, nie będzie się wchłaniała, toteż po zjedzeniu talerza wodnistej zupy i tak musisz wypić te dwa litry. Niestety ludzie dalej w to wierzą, a zwolennicy magicznego "oczyszczania z toksyn" wręcz zwiększają ten limit, pisząc o trzech czy czterech litrach. Przykładem może być pewien rodzaj diety oczyszczająco-odchudzającej, w której mało się je i wypija duże ilości wody. Pozwala bardzo szybko schudnąć, ale zanotowano już kilka zgonów z tego powodu.
Brytyjka Jaqueline Henson wypijała na diecie trzy litry czystej wody na dzień. Pewnego dnia zaczęła od wypicia jednego litra wody źródlanej, a potem siedząc przed telewizorem wypiła dwie półtoralitrowe butelki w ciągu trzech godzin. Nie przejmowała się bólem głowy, bo czytała że to może być objaw oczyszczania organizmu. Po południu zemdlała, dostała drgawek i zatrzymania krążenia.[3]
Inna Brytyjka za namową swej dietetyczki wypijała cztery litry wody dziennie aby "wypłukać toksyny". Gdy zaczęła się źle czuć, dietetyczka powiedziała że to objaw oczyszczania i powinna zwiększyć ilość do sześciu litrów. Po dwóch dniach kobieta straciła przytomność. Wprawdzie ją odratowano ale w wyniku obrzęku doszło do uszkodzenia mózgu[4]
W przypadku Jennifer Strange, na jej stan nałożyło się kilka czynników - była drobna, miała małą wagę, dlatego proporcja ilości wypitej wody była u niej większa niż u innych. Zwyciężczyni konkursu doznała tylko bólu głowy ale nie była hospitalizowana. W dodatku prawdopodobnie Jennifer po przyjściu do domu niczego nie jadła - gdyby zjadła coś bardzo słonego, jak czipsy lub solone frytki, to stężenie elektrolitów mogłoby się wyrównać a przynajmniej nie dojść do tak niebezpiecznie niskiego poziomu. Mąż zmarłej podał stację radiową do sądu. Sprawa ciągnęła się długo, bowiem z jednej strony uczestnicy podpisali dokument iż wiedzą o ryzyku, lecz z drugiej strony nikt im nie powiedział jakie jest to właściwie ryzyko. Ostatecznie w 2009 roku w ramach ugody stacja zapłaciła rodzinie zmarłej 16 mln dolarów.
Historia ta miała jednak chyba zbyt małe rozpowszechnienie, skoro w zeszłym roku brazylijska stacja radiowa ogłosiła podobny konkurs, gdzie nagrodę zdobywał zespół, który wypije najwięcej rozwodnionej yerba mate. W zwycięskim zespole składającym się z 10 osób, który wypił 56 litrów napoju, trzy osoby się rozchorowały a jedna zmarła.[5]
------
* http://en.wikipedia.org/wiki/Water_intoxication
* http://www.pnmedycznych.pl/spnm.php?ktory=138
* http://www.rbs2.com/KDND.pdf
* http://www.protectconsumerjustice.org/a-measure-of-justice-for-a-mother-who-met-a-tragic-end.html
[1] http://fpn.ipin.edu.pl/archiwum/2005/2/t21z2_7.pdf
[2] http://www.maratonypolskie.pl/mp_index.php?dzial=1&action=7&code=4888
[3] http://news.bbc.co.uk/2/hi/uk_news/england/bradford/7779079.stm
[4] http://www.dailymail.co.uk/femail/article-1038829/Water-detox-robbed-wife.html
[5] http://www.campograndenews.com.br/cidades/capital/mulher-de-21-anos-morre-depois-de-passar-mal-em-competicao-de-terere
niedziela, 19 stycznia 2014
Środki osuszające
Zimą, zamknięci w uszczelnionych przed chłodem mieszkaniach, susząc pranie na rozgrzanych kaloryferach doświadczamy niekiedy warunków iście tropikalnych, gdy nasycona wilgocią atmosfera nie pozwala schładzać się ciału. Wtedy też widzimy wilgoć spływającą z chłodnych okien i marszczące się papierowe gazety. I być może przypominamy sobie wówczas reklamy osuszaczy powietrza, które w jakiś magiczny sposób mają wyssać z powietrza wilgoć.
W jaki sposób? W sposób fizyko-chemiczny...
Skłonność substancji do wchłaniania wody obecnej w powietrzu nazywamy higroskopijnością. Aby proces taki mógł zachodzić, między wodą a materiałem wchłaniającym powinny zachodzić odpowiednio silne oddziaływania. Bardzo hydrofobowy polietylen w zasadzie nie wchłania wilgoci, zaś hydrofilowa celuloza czyni to chętnie. Sam proces chłonięcia wody odbywa się na dwa sposoby - przez osadzanie wody na powierzchni, czyli adsorpcję, albo poprzez wchłanianie do wewnątrz struktury materiału.
Głównym oddziaływaniem mającym wpływ na zdolność osuszająca materiału, są wiązania wodorowe, rozpięte między atomem posiadającego wolne pary elektronowe niemetalu w jednej cząsteczce a wodorem w drugiej. Są to dosyć luźne połączenia, raczej przyciąganie elektrostatyczne niż prawdziwe wiązania, jednak występują często i licznie, wpływając na kształt dużych cząsteczek i właściwości fizyczne substancji. Przykładem może być woda w której każda cząsteczka może tworzyć takie wiązania z trzema innymi. Co prawda ruchy termiczne już w temperaturze pokojowej na tyle silnie miotają cząstkami, że wiązania co chwila rozrywają się i tworzą na nowo, ale sumą ich efemerycznego istnienia jest istotne zwiększenie temperatury wrzenia i krzepnięcia - bez nich tlenek wodoru byłby gazem o temperaturze skraplania poniżej -50 stopni.
Jeśli stały materiał zawiera na swej powierzchni grupy z silnie elektroujemnym niemetalem o wolnych parach elektronowych, to cząsteczka wody z powietrza może zostać z nim związana. Takimi materiałami będzie na przykład celuloza lub cukier, mające w strukturze wiele grup hydroksylowych. Między tlenem takiej grupy a wodorem cząsteczki wody powstaje wiązanie. Możliwe jest też wiązanie między wodorem grupy hydroksylowej a tlenem cząsteczki wody. W podobny sposób wodę chłoną białka, gdzie mamy pod dostatkiem atomów elektroujemnych (azot, tlen).
W przypadku naturalnych włókien, ilość pochłoniętej wilgoci wpływa na ich długość - włókno nawodnione rozciąga się a wysuszone kurczy. Praktycznie wykorzystano tą własność w "domkach pogodowych" gdzie włos lub nić bawełniana owinięty wokół osi, rozciągając się lub skracając przy różnej wilgotności powietrza powoduje, że raz z domku wysuwa się figurka kobiety a raz mężczyzny z parasolem.
Nieco inny jest mechanizm wchłaniania wody przez sole nieorganiczne i materiały ceramiczne. Sól taka składa się z anionów reszty kwasowej i kationów metalu. Każdy jon wytwarza wokół siebie niewielkie pole elektryczne, do którego przyciągane są cząsteczki wody o właściwościach dipola. Zależnie od wielkości i tego na ile jest osłonięty przez inne atomy, jon przyciągnie w ten sposób od jednej do sześciu cząsteczek wody. W taki sposób zwykle rozpoczyna się rozpuszczanie soli w wodzie, tu jednak powstaje jedynie jednocząsteczkowa warstwa na samej powierzchni
Ten powierzchniowy sposób nie ma zwykle wpływu na strukturę materiału, chyba że cząsteczki wody utworzą z jonami dużo trwalszą strukturę - hydrat.
W hydracie cząsteczki wody stają się części sieci krystalicznej. Kationy metali chętnie bowiem tworzą z wodą akwakompleksy, a więc związki z przeniesieniem elektronów tlenu na puste powłoki metalu. Powstający wówczas jon kompleksowy może być bardzo trwały. Aniony z kolei mogą wiązać wodę bądź elektrostatycznie, bądź przez wiązania wodorowe jeśli są resztami kwasów tlenowych.
Hydratacja soli często zmienia jej właściwości - bezwodny siarczan miedzi jest sypkim, białym proszkiem; po nawodnieniu staje się intensywnie niebieski za sprawą powstającego jonu kompleksowego Cu[(H2O)4]2+ , piątą cząsteczkę wody wiąże reszta siarczanowa poprzez wiązanie wodorowe, stąd pełny wzór hydratu CuSO4 X 5 H2O.
Wyjątkowo dużo wody może związać krystalicznie siarczan sodu, nazywany solą glauberską. Uwodnione kryształy zwierają 10 cząsteczek wody na jeden ekwiwalent związku, co stanowi więcej niż 50% masy. Sześć cząsteczek wiąże w mało trwałym kompleksie kation sodowy, dwie wiąże reszta siarczanowa zaś dwie kolejne zawierają się w pustych przestrzeniach sieci. Podobny związek w formie przezroczystych kryształów daje węglan sodu. Bezwodny chlorek kobaltu jest intensywnie niebieski (zabarwia się nim emalię), uwodniony staje się różowy.
Małe i silnie naładowane jony na powierzchni kryształu nie tylko przyciągają kilka cząsteczek wody, ale też często ich oddziaływanie jest nadal wystarczające aby do tej warstewki dołączać kolejne, przez co materiał pokrywa się warstwą wody w której może zachodzić rozpuszczanie. Takim jonem jest jon wodorotlenkowy, w efekcie rozpuszczalne wodorotlenki jak sodu czy potasu, pozostawione na powietrzu rozpływają się w gęsty roztwór.
Wreszcie w przypadku materiałów porowatych pewną rolę pełni też kondensacja kapilarna
Osuszacze
Jak wobec powyższego działają komercyjne osuszacze powietrza?
Część urządzeń opiera się na wykraplaniu wilgoci na elemencie chłodzącym, są to urządzenia potrzebujące prądu, ja jednak zajmę się tymi bezprądowymi, opartymi na higroskopii.
Typ jaki najczęściej spotykam to prosty pojemnik z podziurkowanym wieczkiem, do którego wsypuje się granulki, te po pewnym czasie rozpływają się zaś ilość roztworu zwiększa się do pewnego poziomu. Takie osuszacze bazują na pochłanianiu wody przez sole nieorganiczne, najczęściej przez suchy chlorek wapnia.
Związek ten chłonie wodę zamieniając się w hydrat, wiążąc w formie krystalicznej do sześciu cząsteczek wody na jeden równoważnik związku. Hydrat ten jest jednak nadal higroskopijny, chłonąc wodę na powierzchni ziaren tak silnie, że zaczyna rozpływać się "we własnym sosie" tworząc roztwór.
Gdy grudki się rozpłyną, w pojemniku tworzy się syropowata ciecz, zaś w pochłanianiu wilgoci przeważać zaczyna inne niż wyżej opisane zjawisko fizyczne - mianowicie równowaga między parą nasyconą a roztworem. Gdy umieścimy w pojemniku lotną ciecz, zacznie ona parować aż do momentu gdy gazowa część zbiornika osiągnie stan nasycenia. W takim stanie para pozostaje w równowadze z cieczą, co oznacza, że tyle samo cieczy paruje co pozostaje wchłonięte przez roztwór. Jeśli nasz pojemnik nie będzie szczelny, para będzie uciekała i nie osiągnie nasycenia, zaś lotna ciecz powolutku wyschnie.
Zamknięte mieszkanie może być potraktowane jak taki pojemnik, w którym znajdują się źródła pary wodnej. Jej stężenie w powietrzu zmienia się, czasem wzrastając tak bardzo że skrapla się na chłodnych przedmiotach, zazwyczaj jednak jedynie powodując wilgotnienie materiałów za sprawą ich higroskopijności.
W zasadzie dopóki w mieszkaniu nie zapanują tropikalne warunki pełnego nasycenia parą wodną, równowaga między cieczą a parą nie jest zachowana i woda pozostawiona w szklance powoli paruje.
Inaczej będzie gdy w takim wilgotnym mieszkaniu postawimy roztwór zawierający dużo soli.
Sól niejako "rozcieńcza" wodę.
Gdy rozpatrzymy to sobie mikroskopowo, parowanie następuje gdy w granicę faz uderzy cząsteczka o wystarczającej energii. Jeśli teraz rozprowadzimy w wodzie sól, jej cząsteczki zajmą miejsce niektórych cząsteczek wody. Zatem, znów mikroskopowo patrząc, w granicą faz od dołu uderza mniejsza ilość cząsteczek, przez co roztwór jest mniej lotny (ma niższą prężność par).
Skoro tak, to do osiągnięcia stanu równowagi wystarczy zdecydowanie mniejsze nasycenie par nad roztworem. Jeśli do zamkniętego naczynia wstawimy szklankę z wodą i szklankę z roztworem soli, woda będzie parować aż osiągnie stan równowagi z czystą wodą - co będzie jednak stanem nadmiernie wilgotnym dla roztworu soli. Roztwór soli zacznie więc pochłaniać wodę a my obserwujemy, że w jednej szklance poziom opada a w drugiej rośnie.
Gdy w naszym wilgotnym mieszkaniu granulki chlorku wapnia w pochłaniaczu rozpłyną się, powstający roztwór nadal będzie pochłaniał wilgoć, coraz słabiej wraz z rozcieńczaniem. Tak powstały roztwór jest nieszkodliwy, choć może działać drażniąco. Można go odparować do sucha odzyskując środek wiążacy, po schłodzeniu gęstego roztworu wydzielają się kryształy hydratu. Roztworu bądź kryształów można użyć do odladzania przy silnych mrozach.
Inne osuszacze, mające postać saszetek i woreczków, zawierają różnego typu chłonne materiały ceramiczne i naturalne glinki, na przykład bentonit. Wchłaniają mniej wilgoci ale nie rozpływają się, dlatego można używać ich na przyklad w samochodzie.
Bardzo pospolitych środkiem chłonnym jest koloidalna krzemionka. W postaci mlecznych granulek w woreczkach jest wrzucana do butów lub umieszczana w opakowaniach leków - na przykład wewnątrz koreczków tubek z wapnem musującym.
Jest to wytrącony z roztworów krzemianów kwas krzemowy, silnie skondensowany, tak że w większości składa się w usieciowanego tlenku krzemu, na powierzchni mając wolne grupy hydroksylowe, które podobnie jak te w celulozie i w cukrze, łączą się chętnie z cząsteczkami wody. Jest to materiał wyjątkowo porowaty ze szczelinami wewnątrz ziarna, przez co faktyczna powierzchnia ziarna krzemionki jest ogromna.
Czasem dostępny jest typ zmieniający barwę zależnie od nasycenia, zwykle za sprawą dodatku chlorku kobaltu - suchy żel jest wtedy błękitny a gdy jest nasycony i przestaje pochłaniać wilgoć, staje się różowy
Z pochłaniaczy wilgoci korzystają także chemicy - niejednokrotnie ślady wilgoci przeszkadzają w reakcjach, a także utrudniają dokładne odważenie związku. Dlatego sypkie związki przechowuje się zwykle w szklanych naczyniach z grubego szkła - eksykatorach - zawierających w dolnej części sypkie osuszacze różnej mocy. Czasem jest to żel krzemionkowy, zwykle jednak używa się chlorku wapnia lub siarczan magnezu, często też nadchloran magnezu (ale ten ostrożnie bo zanieczyszczony związkami organicznymi może się zapalić) a także tlenku fosforu. Ten ostatni jest silnym pochłaniaczem wilgoci, wiąże ją przez reakcję chemiczną, tworząc kwas fosforowy.
W podobny sposób wiąże wodę tlenek wapnia, tworzący z nią stały wodorotlenek; zwykle suszy się nim niższe alkohole. Osuszacze te mogą być dodawane do płynnych cieczy organicznych aby usunąć z nich ślady wody, jeśli z nimi nie reagują. Skrajnym osuszaczem używanym do rozpuszczalników organicznych, jest metaliczny sód, reagujący z wodą z wydzieleniem wodoru - procedurę opisałem kiedyś w innym wpisie.
Szczególnym przypadkiem są sita molekularne - granulki masy ceramicznej zawierające niewielkie pory, w głąb których wcisnąć mogą się cząsteczki wody ale nie cząsteczki większych substancji. Dlatego dosyć selektywnie odciągają wodę z substancji, pozwalając osiągnąć bardzo dobre rezultaty.
W jaki sposób? W sposób fizyko-chemiczny...
Skłonność substancji do wchłaniania wody obecnej w powietrzu nazywamy higroskopijnością. Aby proces taki mógł zachodzić, między wodą a materiałem wchłaniającym powinny zachodzić odpowiednio silne oddziaływania. Bardzo hydrofobowy polietylen w zasadzie nie wchłania wilgoci, zaś hydrofilowa celuloza czyni to chętnie. Sam proces chłonięcia wody odbywa się na dwa sposoby - przez osadzanie wody na powierzchni, czyli adsorpcję, albo poprzez wchłanianie do wewnątrz struktury materiału.
Głównym oddziaływaniem mającym wpływ na zdolność osuszająca materiału, są wiązania wodorowe, rozpięte między atomem posiadającego wolne pary elektronowe niemetalu w jednej cząsteczce a wodorem w drugiej. Są to dosyć luźne połączenia, raczej przyciąganie elektrostatyczne niż prawdziwe wiązania, jednak występują często i licznie, wpływając na kształt dużych cząsteczek i właściwości fizyczne substancji. Przykładem może być woda w której każda cząsteczka może tworzyć takie wiązania z trzema innymi. Co prawda ruchy termiczne już w temperaturze pokojowej na tyle silnie miotają cząstkami, że wiązania co chwila rozrywają się i tworzą na nowo, ale sumą ich efemerycznego istnienia jest istotne zwiększenie temperatury wrzenia i krzepnięcia - bez nich tlenek wodoru byłby gazem o temperaturze skraplania poniżej -50 stopni.
Jeśli stały materiał zawiera na swej powierzchni grupy z silnie elektroujemnym niemetalem o wolnych parach elektronowych, to cząsteczka wody z powietrza może zostać z nim związana. Takimi materiałami będzie na przykład celuloza lub cukier, mające w strukturze wiele grup hydroksylowych. Między tlenem takiej grupy a wodorem cząsteczki wody powstaje wiązanie. Możliwe jest też wiązanie między wodorem grupy hydroksylowej a tlenem cząsteczki wody. W podobny sposób wodę chłoną białka, gdzie mamy pod dostatkiem atomów elektroujemnych (azot, tlen).
W przypadku naturalnych włókien, ilość pochłoniętej wilgoci wpływa na ich długość - włókno nawodnione rozciąga się a wysuszone kurczy. Praktycznie wykorzystano tą własność w "domkach pogodowych" gdzie włos lub nić bawełniana owinięty wokół osi, rozciągając się lub skracając przy różnej wilgotności powietrza powoduje, że raz z domku wysuwa się figurka kobiety a raz mężczyzny z parasolem.
Nieco inny jest mechanizm wchłaniania wody przez sole nieorganiczne i materiały ceramiczne. Sól taka składa się z anionów reszty kwasowej i kationów metalu. Każdy jon wytwarza wokół siebie niewielkie pole elektryczne, do którego przyciągane są cząsteczki wody o właściwościach dipola. Zależnie od wielkości i tego na ile jest osłonięty przez inne atomy, jon przyciągnie w ten sposób od jednej do sześciu cząsteczek wody. W taki sposób zwykle rozpoczyna się rozpuszczanie soli w wodzie, tu jednak powstaje jedynie jednocząsteczkowa warstwa na samej powierzchni
Ten powierzchniowy sposób nie ma zwykle wpływu na strukturę materiału, chyba że cząsteczki wody utworzą z jonami dużo trwalszą strukturę - hydrat.
W hydracie cząsteczki wody stają się części sieci krystalicznej. Kationy metali chętnie bowiem tworzą z wodą akwakompleksy, a więc związki z przeniesieniem elektronów tlenu na puste powłoki metalu. Powstający wówczas jon kompleksowy może być bardzo trwały. Aniony z kolei mogą wiązać wodę bądź elektrostatycznie, bądź przez wiązania wodorowe jeśli są resztami kwasów tlenowych.
Hydratacja soli często zmienia jej właściwości - bezwodny siarczan miedzi jest sypkim, białym proszkiem; po nawodnieniu staje się intensywnie niebieski za sprawą powstającego jonu kompleksowego Cu[(H2O)4]2+ , piątą cząsteczkę wody wiąże reszta siarczanowa poprzez wiązanie wodorowe, stąd pełny wzór hydratu CuSO4 X 5 H2O.
Wyjątkowo dużo wody może związać krystalicznie siarczan sodu, nazywany solą glauberską. Uwodnione kryształy zwierają 10 cząsteczek wody na jeden ekwiwalent związku, co stanowi więcej niż 50% masy. Sześć cząsteczek wiąże w mało trwałym kompleksie kation sodowy, dwie wiąże reszta siarczanowa zaś dwie kolejne zawierają się w pustych przestrzeniach sieci. Podobny związek w formie przezroczystych kryształów daje węglan sodu. Bezwodny chlorek kobaltu jest intensywnie niebieski (zabarwia się nim emalię), uwodniony staje się różowy.
Małe i silnie naładowane jony na powierzchni kryształu nie tylko przyciągają kilka cząsteczek wody, ale też często ich oddziaływanie jest nadal wystarczające aby do tej warstewki dołączać kolejne, przez co materiał pokrywa się warstwą wody w której może zachodzić rozpuszczanie. Takim jonem jest jon wodorotlenkowy, w efekcie rozpuszczalne wodorotlenki jak sodu czy potasu, pozostawione na powietrzu rozpływają się w gęsty roztwór.
Wreszcie w przypadku materiałów porowatych pewną rolę pełni też kondensacja kapilarna
Osuszacze
Jak wobec powyższego działają komercyjne osuszacze powietrza?
Część urządzeń opiera się na wykraplaniu wilgoci na elemencie chłodzącym, są to urządzenia potrzebujące prądu, ja jednak zajmę się tymi bezprądowymi, opartymi na higroskopii.
Typ jaki najczęściej spotykam to prosty pojemnik z podziurkowanym wieczkiem, do którego wsypuje się granulki, te po pewnym czasie rozpływają się zaś ilość roztworu zwiększa się do pewnego poziomu. Takie osuszacze bazują na pochłanianiu wody przez sole nieorganiczne, najczęściej przez suchy chlorek wapnia.
Związek ten chłonie wodę zamieniając się w hydrat, wiążąc w formie krystalicznej do sześciu cząsteczek wody na jeden równoważnik związku. Hydrat ten jest jednak nadal higroskopijny, chłonąc wodę na powierzchni ziaren tak silnie, że zaczyna rozpływać się "we własnym sosie" tworząc roztwór.
Gdy grudki się rozpłyną, w pojemniku tworzy się syropowata ciecz, zaś w pochłanianiu wilgoci przeważać zaczyna inne niż wyżej opisane zjawisko fizyczne - mianowicie równowaga między parą nasyconą a roztworem. Gdy umieścimy w pojemniku lotną ciecz, zacznie ona parować aż do momentu gdy gazowa część zbiornika osiągnie stan nasycenia. W takim stanie para pozostaje w równowadze z cieczą, co oznacza, że tyle samo cieczy paruje co pozostaje wchłonięte przez roztwór. Jeśli nasz pojemnik nie będzie szczelny, para będzie uciekała i nie osiągnie nasycenia, zaś lotna ciecz powolutku wyschnie.
Zamknięte mieszkanie może być potraktowane jak taki pojemnik, w którym znajdują się źródła pary wodnej. Jej stężenie w powietrzu zmienia się, czasem wzrastając tak bardzo że skrapla się na chłodnych przedmiotach, zazwyczaj jednak jedynie powodując wilgotnienie materiałów za sprawą ich higroskopijności.
W zasadzie dopóki w mieszkaniu nie zapanują tropikalne warunki pełnego nasycenia parą wodną, równowaga między cieczą a parą nie jest zachowana i woda pozostawiona w szklance powoli paruje.
Inaczej będzie gdy w takim wilgotnym mieszkaniu postawimy roztwór zawierający dużo soli.
Sól niejako "rozcieńcza" wodę.
Gdy rozpatrzymy to sobie mikroskopowo, parowanie następuje gdy w granicę faz uderzy cząsteczka o wystarczającej energii. Jeśli teraz rozprowadzimy w wodzie sól, jej cząsteczki zajmą miejsce niektórych cząsteczek wody. Zatem, znów mikroskopowo patrząc, w granicą faz od dołu uderza mniejsza ilość cząsteczek, przez co roztwór jest mniej lotny (ma niższą prężność par).
Skoro tak, to do osiągnięcia stanu równowagi wystarczy zdecydowanie mniejsze nasycenie par nad roztworem. Jeśli do zamkniętego naczynia wstawimy szklankę z wodą i szklankę z roztworem soli, woda będzie parować aż osiągnie stan równowagi z czystą wodą - co będzie jednak stanem nadmiernie wilgotnym dla roztworu soli. Roztwór soli zacznie więc pochłaniać wodę a my obserwujemy, że w jednej szklance poziom opada a w drugiej rośnie.
Gdy w naszym wilgotnym mieszkaniu granulki chlorku wapnia w pochłaniaczu rozpłyną się, powstający roztwór nadal będzie pochłaniał wilgoć, coraz słabiej wraz z rozcieńczaniem. Tak powstały roztwór jest nieszkodliwy, choć może działać drażniąco. Można go odparować do sucha odzyskując środek wiążacy, po schłodzeniu gęstego roztworu wydzielają się kryształy hydratu. Roztworu bądź kryształów można użyć do odladzania przy silnych mrozach.
Inne osuszacze, mające postać saszetek i woreczków, zawierają różnego typu chłonne materiały ceramiczne i naturalne glinki, na przykład bentonit. Wchłaniają mniej wilgoci ale nie rozpływają się, dlatego można używać ich na przyklad w samochodzie.
Bardzo pospolitych środkiem chłonnym jest koloidalna krzemionka. W postaci mlecznych granulek w woreczkach jest wrzucana do butów lub umieszczana w opakowaniach leków - na przykład wewnątrz koreczków tubek z wapnem musującym.
Jest to wytrącony z roztworów krzemianów kwas krzemowy, silnie skondensowany, tak że w większości składa się w usieciowanego tlenku krzemu, na powierzchni mając wolne grupy hydroksylowe, które podobnie jak te w celulozie i w cukrze, łączą się chętnie z cząsteczkami wody. Jest to materiał wyjątkowo porowaty ze szczelinami wewnątrz ziarna, przez co faktyczna powierzchnia ziarna krzemionki jest ogromna.
Czasem dostępny jest typ zmieniający barwę zależnie od nasycenia, zwykle za sprawą dodatku chlorku kobaltu - suchy żel jest wtedy błękitny a gdy jest nasycony i przestaje pochłaniać wilgoć, staje się różowy
Z pochłaniaczy wilgoci korzystają także chemicy - niejednokrotnie ślady wilgoci przeszkadzają w reakcjach, a także utrudniają dokładne odważenie związku. Dlatego sypkie związki przechowuje się zwykle w szklanych naczyniach z grubego szkła - eksykatorach - zawierających w dolnej części sypkie osuszacze różnej mocy. Czasem jest to żel krzemionkowy, zwykle jednak używa się chlorku wapnia lub siarczan magnezu, często też nadchloran magnezu (ale ten ostrożnie bo zanieczyszczony związkami organicznymi może się zapalić) a także tlenku fosforu. Ten ostatni jest silnym pochłaniaczem wilgoci, wiąże ją przez reakcję chemiczną, tworząc kwas fosforowy.
W podobny sposób wiąże wodę tlenek wapnia, tworzący z nią stały wodorotlenek; zwykle suszy się nim niższe alkohole. Osuszacze te mogą być dodawane do płynnych cieczy organicznych aby usunąć z nich ślady wody, jeśli z nimi nie reagują. Skrajnym osuszaczem używanym do rozpuszczalników organicznych, jest metaliczny sód, reagujący z wodą z wydzieleniem wodoru - procedurę opisałem kiedyś w innym wpisie.
Szczególnym przypadkiem są sita molekularne - granulki masy ceramicznej zawierające niewielkie pory, w głąb których wcisnąć mogą się cząsteczki wody ale nie cząsteczki większych substancji. Dlatego dosyć selektywnie odciągają wodę z substancji, pozwalając osiągnąć bardzo dobre rezultaty.
sobota, 19 stycznia 2013
Sól na lód
Temat bardzo zimowy a w pewnym stopniu wiążący się z wcześniejszym wpisem o mieszaninach ogrzewających i krystalizacji. Teraz bowiem będzie nie tylko o topieniu lodu ale i dla równowagi o mieszaninach ochładzających.
Gdy zimą chodniki, drogi, ulice i resztę świata pokrywa śnieg, w miejscach bardziej zdeptanych przeradzający się w lód lub śniegowe błoto, doprawdy bardzo trudno jest się poruszać. Ślizgawica na chodnikach to jeszcze pół biedy, ale na drogach jest nie do pomyślenia. Więc trzeba ten lód rozpuścić. Więc trzeba go posypać solą. Ale dlaczego solą i dlaczego sam piasek nie wystarczy, nie każdy wie.
Topnienie lodu jest przemianą fazową. Faza stała zamienia się bądź to w fazę ciekłą bądź to gazową. Zależy to akurat od warunków - w niskich temperaturach lód może parować w suchym powietrzu, przez co teoretycznie da się wysuszyć pranie na mrozie (tylko kto by tyle czekał?). To w jaki sposób i w jakich warunkach przebiegają przemiany z fazy do fazy, określają równowagi fazowe.
Na to jaka faza, lub układ faz jest akurat trwały, wpływają głównie takie czynniki jak temperatura i ciśnienie - w wysokiej temperaturze lód topnieje, ale pod wysokim ciśnieniem może ponownie zamarznąć. To zrozumiałe. Tak samo jak zrozumiałe jest, że skład substancji wpływa na przebieg równowag - przykładowo woda morska zamarza w zdecydowanie niższej temperaturze.
Teraz na chwilkę się zastanówmy - morze zaczyna zamarzać i na jego powierzchni pojawia się lód. Dla wody w oceanach następuje to w temperaturze -1,9° C. A teraz powiedzmy że temperatura nieco rośnie, do -0,5° C. Pamiętamy że lód topi się w temperaturze 0 stopni. Jest jeszcze za zimno więc - myślimy sobie - lód powinien pozostawać. Tymczasem lód się topi.
Znana nam temperatura topnienia lodu - 0° C - nie jest niczym innym jak temperaturą ustalenia się pewnej równowagi fazowej. W tej temperaturze lód i woda znajdują się w równowadze. Dostarczanie energii zmniejsza ilość fazy stałej, zaś jej odbieranie zmniejsza ilość fazy ciekłej, i tak to trwa aż do zaniku jednej z nich - czyli całkowitego stopienia lub całkowitego zamarznięcia. Tyle tylko, że jest to temperatura równowagi dla faz: Lód/woda. Natomiast w morzu lub w kubku ze słoną wodą mamy do czynienia z fazami: Lód/słona woda - a to już całkiem inna sytuacja.
Ogólnie rzecz biorąc substancje rozpuszczone w wodzie obniżają temperaturę jej topnienia - chyba że same krzepną w wyższych od wody temperaturach. Dla przykładu 40% roztwór alkoholu zamarza przy ok. -35-40° C (czysty etanol zamarza dopiero przy -114). Równowagi fazowe przesuwają się zatem w stronę niższych temperatur. Dla układu lód/nasycony roztwór soli temperatura równowagi to ok. -20° C. Skoro tak, łatwo jest już chyba domyśleć się co zachodzi na naszych chodnikach.
Gdy posypiemy lód solą, jej część rozpuści się od samego zetknięcia. Powstanie roztwór soli, który stykając się z lodem stworzy nasz układ. W takim układzie lód może trwale przebywać w zetknięciu z roztworem w temperaturze -18 czy -20 stopni. Jeśli zatem jest -11 czy -5 to dla takiego układu jest za ciepło. Lód będzie się rozpuszczał, uwalniając chodniki i drogi ze swych węgorzych okowów. Dla bardziej rozcieńczonych roztworów takie błoto może jednak zamarzać już przy mniejszych mrozach.
Pojawia się tu jednak szczególne zjawisko - gdy lód się rozpuszcza, cała mieszanka zaczyna wyraźnie się ochładzać. Dla odpowiednich mieszanek soli z lodem spadek temperatury może sięgać -20 czy -22 stopni, co wykorzystuje się niekiedy do chłodzenia. Jeśli więc mieszanka ochładza się aż do temperatury w której mimo to krzepnie, to dlaczego chodnik posypany solą nie zamarza ponownie po chwili?
A no dlatego, że przecież jest za ciepło. Gdybyśmy naszą chłodzącą mieszankę dobrze odizolowali, to miałaby szansę zamarznąć od samego swojego chłodzenia, ale przecież wciąż jest w kontakcie z za ciepłym otoczeniem. Dlatego nie osiąga tego stanu i cały lód topi się. Wszystko to dobrze działa do momentu, gdy mrozy nie są jeszcze zbyt silne, gdy jednak przekraczają tą temperaturę graniczną, zwykła sól nie wystarcza.
Dlaczego jednak taka mieszanina ochładza się?
Lód, topiąc się, pobiera na ten proces dosyć dużo ciepła, wystarczająco aby ochłodzić całość do niskiej temperatury. Tego typu mieszanki są niekiedy używane do chłodzenia. Dla mieszaniny lody i soli w stosunku 2/1 minimalna temperatura to ok. -20 stopni. Dla mieszanki uwodnionego chlorku wapnia z lodem w ilości 1/0,8 można osiągnąć do -40 stopni. Aby osiągać jeszcze niższe temperatury należy użyć suchego lodu, pozwalającego otrzymać temperatury aż do -78 stopni (z acetonem). W mieszance z eterem dietylowym pozwala na osiągnięcie -100 stopni. Dla jeszcze niższych temperatur używa się ciekłego azotu.
Jeżeli temperatura równowagowa innych soli z lodem jest jeszcze niższa niż dla soli kuchennej, to znaczy, że nadają się i one do odladzania. I faktycznie - chlorek wapnia i magnezu są używane do odladzania podczas silnych mrozów. Jeśli zastosuje się związki bezwodne to podczas rozpuszczania będą wytwarzały dość dużo ciepła, jak to już objaśniałem przy mieszaninach ogrzewających, dając dodatkową korzyść.
Jednak wymienione sole, w odróżnieniu od chlorku sodu, są droższe. Chlorek sodu bądź wydobywa się z kopalń, bądź wyodrębnia z zasolonych wód, że zaś w kraju mamy całkiem przyzwoite złoża, jest to materiał tani - Kłodawa sprzedaje ją za 220-280 zł za tonę netto, oferty które znalazłem podawały ceny rzędu 1500-1800 zł/t dla chlorku wapnia i 2200-2500 zł/t dla chlorku magnezu. Dlatego tego typu środki stosuje się u nas głównie w przypadku silnych mrozów.
Używanie soli do odmrażania ma jednak dość istotne wady - po rozpuszczeniu śniegu pozostaje roztwór solanki, który wnika z podłoże. Zasolenie gleby w miastach jest często tak duże, że nic większego od miniaturowych krzaczków nie chce tam rosnąć. Sól wnikająca w drobne pory betonu i asfaltu osłabia ich strukturę gdy w suchszym okresie zaczyna krystalizować, rozsadzając pory. W przypadku betonu prowadzi to do powstawania odprysków i "łuszczenia się" wierzchniej warstwy. W przypadku asfaltu sprzyja pękaniu. Wnikając w elementy żelazobetonu przyspiesza korozję prętów zbrojeniowych, osłabiając konstrukcje. Z tego samego powodu szkodzi samochodom. Pozostawia także osady na nawierzchni i na butach, a wnikając w skórę buta sprzyja jej pękaniu. W dodatku drogowcy sypią sól bardzo hojnie, czasem wręcz można mieć wrażenie, że wolą posypać niż zgarnąć śnieg. Dlatego od dawna szuka się jej zastępstw.
Wspomniane chlorki wapnia i magnezu są dobrymi alternatywami - są mniej korozyjne i zużywa się ich mniej, co przekłada się na mniejsze stężenie w glebie. Niestety również pozostawiają osady i mimo to nadal wzbogacają ziemię w chlorki. stąd też szybko pojawiły się pomysły zastąpienia chlorków zupełnie innymi solami, znacznie mniej szkodliwymi dla środowiska. Próbowano tutaj stosować preparaty na bazie mocznika, wykazujące działanie do -10 stopni, te jednak dla odmiany mogłyby wywołać przenawożenie gleb, a ponadto zbytnio zalkalizować środowisko.Bardzo ciekawym pomysłem jest preparat Safecoat produkowany z melasy. Przy produkcji białego cukru, po wykrystalizowaniu go z zalkalizowanego zagęszczonego soku, pozostaje odpadowa melasa. Oczyszczone frakcje znajdują zastosowanie w browarnictwie, zaś z pozostałym szlamem, zawierającym chlorek wapnia i inne sole oraz różne substancje organiczne, nie bardzo jest co robić. Amerykanie wpadli na pomysł aby zmieszać te melasowe odpady z solą i wysypywać na drogi; testuje się ten system w niektórych miejscach [1], podobno rezultaty są nie najgorsze. Byłoby bardo ciekawie wprowadzić to u nas - produkuje się u nas bardzo dużo cukru, a melasy eksportujemy do innych krajów najwięcej w europie, z pewnością więc materiał powinien być wyjątkowo tani.
Ciekawym pomysłem są sole prostych kwasów organicznych - octowego i mrówkowego - które łatwo utleniają się i są rozkładane w środowisku. Najpowszechniejszy jest tu octan wapniowo-magnezowy (CMA) powstający przez rozpuszczenie dolomitu w kwasie octowym. Nie zawiera jonów chlorkowych i nie jest tak agresywny korozyjnie; działa do temperatury -12° C, a więc jest prawie tak dobry jak zwykła sól. Stosowanie ogranicza niestety cena - jest prawie 20 razy droższy, głównie z powodu kosztów produkcji kwasu octowego. Mniej stosowany jest octan potasu (KAc), także mało agresywny i niestety drogi, ale mający tą zaletę, że działa dobrze aż do -26° C, w mieszance z mocznikiem jest używany do odladzania pasów startowych lotnisk. W Finlandii stosuje się do tego mrówczanu potasu, w dodatku zalecając używać go na drogach przebiegających przez cenne przyrodniczo obszary i rezerwaty, łatwo bowiem rozkłada się, nawet w niskich temperaturach, a więc nie zanieczyszcza środowiska. Nie znalazłem niestety informacji do jakich temperatur działa, ale musi być dobry skoro sprawdza się w Finlandii.
Wszystkie te alternatywy są niestety droższe, być może postępy biotechnologii pozwolą taniej produkować kwas octowy i mrówkowy na skalę przemysłową, co zmniejszy koszty. Stosunkowo nie najgorszym zastępstwem może być popiół drzewny lub powęglowy, choć działa głównie przez polepszenie przyczepności. No i można jeszcze sypać piaskiem.
Z własnych doświadczeń na ośnieżonym parapecie wynikło mi, że pewne słabe właściwości topienia ma kwasek cytrynowy a nawet cukier puder.
Zajmę się tu jeszcze jedną kwestią, która mnie zafrapowała, gdy szukałem jak to jest z dostępem do tych alternatyw. Często natykałem się na artykuły wychwalające Ekologiczną Sól Drogową , mającą być bardziej wydajną i nieszkodliwą, testowaną w wielu częściach kraju a nawet uznawaną przez ministerstwo ochrony środowiska za bezpieczny zamiennik*. Rzecz oczywista zacząłem szukać składu ale nic nie znalazłem, niektóre artykuły stwierdzały wręcz że skład jest zastrzeżony i opatentowany i dlatego producent nie chce go zdradzać. W zamian za to znalazłem długą listę korzyści, niektóre wydawały się wątpliwe (na przykład pisanie, że zwykła sól przestaje działać przy -6 stopniach) ale pozostałe całkiem uzasadnione. Niektóre artykuły marketingowe wspominają tylko, że nie jest to chlorek wapnia ani potasu. Tylko w kilku miejscach jest wspomniane, że zawiera magnez i potas. Więc może to po prostu mieszanka chlorków tych pierwiastków? Niestety znajduję i takie reklamy, w których twierdzi się, że sól nie zawiera chlorku magnezu. No cóż, zajrzałem więc na jednego z oficjalnych blogów firny, i tam jak byk znajduję ogłoszenia o sprzedaży przez tego samego dostawcę... technicznego chlorku magnezu. Lista zalet przy odladzaniu identyczna.
Zaglądam więc na informację techniczną[2]. Składu brak, tylko wzmianka o obniżonej zawartości "związków chlorku" i informacja że jest biodegradowalna co nie jest zbyt zręcznym określeniem** Przy okazji podano takie dane techniczne, jak masa cząsteczkowa (92,21 g/mol) temperaturę topnienia (708° C) i wrzenia (1412° C) na podstawie których, zaglądając do tablic chemicznych, mogę zidentyfikować związek jako stary, dobrze znany chlorek magnezu.
No to się wyjaśniło. Pozostaje tylko pytanie po co robić marketingową tajemnicę ze składu, skoro można się go domyśleć? Skoro podobno jest zastrzeżony i opatentowany, to można to robić, ale skoro chlorek magnezu już jest używany do tego celu przez różne firmy, obawa o ukradzenie pomysłu na jaką powołuje się producent, jest płonna jak musztarda po obiedzie
------
* Jedynym dokumentem na ten temat jaki znalazłem, była interpelacja poselska, w odpowiedzi na którą ministerstwo stwierdziło, że wykorzystanie ESD leży w gestii zarządcy drogi. To chyba nie to samo co poparcie przez ministerstwo.
** Biodegradacja to rozkład w środowisku związków organicznych. Nie dotyczy soli nieorganicznych i nie jest to to samo co nieszkodliwość.
http://en.wikipedia.org/wiki/De-ice
http://de.wikipedia.org/wiki/Schmelzpunkterniedrigung
http://en.wikipedia.org/wiki/Calcium_Magnesium_Acetate
[1] http://news.bbc.co.uk/local/wiltshire/hi/people_and_places/newsid_9185000/9185244.stm
[2] Informacja techniczna: Ekologiczna Sól Drogowa
 |
| Ziarenko soli drogowej w wytopionej przez siebie jamce |
Topnienie lodu jest przemianą fazową. Faza stała zamienia się bądź to w fazę ciekłą bądź to gazową. Zależy to akurat od warunków - w niskich temperaturach lód może parować w suchym powietrzu, przez co teoretycznie da się wysuszyć pranie na mrozie (tylko kto by tyle czekał?). To w jaki sposób i w jakich warunkach przebiegają przemiany z fazy do fazy, określają równowagi fazowe.
Na to jaka faza, lub układ faz jest akurat trwały, wpływają głównie takie czynniki jak temperatura i ciśnienie - w wysokiej temperaturze lód topnieje, ale pod wysokim ciśnieniem może ponownie zamarznąć. To zrozumiałe. Tak samo jak zrozumiałe jest, że skład substancji wpływa na przebieg równowag - przykładowo woda morska zamarza w zdecydowanie niższej temperaturze.
Teraz na chwilkę się zastanówmy - morze zaczyna zamarzać i na jego powierzchni pojawia się lód. Dla wody w oceanach następuje to w temperaturze -1,9° C. A teraz powiedzmy że temperatura nieco rośnie, do -0,5° C. Pamiętamy że lód topi się w temperaturze 0 stopni. Jest jeszcze za zimno więc - myślimy sobie - lód powinien pozostawać. Tymczasem lód się topi.
Znana nam temperatura topnienia lodu - 0° C - nie jest niczym innym jak temperaturą ustalenia się pewnej równowagi fazowej. W tej temperaturze lód i woda znajdują się w równowadze. Dostarczanie energii zmniejsza ilość fazy stałej, zaś jej odbieranie zmniejsza ilość fazy ciekłej, i tak to trwa aż do zaniku jednej z nich - czyli całkowitego stopienia lub całkowitego zamarznięcia. Tyle tylko, że jest to temperatura równowagi dla faz: Lód/woda. Natomiast w morzu lub w kubku ze słoną wodą mamy do czynienia z fazami: Lód/słona woda - a to już całkiem inna sytuacja.
Ogólnie rzecz biorąc substancje rozpuszczone w wodzie obniżają temperaturę jej topnienia - chyba że same krzepną w wyższych od wody temperaturach. Dla przykładu 40% roztwór alkoholu zamarza przy ok. -35-40° C (czysty etanol zamarza dopiero przy -114). Równowagi fazowe przesuwają się zatem w stronę niższych temperatur. Dla układu lód/nasycony roztwór soli temperatura równowagi to ok. -20° C. Skoro tak, łatwo jest już chyba domyśleć się co zachodzi na naszych chodnikach.
Gdy posypiemy lód solą, jej część rozpuści się od samego zetknięcia. Powstanie roztwór soli, który stykając się z lodem stworzy nasz układ. W takim układzie lód może trwale przebywać w zetknięciu z roztworem w temperaturze -18 czy -20 stopni. Jeśli zatem jest -11 czy -5 to dla takiego układu jest za ciepło. Lód będzie się rozpuszczał, uwalniając chodniki i drogi ze swych węgorzych okowów. Dla bardziej rozcieńczonych roztworów takie błoto może jednak zamarzać już przy mniejszych mrozach.
Pojawia się tu jednak szczególne zjawisko - gdy lód się rozpuszcza, cała mieszanka zaczyna wyraźnie się ochładzać. Dla odpowiednich mieszanek soli z lodem spadek temperatury może sięgać -20 czy -22 stopni, co wykorzystuje się niekiedy do chłodzenia. Jeśli więc mieszanka ochładza się aż do temperatury w której mimo to krzepnie, to dlaczego chodnik posypany solą nie zamarza ponownie po chwili?
A no dlatego, że przecież jest za ciepło. Gdybyśmy naszą chłodzącą mieszankę dobrze odizolowali, to miałaby szansę zamarznąć od samego swojego chłodzenia, ale przecież wciąż jest w kontakcie z za ciepłym otoczeniem. Dlatego nie osiąga tego stanu i cały lód topi się. Wszystko to dobrze działa do momentu, gdy mrozy nie są jeszcze zbyt silne, gdy jednak przekraczają tą temperaturę graniczną, zwykła sól nie wystarcza.
Dlaczego jednak taka mieszanina ochładza się?
Lód, topiąc się, pobiera na ten proces dosyć dużo ciepła, wystarczająco aby ochłodzić całość do niskiej temperatury. Tego typu mieszanki są niekiedy używane do chłodzenia. Dla mieszaniny lody i soli w stosunku 2/1 minimalna temperatura to ok. -20 stopni. Dla mieszanki uwodnionego chlorku wapnia z lodem w ilości 1/0,8 można osiągnąć do -40 stopni. Aby osiągać jeszcze niższe temperatury należy użyć suchego lodu, pozwalającego otrzymać temperatury aż do -78 stopni (z acetonem). W mieszance z eterem dietylowym pozwala na osiągnięcie -100 stopni. Dla jeszcze niższych temperatur używa się ciekłego azotu.
Jeżeli temperatura równowagowa innych soli z lodem jest jeszcze niższa niż dla soli kuchennej, to znaczy, że nadają się i one do odladzania. I faktycznie - chlorek wapnia i magnezu są używane do odladzania podczas silnych mrozów. Jeśli zastosuje się związki bezwodne to podczas rozpuszczania będą wytwarzały dość dużo ciepła, jak to już objaśniałem przy mieszaninach ogrzewających, dając dodatkową korzyść.
Jednak wymienione sole, w odróżnieniu od chlorku sodu, są droższe. Chlorek sodu bądź wydobywa się z kopalń, bądź wyodrębnia z zasolonych wód, że zaś w kraju mamy całkiem przyzwoite złoża, jest to materiał tani - Kłodawa sprzedaje ją za 220-280 zł za tonę netto, oferty które znalazłem podawały ceny rzędu 1500-1800 zł/t dla chlorku wapnia i 2200-2500 zł/t dla chlorku magnezu. Dlatego tego typu środki stosuje się u nas głównie w przypadku silnych mrozów.
Używanie soli do odmrażania ma jednak dość istotne wady - po rozpuszczeniu śniegu pozostaje roztwór solanki, który wnika z podłoże. Zasolenie gleby w miastach jest często tak duże, że nic większego od miniaturowych krzaczków nie chce tam rosnąć. Sól wnikająca w drobne pory betonu i asfaltu osłabia ich strukturę gdy w suchszym okresie zaczyna krystalizować, rozsadzając pory. W przypadku betonu prowadzi to do powstawania odprysków i "łuszczenia się" wierzchniej warstwy. W przypadku asfaltu sprzyja pękaniu. Wnikając w elementy żelazobetonu przyspiesza korozję prętów zbrojeniowych, osłabiając konstrukcje. Z tego samego powodu szkodzi samochodom. Pozostawia także osady na nawierzchni i na butach, a wnikając w skórę buta sprzyja jej pękaniu. W dodatku drogowcy sypią sól bardzo hojnie, czasem wręcz można mieć wrażenie, że wolą posypać niż zgarnąć śnieg. Dlatego od dawna szuka się jej zastępstw.
Wspomniane chlorki wapnia i magnezu są dobrymi alternatywami - są mniej korozyjne i zużywa się ich mniej, co przekłada się na mniejsze stężenie w glebie. Niestety również pozostawiają osady i mimo to nadal wzbogacają ziemię w chlorki. stąd też szybko pojawiły się pomysły zastąpienia chlorków zupełnie innymi solami, znacznie mniej szkodliwymi dla środowiska. Próbowano tutaj stosować preparaty na bazie mocznika, wykazujące działanie do -10 stopni, te jednak dla odmiany mogłyby wywołać przenawożenie gleb, a ponadto zbytnio zalkalizować środowisko.Bardzo ciekawym pomysłem jest preparat Safecoat produkowany z melasy. Przy produkcji białego cukru, po wykrystalizowaniu go z zalkalizowanego zagęszczonego soku, pozostaje odpadowa melasa. Oczyszczone frakcje znajdują zastosowanie w browarnictwie, zaś z pozostałym szlamem, zawierającym chlorek wapnia i inne sole oraz różne substancje organiczne, nie bardzo jest co robić. Amerykanie wpadli na pomysł aby zmieszać te melasowe odpady z solą i wysypywać na drogi; testuje się ten system w niektórych miejscach [1], podobno rezultaty są nie najgorsze. Byłoby bardo ciekawie wprowadzić to u nas - produkuje się u nas bardzo dużo cukru, a melasy eksportujemy do innych krajów najwięcej w europie, z pewnością więc materiał powinien być wyjątkowo tani.
Ciekawym pomysłem są sole prostych kwasów organicznych - octowego i mrówkowego - które łatwo utleniają się i są rozkładane w środowisku. Najpowszechniejszy jest tu octan wapniowo-magnezowy (CMA) powstający przez rozpuszczenie dolomitu w kwasie octowym. Nie zawiera jonów chlorkowych i nie jest tak agresywny korozyjnie; działa do temperatury -12° C, a więc jest prawie tak dobry jak zwykła sól. Stosowanie ogranicza niestety cena - jest prawie 20 razy droższy, głównie z powodu kosztów produkcji kwasu octowego. Mniej stosowany jest octan potasu (KAc), także mało agresywny i niestety drogi, ale mający tą zaletę, że działa dobrze aż do -26° C, w mieszance z mocznikiem jest używany do odladzania pasów startowych lotnisk. W Finlandii stosuje się do tego mrówczanu potasu, w dodatku zalecając używać go na drogach przebiegających przez cenne przyrodniczo obszary i rezerwaty, łatwo bowiem rozkłada się, nawet w niskich temperaturach, a więc nie zanieczyszcza środowiska. Nie znalazłem niestety informacji do jakich temperatur działa, ale musi być dobry skoro sprawdza się w Finlandii.
Wszystkie te alternatywy są niestety droższe, być może postępy biotechnologii pozwolą taniej produkować kwas octowy i mrówkowy na skalę przemysłową, co zmniejszy koszty. Stosunkowo nie najgorszym zastępstwem może być popiół drzewny lub powęglowy, choć działa głównie przez polepszenie przyczepności. No i można jeszcze sypać piaskiem.
Z własnych doświadczeń na ośnieżonym parapecie wynikło mi, że pewne słabe właściwości topienia ma kwasek cytrynowy a nawet cukier puder.
Zajmę się tu jeszcze jedną kwestią, która mnie zafrapowała, gdy szukałem jak to jest z dostępem do tych alternatyw. Często natykałem się na artykuły wychwalające Ekologiczną Sól Drogową , mającą być bardziej wydajną i nieszkodliwą, testowaną w wielu częściach kraju a nawet uznawaną przez ministerstwo ochrony środowiska za bezpieczny zamiennik*. Rzecz oczywista zacząłem szukać składu ale nic nie znalazłem, niektóre artykuły stwierdzały wręcz że skład jest zastrzeżony i opatentowany i dlatego producent nie chce go zdradzać. W zamian za to znalazłem długą listę korzyści, niektóre wydawały się wątpliwe (na przykład pisanie, że zwykła sól przestaje działać przy -6 stopniach) ale pozostałe całkiem uzasadnione. Niektóre artykuły marketingowe wspominają tylko, że nie jest to chlorek wapnia ani potasu. Tylko w kilku miejscach jest wspomniane, że zawiera magnez i potas. Więc może to po prostu mieszanka chlorków tych pierwiastków? Niestety znajduję i takie reklamy, w których twierdzi się, że sól nie zawiera chlorku magnezu. No cóż, zajrzałem więc na jednego z oficjalnych blogów firny, i tam jak byk znajduję ogłoszenia o sprzedaży przez tego samego dostawcę... technicznego chlorku magnezu. Lista zalet przy odladzaniu identyczna.
Zaglądam więc na informację techniczną[2]. Składu brak, tylko wzmianka o obniżonej zawartości "związków chlorku" i informacja że jest biodegradowalna co nie jest zbyt zręcznym określeniem** Przy okazji podano takie dane techniczne, jak masa cząsteczkowa (92,21 g/mol) temperaturę topnienia (708° C) i wrzenia (1412° C) na podstawie których, zaglądając do tablic chemicznych, mogę zidentyfikować związek jako stary, dobrze znany chlorek magnezu.
No to się wyjaśniło. Pozostaje tylko pytanie po co robić marketingową tajemnicę ze składu, skoro można się go domyśleć? Skoro podobno jest zastrzeżony i opatentowany, to można to robić, ale skoro chlorek magnezu już jest używany do tego celu przez różne firmy, obawa o ukradzenie pomysłu na jaką powołuje się producent, jest płonna jak musztarda po obiedzie
------
* Jedynym dokumentem na ten temat jaki znalazłem, była interpelacja poselska, w odpowiedzi na którą ministerstwo stwierdziło, że wykorzystanie ESD leży w gestii zarządcy drogi. To chyba nie to samo co poparcie przez ministerstwo.
** Biodegradacja to rozkład w środowisku związków organicznych. Nie dotyczy soli nieorganicznych i nie jest to to samo co nieszkodliwość.
http://en.wikipedia.org/wiki/De-ice
http://de.wikipedia.org/wiki/Schmelzpunkterniedrigung
http://en.wikipedia.org/wiki/Calcium_Magnesium_Acetate
[1] http://news.bbc.co.uk/local/wiltshire/hi/people_and_places/newsid_9185000/9185244.stm
[2] Informacja techniczna: Ekologiczna Sól Drogowa
Subskrybuj:
Komentarze (Atom)
















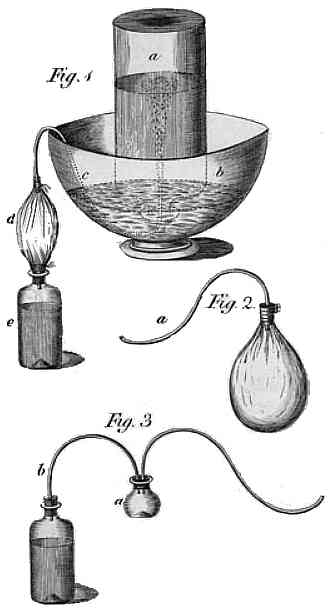










-sulfate.jpg)




