Jakiś czas temu kupiłem w sklepie bezcukrowe cukierki, zaciekawiony co też to za dziwo. Smakowały dziwnie, były raczej słodkawe i można by powiedzieć, że smak był stonowany, bo zarówno słodycz, owocowy posmak jak i mentolowa nuta nie stanowiły wyraźnej dominanty. Ze składu wynikało, że faktycznie nie zawierały cukru, ponad 80% stanowił tajemniczo brzmiący izomalt i syrop izomaltitolowy, co do których domyśleć się mogłem jedynie po nazwie, że zapewne są to alkohole cukrowe pochodne maltozy. Substancje takie, otrzymywane z naturalnych cukrów są stosunkowo często używane jako zamienniki cukru.
A ponieważ jest ich dość dużo, dobrze było poświęcić im osobny wpis.
Cukry to grupa związków organicznych, charakteryzująca się licznymi grupami hydroksylowymi (-OH) połączonymi z atomami węgla tworzącymi łańcuch nasycony, podobnie jak w alkoholach, oraz przynajmniej jedną grupą aldehydową (-CHO) lub ketonową (-C=O), za sprawą której możliwe jest dla nich utworzenie formy pierścieniowej jako hemiacetal. Są też nazywane węglowodanami, bo ich skład pierwiastkowy daje się sprowadzić do wzoru Cx(H2O)y, choć jest trochę wyjątków, jak cukry deoksy.
Na atomach węgla z dołączonymi grupami hydroksylowymi pojawia się szczególna geometria asymetrycznego ułożenia czterech podstawników, przy której możliwe stają się dwie konfiguracje - R i S, różniące się kolejnością przestrzenną dwóch podstawników.
Sytuacja taka dotyczy każdego atomu węgla z grupą hydroksylową, z wyjątkiem końcowego, który ma dwa takie same podstawniki, wodory. Ponieważ cukry zawierają wiele takich atomów, możliwych staje się wiele izomerów, różniących się tylko konfiguracją na poszczególnych węglach ale o takim samym składzie i budowie ogólnej. Dla cukrów sześciowęglowych cztery atomy węgla posiadają asymetrię, a ponieważ dla każdego możliwe są dwie konfiguracje, to istnieje 16 różnych cukrów sześciowęglowych. Jednym z nich jest glukoza.
Najpowszechniej używany do słodzenia cukier stołowy, czyli sacharoza, to związek złożony z dwóch cząsteczek cukrów, glukozy i fruktozy.
Ponieważ formalnie rzecz biorąc cukry są ketonami lub aldehydami, bo posiadają jedną taką grupę, można poddać je utlenieniu, do otrzymania kwasu karboksylowego, lub redukcji. W tym ostatnim przypadku zarówno grupa ketonowa jak i aldehydowa zamienią się w kolejny człon C-OH. Słodziki takie jak ksylitol czy sorbitol są zatem formalnie alkoholami!
Oczywiście nikt się nimi nie upije. Mają one smak słodki podobny do smaku wyjściowych cukrów, jednak zwykle nie są tak łatwo wchłaniane przez organizm, a co za tym idzie, nie mają tak samo dużej kaloryczności. Z tego też powodu zaczęły być używane jako niskokaloryczne słodziki polepszające smak żywności, zwłaszcza tej przeznaczonej dla cukrzyków, muszących dbać o poziom glukozy i insuliny. A ponieważ cukrów wyjściowych jest dużo, to i alkoholi cukrowych znamy i używamy dość wiele. Omówię te faktycznie stosowane w przemyśle spożywczym.
Omówienie alkoholi cukrowych najlepiej zacząć od tych najkrótszych, a więc po kolei:
Glicerol (E 442)
Lepiej znany jako gliceryna, składnik tłuszczów, bardziej kojarzony jako składnik kosmetyków. Łańcuch zawiera tylko trzy węgle. Jeszcze prostszy glikol etylenowy też bywa uznawany za alkohol cukrowy choć jego aldehyd nie jest cukrem, ale tego w żywności nie spotkamy.
Gliceryna to higroskopijna, gęsta, syropowata ciecz o lekko słodkawym smaku stanowiącym około 50-60% słodkości sacharozy. Raczej nie jest używana jako jedyny słodzik, bardziej służy za rozpuszczalnik wzmacniający smak innych środków słodzących, ponadto służy do zagęszczania i zapobiegania wysychaniu. Jest też składnikiem lukrów do ozdabiania ciastek, zapewnia bowiem półpłynną konsystencję bez krystalizacji w opakowaniu. Mieszając się z wodą nieco się ogrzewa, stąd może być mieszana ze słodzikami które ochładzają się przy rozpuszczaniu jeśli akurat nie jest to pożądane
Jako dodatek do żywności jest bezpieczna, organizm metabolizuje ją tylko częściowo, włączając do szlaku przetwarzania węglowodanów ale z minimalnym użyciem insuliny, stąd też jej bardzo niski indeks glikemiczny. Nie stanowi pożywki dla bakterii wywołujących próchnicę ani dla jelitowych, może jednak wykazywać efekt przeczyszczający, znany zresztą wszystkim używającym glicerynowych czopków. Bywa używana jako dodatkowy słodzik w żywności dla diabetyków oraz jako zamiennik alkoholu w preparatach farmaceutycznych i wyciągach ziołowych (gliceryty) jeśli akurat sam alkohol nie jest wskazany.
Erytrytol
Produkt redukcji erytrozy, czterowęglowego cukru prostego zawartego między innymi w ogonkach liści rabarbaru, od którego wziął nazwę (greckie "erythros" czyli "zaczerwieniony"). Wyjściowy cukier nie występuje w naturze zbyt często, dlatego substratem jest glukoza. Poddaje się ją fermentacji z użyciem kolonii grzybów z rodzaju Moniliella lub Aureobasidium, które zwykle odpowiadają za psucie się wysokosłodzonej żywności. Rozbijają one sześciowęglową cząsteczkę glukozy i w warunkach beztlenowych końcowym produktem jest gotowy erytrytol obok innych polioli.
Związek ten ma smak bardzo podobny co sacharozy i niewiele mniejszą słodkość, rzędu 70-80%. Wykazuje synergizm z innymi słodzikami, częściowo maskując gorzki posmak, stąd chętne użycie wraz ze stewią. Co jednak najbardziej interesujące, nie jest prawie w ogóle metabolizowany. Większość zażytej dawki wchłania się jeszcze w jelicie cienkim, po czym w formie niezmienionej zostaje wydalona z moczem. Około 10% dostaje się do jelita grubego, tam jednak bakterie nie za bardzo się nim interesują. Powoduje to, że w odróżnieniu od ksylitolu czy sorbitolu, które w większości przedostają się do okrężnicy i działają osmotycznie, erytrytol nie wywołuje rozwolnienia czy wzdęć.
Ostatecznie tylko niewielka ilość zostaje zmetabolizowana, bez wykorzystania insuliny, stąd przypisuje się mu indeks glikemiczny bliski zeru i kaloryczność ok. 0,2 Kcal.
[1]
Jego diastereoizomerem, różniącym się konfiguracją, jest treitol. Nie jest jednak używany jako słodzik.
Ksylitol
Pięciowęglowy poliol otrzymywany przez redukcję ksylozy, składnika zdrewniałych części roślin. W naturze w wolnej postaci występuje rzadko, głownie w soku niektórych owoców. Jego słodkość jest zbliżona do sacharozy, natomiast indeks glikemiczny wielokrotnie niższy. Wynika to stąd, że jest słabo wchłaniany, duża część pozostaje w treści jelit, część wchłoniętego jest wydalana z moczem. Pewna ilość ksylitolu może być trawiona przez bakterie jelitowe do krótkołańcuchowych kwasów tłuszczowych i w takiej formie wykorzystana; ponadto pewna ilość wchłoniętego związku może być zamieniana w glikogen w wątrobie, ale jest to proces powolny. Łącznie efekty te dają kaloryczność możliwą do wykorzystania przez organizm około 2,4 Kcal, o 40% mniejszą od cukru stołowego.
Przechodzenie dużej ilości ksylitolu do treści jelita grubego skutkuje działaniem osmotycznym, zauważalnym zwłaszcza u osób, których dieta nie zawierała dotychczas takiego składnika. Zanim organizm się przyzwyczai i zacznie inaczej reagować, odpowiednio duża jednorazowa dawka działa rozwalniająco. Ponadto pewien stopień trawienia przez bakterie jelitowe może u niektórych skutkować wzdęciami. Poza tymi drobnymi przypadłościami nie zaobserwowano szkodliwego działania nawet bardzo dużych dawek.
Ksylitol jest natomiast toksyczny dla psów i niektórych ptaków, ze względu na zbyt silne pobudzenie wydzielania insuliny. Dawanie zwierzętom diabetycznych smakołyków raczej nie jest dobrym pomysłem. Napisałem o nim osobny artykuł, tam więcej informacji (Link).
Sorbitol
Alkohol sześciowęglowy otrzymywany przez redukcję glukozy, w naturze występujący w niewielkich ilościach w soku jabłkowym i śliwkowym, po raz pierwszy wyizolowano go z owoców jarzębiny, skąd wzięła się nazwa. Jest chętnie używany w żywności dietetycznej czy gumach do żucia "bez cukru". Jest w małym stopniu wchłaniany i przechodzi do treści jelita grubego, gdzie w zbyt dużej ilości może działać przeczyszczająco. Prawdopodobnie obok samego tylko błonnika przyczynia się do przeczyszczającego działania suszonych śliwek, w których występuje obficie. Bywa używany w medycynie jako diuretyk do obniżania ciśnienia wewnątrz oka
Mannitol
Drugi alkohol sześciowęglowy, od sorbitolu różniący się konfiguracją na asymetrycznych atomach węgla, formalnie będący produktem redukcji mannozy. Zwykle otrzymywany przez uwodornianie fruktozy, ale także stosunkowo duża część zapotrzebowania jest uzupełniana ze źródeł naturalnych, obficie występuje w niektórych krasnorostach i owocach, oraz w soku jesionu mannowego od którego wziął nazwę. Słodkość podobna do cukru stołowego i niski indeks glikemiczny powodują, że także jest chętnie używany jako słodzik.
Stopiony tworzy masę podobną do szkła, która jest praktycznie niehigroskopijna, stąd użycie w cukierkach, gumach do żucia, w polewach pokrywających draże oraz jako składnik ozdób cukierniczych.
Mannitol ma ważne zastosowania medyczne. W formie zastrzyku dożylnego jest używany do szybkiego obniżania ciśnienia wewnątrz gałki ocznej, co wykorzystuje się w leczeniu jaskry, oraz obniża nadmierne ciśnienie wewnątrzczaszkowe. Dodatkowo może zmniejszać obrzęki regulując wydalanie wody. Dożylnie zwiększa też wydzielanie wody przez nerki, co wykorzystuje się przy leczeniu skąpomoczu i przy eliminacji toksyn.
Laktitol
Zredukowana forma laktozy, dwucukru występującego w mleku. Laktoza składa się z cząsteczki glukozy i cząsteczki galaktozy. Laktitol jest otrzymywany poprzez selektywne zredukowanie tylko składowej cząsteczki glukozy, w związku z czym formalnie jest połączeniem galaktozy z mannitolem. Słodycz stanowi około 40% słodkości białego cukru. Ponieważ związek jest dość stabilny w wysokich temperaturach oraz mikrobiologicznie, jest chętnie używanym dodatkiem do dietetycznych wypieków, ciasteczek, czekolady i kremów.
W większych ilościach może działać przeczyszczająco, bywa składnikiem leków przeciw zaparciom. Nie jest polecany osobom nie trawiącym galaktozy.
Maltitol
Produkt częściowej redukcji maltozy, dwucukru złożonego z dwóch cząsteczek glukozy, naturalnie obecnego w dekstrynach i słodzie. Redukcji ulega tylko jedna cząsteczka składowa, toteż formalnie jest to połączenie glukozy i sorbitolu. Produkuje się go w wyniku uwodornienia syropu kukurydzianego, produktu częściowej hydrolizy skrobi. Powstaje wówczas mieszanina maltitolu, sorbitolu i częściowo uwodornionych wielocukrów.
Właściwości fizyczne ma bardzo podobne do sacharozy - podobny smak, gęstość, temperaturę topnienia, skłonność do karmelizacji, dlatego może zastępować ją we wszystkich zastosowaniach spożywczych.
W bardzo dużych ilościach na raz, działa przeczyszczająco, choć ryzyko jest w tym przypadku małe.
Izomalt
Mieszanina częściowo zredukowanych dwucukrów. Wytwarzana w dwuetapowym procesie - najpierw sacharoza jest poddawana reakcji z enzymem otrzymywanym z pewnych bakterii, który zamienia ją w izomaltulozę. Jest to dwucukier w którym glukoza i fruktoza są połączone w inny sposób. W sacharozie jest to wiązanie łączące atom nr.1 jednej cząsteczki z atomem nr.2 drugiej. W izomaltulozie wiązanie przeskakuje w pozycję 1-6. Skutkuje to tym, że jest to cukier o właściwościach redukujących.
Uwodornienie izomaltulozy daje mieszaninę dwóch związków, w związku z tym, że w części przypadków uwodorniła się tylko składowa cząsteczka glukozy a w innym tylko fruktozy, powstaje więc glukozo-sorbitol czyli maltitol, oraz glukozo-mannitol.
Izomalt jest używany głównie do bezcukrowych cukierków, łatwo bowiem tworzy przezroczystą, niehigroskopijną masę i nie ma skłonności do zlepiania się z innymi cukierkami. Jest odporny na krystalizację, stąd użycie do ozdób cukierniczych i rzeźb z topionego cukru
Uwodorniony hydrolizat skrobiowy (HSH)
Mieszanina różnych związków, otrzymywana przez uwodornienie dekstryn wytwarzanych przez częściową hydrolizę skrobi. Może zawierać wyraźną przewagę jednego alkoholu cukrowego, na przykład sorbitolu czy mannitolu, jeśli jednak ponad 50% stanowią częściowo zredukowane wielocukry, używa się właśnie takiej nazwy. Słodkość zależy od stopnia uwodornienia, dochodzi do 50% słodkości białego cukru. Stanowi dodatkowy składnik obok innych słodzików, oraz środek zwiększający lepkość i gęstość
-------
[1] http://ncl.csircentral.net/920/1/th1868.pdf
informacje
środa, 14 lutego 2018
niedziela, 28 stycznia 2018
Co jeszcze, oprócz soli, rozpuszcza lód? (eksperyment)
Prognozy pogody wskazujące na to, że śnieg który spadł w mojej okolicy zbyt długo się nie utrzyma, popędziły mnie do przeprowadzenia doświadczenia o którym myślałem już od pewnego czasu - do sprawdzenia jakie jeszcze prócz soli substancje z kuchni mają właściwość rozpuszczania lodu i śniegu?
Jak to już kiedyś tłumaczyłem w artykule, wiele substancji powoduje roztopienie lodu nawet w ujemnych temperaturach, ze względu na tworzenie nowej równowagi fazowej. Wobec ich roztworów w wodzie lód nie jest trwały w zbyt wysokich temperaturach. Sól kuchenna, to jest chlorek sodu, może rozpuszczać lód aż do temperatury -21 stopni, chlorek wapnia niemal do -50.
Ze względu na szkodliwe działanie soli na rośliny, samochody i budowle czyni się próby zastąpienia jej czymś innym, zwłaszcza na terenach przyrodniczo cennych. Takimi mniej korozyjnymi, ekologicznymi zamiennikami może być octan wapnia, mocznik czy mrówczan sodu. Czy natomiast możliwe jest stworzenie sobie w domu jakiegoś takiego środka, który pomagałby usuwać lód z chodników i podjazdów i zastępowałby sól i piasek?
Aby to sprawdzić wyjąłem kilka substancji, jakie każdy powinien mieć w kuchni - kwasek cytrynowy, sodę oczyszczoną i amoniak do ciast. Następnie wyszedłem przed dom i na ostatnim schodku przygotowałem około centymetrową warstwę śniegu, w której uformowałem poletka doświadczalne:
Zgodnie pokazaną kolejnością testowałem samą sodę, sam kwasek, ich mieszaninę, sam amoniaczek i sól kamienną. Ostatnie poletko zostawiłem bez ingerencji, aby mieć z czym porównać wygląd pozostałych. Na prostokąty śniegu wysypałem przygotowane substancje w ilości dwóch szczypt między kciukiem a palcem wskazującym. Podczas testu, na zewnątrz utrzymywała się temperatura -6 stopni.
Przez następne pół godziny przyglądałem się czy widać istotne zmiany. Najwyraźniej efekty było widać na polu posypanym solą kuchenną - szybko pojawiły się wytopione jamki wokół kryształków, z bliska było widać, jak śnieg nasącza się wodą. Po pewnym czasie spod spodu zaczął przebijać schodek. Na polach posypanych sodą i amoniakiem nie działo się nic szczególnego:
Na poletku posypanym samym kwaskiem cytrynowym dostrzec można było pojawienie się wytopionych jamek wokół kryształków. Najintensywniejszy efekt pojawił się na poletku posypanym i kwaskiem cytrynowym i sodą, śnieg zaczął się roztapiać z wierzchu:
Gdy wyjrzałem na schody jeszcze po godzinie, śnieg w miejscu posypanym solą niemal zupełnie się roztopił, na poletku posypanym kwaskiem i sodą miejscami przebijało się podłoże, na poletku z samym kwaskiem było widać tylko powierzchniowe nadtopienie, a soda i amoniaczek nic nie zmieniły.
W zasadzie spodziewałem się takich efektów. Cytrynian sodu jest w takich niskich temperaturach lepiej rozpuszczalny od samego kwasu, szybsze rozpuszczanie to więcej jonów cytrynianowych, które odpowiadają za efekt odladzający.
Zacząłem więc szukać, czy tego rodzaju eksperymenty zostały już opisane w literaturze.
Na zbliżony pomysł wpadli w zeszłym roku amerykańscy naukowcy.[1] W artykule na temat aktywności różnych soli w rozpuszczaniu lodu, porównywano sól kuchenną, chlorek wapnia, siarczan magnezu (sól z Epsom) i cytrynian trójsodowy. Eksperyment polegał na mierzeniu jaką objętość wody wytopi w stałej temperaturze badana sól rozprowadzona na powierzchni bloku lodu o znanej masie. Chlorek wapnia okazał się działać silniej niż sól kuchenna, taka sama ilość wytapiała więcej lodu. Gorzej działał siarczan magnezu, zaś cytrynian sodu pokazał dość paradoksalny wynik - gdy eksperyment prowadzono w temperaturze pokojowej, z bloku lodu posypanego cytrynianem wytopiło się mniej wody.
Cytrynian trójsodowy rozpuszczając się w wodzie pochłania ciepło, tym samym może hamować topienie lodu. Eksperyment w temperaturze +4, w którym sprawdzano jeszcze wpływ ilości użytej soli pokazał, że gdy cytrynianu użyto bardzo mało, na tyle że pochłanianie ciepła nie ma aż tak dużego wpływu, efekt roztapiania był porównywalny a może nawet nieco lepszy niż dla tej samej niewielkiej ilości soli kuchennej.
Jak to się ma do mojego doświadczenia? Wprawdzie u mnie mieszanina kwasu cytrynowego i sodu działała słabiej niż sól, ale trudno mówić o powstrzymywaniu topnienia, bo jednak w porównaniu z polem kontrolnym śnieg jednak się roztapiał i to lepiej niż pod wpływem samego kwasku.
Po pierwsze, ściśle rzecz biorąc nie zachodziło tutaj rozpuszczanie stałego cytrynianu sodu, powstawał on w roztworze podczas reakcji kwasku z sodą, więc efekt energetyczny rozpuszczania tej soli nie wchodził w grę. Sama reakcja zobojętniania jest nieco endotermiczna [2], ale w danych na temat jej ciepła znalazłem tylko reakcje prowadzące do cytrynianu trójsodowego, otrzymywanego w reakcji z większą ilością sody niż kwasku, tymczasem ja użyłem podobnych ilości obu związków. Widocznie efekt energetyczny przy takiej proporcji i użytej ogółem ilości jest nieznaczący, a powstały cytrynian sodu już dalej sam działa odladzająco.
Ogółem więc jednak łatwo dostępna sól wypada najlepiej, cytrynian sodu lub mieszanina kwasku cytrynowego z sodą ma pewien potencjał, choć działa słabiej. Innych przypraw nie testowałem.
-------
[1] Talen Sehgal, Christopher Wright, Breaking the Ice: A Scientific Take on the Ice Melting Abilities of Household Salts, Journal of Emerging Investigators, December 2017
[2] https://derekcarrsavvy-chemist.blogspot.com/2015/12/chemical-energetics-4-measuring.html
Jak to już kiedyś tłumaczyłem w artykule, wiele substancji powoduje roztopienie lodu nawet w ujemnych temperaturach, ze względu na tworzenie nowej równowagi fazowej. Wobec ich roztworów w wodzie lód nie jest trwały w zbyt wysokich temperaturach. Sól kuchenna, to jest chlorek sodu, może rozpuszczać lód aż do temperatury -21 stopni, chlorek wapnia niemal do -50.
Ze względu na szkodliwe działanie soli na rośliny, samochody i budowle czyni się próby zastąpienia jej czymś innym, zwłaszcza na terenach przyrodniczo cennych. Takimi mniej korozyjnymi, ekologicznymi zamiennikami może być octan wapnia, mocznik czy mrówczan sodu. Czy natomiast możliwe jest stworzenie sobie w domu jakiegoś takiego środka, który pomagałby usuwać lód z chodników i podjazdów i zastępowałby sól i piasek?
Aby to sprawdzić wyjąłem kilka substancji, jakie każdy powinien mieć w kuchni - kwasek cytrynowy, sodę oczyszczoną i amoniak do ciast. Następnie wyszedłem przed dom i na ostatnim schodku przygotowałem około centymetrową warstwę śniegu, w której uformowałem poletka doświadczalne:
Zgodnie pokazaną kolejnością testowałem samą sodę, sam kwasek, ich mieszaninę, sam amoniaczek i sól kamienną. Ostatnie poletko zostawiłem bez ingerencji, aby mieć z czym porównać wygląd pozostałych. Na prostokąty śniegu wysypałem przygotowane substancje w ilości dwóch szczypt między kciukiem a palcem wskazującym. Podczas testu, na zewnątrz utrzymywała się temperatura -6 stopni.
Przez następne pół godziny przyglądałem się czy widać istotne zmiany. Najwyraźniej efekty było widać na polu posypanym solą kuchenną - szybko pojawiły się wytopione jamki wokół kryształków, z bliska było widać, jak śnieg nasącza się wodą. Po pewnym czasie spod spodu zaczął przebijać schodek. Na polach posypanych sodą i amoniakiem nie działo się nic szczególnego:
Na poletku posypanym samym kwaskiem cytrynowym dostrzec można było pojawienie się wytopionych jamek wokół kryształków. Najintensywniejszy efekt pojawił się na poletku posypanym i kwaskiem cytrynowym i sodą, śnieg zaczął się roztapiać z wierzchu:
Gdy wyjrzałem na schody jeszcze po godzinie, śnieg w miejscu posypanym solą niemal zupełnie się roztopił, na poletku posypanym kwaskiem i sodą miejscami przebijało się podłoże, na poletku z samym kwaskiem było widać tylko powierzchniowe nadtopienie, a soda i amoniaczek nic nie zmieniły.
W zasadzie spodziewałem się takich efektów. Cytrynian sodu jest w takich niskich temperaturach lepiej rozpuszczalny od samego kwasu, szybsze rozpuszczanie to więcej jonów cytrynianowych, które odpowiadają za efekt odladzający.
Zacząłem więc szukać, czy tego rodzaju eksperymenty zostały już opisane w literaturze.
Na zbliżony pomysł wpadli w zeszłym roku amerykańscy naukowcy.[1] W artykule na temat aktywności różnych soli w rozpuszczaniu lodu, porównywano sól kuchenną, chlorek wapnia, siarczan magnezu (sól z Epsom) i cytrynian trójsodowy. Eksperyment polegał na mierzeniu jaką objętość wody wytopi w stałej temperaturze badana sól rozprowadzona na powierzchni bloku lodu o znanej masie. Chlorek wapnia okazał się działać silniej niż sól kuchenna, taka sama ilość wytapiała więcej lodu. Gorzej działał siarczan magnezu, zaś cytrynian sodu pokazał dość paradoksalny wynik - gdy eksperyment prowadzono w temperaturze pokojowej, z bloku lodu posypanego cytrynianem wytopiło się mniej wody.
Cytrynian trójsodowy rozpuszczając się w wodzie pochłania ciepło, tym samym może hamować topienie lodu. Eksperyment w temperaturze +4, w którym sprawdzano jeszcze wpływ ilości użytej soli pokazał, że gdy cytrynianu użyto bardzo mało, na tyle że pochłanianie ciepła nie ma aż tak dużego wpływu, efekt roztapiania był porównywalny a może nawet nieco lepszy niż dla tej samej niewielkiej ilości soli kuchennej.
Jak to się ma do mojego doświadczenia? Wprawdzie u mnie mieszanina kwasu cytrynowego i sodu działała słabiej niż sól, ale trudno mówić o powstrzymywaniu topnienia, bo jednak w porównaniu z polem kontrolnym śnieg jednak się roztapiał i to lepiej niż pod wpływem samego kwasku.
Po pierwsze, ściśle rzecz biorąc nie zachodziło tutaj rozpuszczanie stałego cytrynianu sodu, powstawał on w roztworze podczas reakcji kwasku z sodą, więc efekt energetyczny rozpuszczania tej soli nie wchodził w grę. Sama reakcja zobojętniania jest nieco endotermiczna [2], ale w danych na temat jej ciepła znalazłem tylko reakcje prowadzące do cytrynianu trójsodowego, otrzymywanego w reakcji z większą ilością sody niż kwasku, tymczasem ja użyłem podobnych ilości obu związków. Widocznie efekt energetyczny przy takiej proporcji i użytej ogółem ilości jest nieznaczący, a powstały cytrynian sodu już dalej sam działa odladzająco.
Ogółem więc jednak łatwo dostępna sól wypada najlepiej, cytrynian sodu lub mieszanina kwasku cytrynowego z sodą ma pewien potencjał, choć działa słabiej. Innych przypraw nie testowałem.
-------
[1] Talen Sehgal, Christopher Wright, Breaking the Ice: A Scientific Take on the Ice Melting Abilities of Household Salts, Journal of Emerging Investigators, December 2017
[2] https://derekcarrsavvy-chemist.blogspot.com/2015/12/chemical-energetics-4-measuring.html
poniedziałek, 22 stycznia 2018
Chemiczne wieści (14.)
Radioaktywne ocieplenie
Następujące w ostatnich dekadach ocieplenie globalnego klimatu, związane z przekształceniami ekosystemów, wycinaniem lasów i działalnością przemysłową, okazuje się wywoływać nietypowy skutek - woda w oceanach staje się coraz bardziej radioaktywna.
Porównując wyniki pomiarów zawartości radioizotopów w wodzie Oceanu Arktycznego, badacze z USA stwierdzili, że zawartość izotopu radu 227 wzrosła dwukrotnie w ciągu dziesięciu lat. Wzrost dotyczył głównie rejonów, które odmarzają latem silniej niż w poprzednich dekadach. Najprawdopodobniej brak całorocznej pokrywy lodu morskiego intensyfikuje mieszanie wód, zwiększa oddziaływanie fal i zwiększa siłę prądów przypowierzchniowych. Powoduje to spłukanie i przemieszczanie osadów dennych, zwłaszcza na płytkich obszarach szelfów kontynentalnych. Takie obszary są pokryte osadami rzecznymi, zawierającymi związki uranu i toru, praktycznie nierozpuszczalne w wodzie morskiej. Podczas naturalnego rozpadu powstaje z nich rad, który jest lepiej rozpuszczalny, ale zwykle więźnie w warstwach osadowych. Chyba, że poruszy je silniej mieszana wiatrem woda.
Największym źródłem radu jest w oceanie arktycznym wschodniosyberyjski szelf oceaniczny, rozległy obszar bardzo płytkiego morza w pobliżu cieśniny Beringa. [1]
Substancje sprzyjające życiu w meteorycie
Poszukiwacze życia w kosmosie z pewnością zainteresują się wiadomością, że w pewnych meteorytach udało się znaleźć mieszankę podstawowych substancji, sprzyjających powstaniu życia. Przebadano między innymi meteoryt Monahans, który spadł w marcu 1998 roku w Teksasie. Dwa fragmenty spadły na miasto, jeden wbił się w piasek koło boiska szkolnego, drugi wybił niewielki kraterek w asfalcie ulicy.[2] W ich składzie, oprócz ziaren typowych dla chondrytów węglistych, znajdowały się także błękitne kryształy halitu, czyli soli kamiennej, i podobnego sylwinu. Drugim badanym był meteoryt spadły kilka miesięcy później w Maroko, także zawierający halit, możliwe że oba pochodziły z tego samego źródła.
Po latach przeanalizowano dokładniej skład minerału, mając na uwadze, że podczas szybkiej krystalizacji halit może zamykać w małych pęcherzykach porcje roztworu wokół kryształu. Jak się okazało, kryształy z meteorytu zawierają tego typu inkluzje z wodą i związkami organicznymi. Są to głównie alifatyczne węglowodory, związki aromatyczne z grupami aminowymi i tiolowymi, ale także pewna ilość aminokwasów w tym występujące w białkach glicyna, alfa-alanina i beta-alanina, czy niebiałkowe jak kwas gamma-aminomasłowy czy eta-aminokapronowy. Oceniono, że takie aminokwasy mogły powstać w wyniku reakcji chemicznych prostych gazów na ziarnach mineralnych w niezbyt wysokich temperaturach. Pod względem składu enancjomerycznego były to w zasadzie racematy, tylko alanina wykazywała 5% nadmiar formy L.
Analiza ilości izotopów azotu w aminokwasach wykazała inny stosunek niż na Ziemi, co dowodziło pozaziemskiego źródła.[3]
Wcześniejsze badania meteorytu wskazywały na uformowanie się jego materii w stosunkowo dużym obiekcie planetoidalnym, zawierającym przynajmniej w pewnym okresie rezerwuary ciepłej, słonej wody, może w formie warstwy pokrytej lodem, o szacunkowej średnicy 150-250 km. W takich warunkach drogą dość powolnego narastania tworzyły się kryształy halitu, sylwinu i innych lekkich minerałów. Następnie zostały wyrzucone na powierzchnię pokrytą skalnym regolitem, gdzie scementowały się z ziarnami glinokrzemianów i związków węglistych. Ciemne ziarna meteorytu pochłonęły przez ten czas gazy szlachetne z wiatru słonecznego, co wskazuje na zaleganie tego fragmentu blisko powierzchni. Kolejne zdarzenie wyrzuciło bryłkę przemieszanych minerałów, która ostatecznie spadła na Ziemię. Szacunkowy wiek to 4,5 mld lat, czyli materia pochodzi z okresu bliskiego formowaniu się Układu Słonecznego.[4]
Jak na taki mały kamyczek, na prawdę sporo informacji.
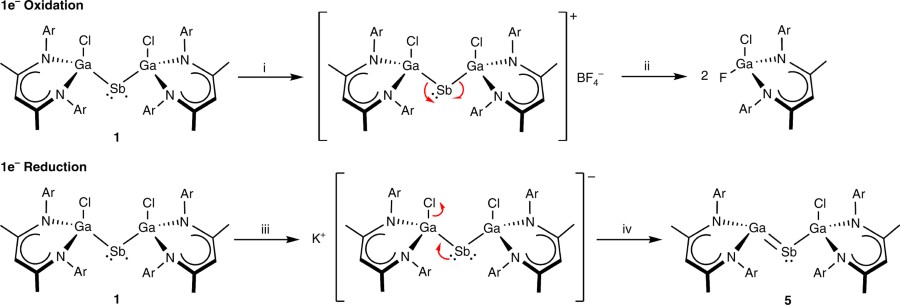
Galoantymonen
Pierwszy przykład obojętnego związku z podwójnym wiązaniem Ga=Sb.
Chemicy bardzo chętnie sprawdzają, czy pewne teoretycznie możliwe połączenia pierwiastków, faktycznie są w stanie występować. Tworzono już takie związki, jak z podwójnym wiązaniem bor-bor czy sześciokrotnym molibden-molibden. Ostatnia publikacja z Nature opisuje eksperymenty na kompleksach metaloorganicznych, w których występuje rzadkie wiązanie gal-bizmut i gal-antymon. Ze względu na zbliżoną elektroujemność i małą energię, metale przejściowe niechętnie tworzą między sobą wiązania. W tym przypadku pomogło dobranie odpowiednio rozbudowanego ligandu organicznego.
Gdy jedno z testowanych połączeń, zawierające gal, antymon, dwa ligandy organiczne i połączony jonowo chlor zredukowano przy pomocy grafitku potasu, między atomami metalu powstało wiązanie podwójne, zwykle kojarzone bardziej ze związkami organicznymi. [5]
Fluorescencja sterowana temperaturą
Zespół opracowujący materiał do koncetratorów światła słonecznego, dokonał przy okazji ciekawego odkrycia materiału, który nie tylko świeci ale też bardzo wyraźnie zmienia kolor świecenia w zależności od temperatury.
Koncentrator fotowoltaiczny to specyficzne urządzenie, które skierowuje padające na niego światło w stronę ogniw fotowoltaicznych. Wydajność energetyczna takiego ogniwa często zależy od natężenia padającego światła, jeśli będzie oświetlone słońcem, będzie osiągać swoją maksymalną sprawność, ale niech tylko słońce zakryje cienka warstwa chmur a nie dość, że na ogniwo będzie padać mniej światła, to jeszcze ono samo będzie przetwarzać na prąd mniejszą ilość tego światła. Stąd powstał pomysł, aby skupiać światło na ogniwach może mniejszych, ale dzięki lepszej wydajności i tak dostarczających więcej prądu. Oprócz koncentratorów typowo optycznych, opartych o szkła czy lustra, sporo uwagi poświęca się koncentratorom luminescencyjnym.
Urządzenie takie ma postać półprzezroczystej płytki, zawierającej materiał, który pochłania część światła przechodzącego i równocześnie sam świeci, ale już bez zachowania kierunku. Ponieważ płytka luminescencyjna jest cienka oraz ma dużo większą gęstość niż powietrze dookoła, wyświecane we wszystkich kierunkach wtórne światło odbija się od wewnątrz w płytce i wylatuje na zewnątrz samymi krawędziami. To tam instaluje się ogniwa słoneczne. Płytka o rozmiarach szyby okiennej może pochłaniać boczną powierzchnią 10% światła, co daje efekt słabego przyciemnienia, ale ta zebrana całą płaszczyzną ilość energii, gdy zostanie skierowania w stronę krawędzi, daje już całkiem jasne światło, z którego można pozyskać trochę prądu.
W opisanym w artykule, który wpadł mi w oko [6], układzie zbierającym, użyto zielonego barwnika fluorescencyjnego umieszczonego w matrycy ciekłego kryształu z dodatkiem perylenodiimidu, będącego akceptorem elektronowym. No i znów trzeba nieco wyjaśnić - ciekłe kryształy to substancje zawierające gęsto upakowane cząsteczki bardzo długie i płaskie, które w pewnych niskich temperaturach zyskują właściwości podobne do krystalicznych. W warstwach tworzonych przez cząsteczki, wszystkie są z braku miejsca ułożone tak samo, choć mają pewną swobodę ruchu. Są niby krystalicznie uporządkowane, ale wciąż są ciekłe. Po podgrzaniu do odpowiednio wysokiej temperatury cząsteczki tracą to uporządkowanie, stając się chaotyczną cieczą.
Badacze zwrócili uwagę na to, że gdy badana mieszanina znajduje się w fazie ciekłokrystalicznej, to jest z cząsteczkami poukładanymi w porządku i ściśle, będący silnym akceptorem perylenodiimid jest słabo rozpuszczalny i tworzy agregaty. W takiej fazie za świecenie odpowiada wyłącznie wolny barwnik, który świeci na zielono. Po podgrzaniu cieczy do powstania fazy nieuporządkowanej, akceptor staje się dobrze rozpuszczalny. Dzięki temu może tworzyć z barwnikiem kompleksy donor-akceptor. W takim połączeniu barwnik reaguje na światło inaczej, i tym razem świeci na czerwono.
Do uzyskania kompletnie innego koloru wystarczy zmiana temperatury o 30 stopni.
-----
[1] Ignatius G. Rigor et al. Increased fluxes of shelf-derived materials to the central Arctic Ocean. Science Advances, 2018; 4 (1): eaao1302 DOI: 10.1126/sciadv.aao1302
[2] https://www.lpi.usra.edu/meteor/?code=16719
[3] Queenie H. S. Chan et al. Organic matter in extraterrestrial water-bearing salt crystals. Science Advances, 2018 DOI: 10.1126/sciadv.aao3521
[4] http://www.meteoritestudies.com/protected_MONAHANS.HTM
[5] Chelladurai Ganesamoorthy et al. From stable Sb- and Bi-centered radicals to a compound with a Ga=Sb double bond, Nature Communications 9, Article number: 87 (2018)
[6] Michael G. Demije et.al. Temperature-Responsive Luminescent Solar Concentrators: Tuning Energy Transfer in a Liquid Crystalline Matrix, Angew. Chem. Int. Ed. Volume 57, Issue 4
January 22, 2018 Pages 1030–1033 - Artykuł dostępny na zasadach Open Acces
Następujące w ostatnich dekadach ocieplenie globalnego klimatu, związane z przekształceniami ekosystemów, wycinaniem lasów i działalnością przemysłową, okazuje się wywoływać nietypowy skutek - woda w oceanach staje się coraz bardziej radioaktywna.
Porównując wyniki pomiarów zawartości radioizotopów w wodzie Oceanu Arktycznego, badacze z USA stwierdzili, że zawartość izotopu radu 227 wzrosła dwukrotnie w ciągu dziesięciu lat. Wzrost dotyczył głównie rejonów, które odmarzają latem silniej niż w poprzednich dekadach. Najprawdopodobniej brak całorocznej pokrywy lodu morskiego intensyfikuje mieszanie wód, zwiększa oddziaływanie fal i zwiększa siłę prądów przypowierzchniowych. Powoduje to spłukanie i przemieszczanie osadów dennych, zwłaszcza na płytkich obszarach szelfów kontynentalnych. Takie obszary są pokryte osadami rzecznymi, zawierającymi związki uranu i toru, praktycznie nierozpuszczalne w wodzie morskiej. Podczas naturalnego rozpadu powstaje z nich rad, który jest lepiej rozpuszczalny, ale zwykle więźnie w warstwach osadowych. Chyba, że poruszy je silniej mieszana wiatrem woda.
Największym źródłem radu jest w oceanie arktycznym wschodniosyberyjski szelf oceaniczny, rozległy obszar bardzo płytkiego morza w pobliżu cieśniny Beringa. [1]
Substancje sprzyjające życiu w meteorycie
Poszukiwacze życia w kosmosie z pewnością zainteresują się wiadomością, że w pewnych meteorytach udało się znaleźć mieszankę podstawowych substancji, sprzyjających powstaniu życia. Przebadano między innymi meteoryt Monahans, który spadł w marcu 1998 roku w Teksasie. Dwa fragmenty spadły na miasto, jeden wbił się w piasek koło boiska szkolnego, drugi wybił niewielki kraterek w asfalcie ulicy.[2] W ich składzie, oprócz ziaren typowych dla chondrytów węglistych, znajdowały się także błękitne kryształy halitu, czyli soli kamiennej, i podobnego sylwinu. Drugim badanym był meteoryt spadły kilka miesięcy później w Maroko, także zawierający halit, możliwe że oba pochodziły z tego samego źródła.
Po latach przeanalizowano dokładniej skład minerału, mając na uwadze, że podczas szybkiej krystalizacji halit może zamykać w małych pęcherzykach porcje roztworu wokół kryształu. Jak się okazało, kryształy z meteorytu zawierają tego typu inkluzje z wodą i związkami organicznymi. Są to głównie alifatyczne węglowodory, związki aromatyczne z grupami aminowymi i tiolowymi, ale także pewna ilość aminokwasów w tym występujące w białkach glicyna, alfa-alanina i beta-alanina, czy niebiałkowe jak kwas gamma-aminomasłowy czy eta-aminokapronowy. Oceniono, że takie aminokwasy mogły powstać w wyniku reakcji chemicznych prostych gazów na ziarnach mineralnych w niezbyt wysokich temperaturach. Pod względem składu enancjomerycznego były to w zasadzie racematy, tylko alanina wykazywała 5% nadmiar formy L.
Analiza ilości izotopów azotu w aminokwasach wykazała inny stosunek niż na Ziemi, co dowodziło pozaziemskiego źródła.[3]
Wcześniejsze badania meteorytu wskazywały na uformowanie się jego materii w stosunkowo dużym obiekcie planetoidalnym, zawierającym przynajmniej w pewnym okresie rezerwuary ciepłej, słonej wody, może w formie warstwy pokrytej lodem, o szacunkowej średnicy 150-250 km. W takich warunkach drogą dość powolnego narastania tworzyły się kryształy halitu, sylwinu i innych lekkich minerałów. Następnie zostały wyrzucone na powierzchnię pokrytą skalnym regolitem, gdzie scementowały się z ziarnami glinokrzemianów i związków węglistych. Ciemne ziarna meteorytu pochłonęły przez ten czas gazy szlachetne z wiatru słonecznego, co wskazuje na zaleganie tego fragmentu blisko powierzchni. Kolejne zdarzenie wyrzuciło bryłkę przemieszanych minerałów, która ostatecznie spadła na Ziemię. Szacunkowy wiek to 4,5 mld lat, czyli materia pochodzi z okresu bliskiego formowaniu się Układu Słonecznego.[4]
Jak na taki mały kamyczek, na prawdę sporo informacji.
Galoantymonen
Pierwszy przykład obojętnego związku z podwójnym wiązaniem Ga=Sb.
Chemicy bardzo chętnie sprawdzają, czy pewne teoretycznie możliwe połączenia pierwiastków, faktycznie są w stanie występować. Tworzono już takie związki, jak z podwójnym wiązaniem bor-bor czy sześciokrotnym molibden-molibden. Ostatnia publikacja z Nature opisuje eksperymenty na kompleksach metaloorganicznych, w których występuje rzadkie wiązanie gal-bizmut i gal-antymon. Ze względu na zbliżoną elektroujemność i małą energię, metale przejściowe niechętnie tworzą między sobą wiązania. W tym przypadku pomogło dobranie odpowiednio rozbudowanego ligandu organicznego.
Gdy jedno z testowanych połączeń, zawierające gal, antymon, dwa ligandy organiczne i połączony jonowo chlor zredukowano przy pomocy grafitku potasu, między atomami metalu powstało wiązanie podwójne, zwykle kojarzone bardziej ze związkami organicznymi. [5]
Fluorescencja sterowana temperaturą
Zespół opracowujący materiał do koncetratorów światła słonecznego, dokonał przy okazji ciekawego odkrycia materiału, który nie tylko świeci ale też bardzo wyraźnie zmienia kolor świecenia w zależności od temperatury.
Koncentrator fotowoltaiczny to specyficzne urządzenie, które skierowuje padające na niego światło w stronę ogniw fotowoltaicznych. Wydajność energetyczna takiego ogniwa często zależy od natężenia padającego światła, jeśli będzie oświetlone słońcem, będzie osiągać swoją maksymalną sprawność, ale niech tylko słońce zakryje cienka warstwa chmur a nie dość, że na ogniwo będzie padać mniej światła, to jeszcze ono samo będzie przetwarzać na prąd mniejszą ilość tego światła. Stąd powstał pomysł, aby skupiać światło na ogniwach może mniejszych, ale dzięki lepszej wydajności i tak dostarczających więcej prądu. Oprócz koncentratorów typowo optycznych, opartych o szkła czy lustra, sporo uwagi poświęca się koncentratorom luminescencyjnym.
Urządzenie takie ma postać półprzezroczystej płytki, zawierającej materiał, który pochłania część światła przechodzącego i równocześnie sam świeci, ale już bez zachowania kierunku. Ponieważ płytka luminescencyjna jest cienka oraz ma dużo większą gęstość niż powietrze dookoła, wyświecane we wszystkich kierunkach wtórne światło odbija się od wewnątrz w płytce i wylatuje na zewnątrz samymi krawędziami. To tam instaluje się ogniwa słoneczne. Płytka o rozmiarach szyby okiennej może pochłaniać boczną powierzchnią 10% światła, co daje efekt słabego przyciemnienia, ale ta zebrana całą płaszczyzną ilość energii, gdy zostanie skierowania w stronę krawędzi, daje już całkiem jasne światło, z którego można pozyskać trochę prądu.
W opisanym w artykule, który wpadł mi w oko [6], układzie zbierającym, użyto zielonego barwnika fluorescencyjnego umieszczonego w matrycy ciekłego kryształu z dodatkiem perylenodiimidu, będącego akceptorem elektronowym. No i znów trzeba nieco wyjaśnić - ciekłe kryształy to substancje zawierające gęsto upakowane cząsteczki bardzo długie i płaskie, które w pewnych niskich temperaturach zyskują właściwości podobne do krystalicznych. W warstwach tworzonych przez cząsteczki, wszystkie są z braku miejsca ułożone tak samo, choć mają pewną swobodę ruchu. Są niby krystalicznie uporządkowane, ale wciąż są ciekłe. Po podgrzaniu do odpowiednio wysokiej temperatury cząsteczki tracą to uporządkowanie, stając się chaotyczną cieczą.
Badacze zwrócili uwagę na to, że gdy badana mieszanina znajduje się w fazie ciekłokrystalicznej, to jest z cząsteczkami poukładanymi w porządku i ściśle, będący silnym akceptorem perylenodiimid jest słabo rozpuszczalny i tworzy agregaty. W takiej fazie za świecenie odpowiada wyłącznie wolny barwnik, który świeci na zielono. Po podgrzaniu cieczy do powstania fazy nieuporządkowanej, akceptor staje się dobrze rozpuszczalny. Dzięki temu może tworzyć z barwnikiem kompleksy donor-akceptor. W takim połączeniu barwnik reaguje na światło inaczej, i tym razem świeci na czerwono.
Do uzyskania kompletnie innego koloru wystarczy zmiana temperatury o 30 stopni.
-----
[1] Ignatius G. Rigor et al. Increased fluxes of shelf-derived materials to the central Arctic Ocean. Science Advances, 2018; 4 (1): eaao1302 DOI: 10.1126/sciadv.aao1302
[2] https://www.lpi.usra.edu/meteor/?code=16719
[3] Queenie H. S. Chan et al. Organic matter in extraterrestrial water-bearing salt crystals. Science Advances, 2018 DOI: 10.1126/sciadv.aao3521
[4] http://www.meteoritestudies.com/protected_MONAHANS.HTM
[5] Chelladurai Ganesamoorthy et al. From stable Sb- and Bi-centered radicals to a compound with a Ga=Sb double bond, Nature Communications 9, Article number: 87 (2018)
[6] Michael G. Demije et.al. Temperature-Responsive Luminescent Solar Concentrators: Tuning Energy Transfer in a Liquid Crystalline Matrix, Angew. Chem. Int. Ed. Volume 57, Issue 4
January 22, 2018 Pages 1030–1033 - Artykuł dostępny na zasadach Open Acces
niedziela, 14 stycznia 2018
Detoksy-Mistyfikacje
Panująca w ostatnich latach moda na oczyszczanie organizmu z bliżej nieokreślonych "toksyn", posiada dwie charakterystyczne cechy - wyolbrzymianie przyczyn i wyolbrzymianie efektów oczyszczenia. To pierwsze realizowane jest przez przypisanie aktualnie modnej przyczynie wszystkich ciężkich chorób, raz wszystkie choroby wywołują "robaki" kiedy indziej grzyby, raz są to metale ciężkie, kiedy indziej opryski rolnicze, raz szczepionki, kiedy indziej mleko. Do wyboru, do koloru, nie sposób trafić na człowieka, który z tym kontaktu nie miał.
Natomiast wyolbrzymiane skutków oprócz obietnicy wyleczenia z ciężkich chorób, oraz równie ważnego schudnięcia w dwa tygodnie, odbywa się też przez zaprezentowanie detoksu w efektownej wizualnie formie. Najlepiej byłoby, gdyby uwalniane toksyny było dobrze widać. Jeszcze lepiej, gdyby wyglądało to obrzydliwie i przypominało brud. Jeśli zaś toksyny nie chcą tak ładnie wyglądać, trzeba im jakoś pomóc...
Plastry czyli brunatnienie octu
Plastry detoksyfikujące wciąż jeszcze są dosyć popularne. Nakleja się je na stopy na noc i rano są całe zbrązowiałe, pokryte kleistą substancją i niemile pachną. I oczywiście ta brązowa substancja to toksyny z organizmu.
Problem w tym, że podobny efekt daje zwilżenie plastra. W ich składzie znajdują się substancje chłonące wilgoć i wyciągi roślinne o brązowym kolorze. W ciągu nocy plaster chłonie wilgoć ze skóry, zwłaszcza pot, więc rano są wilgotne a zawartość saszetki zabawia plaster na brązowo.
Ale, ale - przecież jeśli stosuje się je regularnie, to po pewnym czasie przestają brązowieć. Z czego to wynika? Jednym ze składników takich plastrów jest ocet drzewny otrzymywany ponoć z pędów bambusa. Kwas octowy działając kilka godzin na skórę przez kilkanaście dni, powoduje obkurczenie gruczołów potowych i przejściowe zmniejszenie potliwości na tym fragmencie skóry.
Robiono już testy z ochotnikami i po przeanalizowaniu składu plastrów nie stwierdzono, aby po całonocnym użytkowaniu pojawiały się w nim jakieś metale ciężkie czy znane substancje toksyczne.[1]
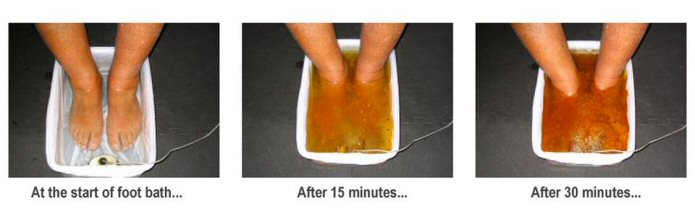
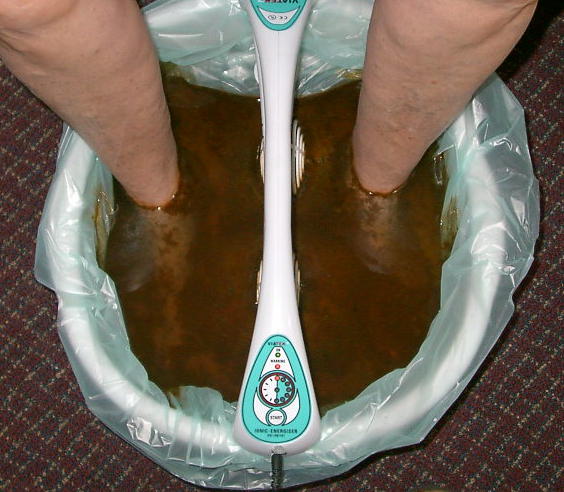
Wanna z błotkiem czyli elektroliza
Pod pewnym względem podobna wydaje się popularna zwłaszcza kilka lat temu metoda z wanienkami, mającymi wywoływać wydalenie toksyn przez stopy. Zanurzało się stopy w korytku, trzymało w rękach elektrody, a po pewnym czasie od włączenia urządzenia, woda robiła się brązowa i śmierdziała. Prowadzący zabieg tłumaczył, że oto pole elektryczne spowodowało wydalenie toksyn do wody i to brązowe w misce to nasze toksyny.
Urządzenie składa się przede wszystkim z miski na wodę i płaskich elektrod, koniecznie stalowych bo inaczej nie zadziała, zasilane jest najczęściej zasilaczem podobnym do tych do telefonów komórkowych, stosując niskie napięcie 12 V i bezpiecznie niskie natężenie.
Dlaczego elektrody muszą być stalowe? Bo inaczej nie zrobi się nam błotko. Nie jest potrzebne nawet wkładanie stóp, zrobi się samo byle płynął prąd.
W urządzeniu takim zachodzi prosta elektroliza wody, zwykle lekko posolonej dla lepszego przewodnictwa, z prądem stałym podłączonym w taki sposób, że na elektrodach w wodzie pojawia się ładunek dodatni. Pod wpływem takiego ładunku zachodzi reakcja utlenienia żelaza z elektrody, w pewnym stopniu też wydzielenie tlenu. Jony żelaza i tlen tworzą tlenki i wodorotlenki, tworzące ostatecznie brązowy osad, zaciemniający wodę i udający toksyny. Efekty wizualne zabiegu nie mają żadnego związku z detoksem.
Biorąc pod uwagę, że stale nierdzewne zawierają domieszki niklu i chromu, które mogą uwalniać się podczas zabiegu do roztworu, namaczanie w nim stóp może się okazać bardzo szkodliwe dla skóry. Nie od dziś wiadomo, że nikiel jest silnym alergenem a chrom wywołuje podrażnienia.
Teoretycznie puszczenie napięcia od rąk do stóp mogłoby spowodować migrację jonów z organizmu do wody, za sprawą jonoforezy, czyli ruchu jonów pod wpływem prądu elektrycznego. Jednak aby, jak to piszą wykonujący ten zabieg szarlatani, usuwać w ten sposób kationy metali ciężkich należałoby... podłączyć prąd dokładnie odwrotnie! Kationy, czyli jony o ładunku dodatnim, migrują do elektrody o ładunku ujemnym, bo przeciwieństwa (elektryczne) się przyciągają.
Ale jak się już domyślacie, podłączenie prądu odwrotnie nie będzie utleniało elektrod i barwiło wody na brązowo. Warto by więc rozważyć, czy przypadkiem podczas zabiegu nie dochodzi do elektroforetycznego wchłaniania do organizmu wspomnianych niklu i chromu z rozpuszczonej elektrody. Co byłoby dla nas dużo bardziej szkodliwe.
W 2012 roku wykonano zresztą eksperymenty z użyciem dostępnych komercyjnie zestawów "Jonowej Kąpieli Stóp". Najpierw badacze przygotowali roztwór soli w destylowanej wodzie, w ilości podanej przez producenta urządzenia i zbadali zawartość w nim kilkunastu pierwiastków. Następnie wlali do urządzenia i włączyli zgodnie z przepisem na 20 minut, bo tyle trwa normalny zabieg, ale nikt nie wkładał tam stóp. Chodziło o sprawdzenie, na ile skład wody zmienia samo działanie urządzenia. Po minięciu odpowiedniego czasu, pobrali wodę z urządzenia i zbadali zmiany zawartości pierwiastków. Wyniki wyglądają bardzo niepokojąco:
- w wodzie pojawił się arsen, kobalt, mangan i kadm, toksyczne pierwiastki
- zawartość wanadu wzrosła o 5800% (z 1 do 59 ug/l)
- zawartość niklu wzrosła o 750 000% (z 2 do 15 179 ug/l)
- zawartość molibdenu wzrosła o 6100% (z 50 do 3155 ug/l)
- zawartość chromu wzrosła o 590 000% (z 4 do 23 634 ug/l)
- zawartość żelaza wzrosła o 375 000% (z 31 do 116 000 ug/l)
- łączny wzrost zawartości składników mineralnych przekroczył milion procentów.
Nic dziwnego, że woda zrobiła się brązowa. A to wszystko po włączeniu wanienki bez wkładania nóg. Zresztą, strach wkładać do czegoś takiego nogę. Skład odpowiada zawartości metali w stali nierdzewnej wysokochromowej.
Zrobiono też jednak testy z ochotnikami, którzy byli poddawani zabiegowi w wanience kilkakrotnie w ciągu czterech tygodni, zgodnie z zalecaną przez producenta kuracją. Także badano zmiany zawartości pierwiastków w wodzie przed i po zabiegu, w moczu ochotników przed i po zabiegu oraz we włosach ochotników przed serią wielu zabiegów i po czterech tygodniach. Ilość metali ciężkich w wanienkach podczas zabiegów wzrastała bardzo podobnie, do wody uwalniane były te same pierwiastki w podobnej ilości - może tylko chromu i niklu było jeszcze więcej, wzrosty ich stężeń dochodziły do miliona procent, co mogło wynikać ze zużywania się elektrod w urządzeniu. Sprawdzano zresztą całkowitą ilość uwalnianych pierwiastków, stwierdzając że stopniowo spadała w miarę kolejnych eksperymentów na tym samym urządzeniu, a ostatecznie przeprowadzono ich 30, wykazując jak szybko rozpuszczają się elektrody.
Podczas badania moczu ochotników stwierdzono u jednego z nich wzrost ilości metali ciężkich w miarę kolejnych zabiegów, zaś w badaniu składu mineralnego włosów także gwałtowny wzrost zawartości metali ciężkich u jednego ochotnika. W przypadku pozostałych ludzi, zmiany ilości pierwiastków były bardzo małe i miały różny kierunek. Nie dało się więc potwierdzić usunięcia metali ciężkich z organizmu w miarę powtarzanych zabiegów w wanience, bo w przypadku pozostałych badanych ilości pierwiastków się nie zmieniły, natomiast wzrost zawartości metali w moczu i włosach jednego pacjenta sugerowałby raczej wzrost zawartości w organizmie, a więc przytrucie.[2]
Ten sam widowiskowy efekt był też wykorzystywany przez przedstawicieli handlowych sprzedających filtry do wody - na pokazach, na które zapraszano głównie naiwne starsze osoby, pokazywano elektrolizę żelaznych elektrod w wodzie wodociągowej, po czym porównywano z elektrolizą w wodzie destylowanej, która przewodzi prąd bardzo słabo i nie daje takich skutków.
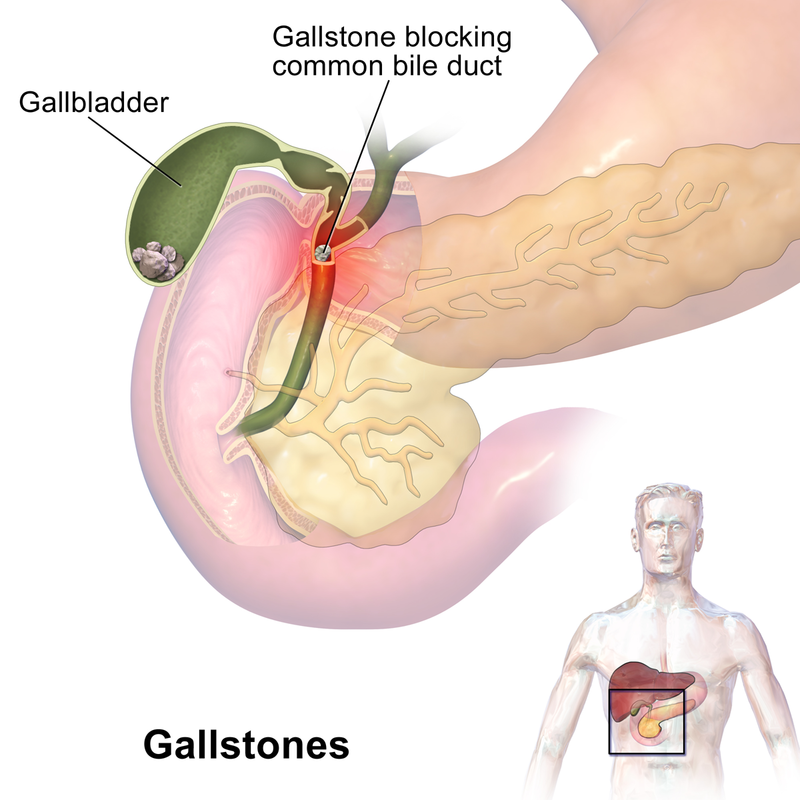
Kamienie prawie żółciowe
Jednym z najpopularniejszych domowych sposobów oczyszczania wątroby, jest wypijanie mieszanki oliwy z sokiem cytrynowym. Efekty ponoć mają być spektakularne, zwłaszcza wydalanie kamieni żółciowych w ilościach hurtowych, zupełnie bez bólu i z możliwością ominięcia operacji. Niestety wielu mających problemy z kamieniami żółciowymi przekonało się już, że mimo poprawnego wykonania takiego zabiegu i wydalenia żółtawych grudek, ilość złogów w ich woreczkach wcale nie spadła. Skoro tak, to skąd się one biorą?
Wątroba i trzustka produkują płyny obfitujące w enzymy trawienne, sole kwasów żółciowych, sole cholesterolu i związki mineralne. Powstała z ich zmieszania się w drogach żółciowych żółć, jest tymczasowo przechowywana w woreczku, oczywiście też żółciowym. Gdy receptory w jelicie w obszarze zakończenia przewodu żółciowego wyczują tłuszcz w treści jelita cienkiego, pobudzony pęcherzyk kurczy się, uwalniając żółć. Ma ona bardzo zasadowy odczyn więc neutralizuje kwas żołądkowy, oraz co ważniejsze, zawiera enzym lipazę który ma trawić tłuszcz. Lipaza rozbija cząsteczki tłuszczów, rozkładając je na kwasy tłuszczowe i glicerynę.
W dalszej kolejności kwasy tłuszczowe powinny zostać podczas trawienia wchłonięte, toteż w normalnej sytuacji kał nie zawiera zbyt dużo tłustych treści. Chyba, że zalejemy jelito dużą ilością tłuszczu i jeszcze popchniemy środkiem przeczyszczającym.
W najpopularniejszej wersji metody używa się jednorazowych dawek oliwy rzędu szklanki czy półtora, wypijanych duszkiem na pusty żołądek, i doprawianych sokiem cytrusowym, często dla lepszego oczyszczenia po pewnym czasie wypija się roztwór soli z Epsom, soli glauberskiej czy jakiegoś innego środka poprawiającego wypróżnianie. Po takiej dawce oleju w jelitach tworzy się dość dużo wolnych kwasów tłuszczowych, które nie mają czasu zostać dalej strawione i wchłonięte, zamiast tego zostają wydalone. W połączeniu z solami mineralnymi (zwłaszcza połkniętą solą z Epsom będącą siarczanem magnezu) kwasy te tworzą trudnorozpuszczalne mydła.
Tym, co zostaje ostatecznie wydalone, są grudki zawierające mydła, wolne kwasy tłuszczowe i składniki żółci, o kolorze od żółtego, przez żółtawozielony do wyraźnie zielonych (kolor zależy od składników oliwy, ilości żółci i treści jelit), uformowane przez ruchy robaczkowe w formę "kamyków".
Chorzy, którzy stosowali tą metodę wiele razy, donosili o liczbach rzędu setek a nawet tysięcy złogów, co przekracza pojemność woreczka żółciowego. Dlatego też szarlatani twierdzą, że dodatkowe ilości złogów schodzą z przewodów żółciowych czy nawet z wnętrza wątroby (wędrują przez miąższ organu?) i dlatego jest ich tak dużo. Jak łatwo się domyśleć, "kamyki" będą się pojawiały tak długo jak długo chory będzie pił oliwę a jego wątroba produkowała żółć. Chyba, że w trakcie "kuracji" woreczek się w końcu zatka a pacjent trafi do szpitala z ostrym zapaleniem.
W 2005 roku w czasopiśmie medycznym The Lancet opisano przypadek kobiety ze stwierdzonymi złogami w woreczku żółciowym, która chciała oczyścić się tą metodą. Prowadzący ją lekarze postanowili wykorzystać okazję i sprawdzić, czy to faktycznie działa. Pacjentka wypiła 600 ml oleju z oliwek i 300 ml soku z cytryny w kilku porcjach. Wydaliła wiele żółtozielonych "kamyczków", które wzięto do analizy. Złogi roztapiały się w gorącej wodzie, w ich składzie brakowało cholesterolu, bilirubiny i soli wapniowych kwasów żółciowych, a więc składników kamieni z woreczka żółciowego. Głównym składnikiem okazało się mydło kwasu oleinowego oraz długocząsteczkowe, trudnotopliwe kwasy tłuszczowe. Wnioskiem lekarzy było stwierdzenie, że wydalone złogi utworzyły się w wyniku trawienia oliwy w jelicie i nie pochodziły z dróg żółciowych.[3]
Wystarczy zresztą zastanowić się nad tym, w jaki sposób mogłoby wyglądać takie wydalanie - niektórzy opisują wydalenie tą metodą złogów o wielkości kilku centymetrów. Kanał żółciowy ma jednak ograniczoną szerokość, złóg większy niż kilka milimetrów po prostu go zatka. Masa tych rozmiarów, przesuwająca się wzdłuż żółciowodu, który jest przewodem dość dobrze unerwionym, musi skończyć się potwornym bólem, czyli atakiem kolki żółciowej. Jeśli więc ktoś nie czuł niczego szczególnego a wydalił centymetrową kulkę, to nie pochodzi ona z jego pęcherzyka.[4] Sól z Epsom nie poszerzy przewodu żółciowego aż tak bardzo (a tak twierdzą szarlatani), bo nie jest on zbyt elastyczny i się nie rozciągnie.
Ponieważ metoda przynosi efekty wyglądające spektakularnie, chętnie powołują się na nią różni dieto-uzdrawiacze. W Polsce najszerzej znana jest jako metoda Huldy Clark, od autorki książek na temat oczyszczania organizmu i leczenia raka, tytułującej się doktorem choć nie ukończyła nigdy medycyny. Inna nazwa to metoda dr Brouse, albo dr Kelley, albo dr. Moritza, bo wielu specjalistów od diety się pod nią podczepiało, z drobnymi modyfikacjami w rodzaju zastąpienia cytryny sokiem jabłkowym.
Pisał o niej też Tombak a za nim, z lekkimi modyfikacjami, Słonecki, tylko u nich miała to być metoda na kamienie kałowe, rzekomo gromadzące się w człowieku w kilogramowych ilościach. Obecnie bez cytowania źródła wspominają o niej liczne portale lifestylowe, jest to więc jedna z najbardziej popularnych medycznych bzdur w temacie oczyszczania organizmu.
Kapsułki oszustwa
W świetnej książce reporterskiej "Nic nie zdarza się przypadkiem" autor, włoski dziennikarz Tiziano Terzani, opisuje kilka lat walki z nowotworem, podczas której równolegle do leczenia klasycznego jeździł po świecie od uzdrawiacza do uzdrawiacza, w pewien sposób dając obraz kultur poprzez ich podejście do zdrowia i śmierci.
W jednym z rozdziałów opisuje jak to został zaproszony na egzotyczną wyspę na dwutygodniową sesję oczyszczającą, polegającą na głodówce, zażywaniu witamin i saunie. Prowadzący zachęcał obecnych aby codziennie oglądali na sitku, czy wydalają z organizmu złogi i toksyny, mające mieć postać żelowatych grudek różnych kolorów. Dowodem na to, że organizm się oczyścił, miało być ich zniknięcie z wydalin, jeśli do końca kuracji nie znikały, można było ją przedłużyć.
Po kilku dniach reporter zorientował się, że w skład suplementów witaminowych wchodził środek żelujący, a kolorowe kawałki to pozostałości osłonek kapsułek witamin. Gdy przestał je łykać, kolorowe grudki przestały się pojawiać.
Test burakowy
Nie jest to wprost metoda detoksyfikacji, a raczej wstęp do którejś z nich. Artykuły pseudodietetyków promują ten test jako metodę sprawdzenia stanu szczelności jelit. A jeśli jelita są nieszczelne, to organizm jest zatruty i trzeba go czyścić. Test polega bądź na zjedzeniu tartego buraka lub na wypiciu świeżego soku, jeśli po takiej potrawie mocz zabarwi się komuś na różowo lub czerwono, to znaczy, że ma nieszczelne jelita i kawałki treści jelit przedostają się mu do krwi. Bardzo obrazowy opis, trzeba przyznać.
W rzeczywistości zabarwienie moczu po burakach, czyli betaninuria, to stosunkowo częsty stan fizjologiczny, pojawiający się okresowo nawet u 10-15% ludzi. Wynika z wydalenia czerwonego barwnika buraka, betaniny, wraz z moczem po tym, jak został wchłonięty w jelitach. Nie następuje to u każdego i zawsze dlatego, bo zwykle betanina do jelita nie dociera. Barwnik ten jest dość wrażliwy na warunki, zwłaszcza kwasowość. Ulega rozpadowi do bezbarwnych produktów zarówno w środowisku zbyt kwaśnym (pH ok. 2 i mniejsze) jak i zbyt alkalicznym. W zasadzie zaczyna degradować już w warunkach obojętnych, zwłaszcza przy podgrzewaniu, stąd przy gotowaniu barszczu zawsze się go lekko zakwasza cytryną lub octem. Po drodze od ust do miejsca wchłonięcia, połknięty burak najpierw wpada do żołądka, który wytwarza kwas, po czym częściowo przetrawiona treść trafia do jelita cienkiego, gdzie zalewa ją dla odmiany bardzo zasadowa żółć. Ostatecznie więc w normalnych warunkach wchłania się niewielka ilość barwnika, niewystarczająca aby wpłynąć na kolor moczu.
Pojawienie się więc zabarwienia uryny oznacza, że po drodze warunki były dla buraka łagodniejsze niż zwykle - jeśli do żołądka trafiło dużo treści, jeszcze w dodatku popitej, barwnik nie był narażony na takie znów silne działanie kwasu. Jeśli ostatecznie posiłek nie był ciężkostrawny, to nie przebywał w żołądku zbyt długo. Z kolei na ilość wydzielonej żółci wpływ ma tłustość posiłku i jego pierwotna kwasowość. Gdy burak był mocniej zakwaszony sokiem z cytryny lub szczawiem, kwasy organiczne przeszkadzają żółci, działając jak bufor stabilizujący nieco kwaśniejsze warunki.
Nakładanie się tych dwóch efektów powoduje ostatecznie, że betanina nie zostaje zupełnie zdegradowana i wchłania się w dalszych odcinkach jelita dostatecznie, aby zabarwić mocz. W efekcie ta sama osoba może czasem doznawać zabarwienia a czasem nie, zależnie od kwasoty żołądka, obfitości posiłku, rodzaju posiłku i ilości buraka w porcji. Pewne badania sugerują częstsze pojawianie się betaninurii u osób z niedoborem żelaza, ale zjawisko jest zbyt mało specyficzne (jest za wiele sytuacji gdy efekt nie wynika z niedoboru żelaza tylko z rodzaju posiłku) aby służyło za test diagnostyczny.[5], [6]
----------
Źródła:
[1] https://www.livestrong.com/article/130395-detox-foot-patches-work/
[2] Deborah A. Kennedy et al. Objective Assessment of an Ionic Footbath (IonCleanse): Testing Its Ability to Remove Potentially Toxic Elements from the Body, Journal of Environmental and Public Health Volume 2012 (2012), Article ID 258968, 13 pages
[3] http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(05)66373-8/fulltext
[4] https://sciencebasedmedicine.org/would-you-like-a-liver-flush-with-that-colon-cleanse/
[5] https://udel.edu/~mcdonald/mythbeeturia.html
[6] Eastwood, MA; Nyhlin, H (1995). "Beeturia and colonic oxalic acid". QJM. 88 (10): 711–7
Natomiast wyolbrzymiane skutków oprócz obietnicy wyleczenia z ciężkich chorób, oraz równie ważnego schudnięcia w dwa tygodnie, odbywa się też przez zaprezentowanie detoksu w efektownej wizualnie formie. Najlepiej byłoby, gdyby uwalniane toksyny było dobrze widać. Jeszcze lepiej, gdyby wyglądało to obrzydliwie i przypominało brud. Jeśli zaś toksyny nie chcą tak ładnie wyglądać, trzeba im jakoś pomóc...
Plastry czyli brunatnienie octu
Plastry detoksyfikujące wciąż jeszcze są dosyć popularne. Nakleja się je na stopy na noc i rano są całe zbrązowiałe, pokryte kleistą substancją i niemile pachną. I oczywiście ta brązowa substancja to toksyny z organizmu.
Problem w tym, że podobny efekt daje zwilżenie plastra. W ich składzie znajdują się substancje chłonące wilgoć i wyciągi roślinne o brązowym kolorze. W ciągu nocy plaster chłonie wilgoć ze skóry, zwłaszcza pot, więc rano są wilgotne a zawartość saszetki zabawia plaster na brązowo.
Ale, ale - przecież jeśli stosuje się je regularnie, to po pewnym czasie przestają brązowieć. Z czego to wynika? Jednym ze składników takich plastrów jest ocet drzewny otrzymywany ponoć z pędów bambusa. Kwas octowy działając kilka godzin na skórę przez kilkanaście dni, powoduje obkurczenie gruczołów potowych i przejściowe zmniejszenie potliwości na tym fragmencie skóry.
Robiono już testy z ochotnikami i po przeanalizowaniu składu plastrów nie stwierdzono, aby po całonocnym użytkowaniu pojawiały się w nim jakieś metale ciężkie czy znane substancje toksyczne.[1]
Wanna z błotkiem czyli elektroliza
Pod pewnym względem podobna wydaje się popularna zwłaszcza kilka lat temu metoda z wanienkami, mającymi wywoływać wydalenie toksyn przez stopy. Zanurzało się stopy w korytku, trzymało w rękach elektrody, a po pewnym czasie od włączenia urządzenia, woda robiła się brązowa i śmierdziała. Prowadzący zabieg tłumaczył, że oto pole elektryczne spowodowało wydalenie toksyn do wody i to brązowe w misce to nasze toksyny.
Urządzenie składa się przede wszystkim z miski na wodę i płaskich elektrod, koniecznie stalowych bo inaczej nie zadziała, zasilane jest najczęściej zasilaczem podobnym do tych do telefonów komórkowych, stosując niskie napięcie 12 V i bezpiecznie niskie natężenie.
Dlaczego elektrody muszą być stalowe? Bo inaczej nie zrobi się nam błotko. Nie jest potrzebne nawet wkładanie stóp, zrobi się samo byle płynął prąd.
W urządzeniu takim zachodzi prosta elektroliza wody, zwykle lekko posolonej dla lepszego przewodnictwa, z prądem stałym podłączonym w taki sposób, że na elektrodach w wodzie pojawia się ładunek dodatni. Pod wpływem takiego ładunku zachodzi reakcja utlenienia żelaza z elektrody, w pewnym stopniu też wydzielenie tlenu. Jony żelaza i tlen tworzą tlenki i wodorotlenki, tworzące ostatecznie brązowy osad, zaciemniający wodę i udający toksyny. Efekty wizualne zabiegu nie mają żadnego związku z detoksem.
Biorąc pod uwagę, że stale nierdzewne zawierają domieszki niklu i chromu, które mogą uwalniać się podczas zabiegu do roztworu, namaczanie w nim stóp może się okazać bardzo szkodliwe dla skóry. Nie od dziś wiadomo, że nikiel jest silnym alergenem a chrom wywołuje podrażnienia.
Teoretycznie puszczenie napięcia od rąk do stóp mogłoby spowodować migrację jonów z organizmu do wody, za sprawą jonoforezy, czyli ruchu jonów pod wpływem prądu elektrycznego. Jednak aby, jak to piszą wykonujący ten zabieg szarlatani, usuwać w ten sposób kationy metali ciężkich należałoby... podłączyć prąd dokładnie odwrotnie! Kationy, czyli jony o ładunku dodatnim, migrują do elektrody o ładunku ujemnym, bo przeciwieństwa (elektryczne) się przyciągają.
Ale jak się już domyślacie, podłączenie prądu odwrotnie nie będzie utleniało elektrod i barwiło wody na brązowo. Warto by więc rozważyć, czy przypadkiem podczas zabiegu nie dochodzi do elektroforetycznego wchłaniania do organizmu wspomnianych niklu i chromu z rozpuszczonej elektrody. Co byłoby dla nas dużo bardziej szkodliwe.
W 2012 roku wykonano zresztą eksperymenty z użyciem dostępnych komercyjnie zestawów "Jonowej Kąpieli Stóp". Najpierw badacze przygotowali roztwór soli w destylowanej wodzie, w ilości podanej przez producenta urządzenia i zbadali zawartość w nim kilkunastu pierwiastków. Następnie wlali do urządzenia i włączyli zgodnie z przepisem na 20 minut, bo tyle trwa normalny zabieg, ale nikt nie wkładał tam stóp. Chodziło o sprawdzenie, na ile skład wody zmienia samo działanie urządzenia. Po minięciu odpowiedniego czasu, pobrali wodę z urządzenia i zbadali zmiany zawartości pierwiastków. Wyniki wyglądają bardzo niepokojąco:
- w wodzie pojawił się arsen, kobalt, mangan i kadm, toksyczne pierwiastki
- zawartość wanadu wzrosła o 5800% (z 1 do 59 ug/l)
- zawartość niklu wzrosła o 750 000% (z 2 do 15 179 ug/l)
- zawartość molibdenu wzrosła o 6100% (z 50 do 3155 ug/l)
- zawartość chromu wzrosła o 590 000% (z 4 do 23 634 ug/l)
- zawartość żelaza wzrosła o 375 000% (z 31 do 116 000 ug/l)
- łączny wzrost zawartości składników mineralnych przekroczył milion procentów.
Nic dziwnego, że woda zrobiła się brązowa. A to wszystko po włączeniu wanienki bez wkładania nóg. Zresztą, strach wkładać do czegoś takiego nogę. Skład odpowiada zawartości metali w stali nierdzewnej wysokochromowej.
Zrobiono też jednak testy z ochotnikami, którzy byli poddawani zabiegowi w wanience kilkakrotnie w ciągu czterech tygodni, zgodnie z zalecaną przez producenta kuracją. Także badano zmiany zawartości pierwiastków w wodzie przed i po zabiegu, w moczu ochotników przed i po zabiegu oraz we włosach ochotników przed serią wielu zabiegów i po czterech tygodniach. Ilość metali ciężkich w wanienkach podczas zabiegów wzrastała bardzo podobnie, do wody uwalniane były te same pierwiastki w podobnej ilości - może tylko chromu i niklu było jeszcze więcej, wzrosty ich stężeń dochodziły do miliona procent, co mogło wynikać ze zużywania się elektrod w urządzeniu. Sprawdzano zresztą całkowitą ilość uwalnianych pierwiastków, stwierdzając że stopniowo spadała w miarę kolejnych eksperymentów na tym samym urządzeniu, a ostatecznie przeprowadzono ich 30, wykazując jak szybko rozpuszczają się elektrody.
Podczas badania moczu ochotników stwierdzono u jednego z nich wzrost ilości metali ciężkich w miarę kolejnych zabiegów, zaś w badaniu składu mineralnego włosów także gwałtowny wzrost zawartości metali ciężkich u jednego ochotnika. W przypadku pozostałych ludzi, zmiany ilości pierwiastków były bardzo małe i miały różny kierunek. Nie dało się więc potwierdzić usunięcia metali ciężkich z organizmu w miarę powtarzanych zabiegów w wanience, bo w przypadku pozostałych badanych ilości pierwiastków się nie zmieniły, natomiast wzrost zawartości metali w moczu i włosach jednego pacjenta sugerowałby raczej wzrost zawartości w organizmie, a więc przytrucie.[2]
Ten sam widowiskowy efekt był też wykorzystywany przez przedstawicieli handlowych sprzedających filtry do wody - na pokazach, na które zapraszano głównie naiwne starsze osoby, pokazywano elektrolizę żelaznych elektrod w wodzie wodociągowej, po czym porównywano z elektrolizą w wodzie destylowanej, która przewodzi prąd bardzo słabo i nie daje takich skutków.
Kamienie prawie żółciowe
Jednym z najpopularniejszych domowych sposobów oczyszczania wątroby, jest wypijanie mieszanki oliwy z sokiem cytrynowym. Efekty ponoć mają być spektakularne, zwłaszcza wydalanie kamieni żółciowych w ilościach hurtowych, zupełnie bez bólu i z możliwością ominięcia operacji. Niestety wielu mających problemy z kamieniami żółciowymi przekonało się już, że mimo poprawnego wykonania takiego zabiegu i wydalenia żółtawych grudek, ilość złogów w ich woreczkach wcale nie spadła. Skoro tak, to skąd się one biorą?
 |
| Prawdziwe ludzkie kamienie żółciowe typu cholesterolowych |
Wątroba i trzustka produkują płyny obfitujące w enzymy trawienne, sole kwasów żółciowych, sole cholesterolu i związki mineralne. Powstała z ich zmieszania się w drogach żółciowych żółć, jest tymczasowo przechowywana w woreczku, oczywiście też żółciowym. Gdy receptory w jelicie w obszarze zakończenia przewodu żółciowego wyczują tłuszcz w treści jelita cienkiego, pobudzony pęcherzyk kurczy się, uwalniając żółć. Ma ona bardzo zasadowy odczyn więc neutralizuje kwas żołądkowy, oraz co ważniejsze, zawiera enzym lipazę który ma trawić tłuszcz. Lipaza rozbija cząsteczki tłuszczów, rozkładając je na kwasy tłuszczowe i glicerynę.
W dalszej kolejności kwasy tłuszczowe powinny zostać podczas trawienia wchłonięte, toteż w normalnej sytuacji kał nie zawiera zbyt dużo tłustych treści. Chyba, że zalejemy jelito dużą ilością tłuszczu i jeszcze popchniemy środkiem przeczyszczającym.
W najpopularniejszej wersji metody używa się jednorazowych dawek oliwy rzędu szklanki czy półtora, wypijanych duszkiem na pusty żołądek, i doprawianych sokiem cytrusowym, często dla lepszego oczyszczenia po pewnym czasie wypija się roztwór soli z Epsom, soli glauberskiej czy jakiegoś innego środka poprawiającego wypróżnianie. Po takiej dawce oleju w jelitach tworzy się dość dużo wolnych kwasów tłuszczowych, które nie mają czasu zostać dalej strawione i wchłonięte, zamiast tego zostają wydalone. W połączeniu z solami mineralnymi (zwłaszcza połkniętą solą z Epsom będącą siarczanem magnezu) kwasy te tworzą trudnorozpuszczalne mydła.
Tym, co zostaje ostatecznie wydalone, są grudki zawierające mydła, wolne kwasy tłuszczowe i składniki żółci, o kolorze od żółtego, przez żółtawozielony do wyraźnie zielonych (kolor zależy od składników oliwy, ilości żółci i treści jelit), uformowane przez ruchy robaczkowe w formę "kamyków".
Chorzy, którzy stosowali tą metodę wiele razy, donosili o liczbach rzędu setek a nawet tysięcy złogów, co przekracza pojemność woreczka żółciowego. Dlatego też szarlatani twierdzą, że dodatkowe ilości złogów schodzą z przewodów żółciowych czy nawet z wnętrza wątroby (wędrują przez miąższ organu?) i dlatego jest ich tak dużo. Jak łatwo się domyśleć, "kamyki" będą się pojawiały tak długo jak długo chory będzie pił oliwę a jego wątroba produkowała żółć. Chyba, że w trakcie "kuracji" woreczek się w końcu zatka a pacjent trafi do szpitala z ostrym zapaleniem.
W 2005 roku w czasopiśmie medycznym The Lancet opisano przypadek kobiety ze stwierdzonymi złogami w woreczku żółciowym, która chciała oczyścić się tą metodą. Prowadzący ją lekarze postanowili wykorzystać okazję i sprawdzić, czy to faktycznie działa. Pacjentka wypiła 600 ml oleju z oliwek i 300 ml soku z cytryny w kilku porcjach. Wydaliła wiele żółtozielonych "kamyczków", które wzięto do analizy. Złogi roztapiały się w gorącej wodzie, w ich składzie brakowało cholesterolu, bilirubiny i soli wapniowych kwasów żółciowych, a więc składników kamieni z woreczka żółciowego. Głównym składnikiem okazało się mydło kwasu oleinowego oraz długocząsteczkowe, trudnotopliwe kwasy tłuszczowe. Wnioskiem lekarzy było stwierdzenie, że wydalone złogi utworzyły się w wyniku trawienia oliwy w jelicie i nie pochodziły z dróg żółciowych.[3]
Wystarczy zresztą zastanowić się nad tym, w jaki sposób mogłoby wyglądać takie wydalanie - niektórzy opisują wydalenie tą metodą złogów o wielkości kilku centymetrów. Kanał żółciowy ma jednak ograniczoną szerokość, złóg większy niż kilka milimetrów po prostu go zatka. Masa tych rozmiarów, przesuwająca się wzdłuż żółciowodu, który jest przewodem dość dobrze unerwionym, musi skończyć się potwornym bólem, czyli atakiem kolki żółciowej. Jeśli więc ktoś nie czuł niczego szczególnego a wydalił centymetrową kulkę, to nie pochodzi ona z jego pęcherzyka.[4] Sól z Epsom nie poszerzy przewodu żółciowego aż tak bardzo (a tak twierdzą szarlatani), bo nie jest on zbyt elastyczny i się nie rozciągnie.
Ponieważ metoda przynosi efekty wyglądające spektakularnie, chętnie powołują się na nią różni dieto-uzdrawiacze. W Polsce najszerzej znana jest jako metoda Huldy Clark, od autorki książek na temat oczyszczania organizmu i leczenia raka, tytułującej się doktorem choć nie ukończyła nigdy medycyny. Inna nazwa to metoda dr Brouse, albo dr Kelley, albo dr. Moritza, bo wielu specjalistów od diety się pod nią podczepiało, z drobnymi modyfikacjami w rodzaju zastąpienia cytryny sokiem jabłkowym.
Pisał o niej też Tombak a za nim, z lekkimi modyfikacjami, Słonecki, tylko u nich miała to być metoda na kamienie kałowe, rzekomo gromadzące się w człowieku w kilogramowych ilościach. Obecnie bez cytowania źródła wspominają o niej liczne portale lifestylowe, jest to więc jedna z najbardziej popularnych medycznych bzdur w temacie oczyszczania organizmu.
Kapsułki oszustwa
W świetnej książce reporterskiej "Nic nie zdarza się przypadkiem" autor, włoski dziennikarz Tiziano Terzani, opisuje kilka lat walki z nowotworem, podczas której równolegle do leczenia klasycznego jeździł po świecie od uzdrawiacza do uzdrawiacza, w pewien sposób dając obraz kultur poprzez ich podejście do zdrowia i śmierci.
W jednym z rozdziałów opisuje jak to został zaproszony na egzotyczną wyspę na dwutygodniową sesję oczyszczającą, polegającą na głodówce, zażywaniu witamin i saunie. Prowadzący zachęcał obecnych aby codziennie oglądali na sitku, czy wydalają z organizmu złogi i toksyny, mające mieć postać żelowatych grudek różnych kolorów. Dowodem na to, że organizm się oczyścił, miało być ich zniknięcie z wydalin, jeśli do końca kuracji nie znikały, można było ją przedłużyć.
Po kilku dniach reporter zorientował się, że w skład suplementów witaminowych wchodził środek żelujący, a kolorowe kawałki to pozostałości osłonek kapsułek witamin. Gdy przestał je łykać, kolorowe grudki przestały się pojawiać.
Test burakowy
Nie jest to wprost metoda detoksyfikacji, a raczej wstęp do którejś z nich. Artykuły pseudodietetyków promują ten test jako metodę sprawdzenia stanu szczelności jelit. A jeśli jelita są nieszczelne, to organizm jest zatruty i trzeba go czyścić. Test polega bądź na zjedzeniu tartego buraka lub na wypiciu świeżego soku, jeśli po takiej potrawie mocz zabarwi się komuś na różowo lub czerwono, to znaczy, że ma nieszczelne jelita i kawałki treści jelit przedostają się mu do krwi. Bardzo obrazowy opis, trzeba przyznać.
W rzeczywistości zabarwienie moczu po burakach, czyli betaninuria, to stosunkowo częsty stan fizjologiczny, pojawiający się okresowo nawet u 10-15% ludzi. Wynika z wydalenia czerwonego barwnika buraka, betaniny, wraz z moczem po tym, jak został wchłonięty w jelitach. Nie następuje to u każdego i zawsze dlatego, bo zwykle betanina do jelita nie dociera. Barwnik ten jest dość wrażliwy na warunki, zwłaszcza kwasowość. Ulega rozpadowi do bezbarwnych produktów zarówno w środowisku zbyt kwaśnym (pH ok. 2 i mniejsze) jak i zbyt alkalicznym. W zasadzie zaczyna degradować już w warunkach obojętnych, zwłaszcza przy podgrzewaniu, stąd przy gotowaniu barszczu zawsze się go lekko zakwasza cytryną lub octem. Po drodze od ust do miejsca wchłonięcia, połknięty burak najpierw wpada do żołądka, który wytwarza kwas, po czym częściowo przetrawiona treść trafia do jelita cienkiego, gdzie zalewa ją dla odmiany bardzo zasadowa żółć. Ostatecznie więc w normalnych warunkach wchłania się niewielka ilość barwnika, niewystarczająca aby wpłynąć na kolor moczu.
Pojawienie się więc zabarwienia uryny oznacza, że po drodze warunki były dla buraka łagodniejsze niż zwykle - jeśli do żołądka trafiło dużo treści, jeszcze w dodatku popitej, barwnik nie był narażony na takie znów silne działanie kwasu. Jeśli ostatecznie posiłek nie był ciężkostrawny, to nie przebywał w żołądku zbyt długo. Z kolei na ilość wydzielonej żółci wpływ ma tłustość posiłku i jego pierwotna kwasowość. Gdy burak był mocniej zakwaszony sokiem z cytryny lub szczawiem, kwasy organiczne przeszkadzają żółci, działając jak bufor stabilizujący nieco kwaśniejsze warunki.
Nakładanie się tych dwóch efektów powoduje ostatecznie, że betanina nie zostaje zupełnie zdegradowana i wchłania się w dalszych odcinkach jelita dostatecznie, aby zabarwić mocz. W efekcie ta sama osoba może czasem doznawać zabarwienia a czasem nie, zależnie od kwasoty żołądka, obfitości posiłku, rodzaju posiłku i ilości buraka w porcji. Pewne badania sugerują częstsze pojawianie się betaninurii u osób z niedoborem żelaza, ale zjawisko jest zbyt mało specyficzne (jest za wiele sytuacji gdy efekt nie wynika z niedoboru żelaza tylko z rodzaju posiłku) aby służyło za test diagnostyczny.[5], [6]
----------
Źródła:
[1] https://www.livestrong.com/article/130395-detox-foot-patches-work/
[2] Deborah A. Kennedy et al. Objective Assessment of an Ionic Footbath (IonCleanse): Testing Its Ability to Remove Potentially Toxic Elements from the Body, Journal of Environmental and Public Health Volume 2012 (2012), Article ID 258968, 13 pages
[3] http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(05)66373-8/fulltext
[4] https://sciencebasedmedicine.org/would-you-like-a-liver-flush-with-that-colon-cleanse/
[5] https://udel.edu/~mcdonald/mythbeeturia.html
[6] Eastwood, MA; Nyhlin, H (1995). "Beeturia and colonic oxalic acid". QJM. 88 (10): 711–7
Subskrybuj:
Komentarze (Atom)