Przygotowując się do pokazów chemicznych, jakie mam prowadzić w firmie na imprezie plenerowej, postanowiłem przetestować klasyczne doświadczenie, którego jakoś tak nie miałem okazji jeszcze oglądać gdzieś indziej. Tak zwana "burza w próbówce" to efektowna forma spalania, w której najbardziej interesujący jest właściwy utleniacz.
Wykonanie nie jest skomplikowane, choć nie należy do zupełnie bezpiecznych. Do szklanej próbówki nalewa się niedużo (2-3 ml) stężonego kwasu siarkowego. Na tą ciecz pipetą, aby nie doszło do wymieszania, dodaje się alkohol etylowy; ja użyłem 96%. Powstają dwie przezroczyste warstwy o wyraźnie różnej gęstości. Następnie do próbówki nasypuje się szybko odrobinę (na koniec metalowej łopatki) suchego nadmanganianu potasu. Doświadczenie lepiej wychodzi, jeśli nadmanganian ma formę kryształków a nie drobnego proszku.
Kryształki przechodzą przez alkohol bez zmian, po czym wpadają w warstwę kwasu, która zabarwia się na brunatno. Po pewnym czasie z pogranicza faz zaczynają unosić się bąbelki, oraz pojawiać się rozbłyski światła, którym towarzyszy słyszalny trzask.
Efekt nie pojawił się od razu. Po wsypaniu pierwszej porcji bardzo drobnego pyłku, kwas się zabarwił na zielono, a trzaski pojawiały się bardzo rzadko, może raz na minutę. Byłem rozczarowany, więc sypnąłem więcej. Rozbłyski stały się nieco intensywniejsze. Dopiero użycie porcji kryształków odsianych, aby były nieco większe, dało efekt jak na filmie.
Jaki jest mechanizm? W często podawanych opisach po prostu nadmanganian w kwaśnym środowisku utlenia alkohol, a rozbłyski wywołują grudki na granicy faz, to jednak trochę za duże uproszczenie, nie tłumaczące czemu bardziej intensywne trzaski pojawiają się po pewnym czasie od wyraźnie widocznego przebicia faz i zatonięcia kryształków w samym kwasie.
Nadmanganian potasu to sól - kationem jest potas zaś anionem nadmanganian. Każdemu anionowi w soli powinien odpowiadać jakiś kwas, który po deprotonacji wytworzy ten anion. Czasem wolnych kwasów odpowiadających anionom nie da się wyizolować, bo są nietrwałe. Podobnie jest w tym przypadku.
W stężonym kwasie siarkowym jon nadmanganianowy tworzy kwas manganowy VII (HMnO4), ten jest jednak nietrwały i w stężonym kwasie siarkowym traci cząsteczkę wody. Powstaje więc tlenek manganu VII (Mn2 O7 ), nazywany też siedmiotlenkiem manganu, który formalnie jest bezwodnikiem tego kwasu.
Siedmiotlenek manganu to natomiast substancja bardzo interesująca. Mimo że jest tlenkiem metalu, w temperaturze pokojowej jest cieczą o głębokim, zielonym kolorze. Wypływa na wierzch mieszaniny kwasu siarkowego z nadmanganianem potasu tworząc oleistą, połyskującą warstewkę:
Jest też cząsteczką niezwykle silnie reaktywną. Powoli rozkłada się na tlen i niższe tlenki manganu, wydzielając też przy okazji niewielką ilość ozonu, wyczuwalną jako ostry zapach. W kontakcie z substancjami organicznymi wywołuje ich gwałtowny zapłon. Sam przebieg reakcji jest podkręcany tym, że powyżej temperatury 60 stopni wybucha, rozkładając się na tlen, ozon i tlenki manganu o niższym stopniu utlenienia.
Mechanizm powstawania burzy w próbówce jest więc następujący: kryształki nadmanganianu rozpuszczają się w kwasie, powstaje siedmiotlenek manganu. Część z niego rozpuszcza się w kwasie tworząc zieloną parę jonową, część natomiast formuje krople, które przedostają się do interfazy, gdzie wchodzą w reakcję z alkoholem. W wyniku wysokiej temperatury utleniania alkoholu wybuchają.
Równie gwałtowny przebieg ma reakcja z dowolną inną materią organiczną. Tutaj przykład reakcji z papierem, w parowniczce, w której udało mi się uzyskać większą ilość tlenku:
Eksperyment w próbówce nie jest do końca bezpieczny. Nieco większa niż zazwyczaj kropla może rozbić próbówkę, a płonąca mieszanina alkoholu, tlenku manganu i stężonego kwasu siarkowego, to nie jest coś co chciałbym zobaczyć na którymkolwiek stole.
Pozostałości po reakcji należy szybko przelać do dużej zlewki z zimną wodą i zobojętnić.
informacje
sobota, 1 czerwca 2019
wtorek, 28 maja 2019
Chemiczne wieści (22.)
Reakcja psuta przez teflon z mieszadeł
Mieszadła magnetyczne to obecnie jeden z najpopularniejszych sprzętów laboratoryjnych. W podstawce, często podgrzewanej, znajdują się magnesy, które działają na magnetyczny "drops" wrzucany do naczynia, pozwalając na wygodne i szybkie mieszanie. Magnes wkładany do naczynia zwykle jest chroniony warstwą białego teflonu, materiału na tyle niereaktywnego, że wytrzymuje mieszanie nim kwasów i środków utleniających.
Jak wynika z niedawnej publikacji badaczy z Rice University, teflon w takich mieszadłach czasem jest jednak niedostatecznie niereaktywny.
Prowadzili oni dodawanie grup funkcyjnych na powierzchni nanorurek, stosując jako jeden z etapów redukcję Billupsa-Bircha. To modyfikacja znanej redukcji metalicznym sodem w ciekłym amoniaku, w której następuje równoczesna alkilacja powierzchni węglowej w miejscach defektów sieci. W tym konkretnym przypadku funkcjonalizowano nanorurki borazynowe, a więc ze związku złożonego z atomów boru i azotu w stosunku 1:1. O dziwo w czasie reakcji zawiesina kremowych rurek stała się szara, natomiast magnetyczne mieszadełko stało się czarne. Standardowo używana do takich cząsteczek analiza termograwitacyjna nie wykazała, aby z rurkami stało się coś złego. Jednak nietypowy kolor był wyraźnie widoczny. Problemem było też uzyskanie spójnych wyników, które raz wskazywały na wysoki stopień podstawienia a kiedy indziej na bardzo niski.
Dokładniejsze badania wykazały, że w warunkach reakcji lit rozpuszczony w amoniaku reaguje z teflonem. Następuje to w szybkiej reakcji rodnikowej, która przeszkadza w alkilowaniu rurek, w dodatku podstawiając je dodatkowymi, nie planowanymi grupami. Dlatego te otrzymywane przy pomocy świeżych mieszadełek były słabo podstawione, a te ze starymi, już poczernionymi, reagowały lepiej. Ponieważ dotychczas używano tej reakcji do modyfikacji rurek węglowych, które są czarne, naukowcy sądzili w takich przypadkach, że zmiana koloru magnesów wynika z osadzania się rurek na teflonie. A w każdym razie, że nawet jeśli teflon się zmieniał to nie musiało to wpływać na wyniki.
Gdy badacze zamienili mieszadełka na takie o szklanej otoczce, wyniki stały się powtarzalne, a nanorurki nie ciemniały. [a]
Sam obserwowałem trwałe ciemnienie mieszadełek po reakcjach ze środkami alkilującymi i chlorującymi, ale nie stwierdziłem aby wpływało to na wydajność czy powstawanie ubocznych produktów.
Wodorek helu wreszcie wykryty
Gdy po Wielkim Wybuchu wszechświat się rozrzedzał i chłodził, początkowa plazma różnych nietrwałych, naładowanych cząsteczek zaczęła się stopniowo łączyć w obojętne cząstki. To wtedy przestrzeń nabrała dostatecznej przezroczystości dla światła, aby dało się coś zobaczyć. Najwięcej powstawało atomów wodoru, cząsteczek wodoru i atomów helu, może z domieszką litu. Wśród powstających molekuł powinien się pojawić też kation wodorku helu HeH+. Jest to nietrwałe połączenie, proton łatwo dysocjuje (pKa=63), dlatego cząsteczka istnieje bądź jako element równowagi między helem i wodorem w zagęszczonych, zjonizowanych gazach, lub jako składnik gazów tak bardzo schłodzonych i rozrzedzonych, że w trakcie swego trwania nie ma z czym zareagować.
Obserwowano ją w eksperymentach na ziemi, ale w kosmosie o dziwo nie udawało się jej wykryć. Aż do teraz. W niedawnej publikacji badaczy z Instytutu Radioastronomii Maxa Plancka potwierdzono istnienie charakterystycznej linii emisyjnej 149.1 µm, której wykrycie dotychczas uniemożliwiała słaba rozdzielność spektralna i przeszkadzające zanieczyszczenia w atmosferze. Bardzo blisko tej linii znajduje się jeden z sygnałów wiązania C-H (149.09 µm) w związku z czym proste węglowodory obecne w przestrzeni mogą maskować szukaną linię, w dodatku w zakres ten częściowo wchodzi pochłanianie przez wodę w atmosferze, co dodatkowo osłabia sygnały. Badacze skorzystali więc z udostępnionego przez NASA teleskopu na pokładzie dużego samolotu, który z wysokości 12 kilometrów przeprowadził pomiar widma w mgławicy NGC 7027. Sygnały były już dostatecznie mocne, aby możliwe było odfiltrowanie dwóch bliskich linii widmowych i potwierdzenie istnienia szukanej molekuły.[b]
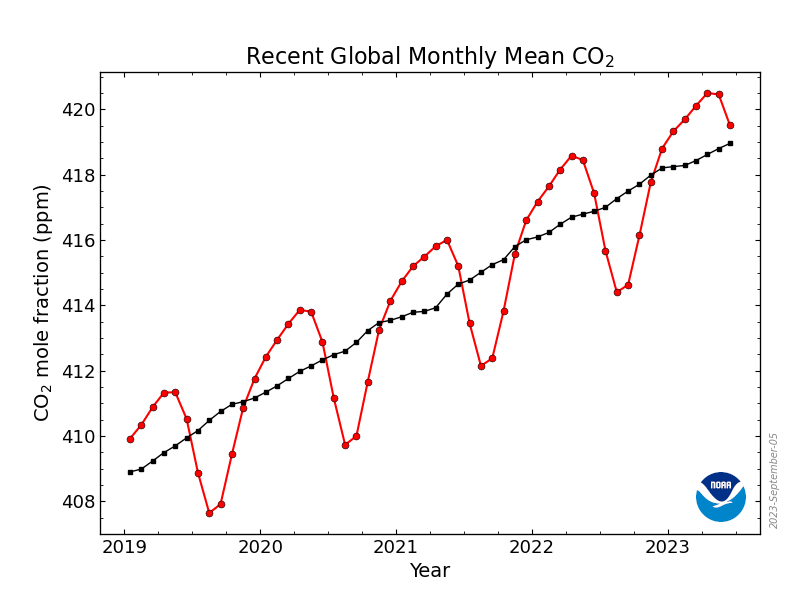
Rekordowy poziom dwutlenku węgla
Średnia globalna zawartość dwutlenku węgla atmosferze przekroczyła w kwietniu 410 ppm, z kolei w obserwatorium na Mauna Loa przekroczyła 415 ppm. Teraz zapewne średnie miesięczne zaczną spadać zgodnie z rocznym cyklem:
Kształt krzywej dla danych globalnych wynika głownie ze zmian sezonowych na półkulach. Na półkuli północnej jest więcej lądów, które silniej reagują na zmiany pór roku. Rośliny na lądach zmniejszają aktywność zimą i stopniowo zwiększają z początkiem wiosny, w czerwcu ich aktywność fotosyntetyczna jest już na tyle wysoka, że obniżają stężenie CO2 w powietrzu na stacjach pomiarowych na półkuli północnej, minimum przypada na jesień, kiedy to mniejsza aktywność roślin oraz rozpoczynające się procesy butwienia ponownie zwiększają poziom CO2. W ciągu roku wahania dochodzą więc do 5 ppm, natomiast z roku na rok następuje stały wzrost stężenia tego gazu o około jedną-trzecią wahań rocznych.
Selektywny odzysk uranu z morskiej wody
Uran jest pierwiastkiem dosyć rzadkim w skorupie ziemskiej, poza rudami tlenkowymi występuje w dużym rozproszeniu. Badacze z Oak Ridge University pokazali, że mimo wszystko da się go odzyskiwać nawet z takich materiałów, jak morska woda, w której występuje w średnim stężeniu około 3 miligramów na tonę.
Inspiracją były bakterie i grzyby gromadzące w sobie żelazo. Posiadały białka połączone ze specjalnymi cząsteczkami, nazwanymi syderoforami, które bardzo selektywnie wyłapywały krążące w otoczeniu żelazo. Postanowiono sprawdzić, czy poprzez modyfikacje tych cząsteczek da się wytworzyć takie, które będą skutecznie wyłapywać inne pierwiastki. Metodą symulacji komputerowych i testów eksperymentalnych stworzono optymalną cząsteczkę - 2,6-bis[hydroksy(metylo)amino-4-morfolino-1,3,5-triazynę, która bardzo selektywnie pochłania jony uranowe i uranylowe. Potencjalnie więc możliwe byłoby użycie jej do odzysku tego pierwiastka. Musiałaby być osadzona na polimerowym nośniku w formie proszku, przez który można przepuścić wiele wody, aż do wysycenia cennym pierwiastkiem. [c]
--------
[a] Angel A. Martí et al. Adverse Effect of PTFE Stir Bars on the Covalent Functionalization of Carbon and Boron Nitride Nanotubes Using Billups–Birch Reduction Conditions. ACS Omega, 2019; 4 (3): 5098
[b] Rolf Güsten, Helmut Wiesemeyer, David Neufeld, Karl M. Menten, Urs U. Graf, Karl Jacobs, Bernd Klein, Oliver Ricken, Christophe Risacher & Jürgen Stutzki, Astrophysical detection of the helium hydride ion HeH+ , Nature volume 568, pages357–359 (2019)
[c] Ilja Popovs et al. Siderophore-inspired chelator hijacks uranium from aqueous medium. Nature Communications, 2019; 10 (1)
Mieszadła magnetyczne to obecnie jeden z najpopularniejszych sprzętów laboratoryjnych. W podstawce, często podgrzewanej, znajdują się magnesy, które działają na magnetyczny "drops" wrzucany do naczynia, pozwalając na wygodne i szybkie mieszanie. Magnes wkładany do naczynia zwykle jest chroniony warstwą białego teflonu, materiału na tyle niereaktywnego, że wytrzymuje mieszanie nim kwasów i środków utleniających.
Jak wynika z niedawnej publikacji badaczy z Rice University, teflon w takich mieszadłach czasem jest jednak niedostatecznie niereaktywny.
Prowadzili oni dodawanie grup funkcyjnych na powierzchni nanorurek, stosując jako jeden z etapów redukcję Billupsa-Bircha. To modyfikacja znanej redukcji metalicznym sodem w ciekłym amoniaku, w której następuje równoczesna alkilacja powierzchni węglowej w miejscach defektów sieci. W tym konkretnym przypadku funkcjonalizowano nanorurki borazynowe, a więc ze związku złożonego z atomów boru i azotu w stosunku 1:1. O dziwo w czasie reakcji zawiesina kremowych rurek stała się szara, natomiast magnetyczne mieszadełko stało się czarne. Standardowo używana do takich cząsteczek analiza termograwitacyjna nie wykazała, aby z rurkami stało się coś złego. Jednak nietypowy kolor był wyraźnie widoczny. Problemem było też uzyskanie spójnych wyników, które raz wskazywały na wysoki stopień podstawienia a kiedy indziej na bardzo niski.
Dokładniejsze badania wykazały, że w warunkach reakcji lit rozpuszczony w amoniaku reaguje z teflonem. Następuje to w szybkiej reakcji rodnikowej, która przeszkadza w alkilowaniu rurek, w dodatku podstawiając je dodatkowymi, nie planowanymi grupami. Dlatego te otrzymywane przy pomocy świeżych mieszadełek były słabo podstawione, a te ze starymi, już poczernionymi, reagowały lepiej. Ponieważ dotychczas używano tej reakcji do modyfikacji rurek węglowych, które są czarne, naukowcy sądzili w takich przypadkach, że zmiana koloru magnesów wynika z osadzania się rurek na teflonie. A w każdym razie, że nawet jeśli teflon się zmieniał to nie musiało to wpływać na wyniki.
Gdy badacze zamienili mieszadełka na takie o szklanej otoczce, wyniki stały się powtarzalne, a nanorurki nie ciemniały. [a]
Sam obserwowałem trwałe ciemnienie mieszadełek po reakcjach ze środkami alkilującymi i chlorującymi, ale nie stwierdziłem aby wpływało to na wydajność czy powstawanie ubocznych produktów.
Wodorek helu wreszcie wykryty
Gdy po Wielkim Wybuchu wszechświat się rozrzedzał i chłodził, początkowa plazma różnych nietrwałych, naładowanych cząsteczek zaczęła się stopniowo łączyć w obojętne cząstki. To wtedy przestrzeń nabrała dostatecznej przezroczystości dla światła, aby dało się coś zobaczyć. Najwięcej powstawało atomów wodoru, cząsteczek wodoru i atomów helu, może z domieszką litu. Wśród powstających molekuł powinien się pojawić też kation wodorku helu HeH+. Jest to nietrwałe połączenie, proton łatwo dysocjuje (pKa=63), dlatego cząsteczka istnieje bądź jako element równowagi między helem i wodorem w zagęszczonych, zjonizowanych gazach, lub jako składnik gazów tak bardzo schłodzonych i rozrzedzonych, że w trakcie swego trwania nie ma z czym zareagować.
Obserwowano ją w eksperymentach na ziemi, ale w kosmosie o dziwo nie udawało się jej wykryć. Aż do teraz. W niedawnej publikacji badaczy z Instytutu Radioastronomii Maxa Plancka potwierdzono istnienie charakterystycznej linii emisyjnej 149.1 µm, której wykrycie dotychczas uniemożliwiała słaba rozdzielność spektralna i przeszkadzające zanieczyszczenia w atmosferze. Bardzo blisko tej linii znajduje się jeden z sygnałów wiązania C-H (149.09 µm) w związku z czym proste węglowodory obecne w przestrzeni mogą maskować szukaną linię, w dodatku w zakres ten częściowo wchodzi pochłanianie przez wodę w atmosferze, co dodatkowo osłabia sygnały. Badacze skorzystali więc z udostępnionego przez NASA teleskopu na pokładzie dużego samolotu, który z wysokości 12 kilometrów przeprowadził pomiar widma w mgławicy NGC 7027. Sygnały były już dostatecznie mocne, aby możliwe było odfiltrowanie dwóch bliskich linii widmowych i potwierdzenie istnienia szukanej molekuły.[b]
Rekordowy poziom dwutlenku węgla
Średnia globalna zawartość dwutlenku węgla atmosferze przekroczyła w kwietniu 410 ppm, z kolei w obserwatorium na Mauna Loa przekroczyła 415 ppm. Teraz zapewne średnie miesięczne zaczną spadać zgodnie z rocznym cyklem:
Kształt krzywej dla danych globalnych wynika głownie ze zmian sezonowych na półkulach. Na półkuli północnej jest więcej lądów, które silniej reagują na zmiany pór roku. Rośliny na lądach zmniejszają aktywność zimą i stopniowo zwiększają z początkiem wiosny, w czerwcu ich aktywność fotosyntetyczna jest już na tyle wysoka, że obniżają stężenie CO2 w powietrzu na stacjach pomiarowych na półkuli północnej, minimum przypada na jesień, kiedy to mniejsza aktywność roślin oraz rozpoczynające się procesy butwienia ponownie zwiększają poziom CO2. W ciągu roku wahania dochodzą więc do 5 ppm, natomiast z roku na rok następuje stały wzrost stężenia tego gazu o około jedną-trzecią wahań rocznych.
Selektywny odzysk uranu z morskiej wody
Uran jest pierwiastkiem dosyć rzadkim w skorupie ziemskiej, poza rudami tlenkowymi występuje w dużym rozproszeniu. Badacze z Oak Ridge University pokazali, że mimo wszystko da się go odzyskiwać nawet z takich materiałów, jak morska woda, w której występuje w średnim stężeniu około 3 miligramów na tonę.
Inspiracją były bakterie i grzyby gromadzące w sobie żelazo. Posiadały białka połączone ze specjalnymi cząsteczkami, nazwanymi syderoforami, które bardzo selektywnie wyłapywały krążące w otoczeniu żelazo. Postanowiono sprawdzić, czy poprzez modyfikacje tych cząsteczek da się wytworzyć takie, które będą skutecznie wyłapywać inne pierwiastki. Metodą symulacji komputerowych i testów eksperymentalnych stworzono optymalną cząsteczkę - 2,6-bis[hydroksy(metylo)amino-4-morfolino-1,3,5-triazynę, która bardzo selektywnie pochłania jony uranowe i uranylowe. Potencjalnie więc możliwe byłoby użycie jej do odzysku tego pierwiastka. Musiałaby być osadzona na polimerowym nośniku w formie proszku, przez który można przepuścić wiele wody, aż do wysycenia cennym pierwiastkiem. [c]
--------
[a] Angel A. Martí et al. Adverse Effect of PTFE Stir Bars on the Covalent Functionalization of Carbon and Boron Nitride Nanotubes Using Billups–Birch Reduction Conditions. ACS Omega, 2019; 4 (3): 5098
[b] Rolf Güsten, Helmut Wiesemeyer, David Neufeld, Karl M. Menten, Urs U. Graf, Karl Jacobs, Bernd Klein, Oliver Ricken, Christophe Risacher & Jürgen Stutzki, Astrophysical detection of the helium hydride ion HeH+ , Nature volume 568, pages357–359 (2019)
[c] Ilja Popovs et al. Siderophore-inspired chelator hijacks uranium from aqueous medium. Nature Communications, 2019; 10 (1)
czwartek, 16 maja 2019
Ostatnio w laboratorium (67.)
Wzory wytrąceniowe szczawianu kobaltu:
Widoczek przypomina trochę kolonie pleśni na odżywce, ale ma zupełnie inną naturę. O tym ciekawym fenomenie dowiedziałem się niedawno, szukając informacji na temat innej reakcji. Publikacja sprzed 10 lat* opisywała nowy rodzaj samoorganizacji w procesach chemicznych. Gdy kryształ soli zostaje umieszczony w cienkiej warstwie roztworu, w którym wytrąca osad, w niektórych przypadkach osad nie tworzy po prostu równego kółeczka, sięgającego do miejsca, w którym stężenie powstających związków jeszcze wystarczało na wytrącenie. Zamiast tego powstają promienie, w których strąca się więcej osadu, przedzielone obszarami bez wytrąceń. Dokładny wzór zależy od warunków.
Efekt zauważono w przypadku soli miedzi i kobaltu w warstwie roztworu szczawianu sodu. Takie też zestawy testowałem. W powyższym przypadku sole miedzi (na dole) dały bardzo słaby efekt, w dodatku wzór rozmył się po przeniesieniu szalki na ciemniejsze tło. Natomiast kobalt dał wyraźny wzór rzadko rozłożonych promieni strzelających z okrągłej plamki osadów.
Przy kolejnym powtórzeniu, z innym stężeniem szczawianu i z cieńszą warstwą roztworu, wzór dla kobaltu wyszedł dużo gęstszy i mniej czysty:
W innej porcji tego samego roztworu sól miedzi także dała gęsty wzór:
Po pewnym czasie osady były na tyle dobrze związane z podłożem, że można było wyssać roztwór pipetką.
Skąd ten efekt? Autorzy artykułu podają, że to wynik nałożenia się kilku zjawisk. Rozchodzenie się jonów wokół kryształka nie następuje tylko na drodze prostej dyfuzji. Początkowo tworzy się znacznie gęstszy roztwór danej soli, który rozprzestrzenia się tuż przy dnie. Generuje to w warstwie roztworów ruch warstw - przydennej na zewnątrz a powierzchniowej do środka. Pierwsze porcje wytrącającego się osadu wprowadzają w ten ruch zaburzenia. Ostatecznie zawirowania porządkują się w układ podobnej wielkości poziomych wirów, rozciąganych ruchem rozpływającej się warstwy przy dnie. W tak ukształtowanych strumieniach wytrąca się więcej osadu.
Był to efekt nieoczekiwany, zamierzeniem autorów było badanie tworzenia się osadu w przepływie grawitacyjnym, powstawanie kolistych wytrąceń wokół miejsca rozprzestrzeniania roztworu wytrącanego było znane, tymczasem po uzyskaniu odpowiednich warunków stężeń i grubości roztworu powstawały promienie, których dotychczas w literaturze nie opisywano.
W obrębie jednolitego koła kryształki szczawianów miały normalną formę wielościennych kryształów i ich kulistych skupień. W promieniach natomiast tworzyły włókna o grubości 3 mikrometrów i długości do jednego czy nawet kilku milimetrów. Dosłownie włos z pojedynczych kryształów.
Badacze wykazali pojawianie się tego efektu w dość rozcieńczonych roztworach mrówczanu (0,01-0,03M) , w za bardzo stężonych cała rozpuszczana sól formowała jednolite koło albo osad oblepiał wrzucony kryształek. Mam więc w sumie szczęście, że udało mi się ten efekt odtworzyć, bo stężenia były dobierane na oko.
----------
* J. Maselko et al., Precipitation Pattern Formation in the Copper(II) Oxalate System with Gravity Flow and Axial Symmetry, J. Phys. Chem. A, 2009, 113 (29), pp 8243–8248
Efekt zauważono w przypadku soli miedzi i kobaltu w warstwie roztworu szczawianu sodu. Takie też zestawy testowałem. W powyższym przypadku sole miedzi (na dole) dały bardzo słaby efekt, w dodatku wzór rozmył się po przeniesieniu szalki na ciemniejsze tło. Natomiast kobalt dał wyraźny wzór rzadko rozłożonych promieni strzelających z okrągłej plamki osadów.
Przy kolejnym powtórzeniu, z innym stężeniem szczawianu i z cieńszą warstwą roztworu, wzór dla kobaltu wyszedł dużo gęstszy i mniej czysty:
W innej porcji tego samego roztworu sól miedzi także dała gęsty wzór:
Po pewnym czasie osady były na tyle dobrze związane z podłożem, że można było wyssać roztwór pipetką.
Skąd ten efekt? Autorzy artykułu podają, że to wynik nałożenia się kilku zjawisk. Rozchodzenie się jonów wokół kryształka nie następuje tylko na drodze prostej dyfuzji. Początkowo tworzy się znacznie gęstszy roztwór danej soli, który rozprzestrzenia się tuż przy dnie. Generuje to w warstwie roztworów ruch warstw - przydennej na zewnątrz a powierzchniowej do środka. Pierwsze porcje wytrącającego się osadu wprowadzają w ten ruch zaburzenia. Ostatecznie zawirowania porządkują się w układ podobnej wielkości poziomych wirów, rozciąganych ruchem rozpływającej się warstwy przy dnie. W tak ukształtowanych strumieniach wytrąca się więcej osadu.
Był to efekt nieoczekiwany, zamierzeniem autorów było badanie tworzenia się osadu w przepływie grawitacyjnym, powstawanie kolistych wytrąceń wokół miejsca rozprzestrzeniania roztworu wytrącanego było znane, tymczasem po uzyskaniu odpowiednich warunków stężeń i grubości roztworu powstawały promienie, których dotychczas w literaturze nie opisywano.
W obrębie jednolitego koła kryształki szczawianów miały normalną formę wielościennych kryształów i ich kulistych skupień. W promieniach natomiast tworzyły włókna o grubości 3 mikrometrów i długości do jednego czy nawet kilku milimetrów. Dosłownie włos z pojedynczych kryształów.
Badacze wykazali pojawianie się tego efektu w dość rozcieńczonych roztworach mrówczanu (0,01-0,03M) , w za bardzo stężonych cała rozpuszczana sól formowała jednolite koło albo osad oblepiał wrzucony kryształek. Mam więc w sumie szczęście, że udało mi się ten efekt odtworzyć, bo stężenia były dobierane na oko.
----------
* J. Maselko et al., Precipitation Pattern Formation in the Copper(II) Oxalate System with Gravity Flow and Axial Symmetry, J. Phys. Chem. A, 2009, 113 (29), pp 8243–8248
sobota, 11 maja 2019
Kolory karminu
Indygokarmin to barwnik, będący pochodną indygo, znanego szerzej jako niebieski pigment, którym farbowane są dżinsy, a o którym kiedyś już pisałem (link). Dwie grupy sulfonowe, będące resztami kwasu siarkowego, powodują w jego przypadku, że związek ten w odróżnieniu od wolnego indygo jest dość dobrze rozpuszczalny w wodzie, oraz reaguje na zmiany kwasowości. Przy pH bardzo zasadowym, powyżej 13, zmienia kolor na żółty, przy obojętnym lub kwaśnym jest niebieski, zaś przy lekko zasadowym obie formy pojawiają się w ramach równowagi, dając wypadkowy kolor zielony.
Jest często stosowanym barwnikiem spożywczym, można go też spotkać w niebieskich kapsułkach leków.
Inną ciekawą właściwością związku jest wyraźna reakcja na redukcję lub utlenienie, co znajduje zastosowanie w tym ciekawym i efektownym eksperymencie.
Przepis jest w zasadzie dość prosty - należy wziąć około 3% roztwór glukozy i 3% roztwór wodorotlenku sodu, połączyć je w szklanej butelce na ciepło, w temperaturze około 40 stopni, dodając taką ilość indygokarmiu, aby widać było wyraźny kolor. Początkowo roztwór będzie zielony, potem pociemnieje i poprzez czerwonawy odcień stanie się żółty. W tym momencie nie trzeba go już ogrzewać, dalej będzie reagował na zimno. Co takiego będzie się działo?
Jeśli zaczniemy wytrząsać napełnioną do połowy butelkę, roztwór zmieni kolor. Najpierw z żółtego zrobi się czerwony, a po dokładniejszym wytrząsaniu zielony. Odstawiony powraca do żółtego koloru w ciągu około minuty, po czym znów może być wytrząsany ze zmianami koloru, odstawiony aż powróci do żółtego i tak kilkanaście razy.
Ze względu na zestaw kolorów eksperyment znany jest jako "chemiczne światła drogowe".
Nagrałem jeden taki cykl bez cięć, aby było widać szybkość przemian:
W tle kolbka z roztworem indygokarminu w wodzie destylowanej.
Na czym właściwie polegają te przemiany? Glukoza jest związkiem o właściwościach redukujących, co zawdzięcza obecności grupy aldehydowej na jednym z końców. Indygokarmin zaś jest na redukcję wrażliwy. W alkalicznych warunkach cząsteczki glukozy w formie pierścienia otwierają się, i stają się aktywnymi reduktorami. Barwnik zaczyna reagować, przyłączając elektrony i protony. Ponieważ cząsteczka posiada dwa miejsca mogące ulegać redukcji, w trakcie reakcji pojawia się związek pośredni, ze zredukowaną tylko jedną grupą, który ma w roztworze kolor czerwony. Całkowite przereagowanie daje związek żółty, tak zwany leuko-indygokarmin.
Glukoza jest natomiast utleniana, przede wszystkim do kwasu glukuronowego. Podczas wytrząsania następuje proces odwrotny - tlen z powietrza reaguje z leuko-barwnikiem w ten sam sposób przez związek pośredni. Mamy tutaj więc dość ciekawy przypadek dwuetapowego procesu, w którym ustala się pewna równowaga między formami. Pośrednia forma czerwona stanowi w fazie, w której roztwór jest czerwony, niemal jedyną postać barwnika. Całkowicie zredukowana forma żółta może pojawiać się dopiero od momentu zaniku w roztworze niezredukowanej formy zielonej, w przeciwnym razie ich cząsteczki będą wymieniać między sobą elektrony i protony do pośredniej formy czerwonej. Od tego momentu potrzebna jest dostatecznie duża ilość reduktora, bo przy za małym jego stężeniu, w formę żółtą nie zmieni się zauważalna ilość substancji.
Co ciekawe, bezpośrednia reakcja glukozy z tlenem z powietrza jest dość powolna. Indygokarmin przez to, że chętnie reaguje zarówno z jednym jak i drugim, jest katalizatorem procesu.
Przy podanych stężeniach cykle można powtarzać kilkanaście razy, aż do wyczerpania któregoś ze składników - przy małej ilości roztworu w dużej butelce pierwsza wyczerpie się glukoza i przy zbyt małym jej stężeniu, równowaga procesu zostanie zaburzona, a pozostawiony sam sobie roztwór osiągnie tylko czerwony etap pośredni. W tym momencie nawet mały dodatek zasadowego roztworu glukozy wystarczy aby dokończyć proces, toteż taki niedoredukowany roztwór mógłby ją wykrywać (lub inne reduktory).
Sprawdziłem to dodając do takiego roztworu sok jabłkowy, kilka mililitrów zawierających cukry redukujące i zapewne kwas askorbinowy wystarczało w zupełności.
W odwrotnej sytuacji, gdy dużo roztworu umieścimy w małej butelce, z małą ilością powietrza, to tlen pierwszy się skończy. Wówczas żółty roztwór podczas wytrząsania stanie się najwyżej czerwony. Zdarzyło mi się tak z jedną z prób. Kolba zostawiona na noc, następnego dnia nie reagowała na wytrząsanie. Sądziłem, że widocznie składniki się już zużyły i chciałem wylać. Zauważyłem jednak, że zassał się koreczek. Po otwarciu kolby przedmuchałem ją więc i wytrząsnąłem. Zielony kolor powrócił.
Szybkość zmian kolorów zależy od stężeń glukozy i barwnika, oraz od temperatury. Na kanale Royal Society podano formułę, która w temperaturze roztworu około 45 stopni po wytrząśnięciu powraca do żółtego koloru w 10 sekund. Żółty roztwór z końcowym, zredukowanym związkiem, stanowi dość czuły odczynnik wykrywający tlen, wodę utlenioną lub nadtlenki, co wykorzystuje się nawet w badaniach biologicznych.
Przy podanych stężeniach roztwór jest na tyle mało szkodliwy, że po rozcieńczeniu wodą można go wylać do zlewu.
Co ciekawe, indygokarmin może też ulegać przeciwnej reakcji i ze stanu podstawowego może zostać utleniony. Powstaje wówczas żółte dehydroindygo, które rozpada się na sulfonowaną izatynę. Wykorzystuje się tę reakcję przy manganometrycznym oznaczaniu garbników, zanik koloru wskaźnika wyznacza moment, gdy polifenole z roztworu zostały już utlenione.
-----
* Beyond The Blue Bottle - Royal Society of Chemistry, YT
Jest często stosowanym barwnikiem spożywczym, można go też spotkać w niebieskich kapsułkach leków.
Inną ciekawą właściwością związku jest wyraźna reakcja na redukcję lub utlenienie, co znajduje zastosowanie w tym ciekawym i efektownym eksperymencie.
Przepis jest w zasadzie dość prosty - należy wziąć około 3% roztwór glukozy i 3% roztwór wodorotlenku sodu, połączyć je w szklanej butelce na ciepło, w temperaturze około 40 stopni, dodając taką ilość indygokarmiu, aby widać było wyraźny kolor. Początkowo roztwór będzie zielony, potem pociemnieje i poprzez czerwonawy odcień stanie się żółty. W tym momencie nie trzeba go już ogrzewać, dalej będzie reagował na zimno. Co takiego będzie się działo?
Jeśli zaczniemy wytrząsać napełnioną do połowy butelkę, roztwór zmieni kolor. Najpierw z żółtego zrobi się czerwony, a po dokładniejszym wytrząsaniu zielony. Odstawiony powraca do żółtego koloru w ciągu około minuty, po czym znów może być wytrząsany ze zmianami koloru, odstawiony aż powróci do żółtego i tak kilkanaście razy.
Ze względu na zestaw kolorów eksperyment znany jest jako "chemiczne światła drogowe".
Nagrałem jeden taki cykl bez cięć, aby było widać szybkość przemian:
W tle kolbka z roztworem indygokarminu w wodzie destylowanej.
Na czym właściwie polegają te przemiany? Glukoza jest związkiem o właściwościach redukujących, co zawdzięcza obecności grupy aldehydowej na jednym z końców. Indygokarmin zaś jest na redukcję wrażliwy. W alkalicznych warunkach cząsteczki glukozy w formie pierścienia otwierają się, i stają się aktywnymi reduktorami. Barwnik zaczyna reagować, przyłączając elektrony i protony. Ponieważ cząsteczka posiada dwa miejsca mogące ulegać redukcji, w trakcie reakcji pojawia się związek pośredni, ze zredukowaną tylko jedną grupą, który ma w roztworze kolor czerwony. Całkowite przereagowanie daje związek żółty, tak zwany leuko-indygokarmin.
Glukoza jest natomiast utleniana, przede wszystkim do kwasu glukuronowego. Podczas wytrząsania następuje proces odwrotny - tlen z powietrza reaguje z leuko-barwnikiem w ten sam sposób przez związek pośredni. Mamy tutaj więc dość ciekawy przypadek dwuetapowego procesu, w którym ustala się pewna równowaga między formami. Pośrednia forma czerwona stanowi w fazie, w której roztwór jest czerwony, niemal jedyną postać barwnika. Całkowicie zredukowana forma żółta może pojawiać się dopiero od momentu zaniku w roztworze niezredukowanej formy zielonej, w przeciwnym razie ich cząsteczki będą wymieniać między sobą elektrony i protony do pośredniej formy czerwonej. Od tego momentu potrzebna jest dostatecznie duża ilość reduktora, bo przy za małym jego stężeniu, w formę żółtą nie zmieni się zauważalna ilość substancji.
Co ciekawe, bezpośrednia reakcja glukozy z tlenem z powietrza jest dość powolna. Indygokarmin przez to, że chętnie reaguje zarówno z jednym jak i drugim, jest katalizatorem procesu.
Przy podanych stężeniach cykle można powtarzać kilkanaście razy, aż do wyczerpania któregoś ze składników - przy małej ilości roztworu w dużej butelce pierwsza wyczerpie się glukoza i przy zbyt małym jej stężeniu, równowaga procesu zostanie zaburzona, a pozostawiony sam sobie roztwór osiągnie tylko czerwony etap pośredni. W tym momencie nawet mały dodatek zasadowego roztworu glukozy wystarczy aby dokończyć proces, toteż taki niedoredukowany roztwór mógłby ją wykrywać (lub inne reduktory).
Sprawdziłem to dodając do takiego roztworu sok jabłkowy, kilka mililitrów zawierających cukry redukujące i zapewne kwas askorbinowy wystarczało w zupełności.
W odwrotnej sytuacji, gdy dużo roztworu umieścimy w małej butelce, z małą ilością powietrza, to tlen pierwszy się skończy. Wówczas żółty roztwór podczas wytrząsania stanie się najwyżej czerwony. Zdarzyło mi się tak z jedną z prób. Kolba zostawiona na noc, następnego dnia nie reagowała na wytrząsanie. Sądziłem, że widocznie składniki się już zużyły i chciałem wylać. Zauważyłem jednak, że zassał się koreczek. Po otwarciu kolby przedmuchałem ją więc i wytrząsnąłem. Zielony kolor powrócił.
Szybkość zmian kolorów zależy od stężeń glukozy i barwnika, oraz od temperatury. Na kanale Royal Society podano formułę, która w temperaturze roztworu około 45 stopni po wytrząśnięciu powraca do żółtego koloru w 10 sekund. Żółty roztwór z końcowym, zredukowanym związkiem, stanowi dość czuły odczynnik wykrywający tlen, wodę utlenioną lub nadtlenki, co wykorzystuje się nawet w badaniach biologicznych.
Przy podanych stężeniach roztwór jest na tyle mało szkodliwy, że po rozcieńczeniu wodą można go wylać do zlewu.
Co ciekawe, indygokarmin może też ulegać przeciwnej reakcji i ze stanu podstawowego może zostać utleniony. Powstaje wówczas żółte dehydroindygo, które rozpada się na sulfonowaną izatynę. Wykorzystuje się tę reakcję przy manganometrycznym oznaczaniu garbników, zanik koloru wskaźnika wyznacza moment, gdy polifenole z roztworu zostały już utlenione.
-----
* Beyond The Blue Bottle - Royal Society of Chemistry, YT
Subskrybuj:
Komentarze (Atom)