|
| Największy na świecie blok złota o masie 250 kg. Wikipedia |
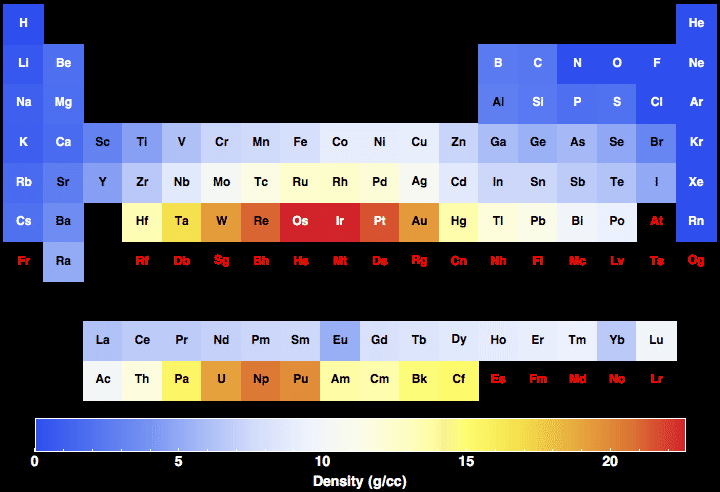
Metale generalnie charakteryzują się specyficznym oddziaływaniem ze światłem, powodującym powstawanie silnego połysku, a przy odpowiedniej gładkości powierzchni także lustrzanych odbić od powierzchni. Jest to wynikiem wewnętrznej, podstawowej cechy, mianowicie istnienia w ich sieci krystalicznej elektronów nie związanych z konkretnymi atomami, mogącymi wędrować po całej sieci i tworzących tak zwaną chmurę elektronową.
Fotony padające na dany obiekt oddziałują przede wszystkim z elektronami i to od ich stanów zależy, co się z tymi fotonami stanie. Zwykle w atomach lub cząsteczkach elektrony przyjmują pewne określone poziomy energetyczne. Jeśli trafi w nie foton o energii takiej, jak potrzebna do przeskoku na wyższy poziom, to zostanie on pochłonięty. Pochłanianie fotonów o pewnych energiach, odpowiadających fali światła w pewnych długościach, powoduje że odbite światło nabiera koloru.
W przypadku metali jest inaczej - ponieważ elektrony w chmurze nie są bezpośrednio związane z określonym atomem, ich energie zawierają się w pewnym szerszym przedziale. Gdy pada na nie światło, pochłaniają fotony z szerokiego zakresu energii, po czym powracając do poprzedniego stanu emitują je z taką samą energią i w kierunku zgodnym z zasadą zachowania pędu, czas trwania stanu wzbudzonego jest bowiem w chmurze elektronowej bardzo krótki. Obserwujemy zatem odbijanie światła we wszystkich zakresach i brak określonego koloru.
Bardziej trwałe przejścia energetyczne, powodujące pochłonięcie konkretnych długości fal, w większości metali dotyczy dużo wyższych energii, przez co absorpcja zachodzi dopiero w zakresie ultrafioletu.Ultrafioletu nie widzimy, a pozostałe światło jest już odbijane, dlatego metale nie mają własnego koloru.
 |
| Miedź |
W przypadku złota nie ma tak łatwo. Jego konfiguracja elektronowa to [Xe]4f145d106s1 , ma zatem podobnie jak miedź całkowicie zapełnioną podpowłokę f i d i tylko jeden elektron na podpowłoce 6s. Niezupełne zapełnienie ostatniej podpowłoki umożliwiałoby przeskok elektronu z najbliższej podpowłoki 5d. Jednak z wyliczeń na podstawie praw okresowości wynika, że odstęp energetyczny między tymi poziomami w dużo cięższym i większym złocie wymagałby kwantu energii odpowiadającego światłu z zakresu ultrafioletu. Zatem złoto powinno, jak wiele innych metali, pochłaniać ultrafiolet zaś światło widzialne odbijać bez wpływu na kolor. Tak rzecz wygląda choćby dla leżącego nad nim srebra, o konfiguracji elektronowej [Kr]4d105s1 , które ma czysty, metaliczny wygląd.
Tymczasem jednak pomiary energii jonizacji wskazują na to, że w złocie odstęp energetyczny między podpowłokami jest mniejszy i mieści się w zakresie kwantów światła fioletowego i niebieskiego. Wyjaśnienie tej prawidłowości okazało się dla fizyków bardzo trudne, zarówno na gruncie fizyki klasycznej jak i kwantowej. Nic dziwnego więc, że trzeba było zaprząc do pracy trzecią dziedzinę - fizykę relatywistyczną opartą o efekty przewidziane przez teorię względności.
Ze względu na dwojaką naturę cząstek podlegającym prawom fizyki kwantowej, w ich zachowaniu się wyróżnić można cechy związane z falową formią jak i cechy związane z postacią cząstkową. Wprawdzie więc zrezygnowaliśmy z planetarnego modelu Bohra na rzecz bardziej rozmytych przestrzennie orbitali, ale wciąż przypisujemy elektronom moment orbitalny i pęd.
Im cięższy jest atom oraz im więcej ma łącznie powłok, tym jest większy i tym szybciej musi poruszać się jego najdalszy elektron, na który działa większe przyspieszenie. W przypadku masywnych i dużych atomów z szóstego okresu, prędkości liniowe zewnętrznych elektronów zaczynają stawać się istotnymi ułamkami prędkości światła.* Co zaś zbliża się do tej prędkości, to musi też nabierać relatywistycznych cech. Jednym z efektów, które się obserwuje, jest masa relatywistyczna - zwiększenie bezwładności, czyli pozorny wzrost masy oddziałujący wzdłuż kierunku ruchu.
Efekty te najsilniej odczuwają elektrony podpowłoki 6s, najbardziej zewnętrznej. Relatywistyczny wzrost masy pociąga za sobą zmniejszenie rozmiaru tejże powłoki i spadek energii orbitalnej. W związku z tym odstęp energetyczny między całkowicie wypełnioną podpowłoką 5d a częściowo 6s zmniejsza się. W efekcie zwęża się pasmo energetyczne populacji elektronów w metalu, zaś do przeskoku z niższej podpowłoki do wyższej wystarcza już mniejsza energia - odpowiadająca fotonom z zakresu światła fioletowego i niebieskiego. Obserwowanym więc efektem jest żółty kolor metalu, który w pozostałych zakresach odbija światło bez zmian.
To zresztą nie jedyny efekt. Przybliżenie zewnętrznych elektronów powoduje też zwiększenie energii potrzebnej do wyrwania ich z atomu. Osłabia to skłonność złota do tworzenia związków chemicznych, skutkując jego szlachetnością. Mniejszy rozmiar zewnętrznej, niezupełnie wypełnionej powłoki, skutkuje też większą elektroujemnością i pojawieniem się pewnych cech podobnych do niemetali. Na przykład złoto stosunkowo łatwo tworzy aniony w solach międzymetalicznych z cezem i rubidem. Mniej chętne tworzenie wiązań metalicznych skutkuje słabszym przyciąganiem się do ciebie atomów w metalu, a co za tym idzie dużą miękkością i kowalnością. Efekty te powodują też wysoką przewodność cieplną i elektryczną.
 |
| Cez |
Efekty relatywistyczne wpływają też na inne pierwiastki, najsilniej ujawniając się w tych na dole układu okresowego, w zaczynających zapełniać lub kończących zapełniane nowej podpowłoki. Ten sam efekt zmiany pasma elektronowego, co u złota, występuje też w przypadku cezu, który w stanie czystym, bez warstewki tlenków, jest jasno-złoty. Zaczynający 7 okres frans także powinien mieć taki kolor, jest jednak pierwiastkiem silnie radioaktywnym, którego nie uzyskano w makroskopowych ilościach, gdyby zaś nawet, to odparowałby pod wpływem własnej aktywności.
Następująca zaraz po złocie rtęć korzysta z tych efektów w odmienny sposób - znajdując się na końcu bloku D ma całkowicie wypełnione podpowłoki 5f i 6s, niechętnie więc tworzy wiązania - również sama ze sobą. Pierwiastki nad nią są stosunkowo niskotopliwe. Relatywistyczne zwiększenie masy dotyczy u niej całej pary elektronowej na najbardziej zewnętrznej podpowłoce, co jeszcze bardziej osłabia wiązania metaliczne. Wiązanie Hg-Hg jest więc na tyle słabe i długie, że już w temperaturze pokojowej drgania termiczne je zrywają. W efekcie rtęć jest metalem płynnym nie tylko w temperaturze pokojowej, ale nawet jeszcze do -39 ° C gdy to ostatecznie krzepnie.
W następujących dalej pierwiastkach z bloku P, relatywistyczne obciążenie dotyczące całej pary podpowłoki s powoduje, że pierwiastki te dużo mniej chętnie oddają te dwa elektrony. Następuje więc stabilizacja poziomów utleniania o 2 mniejszych niż typowo dla grupy. Grupa 13, borowców, ma typowy stopień utlenienia 3, z najtrwalszymi związkami zawierającymi kationy 3+; leżący na samym dole tal, tworzy natomiast trwałe związki na stopniu utlenienia 1 co ma wpływ na jego silne właściwości toksyczne. W grupie azotowców typowym trwałym stopniem utlenienia jest 5, z wyjątkiem leżącego na samym dole bizmutu o preferowanym stopniu 3.
Efekt ten skutkuje też osłabieniem metaliczności i wzrostem elektroujemności metali, przez co ołów jest dość miękki, a bizmut ma wysoką oporność elektryczną.
Relatywistyczne zmniejszenie orbitalu s stanowi też około 10% zjawiska kontrakcji lantanowcowej, czyli nie powiększania się średnic atomów lantanowców, mimo zwiększania się ilości elektronów, za które głownie odpowiada słaba siła ekranująca ładunek jądra podpowłoki f.
--------
* przybliżony wzór na prędkość elektronu na ostatniej orbicie, to liczba atomowa Z, podzielona przez stałą struktury subtelnej, razy prędkość światła.
https://pl.wikipedia.org/wiki/Efekt_biernej_pary_elektronowej
https://en.wikipedia.org/wiki/Relativistic_quantum_chemistry