Gdy będąc jeszcze w technikum robiliśmy preparat drożdży w różnych roztworach, zwrócił moją uwagę interesujący artefakt - pęcherzyk powietrza między szkiełkami. Wyglądał jak słonecznik, toteż zrobiłem mu zdjęcie:
informacje
poniedziałek, 29 października 2012
piątek, 26 października 2012
Otrzymywanie biodiesla
W tym roku (już czwartym) jedną z moich pracowni jest Chemia Proekologiczna, prowadzona przez
dr Teodozję Lipińską. Określenie przedmiotu jest może trochę niezgrabne ale określa jego zakres nieco lepiej niż będące kalkami z angielskiego określenia Zielona Chemia czy Chemia Zrównoważona. Najogólniej mówiąc chodzi tu o takie przeprowadzane procesów chemicznych, aby przyniosło to dla środowiska jak najmniejsze skutki negatywne, co obejmuje metody syntezy z małą ilością odpadów, metody z użyciem małej ilości rozpuszczalników organicznych lub bez nich i procesy zużywające mało energii. Wliczają się tu także wynalazki mające zmniejszyć zanieczyszczenia z innych źródeł, jak katalizatory do spalin czy metody odsiarczania gazu i ropy.
Jednym z takich procesów chemicznych, przynoszącym korzyść dla środowiska, jest przerób olejów roślinnych na paliwo właściwościach podobnych do olejów napędowych. Oleje otrzymuje się z roślin, toteż przy ich produkcji nie trzeba wydobywać kopalin, zatem biodiesel można zaliczyć do odnawialnych źródeł energii. Ponieważ ze spalania takiego paliwa nie dorzucamy do atmosfery nowego dwutlenku węgla, a jedynie odpowiednik tego pochłoniętego dawniej przez olejodajne rośliny, stosowanie paliw odnawialnych powinno przyczynić się do ograniczenia emisji tego gazu.
Jednak czy oleje roślinne rzeczywiście nadają się do takich celów?
Olej, chemicznie rzecz biorąc, jest mieszaniną estrów gliceryny z kwasami tłuszczowymi. Gliceryna posiada trzy grupy wodorotlenowe z którymi może związać trzy łańcuchy kwasów. Natomiast same kwasy tłuszczowe najogólniej można nazwać długimi węglowodorami z grupą karboksylową:
Jeśli więc wyższe kwasy tłuszczowe nie wiele różnią się od węglowodorów, z których składa się ropa i olej napędowy, to powinny być palne. I rzeczywiście, oleje i łoje zwierzęce przez wiele wieków używano w celach oświetleniowych, w tanich lampkach i kagankach. Mało kto wie, że pierwszy model silnika spalinowego Diesla działał na olej arachidowy. Niedługo po tym wprowadzono specjalny model silników przeznaczonych do spalania oleju. Oleje mineralne zaczęto stosować dopiero potem. Mieszanka powietrzno-olejowa zapala się w tym silniku w fazie silnego sprężenia.
Problemem dla takiego stosowania jest jednak ich niedostateczna palność, do czego przyczynia się między innymi przyczepiona do kwasów tłuszczowych gliceryna. Z drugiej strony same wolne kwasy tłuszczowe często krzepną już w stosunkowo wysokich temperaturach, czego przykładem kwas stearynowy używany do wyrobu świec. Należałoby zatem z jednej strony oswobodzić kwasy, a z drugiej nadać im formę płynną.
Pierwszym kto wpadł na pomysł co też należy zrobić był G.Chavanne z Belgii, który w 1937 roku otrzymał patent na metodę zamiany oleju w płynne paliwo pędne.
Pomysł był w zasadzie bardzo prosty - gliceryna przeszkadza, więc usuńmy ją. Wolne grupy karboksylowe za sprawą oddziaływań pomiędzy sobą (głównie wiązania wodorowe) podwyższają temperaturę krzepnięcia, zatem przyłączmy do nich coś, co temu zapobiegnie. Na przykład cząsteczkę alkoholu. Cała tajemnica polega zatem na zamianie jednych estrów (glicerynowych) na inne, na przykład metylowe lub etylowe. Proces tego typu, a więc zamiany podstawników w estrze nazywamy transestyfikacją.
Odpadem jest tutaj gliceryna. Wodorotlenek sodu lub potasu katalizuje reakcję.
Tak więc: surowcem naszym był olej rzepakowy:
 |
| Olej rzepakowy przed reakcją |
Do kolby na 250 ml wlaliśmy olej, metanol i suchy wodorotlenek potasu. Ponieważ potaż jest bardzo żrący każdy musiał mieć założone okulary ochronne. Zanim zdążyliśmy go wsypać zaczął nadżerać kartkę na której był odważany:
 |
| Wodorotlenek potasu |
Następnie zamknęliśmy kolbę korkiem szklanym, nałożyliśmy dodatkowe zabezpieczenie i wytrząsaliśmy na zmianę przez pół godziny:
 |
| Wytrząsanie |
Wytrząsanie musiało być intensywne, tak aby kontakt między nierozpuszczalnym wodorotlenkiem a mieszaniną alkoholu z olejem był jak najlepszy. Od tego etapu głównie zależało to jak dobrze będzie zachodziła reakcja, dlatego trzęśliśmy aż do omdlenia rąk. Następnie wlaliśmy mieszaninę do dużego rozdzielacza i odczekaliśmy aż cięższa gliceryna zbierze się przy dnie:
 |
| Powolny rozdział. Na granicy faz ciemna warstewka zawieszonych kropel gliceryny |
Ostrożnie oddzieliliśmy glicerynę, zlewając do innego naczynia. Nasz produkt nadal zawierał glicerynę, nie przereagowany metanol, a ponadto zawieszony wodorotlenek a może nawet odrobinę mydła, jakie mogło zacząć powstawać w takich warunkach. Ponieważ biodiesel nie miesza się z wodą, należało dokonać ekstrakcji rozpuszczalnych zanieczyszczeń. W tym celu zanurzyliśmy rozdzielacz w zlewce ciepłej wody i dolaliśmy do mieszaniny wody destylowanej, lekko mieszając. Woda opadła na dno, zabarwiając się na mleczny kolor pochodzący zapewne od drobnych kropelek produktu. Tuż przy granicy faz zbierała się warstewka przypominająca zwarzoną śmietankę, podejrzewam że były to cząstki wolnych, nasyconych kwasów tłuszczowych, w tej temperaturze przyjmujących postać stałą. Kwasy te, częściowo rozpuszczalne w wodzie, mogły działać jak emulgatory, dlatego podczas ekstrakcji nie wytrząsaliśmy biodiesla z dodawaną wodą, aby nie musieć długo czekać na rozdział.
 |
| Ekstrakcja z wodą. Resztki gliceryny zebrały się w rurce rozdzielacza |
Po trzech ekstrakcjach uznaliśmy że już wystarczy, choć produkt wciąż był jeszcze dosyć alkaliczny (pH 8) co świadczyło o nie w pełni usuniętym wodorotlenku. Zawiesina wolnych kwasów i być może drobnych kropelek wody sprawiły, że otrzymany produkt był dosyć mętny:
Za tydzień postaram się zrobić zdjęcie produktu po odstaniu się, powinien być bardziej klarowny.
Czy tak otrzymany ester jest lepszym paliwem? W porównaniu z olejem rzepakowym na pewno. Olej ten jest wprawdzie najlepiej dostępnym z uwagi na ogromny areał upraw i najbardziej korzystny stosunek wydajności oleistej do powierzchni uprawy, ale wadą jest dosyć duża lepkość, kilkukrotnie większa niż równie wydajnych olejów mineralnych. W instalacjach wykorzystujących go jako materiał pędny, stosuje się wstępne ogrzewanie, mające go rozrzedzić i ułatwić rozpylenie przy wtrysku. Czasem rozrzedza się go dodając lekkie oleje mineralne lub tworząc mikroemulsję z metanolem. Inną wadą rzepaku jest skłonność do utleniania się i tworzenia nierozpuszczalnych wytrąceń, mogących osadzać się w zakamarkach silnika. Próby wlania oleju do nieprzystosowanego samochodu mogą skończyć się uszkodzeniem instalacji.
Rzepakowy biodiesel jest mniej lepki, przez co zmniejsza się ryzyko zatkania filtrów bądź osadzania częściowo spalonych resztek w silniku. Ponieważ ma właściwości smarne, silnik nie zaciera się i ma dłuższą żywotność. Z drugiej strony w porównaniu z olejami mineralnymi o tej samej liczbie cetanowej, biodiesel ma wyższą temperaturę zapłonu i nieco niższą wartość opałową. W efekcie mogą pojawiać się problemy z rozruchem, gdy silnik nie jest nagrzany, a zużycie paliwa może być nieco większe. Estry metylowe mogą ponadto rozpuszczać lub zmiękczać niektóre tworzywa sztuczne, toteż w przystosowanych samochodach stosuje się inne materiały uszczelek i złączy.
Wydawałoby się, że produkcja takiego paliwa, stosunkowo prosta i tania, powinna być dobrym sposobem odciążenia budżetu. Olej spożywczy jest znacznie tańszy od mineralnego, i mimo nieco droższej metody produkcji różnica w akcyzie powoduje, że produkt wychodzi nieco tańszy od zwykłego paliwa. Z tego co się orientuję prawo zezwala rolnikom produkcję takiego paliwa na własny użytek, po zarejestrowaniu i dla stosunkowo niedużych ilości. Problemem domowych instalacji jest jednak przede wszystkim właściwe oczyszczenie produktu. Resztki gliceryny, metanolu a zwłaszcza stałego wodorotlenku, zwiększają korozyjność i zmniejszają stabilność paliwa. Gliceryna dodatkowo wywołuje niemiły zapach spalin, przypominający palony olej.
Warto zwrócić uwagę na skład spalin z silnika napędzanego takim paliwem. Badania stwierdziły, że są one zdecydowanie mniej toksyczne, zawierając do 30% mniej cząstek stałych, znacznie mniej wielopierścieniowych węglowodorów aromatycznych (WWA) o dobrze potwierdzonej rakotwórczości, oraz prawie w ogóle nie zawierają dwutlenku siarki z uwagi na praktycznie śladowe zasiarczenie - co ma spory wpływ na powstawanie i szkodliwość smogu miejskiego. Z drugiej strony podczas spalania powstaje więcej tlenków azotu. Ponadto odmiany słabo oczyszczone, zawierające domieszki gliceryny i etanolu, dają spaliny z rakotwórczą akroleiną i drażniącym aldehydem octowym. Ostatecznie jednak uznano, że ogólna zawartość szkodliwych związków jest znacząco mniejsza, niż w przypadku olejów napędowych. Efekty cytotoksyczne są w tym przypadku aż cztery razy mniejsze[1]
Teoretycznie takie odnawialne paliwo, powinno przynosić ogólnoświatowe zyski dla środowiska - do atmosfery nie jest uwalniany nowy dwutlenek węgla, nie są uwalniane tlenki siarki i wreszcie jest co zrobić z zanieczyszczonymi, zużytymi tłuszczami. Teoretycznie, bo jak wiadomo, ze wszystkim można przesadzić. Najlepiej widać to w Malezji i Indonezji, gdzie głównym surowcem do biodiesla jest palma olejowa.
Paliwo jest szybko zużywane na krajowym rynku a przede wszystkim eksportowane do Europy, będąc stosunkowo tanie. Ponieważ popyt szybko rośnie, wzrasta też powierzchnia upraw, zaś zarządzający niespecjalnie przejmują się rozwojem zrównoważonym. W efekcie bywa że dziewicze puszcze wycina się po to, aby posadzić w tym miejscu monokulturę palmy olejowej, przez co cały proceder zaczyna przynosić środowisku więcej szkody niż pożytku. W tym roku Amerykańska Agencja Ochrony Środowiska uznała, że z tego powodu, olej palmowy nie powinien być zaliczany do ekologicznych paliw odnawialnych[2]
Popyt na malezyjskie biopaliwa, wraz z wysokimi cenami ropy spowodował, że w wyniku eksportowania większości oleju za granicę, zaczęło go brakować na rynku krajowym, choć jest tu głównym olejem spożywczym[3] Dyskusyjną kwestią jest to na ile zamiana zbiorów rolniczych na paliwa wpływa na globalny wzrost cen żywności, szacuje się że proceder ten odpowiada za jedną trzecią wzrostu cen kukurydzy w USA. Wszystko to pokazuje, że co za dużo, to nie zdrowo i nawet najświetniejsza technologia, wprowadzana bez rozmysłu, może przynieść negatywne skutki.
 |
| Plantacja palmy olejowej na Jawie. W tle lasy tropikalne |
Dodatkowym problemem jaki pojawia się w tym procesie, jest gliceryna, powstająca jako odpad. Szacunkowo z każdej tony oleju powstaje 100 kg gliceryny, z którą trzeba coś zrobić. Część można oczyścić i przetworzyć na kosmetyki lub farmaceutyki, ale popyt na taki surowiec jest ograniczony, stąd próby wykorzystania jej jako surowca w przemyśle chemicznym. Głównym procesem jest konwersja do epichlorohydryny, będącej głównym surowcem do wytwarzania żywic epoksydowych. Powtórna estryfikacja kwasem octowym daje produkt, mogący służyć do zmniejszenia lepkości paliw. Utleniając, można zamienić ją na kwas cytrynowy. Najciekawszym jednak pomysłem jest bezpośrednia konwersja do metanolu - powstały alkohol można by zawrócić do procesu i zwiększyć samowystarczalność instalacji produkcyjnej[4].
I tak minęła mi pierwsza proekologiczna pracownia.
------
[1] Kimberly J. Swanson , 1 Michael C. Madden , 2 i Andrew J. Ghio 2 Biodiesel Exhaust: The Need for Health Effects Research, Environ Health Perspect v.115 (4), kwiecień 2007 PMC1852688
[2] http://thehill.com/blogs/e2-wire/e2-wire/206781-epa-palm-oil-based-fuels-flunk-the-climate-test
[3] http://www.abc.net.au/news/2007-07-19/biofuel-demand-makes-fried-food-expensive-in/2506908
[4] http://www.greencarcongress.com/2008/11/new-process-for.html
piątek, 19 października 2012
Kwasek śmierci i inne bzdury
Kwas cytrynowy należy do najczęstszych stosowanych dodatków żywnościowych, również przez nas samych w domowym zakresie. Nic więc dziwnego że znalazł się na celowników internetowych panikarzy, do wszystkiego co oznaczone literką E podchodzących jak diabeł do wody być może święconej. Co zaskakujące, dokładnie przeciwny stosunek mają do obfitujących w ten związek owoców cytrusowych, stanowiących częsty składnik mikstur detoksykacyjnych.
Swoistą kwintesencję krążących po internecie plotek stanowi artykuł z Astromarii, który będę dalej selektywnie cytował:
Kwasy hamują proces utleniania, a więc są naturalnymi konserwantami. Naturalne kwasy występują w wielu produktach spożywczych, takich jak kiszonki oraz przetwory mleczne i owocowe. Ale władza uznała, że tamte kwasy nie wystarczą, konieczny jest jeszcze jeden. Mało tego, według nich zakwaszania wymagają również te wyroby, które z natury kwaśne nie są (a więc praktycznie wszystkie). Mogliby oczywiście wybrać kwas askorbinowy, który nie dość, że jest tani, to jeszcze zdrowy (witamina C), ale dziwnym trafem wybrali nienaturalny i pozbawiony wartości zdrowotnych kwasek cytrynowy i przekonali producentów, że jest on niezbędny i trzeba go sypać wszędzie, nawet tam, gdzie jest już i tak wystarczająco kwaśno. I mimo, że ma on właściwości konserwujące (po to przecież jest dodawany) ładują do wszystkiego jeszcze różne benzoesany i inne konserwanty.A więc dla porządku:
Wbrew ładnie brzmiącej nazwie kwasek cytrynowy nie ma nic wspólnego ani z naturą, ani z cytrynami, chociaż w swojej naturalnej postaci występuje w wielu owocach, w tym również w cytrynach. Spełnia on również ważną rolę w metabolizmie organizmów żywych (cykl Krebsa). Jednak ten stosowany w przemyśle spożywczym jest czysto syntetyczną substancją, otrzymywaną głównie przez fermentację cukru za pomocą kultur kropidlaka Aspergillus niger. Kropidlak ten jest bardzo niebezpieczną dla zdrowia pleśnią, powodującą wiele poważnych chorób.[1]
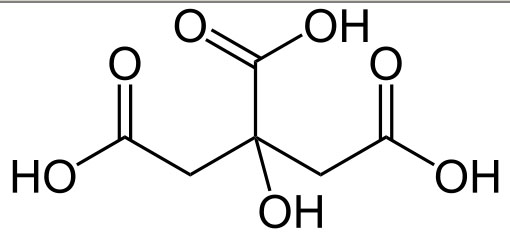
Kwas cytrynowy to stosunkowo pospolity w przyrodzie kwas organiczny, zawierający trzy grupy karboksylowe. Zgodnie z nazwą występuje w cytrynach. Pierwsza wzmianka o kwaśnych właściwościach ich soku pochodzi z VIII wieku z pism Gebera, jednak właściwy związek za to odpowiedzialny, wyizolował dopiero w 1784 Carl Scheele. Przez długi czas produkowano go z soków owocowych, do czasu aż w 1893 roku odkryto, że powstaje jako produkt metabolizmu pewnych gatunków pleśni, podobnie jak kwasy mlekowy, octowy i propionowy w pewnych typach fermentacji. Synteza tą metodą rozpoczęła się jednak niemal trzydzieści lat później. Najczęściej stosowany jest szczep Aspergillus niger, zaś pożywką jest nierafinowany cukier, melasa, syrop kukurydziany lub nawet nieprzetworzony sok z buraków cukrowych.
Gdy stężenie kwasu w pożywce wzrasta do odpowiedniego poziomu, dodaje się do niej mleka wapiennego, wytrącając cytrynian wapnia. Po odsączeniu traktowany jest kwasem siarkowym, zaś z zakwaszonego roztworu krystalizuje czysty kwas cytrynowy.
 |
| Mojej hodowli kryształy kwasu cytrynowego, o czym pisałem tu. |
Dlaczego dodaje się go do jedzenia? Głównie dla uzyskania odpowiedniego smaku, w czym jest o tyle lepszy od octu, że nie posiada własnego zapachu. Zakwaszając produkt przedłuża jego trwałość, i to na dwa sposoby - większość bakterii nie rozwija się w kwaśnym środowisku. Poza tym niskie pH zasadniczo przeszkadza reakcjom utlenienia, a właśnie one odpowiadają za większość reakcji rozkładu żywności. Dodatkowo w przypadku produktów nieprzetworzonych zakwaszenie unieczynnia enzymy degradujące, o czym każdy się nieraz przekonał, próbując powstrzymać brązowienie ziemniaków lub jabłek.
No dobra - a kwas askorbinowy? Witamina C to cenny przeciwutleniacz, w większości przypadków dodaje się ją nie jako środek wzbogacający, ale właśnie dla przedłużenia trwałości, ma jednak dwie wady - jest słabym kwasem i za łatwo się utlenia. Z tego powodu niektóre produkty mogą szybko ją utracić, co zmniejszy ich wartość zdrowotną. Można jednak spowolnić ten proces stwarzając dogodne warunki. Na przykład przez zakwaszenie.
Natomiast co do kwestii naturalności związku - producent który go dodaje może potem napisać na opakowaniu, że produkt nie zawiera sztucznych konserwantów. Związek syntetyczny to taki, który otrzymano drogą przemian chemicznych z prostych substratów, na przykład w tym przypadku z propanu, tymczasem tutaj mamy do czynienia ze związkiem wytworzonym przez pewne organizmy żywe. Nie są to może cytryny ale fabryka chemiczna też nie.
I proszę mi nie mówić, że cytryny są zdrowe. Oczywiście, że są. Zawierają kwas cytrynowy, ale naturalny, a oprócz niego witaminy, enzymy, sole mineralne i inne zdrowe składniki, które razem działają zbawiennie na nasze zdrowie. Owoce są dziełem natury, są harmonijną całością, a zawarte w nich składniki chemiczne są doskonale przyswajane przez nasze organizmy[2]Tylko czymże naturalny kwas, wytworzony przez taki organizm żywy jaki cytryna, różni się od kwasu rzekomo syntetycznego, wytworzonego przez organizm żywy kropidlaka? Związek ten nie ma odmian prawo i lewoskrętnej ani jakiejś unikalnej struktury, na co niekiedy powołują się producenci różnych suplementów.
Dlaczego jest szkodliwy? Z prostej przyczyny – kwas cytrynowy zakłóca przewodnictwo elektrochemiczne w naszych komórkach mózgowych i zmienia w nich reakcje chemiczne. Dodając kwasek do potraw i napojów (również dla niemowląt i małych dzieci) ktoś sprytnie zmienia nas w bezmyślne baranki. Wiemy nie od dziś, że władza nie lubi inteligentnych obywateli, bo takimi trudno jest rządzić, szczególnie, że władza sama nie grzeszy inteligencją i doskonale zdaje sobie z tego sprawę.[3]Kwestia szkodliwego wpływu na mózg, pojawia się w tego typu tekstach co i rusz, nigdzie jednak nie podano kto to zbadał, jak i kiedy. Astromaria powołuje się na jakichś dwóch lekarzy, tylko nie chce podać jakich. Musiałem więc sam grzebnąć.
Wedle raportu SIDS z 2000 roku toksyczność związku jest bardzo niska, LD w badaniach na szczurach wyniosła 1200mg/kg/dzień, czyli 1,2 grama na kilogram masy ciała. Dla człowieka ważącego 60 kg odpowiada to całkowitej dawce 80g związku. Nie wykazano w jego przypadku rakotwórczości ani nie jest o to podejrzewany. To samo tyczy się mutagenności i teratogenności. Nie stwierdzono aby był alergenem, choć wywołuje podrażnienia błon śluzowych i oczu. U osób zawodowo stykających się na co dzień z tym związkiem, podrażnienia mogą rozwinąć się w zapalenie skóry. W dwóch kolejnych pokoleniach szczurów zażywających karmę z 1% związku, nie stwierdzono deformacji. Nefrotoksyczności nie potwierdzono. [4] Jak to już opisywałem, kwas cytrynowy zwiększa wchłanianie aluminium z pożywienia, wygląda jednak że może to działać też w drugą stronę - zażywanie większych dawek prowokuje zwiększone wydalanie glinu z organizmu[5]. Stała obecność kwasu w diecie zapobiega kamicy nerkowej związanej z solami wapnia[6]
Zresztą kwas cytrynowy występuje naturalnie w naszym organizmie. Powstaje podczas metabolizmu jako jeden z elementów Cyklu Krebsa, mającego wytworzyć energię komórce. Każdy go ma w sobie.
Co ciekawsze, obecność kwasu wcale nie przeszkadza wielu specjalistom od alternatywnej medycyny polecać częste spożywanie cytryn. Jest elementem kuracji oczyszczającej Tombaka, podczas której w ciągu dwóch tygodni spożywa się sok z łącznie 200 cytryn[7]. Sam Tombak pisze coś o unikalnych właściwościach soli cytrynowych, ale jak to zwykle u niego, nie wiadomo skąd mu to wiadomo. Inna wersja to zażywanie mieszanki oliwy z sokiem cytrynowym. W dodatku sok z cytryny ma w jakiś paradoksalny sposób sprzyjać powstawaniu w organizmie odczynu zasadowego, co podobno też przynosić jakieś tam korzyści. A to wszystko za sprawą tego całego okropnego kwasu cytrynowego....
Jak się wydaje całe zamieszanie ma swe źródło w krążącej po świecie od połowy lat 70. "liście z Villejuif" - anonimowego tekstu ostrzegającego przed szkodliwymi dodatkami do żywności. Najgorszym, silnie rakotwórczym, miał być E 330 czyli właśnie kwas cytrynowy. Lista, w formie listów-łańcuszków rozlała się na cały świat, rozprzestrzeniana w formie zaraźliwego, bardzo wiarygodnie brzmiącego memu. Wkrótce zresztą objawiła się siła obaw zdrowotnych w społeczeństwie - gdy lekarze zaczęli wydawać oświadczenia, że lista jest fałszywa, wiele osób zaczęło bardziej w nią wierzyć uznając, że gdyby coś nie było na rzeczy, nikt by się tym tak bardzo nie przejmował. Podobne listy można spotkać w polskim internecie, niejednokrotnie poszerzone na wszystkie 1200 dodatków z listy E. Można się tam zresztą spotkać z zabawną niekonsekwencją - za rakotwórczy uznany jest tam kwas cytrynowy, ale jego sole już nie. Nawiasem mówiąc tak wychwalany kwas askorbinowy, znajduje się na tej liście pod nazwą E 300...
-------
[1],[2],[3] http://astromaria.wordpress.com/2009/09/23/kolejna-podstepna-trucizna/
[4] http://www.inchem.org/documents/sids/sids/77929.pdf
[5] Yong‐Hua Yanga & Hong‐Yan Zhanga Effect of citric acid on aluminum toxicity in the growth of mungbean seedlings, Journal of Plant Nutrition Volume 21, Issue 5, 1998
[6] Kang DE , Sur RL , Haleblian GE , Fitzsimons NJ , Borawski KM , Preminger GM .
Long-term lemonade based dietary manipulation in patients with hypocitraturic nephrolithiasis. J Urol. 2007 Apr;177(4):1358-62; discussion 1362; quiz 1591
[7] http://cudownediety.blogspot.com/2012/03/kuracja-cytrynowa-m-tombaka.html
poniedziałek, 8 października 2012
Nietypowe nieorganiczne
Kilka ciekawostek z zakresu chemii nieorganicznej:
Tlenek manganu VII
Jest to najprawdopodobniej jedyny tlenek metalu, którzy w temperaturze pokojowej ma postać ciekłą. Powstaje w reakcji stężonego kwasu siarkowego z nadmanganianem (manganianem VII) potasu. Początkowo z takiej mieszaniny powstaje kwas manganianowy, natychmiast jednak odwadnia się tworząc tlenek, mający postać oleistej, ciemnofioletowej cieczy, krzepnącej w niższych temperaturach.
Jest związkiem nietrwałym, rozkłada się z wydzieleniem tlenu i ozonu. Jako silny utleniacz reaguje ze związkami organicznymi w sposób wybuchowy, stąd też jego sporadyczne powstawanie podczas niektórych syntez może się stać bardzo kłopotliwe.
Czterotlenek osmu
Jest to tlenek metalu łatwo lotny w warunkach normalnych. Ma niemiły zapach i powstaje już pod wpływem powietrza na rozdrobniony metal - stąd zresztą nazwa pierwiastka (gr. Osme - zapach). Jego nietypowość wiąże się też ze stopniem utlenienia +8, najwyższym i bardzo rzadkim. Jeszcze tylko iryd i pluton oraz niektóre lantanowce dają takie związki.
Jest związkiem trującym, w większych stężeniach wywołuje obrzęk płuc. Zarazem jednak okazuje się bardzo przydatny w syntezie organicznej, w tym do hydrolizowania wiązań podwójnych. Rozrywając jedno z wiązań i łącząc się z dwoma atomami węgla, tworzy nietrwałe połączenie pierścieniowe. Po jego rozerwaniu otrzymujemy cis-diol:
Jest to jednak drogi odczynnik, czasem zastępuje się go nadmanganianem ale - jak mi tu podpowiadają w komentarzu - nie jest on tu zbyt skuteczny. Zamiast tego można użyć tlenku osmu w ilości katalitycznej wraz z odpowiednim innym utleniaczem regenerującym tlenek po przereagowaniu, na przykład N-metylo-N-tlenkiem morfoliny (NMO). W mieszaninie z nadjodanem służy do rozszczepiania alkenów na dwie połowy.
Dimolibden
Nietrwała cząsteczka składająca się z dwóch atomów molibdenu, połączonych unikalnym wiązaniem sześciokrotnym - są to zarówno wiązania sigma, powstające z nakładania się orbitali S, wiązania pi z nakładania bocznego orbitali P i wiązania delta z bocznego nakładania się orbitali D. Podobne połączenie otrzymano dla wolframu.
Znane są też związki z wiązaniami pięciokrotnymi i poczwórnymi. Do tych ostatnich należy octan chromu II stosunkowo łatwy do wytworzenia. Tam dwa atomu chromu połączone są wiązaniem czterokrotnym i mostkami skompleksowanych grup karboksylowych.
Pentazol
Niezwykła cząsteczka lokująca się na pograniczu związków organicznych i nieorganicznych. Jest logiczną kontynuacją azoli - związków pierścieniowych zawierających jeden lub więcej atomów azotu w pierścieniu. W tym przypadku pierścień jest pięciokątny i zawiera pięć atomów azotu... Czyli że składa się tylko z azotu
Tylko odpowiednio podstawione pochodne są na tyle trwałe, aby dało się je wyizolować. Teoretycznie przewiduje się możliwość powstania heksazyny, składającej się z sześciu atomów azotu, ale dotychczas nie potwierdzono jej otrzymania
Fluorek tlenu
Definicja tlenków mówi, że są to związki tlenu w których tlen przyjmuje elektrony drugiego pierwiastka, zatem dotyczy związków z pierwiastkami o mniejszej elektroujemności niż tlen, czyli prawie wszystkich. Prawie, bo jeszcze większą elektroujemność ma fluor, w związku z czym jest to jedyny pierwiastek który nie tworzy tlenku, choć łączy się z tlenem.
Diflluorek tlenu ma postać gazu, o strukturze cząsteczki podobnej do wody, bardzo nietrwałej. Jest silnym środkiem fluorującym i jednym z najsilniejszych utleniaczy, z tego też powodu jest trujący
Tlenek manganu VII
Jest to najprawdopodobniej jedyny tlenek metalu, którzy w temperaturze pokojowej ma postać ciekłą. Powstaje w reakcji stężonego kwasu siarkowego z nadmanganianem (manganianem VII) potasu. Początkowo z takiej mieszaniny powstaje kwas manganianowy, natychmiast jednak odwadnia się tworząc tlenek, mający postać oleistej, ciemnofioletowej cieczy, krzepnącej w niższych temperaturach.
Jest związkiem nietrwałym, rozkłada się z wydzieleniem tlenu i ozonu. Jako silny utleniacz reaguje ze związkami organicznymi w sposób wybuchowy, stąd też jego sporadyczne powstawanie podczas niektórych syntez może się stać bardzo kłopotliwe.
Czterotlenek osmu
Jest to tlenek metalu łatwo lotny w warunkach normalnych. Ma niemiły zapach i powstaje już pod wpływem powietrza na rozdrobniony metal - stąd zresztą nazwa pierwiastka (gr. Osme - zapach). Jego nietypowość wiąże się też ze stopniem utlenienia +8, najwyższym i bardzo rzadkim. Jeszcze tylko iryd i pluton oraz niektóre lantanowce dają takie związki.
Jest związkiem trującym, w większych stężeniach wywołuje obrzęk płuc. Zarazem jednak okazuje się bardzo przydatny w syntezie organicznej, w tym do hydrolizowania wiązań podwójnych. Rozrywając jedno z wiązań i łącząc się z dwoma atomami węgla, tworzy nietrwałe połączenie pierścieniowe. Po jego rozerwaniu otrzymujemy cis-diol:
Dimolibden
Nietrwała cząsteczka składająca się z dwóch atomów molibdenu, połączonych unikalnym wiązaniem sześciokrotnym - są to zarówno wiązania sigma, powstające z nakładania się orbitali S, wiązania pi z nakładania bocznego orbitali P i wiązania delta z bocznego nakładania się orbitali D. Podobne połączenie otrzymano dla wolframu.
Znane są też związki z wiązaniami pięciokrotnymi i poczwórnymi. Do tych ostatnich należy octan chromu II stosunkowo łatwy do wytworzenia. Tam dwa atomu chromu połączone są wiązaniem czterokrotnym i mostkami skompleksowanych grup karboksylowych.
Pentazol
Niezwykła cząsteczka lokująca się na pograniczu związków organicznych i nieorganicznych. Jest logiczną kontynuacją azoli - związków pierścieniowych zawierających jeden lub więcej atomów azotu w pierścieniu. W tym przypadku pierścień jest pięciokątny i zawiera pięć atomów azotu... Czyli że składa się tylko z azotu
Tylko odpowiednio podstawione pochodne są na tyle trwałe, aby dało się je wyizolować. Teoretycznie przewiduje się możliwość powstania heksazyny, składającej się z sześciu atomów azotu, ale dotychczas nie potwierdzono jej otrzymania
Fluorek tlenu
Definicja tlenków mówi, że są to związki tlenu w których tlen przyjmuje elektrony drugiego pierwiastka, zatem dotyczy związków z pierwiastkami o mniejszej elektroujemności niż tlen, czyli prawie wszystkich. Prawie, bo jeszcze większą elektroujemność ma fluor, w związku z czym jest to jedyny pierwiastek który nie tworzy tlenku, choć łączy się z tlenem.
Diflluorek tlenu ma postać gazu, o strukturze cząsteczki podobnej do wody, bardzo nietrwałej. Jest silnym środkiem fluorującym i jednym z najsilniejszych utleniaczy, z tego też powodu jest trujący
Subskrybuj:
Posty (Atom)