Jednym z obowiązków doktorantów jest przeprowadzenie odpowiedniej ilości godzin dydaktycznych ze studentami. W zeszłym roku pomagałem przy preparatyce organicznej, w tym natomiast przy zajęciach z fizyki.
Jedną z zalet tych zajęć było to, że mogłem jeszcze raz samemu przyswoić sobie pewne podstawy. Oraz że czasem miałem okazję zrobić ładne zdjęcia. Tak było podczas prowadzenia ćwiczenia ze spektroskopii - student na stole mierzył spektroskopem kąty ugięcia poszczególnych prążków emisyjnych emitowanych przez lampy z różnymi gazami, a ja próbowałem jakoś ładnie to uchwycić:
Najlepiej wyglądało to przy użyciu siatki dyfrakcyjnej lustrzanej, dającej jasne obrazy. Tutaj lampa ze świecącym helem:
a tu ta sama lampa bez rozszczepienia światła:
Tu zaś widmo lampy z neonem:
Jak widać na prawdę bogate w linie.
informacje
piątek, 7 lipca 2017
poniedziałek, 26 czerwca 2017
Czy warto iść na studia chemiczne?
Ponieważ matury już się skończyły a temat studiów zaczyna się coraz częściej pojawiać w hasłach wyszukiwania bloga, postanowiłem napisać na ten temat kilka uwag. Nie wiem na ile będą komukolwiek przydatne. A zatem - czy warto iść na studia chemiczne? A no zarazem tak i nie.
Czy iść?
Wszystko zależy od zainteresowań danej osoby, jeśli ktoś interesuje się chemią, całkiem nieźle idzie mu ogółem w dziedzinach ścisłych, to powinien taką możliwość rozważyć. W moim przypadku wyglądało to tak, że naukami ścisłymi zainteresowałem się w szkole podstawowej, w piątej klasie brałem udział w olimpiadach, zamiast liceum wybrałem technikum chemiczne. Wobec tego wybieranie powiedzmy studiów ekonomicznych, filologicznych czy budowlanych mijałoby się z moimi predyspozycjami i byłoby marnowaniem już zużytego czasu.
Z drugiej strony nie może to być decyzja na tej zasadzie, że ktoś nie czuje się "humanistą" więc idzie na "jakiś kierunek ścisły". Gdy zaczynałem studia w UPH w Siedlcach na pierwszym semestrze zapisanych było ponad 120 osób, w tym takie które poszły tu na zasadzie "bo ten wydział jest blisko domu" albo "bo koleżanka mówiła że będzie tu zdawać" czy też "nie szło mi z polskiego i z biologii też więc poszedłem na chemię". Takie osoby szybko się wykruszyły, niektóre zmieniły kierunek już po miesiącu, inne odpadały podczas zaliczeń semestru czy końca roku. Do samego końca dotrwało ledwie 40 osób.
Kolejną rzeczą nad jaką warto się zastanowić, jest to, czy w ogóle trzeba iść na jakieś studia. W społeczeństwie panuje niestety powszechne przekonanie, że po studiach człowiek znajdzie pracę, ale po jakichkolwiek. Nieważne co skończyłeś, jak masz dyplom to coś tam znajdziesz. Że wystarczy mieć odpowiednie dokumenty i dyplomy z okrągłą pieczątką, a magiczne zaklęcie zadziała. Rozsiewają to chyba dyrektorowie prywatnych uczelni, które w tak sprzyjającym środowisku wyskakują jak grzyby po deszczu.
Niestety ale magister politologii nie umiejący obsługiwać krajzegi będzie dla dyrektora firmy meblarskiej równie bezużyteczny co świeżo upieczony maturzysta z podobną przypadłością. Natomiast obaj nie powinni mieć problemu aby pracować na kasie w Biedronce.
Jak będzie na chemii?
Cóż, nie łatwo. To w końcu dziedzina ścisła. Oprócz znajomości samej chemii konieczne będzie podszkolenie się z dziedzin sąsiednich, na pierwszym roku pojawi się na przykład bardziej niż w przeciętnym liceum zaawansowany kurs matematyki, potrzebny aby zrozumieć pewne zależności teoretyczne, a więc rozwiązywanie całek, macierze, układy równań itp. Zapewne trafi się też kurs z podstawowej fizyki, obejmujący tak "chemiczne" ćwiczenia jak badanie ruchu wahadła fizycznego, czy przewodnictwa.
Materiał kursów przedmiotowych jest często obszerny i wymaga zapamiętania dużej ilości nowych pojęć. Pewną trudność dla absolwenta liceum może też sprawiać nauczenie się jak korzystać z wykładów, gdzie wykładowca ciągnie cały czas temat i nie mówi nic o tym co trzeba zapisać do zeszytu. Z kolei na zajęciach laboratoryjnych dużo uwagi poświęca się samodzielnej pracy z próbówkami i odczynnikami, co dla jednych może być zachętą a dla innych barierą
Co po chemii?
Jednym z najważniejszych pytań jakie zadaje sobie maturzysta jest, czy po tych studiach znajdzie pracę. To znaczy mam nadzieję, że zada sobie takie pytanie.
Wybieranie na studia kierunku pożądanego w gospodarce z pewnością zwiększa szanse na to, że pracodawcy będą takiego absolwenta szukać, a akurat chemików jest w kraju niedostatek. Dużo oczywiście zależy od tego w jakim konkretnym kierunku się w trakcie studiów i etapu magisterskiego wyspecjalizujecie. Chemik analityk znający się na najczęściej używanych technikach jak chromatografia, kolorymetria, spektroskopia IR czy krystalografia proszkowa powinien znaleźć wiele ofert które będą odpowiadać jego zdolnościom. Chemicy organicy też powinni znaleźć odpowiednie oferty na przykład w firmach farmaceutycznych.
Jednym z problemów związanych z szukaniem pracy po studiach jest jednak to, że niekoniecznie samo wykształcenie w odpowiednim kierunku jest warunkiem najważniejszym. W większości ogłoszeń pojawia się także wymóg posiadania doświadczenia w pracy w podobnych jak u pracodawcy laboratoriach. Z tym może być problem. Jedną z szans na nabycie takiego doświadczenia są letnie praktyki studenckie; postaranie się o to aby dostać się na praktyki do dobrej firmy, po pierwsze daje pewne doświadczenie i jest już jakimś dodatkowym plusem w CV, a po drugie zwiększa szanse, że po skończeniu studiów będzie chciał nas zatrudnić ten sam pracodawca. Tak udało się mojemu koledze z roku - dostał się na dwumiesięczne praktyki w laboratorium kontroli jakości fabryki Cocacoli i po obronieniu magistra poszedł tam pracować.
Inni studenci korzystają z tego, że firmy chętnie zatrudniają studentów aby korzystać z ulg podatkowych, na etapie studiów magisterskich, gdy obciążenie zajęciami jest mniejsze, można więc próbować znaleźć pracę jeszcze przed ukończeniem studiów.
*poprawiony błąd w "nie ważne"
Czy iść?
Wszystko zależy od zainteresowań danej osoby, jeśli ktoś interesuje się chemią, całkiem nieźle idzie mu ogółem w dziedzinach ścisłych, to powinien taką możliwość rozważyć. W moim przypadku wyglądało to tak, że naukami ścisłymi zainteresowałem się w szkole podstawowej, w piątej klasie brałem udział w olimpiadach, zamiast liceum wybrałem technikum chemiczne. Wobec tego wybieranie powiedzmy studiów ekonomicznych, filologicznych czy budowlanych mijałoby się z moimi predyspozycjami i byłoby marnowaniem już zużytego czasu.
Z drugiej strony nie może to być decyzja na tej zasadzie, że ktoś nie czuje się "humanistą" więc idzie na "jakiś kierunek ścisły". Gdy zaczynałem studia w UPH w Siedlcach na pierwszym semestrze zapisanych było ponad 120 osób, w tym takie które poszły tu na zasadzie "bo ten wydział jest blisko domu" albo "bo koleżanka mówiła że będzie tu zdawać" czy też "nie szło mi z polskiego i z biologii też więc poszedłem na chemię". Takie osoby szybko się wykruszyły, niektóre zmieniły kierunek już po miesiącu, inne odpadały podczas zaliczeń semestru czy końca roku. Do samego końca dotrwało ledwie 40 osób.
Kolejną rzeczą nad jaką warto się zastanowić, jest to, czy w ogóle trzeba iść na jakieś studia. W społeczeństwie panuje niestety powszechne przekonanie, że po studiach człowiek znajdzie pracę, ale po jakichkolwiek. Nieważne co skończyłeś, jak masz dyplom to coś tam znajdziesz. Że wystarczy mieć odpowiednie dokumenty i dyplomy z okrągłą pieczątką, a magiczne zaklęcie zadziała. Rozsiewają to chyba dyrektorowie prywatnych uczelni, które w tak sprzyjającym środowisku wyskakują jak grzyby po deszczu.
Niestety ale magister politologii nie umiejący obsługiwać krajzegi będzie dla dyrektora firmy meblarskiej równie bezużyteczny co świeżo upieczony maturzysta z podobną przypadłością. Natomiast obaj nie powinni mieć problemu aby pracować na kasie w Biedronce.
Jak będzie na chemii?
Cóż, nie łatwo. To w końcu dziedzina ścisła. Oprócz znajomości samej chemii konieczne będzie podszkolenie się z dziedzin sąsiednich, na pierwszym roku pojawi się na przykład bardziej niż w przeciętnym liceum zaawansowany kurs matematyki, potrzebny aby zrozumieć pewne zależności teoretyczne, a więc rozwiązywanie całek, macierze, układy równań itp. Zapewne trafi się też kurs z podstawowej fizyki, obejmujący tak "chemiczne" ćwiczenia jak badanie ruchu wahadła fizycznego, czy przewodnictwa.
Materiał kursów przedmiotowych jest często obszerny i wymaga zapamiętania dużej ilości nowych pojęć. Pewną trudność dla absolwenta liceum może też sprawiać nauczenie się jak korzystać z wykładów, gdzie wykładowca ciągnie cały czas temat i nie mówi nic o tym co trzeba zapisać do zeszytu. Z kolei na zajęciach laboratoryjnych dużo uwagi poświęca się samodzielnej pracy z próbówkami i odczynnikami, co dla jednych może być zachętą a dla innych barierą
Co po chemii?
Jednym z najważniejszych pytań jakie zadaje sobie maturzysta jest, czy po tych studiach znajdzie pracę. To znaczy mam nadzieję, że zada sobie takie pytanie.
Wybieranie na studia kierunku pożądanego w gospodarce z pewnością zwiększa szanse na to, że pracodawcy będą takiego absolwenta szukać, a akurat chemików jest w kraju niedostatek. Dużo oczywiście zależy od tego w jakim konkretnym kierunku się w trakcie studiów i etapu magisterskiego wyspecjalizujecie. Chemik analityk znający się na najczęściej używanych technikach jak chromatografia, kolorymetria, spektroskopia IR czy krystalografia proszkowa powinien znaleźć wiele ofert które będą odpowiadać jego zdolnościom. Chemicy organicy też powinni znaleźć odpowiednie oferty na przykład w firmach farmaceutycznych.
Jednym z problemów związanych z szukaniem pracy po studiach jest jednak to, że niekoniecznie samo wykształcenie w odpowiednim kierunku jest warunkiem najważniejszym. W większości ogłoszeń pojawia się także wymóg posiadania doświadczenia w pracy w podobnych jak u pracodawcy laboratoriach. Z tym może być problem. Jedną z szans na nabycie takiego doświadczenia są letnie praktyki studenckie; postaranie się o to aby dostać się na praktyki do dobrej firmy, po pierwsze daje pewne doświadczenie i jest już jakimś dodatkowym plusem w CV, a po drugie zwiększa szanse, że po skończeniu studiów będzie chciał nas zatrudnić ten sam pracodawca. Tak udało się mojemu koledze z roku - dostał się na dwumiesięczne praktyki w laboratorium kontroli jakości fabryki Cocacoli i po obronieniu magistra poszedł tam pracować.
Inni studenci korzystają z tego, że firmy chętnie zatrudniają studentów aby korzystać z ulg podatkowych, na etapie studiów magisterskich, gdy obciążenie zajęciami jest mniejsze, można więc próbować znaleźć pracę jeszcze przed ukończeniem studiów.
*poprawiony błąd w "nie ważne"
czwartek, 1 czerwca 2017
Zrób sobie sam: Świeczka z mydła
Opiszę tutaj dość proste doświadczenie, będące w zasadzie rozwinięciem myśli o jakiej wspominałem w artykule o usuwaniu kamienia z czajnika - z mydła da się zrobić całkiem niezłą świeczkę, i to przy użyciu bardzo skromnych, kuchennych sposobów.
Ba, tylko jak? Pierwsza nasuwająca się myśl, aby kostkę mydła przewiercić, wsadzić knot i podpalić, jest błędna, mydło słabo się pali (próbowałem). Aby się tego domyśleć, należy zacząć od rozważenia, czym właściwie mydło jest.
Wiele źródeł podaje, że mydło wynaleziono w starożytnej Gracji w świątyni na górze Sapo, gdzie tłuszcz wytapiający się z ofiar całopalnych mieszał się z popiołem ogniska a powstające szare bryłki pieniły się w wodzie. Jest to jednak mit - nie dość że źródła starożytne nie wspominają o żadnej górze Sapo, to na dodatek Grecy nie stosowali mydła.
Poza obmywaniem się w wodzie, ścieraniem brudu pumeksem i perfumowaniem, Grecy nacierali ciało olejem czasem z dodatkiem startego pumeksu, który następnie zbierano listewką, usuwając wraz z nim brud i zapach, zwykle przecież tłuste. Zbliżony do mydła przepis mieszaniny oleju, wonności i potażu podaje wprawdzie w tych czasów Piliniusz, ale była to pomada do usztywniania i farbowania na rudo włosów, używana przez wojowników w krajach północnych.
Przepisy na środki myjące oparte o popiół i tłuszcz pojawiają się w starożytnym Sumerze i Egipcie, ale nie ma dowodów na powszechne ich używanie dla higieny ciała. Sumerowie używali ich do oczyszczania wełny, zaś Egipcjanie jako składnik maści leczących choroby skóry. W efekcie, co może wydawać się zaskakujące, w historiografii pierwsze wzmianki o mydle jako twardych bryłkach używanych do mycia się pojawiają się dopiero gdy Rzymianie podbili dalsze zakątki Europy i spotkali się z takich zwyczajem wśród "barbarzyńskich" Galów i Celtów.
Żyjący w I wieku n.e. Areteusz z Kapadocji opisuje jak Galowie noszą ze sobą kule mydlanej masy, używając ich codziennie; pisze o tym z dezaprobatą, uważając za uwłaczający fakt, że mężczyźni barbarzyńców używają mydła (kojarzonego z kosmetykami do upiększania ciała) częściej niż niejedna Rzymianka.
Od nich pochodzi też nazwa - łacińskie "sapo" to bezpośrednie zapożyczenie z galijskiego saipo. Podobne słowa zachowały się też w językach germańskich, wywodząc się zapewne od wspólnego indoeuropejskiego rdzenia *seib/*seip znaczącego "coś co spływa, coś co się rozmazuje". Stąd zresztą także łacińskie "sebum" oznaczające łój lub smar. Nic dziwnego, bowiem łój zwierzęcy był głównym używanym składnikiem ówczesnych mydeł.
Z czasem "barbarzyński" zwyczaj zaczął się upowszechniać w Rzymie, mydlarnie zaczęły też powstawać na obrzeżach imperium.
Produkcja mydeł w kostkach na większą skalę zaczęła upowszechniać się dopiero w średniowieczu, za pośrednictwem Arabów, którzy wprowadzili dodatkową innowację, używając jako składnika natronu. Wtedy powstały słynne do dziś pracownie w Aleppo, i Marsylii używające jako składników oleju z oliwek lub oleju laurowego.
Ale czym jest mydło, w ujęciu chemicznym?
Podstawowymi składnikami potrzebnymi do jego wytwarzania są tłuszcze i silne mineralne zasady, dawniej był to głownie potaż otrzymywany ze spalonego drewna, ale też soda z natronu. Tłuszcz z kolei to ester, połączenie kwasów tłuszczowych z będącą alkoholem gliceryną:
Pod wpływem silnej zasady kwasy tłuszczowe odczepiają się od gliceryny i tworzą sole. Na własności i konsystencję mydła wpływa to jakie kwasy tłuszczowe przeważają w danej mieszaninie i jakiej użyto zasady, przykładowo mydła sodowe są twarde, ale już potasowe mają konsystencję bardziej mazistą. Mydła zawierające litowce są rozpuszczalne w wodzie, ale już na przykład wapniowe czy magnezowe rozpuszczają się słabo, i to ona z czasem tworzą osad w umywalkach czy wannach gdy mydło ma kontakt z twardą wodą. Mydło litowe jest twarde i stanowi składnik suchych smarów.
Jak zapewne pamiętacie z lekcji chemii, kwasy można uszeregować wedle mocy, to jest skłonności odszczepiania protonów. Kwasy mocniejsze potrafią wypierać z soli kwasy słabsze i tak dodanie kwasu solnego do kredy wypiera z węglanów kwas węglowy, rozkładający się do dwutlenku węgla, a dodanie kwasu solnego do octanu sodu wytworzy wolny kwas octowy.
W świetle powyższego łatwo się domyśleć, że jeśli poddamy mydło reakcji z jakimś mocniejszym kwasem, wyprzemy z niego wolne kwasy tłuszczowe. Mają one tłustą konsystencję, nie mieszają się z wodą i podobnie jak tłuszcze dobrze się palą. Znana powszechnie stearyna z której robiono kiedyś świece, była produkowana z łoju wołowego lub świńskiego, które najpierw zmydlano a potem zakwaszano oddzielając mieszaninę kwasów tłuszczowych, głownie stearynowego.
I na tym właśnie polegało doświadczenie, jakie przeprowadzałem.
Proces.
Produkcję świecy zacząłem od znalezienia dobrego mydła. Zależało mi na tym, aby miało możliwie najmniej dodatków, które mogłyby przeszkadzać, dlatego kupiłem hipoalergiczne mające w składzie tylko zmydlony olej palmowy i glicerynę.
Należało je teraz rozpuścić w wodzie. Pokroiłem je więc na drobną kostkę i zalałem ciepłą wodą w dużym pojemniku. Z perspektywy czasu sądzę jednak, że być może lepszym rozwiązaniem byłoby zetrzeć je na wiórki, większe bryłki nie chciały się bowiem tak dobrze rozpuszczać, nawet pod sam koniec wydłubywałem nieprzereagowane kawałki z otrzymanej masy.
Z rozpuszczaniem był zresztą problem, bo trzeba było na to dużo wody. Po pewnym czasie w pojemniku powstawała gęsta, kisielowata, ciągnąca się masa, pod którą pozostawało jeszcze dużo nie rozpuszczonych kawałków. Odlewałem ją przez sitko i zalewałem resztki kolejny raz:
I tak kilka razy aż z jednej 200 gramowej kostki zrobiły mi się ponad dwa litry skoncentrowanych mydlin. Ale to nie był jeszcze koniec, bo musiałem przygotować kwas.
Ponieważ w założeniu eksperyment miał być możliwy do powtórzenia w warunkach kuchennych, jako kwasu użyłem kwasku cytrynowego. Jest on mocniejszy od kwasów tłuszczowych i wypiera je z mydeł. Można to przetestować na małą skalę w prostym doświadczeniu z talerzem - bierzemy czysty talerz, moczymy go i smarujemy dno mokrym mydłem. Następnie jedną połowę zalewamy sokiem z cytryny i po chwili spłukujemy. Połowa talerza nie skropiona cytryną spłukuje się łatwo, natomiast druga okaże się tłusta w dotyku, jak nasmarowana smalcem.
Kwasek cytrynowy rozpuszczałem w wodzie, na stłuszczenie kostki mydła zużyłem sześć 20 gramowych opakowań. Mydliny podzieliłem na porcje po około pół litra i dolewałem szklankę roztworu kwasku szybko mieszając. Gęsta, ciągnąca się masa szybko zamieniła się w białe, drobne grudki o tłustym dotyku, lepiące się do ścianek naczynia:
Proces przypominał trochę ścinanie mleka przy produkcji twarogu. Mieszaninę odstawiłem na jakiś czas pozwalając jej do końca przereagować, aż zawiesina rozdzieliła się na warstwy:
Całość należało teraz przesączyć.
Początkowo planowałem zrobić to porządnie, przez papierowy filtr do kawy, złożony i karbowany, w kuchennym lejku, ale nie przewidziałem że wyjdzie tego aż tyle. Gdy wyobraziłem sobie jak siedzę w kuchni i mozolnie przesączam przez mały lejeczek trzy litry zawiesiny, postanowiłem użyć czegoś mniej profesjonalnego - sitka z ręcznikiem papierowym w charakterze filtra. Ma dużą powierzchnię sączenia, więc całość nie powinna była trwać długo.
Osad odsączony od opalizujacego płynu dodatkowo wycisnąłem, otrzymując grudkowatą, tłustą masę, faktycznie podobną do twarogu:
Zawierała ona jednak wciąż dużo wody zamkniętej w strukturze, a ponadto kawałki nieprzereagowanego mydła. Należało ją teraz przetopić. Początkowo używałem do tego małego garnuszka postawionego na słabym grzaniu:
Potem uznałem, że akurat ten pierwszy etap można przeprowadzić zalewając masę wrzątkiem wprost z czajnika. Wolne kwasy tłuszczowe topiły się w żółtą, oleistą ciecz, która nie mieszała się z wodą i wypływała na powierzchnię. Po ostygnięciu wystarczyło przebić skorupę i odlać spod spodu wodę z resztkami mydła:
Masę więc już miałem. Przypominała smalec, była tłusta w dotyku, lepiła się do palców. Zapach miała natomiast nieokreślony, właściwie to mydlany ale też z nutami przypominającymi zapach skór zwierzęcych. Wolne kwasy tłuszczowe często mają zapachy nieprzyjemne, zwłaszcza te małocząsteczkowe, na przykład kapronowy i kaprylowy śmierdzą kozą. Tutaj miałem głównie kwas palmitynowy i oleinowy, o dużych, długich cząsteczkach, zasadniczo więc niemal nielotne, widocznie jednak dostatecznie aby było czuć trudny do sprecyzowania, mdły zapach.
Podczas próby z małą porcją przekonałem się, że masa jest owszem palna i nawet wcale nie śmierdzi ani nie kopci czego się obawiałem, natomiast jest niskotopliwa. Kwas palmitynowy topi się w temperaturze 65°C, a oleinowy w 15°C. Dlatego po zapaleniu mała świeczka szybko całkowicie się rozpływała. Musiałem więc zrobić świeczkę w jakimś pojemniku. Użyłem słoika.
Zebrane wszystkie oczyszczone frakcje stopiłem w kubku wsadzonym do garnka z gotującą się wodą, i przelałem do słoika z knotem z ciemnego bawełnianego sznurka. Lepiej użyć naturalnego włókna, sznurek z czegoś sztucznego mógłby się stopić albo co gorsza zacząć śmierdzieć palonym plastikiem. Na tym ostatnim etapie do jeszcze płynnej masy dodałem olejki eteryczne aby świeczka pachniała i niebieski barwnik spożywczy. To ostatnie okazało się niezbyt dobrym pomysłem, barwnik w ogóle się nie rozpuścił i utworzył ciemne grudki. No ale.
Świeczka pali się dobrze, jasnym płomieniem, bez kopcenia i bez specjalnego zapachu. Obawiałem się, że będzie śmierdziała stearyną albo spalonym olejem. Płomień wygląda na otoczony dodatkową, pomarańczową "aurą", podejrzewam że to skutek dużej ilości soli sodu, widać to dobrze na zdjęciu z pierwszej próby z małą ilością:
Tak więc jak widzicie, było w tym trochę roboty, ale też sporo zabawy, czego też życzę czytelnikom gdyby przyszło im do głowy eksperyment powtórzyć. Z jednej 200 gramowej kostki mydła otrzymałem około 100 ml masy palnej. Spadek objętości to kwestia oddzielenia wody którą mydło na początku zawierało, gliceryny oraz nie zupełne przereagowanie wszystkich kawałeczków.
ps. Tak się składa że to już 250 opublikowany wpis na tym blogu.
Ba, tylko jak? Pierwsza nasuwająca się myśl, aby kostkę mydła przewiercić, wsadzić knot i podpalić, jest błędna, mydło słabo się pali (próbowałem). Aby się tego domyśleć, należy zacząć od rozważenia, czym właściwie mydło jest.
Wiele źródeł podaje, że mydło wynaleziono w starożytnej Gracji w świątyni na górze Sapo, gdzie tłuszcz wytapiający się z ofiar całopalnych mieszał się z popiołem ogniska a powstające szare bryłki pieniły się w wodzie. Jest to jednak mit - nie dość że źródła starożytne nie wspominają o żadnej górze Sapo, to na dodatek Grecy nie stosowali mydła.
Poza obmywaniem się w wodzie, ścieraniem brudu pumeksem i perfumowaniem, Grecy nacierali ciało olejem czasem z dodatkiem startego pumeksu, który następnie zbierano listewką, usuwając wraz z nim brud i zapach, zwykle przecież tłuste. Zbliżony do mydła przepis mieszaniny oleju, wonności i potażu podaje wprawdzie w tych czasów Piliniusz, ale była to pomada do usztywniania i farbowania na rudo włosów, używana przez wojowników w krajach północnych.
Przepisy na środki myjące oparte o popiół i tłuszcz pojawiają się w starożytnym Sumerze i Egipcie, ale nie ma dowodów na powszechne ich używanie dla higieny ciała. Sumerowie używali ich do oczyszczania wełny, zaś Egipcjanie jako składnik maści leczących choroby skóry. W efekcie, co może wydawać się zaskakujące, w historiografii pierwsze wzmianki o mydle jako twardych bryłkach używanych do mycia się pojawiają się dopiero gdy Rzymianie podbili dalsze zakątki Europy i spotkali się z takich zwyczajem wśród "barbarzyńskich" Galów i Celtów.
Żyjący w I wieku n.e. Areteusz z Kapadocji opisuje jak Galowie noszą ze sobą kule mydlanej masy, używając ich codziennie; pisze o tym z dezaprobatą, uważając za uwłaczający fakt, że mężczyźni barbarzyńców używają mydła (kojarzonego z kosmetykami do upiększania ciała) częściej niż niejedna Rzymianka.
Od nich pochodzi też nazwa - łacińskie "sapo" to bezpośrednie zapożyczenie z galijskiego saipo. Podobne słowa zachowały się też w językach germańskich, wywodząc się zapewne od wspólnego indoeuropejskiego rdzenia *seib/*seip znaczącego "coś co spływa, coś co się rozmazuje". Stąd zresztą także łacińskie "sebum" oznaczające łój lub smar. Nic dziwnego, bowiem łój zwierzęcy był głównym używanym składnikiem ówczesnych mydeł.
Z czasem "barbarzyński" zwyczaj zaczął się upowszechniać w Rzymie, mydlarnie zaczęły też powstawać na obrzeżach imperium.
Produkcja mydeł w kostkach na większą skalę zaczęła upowszechniać się dopiero w średniowieczu, za pośrednictwem Arabów, którzy wprowadzili dodatkową innowację, używając jako składnika natronu. Wtedy powstały słynne do dziś pracownie w Aleppo, i Marsylii używające jako składników oleju z oliwek lub oleju laurowego.
Ale czym jest mydło, w ujęciu chemicznym?
Podstawowymi składnikami potrzebnymi do jego wytwarzania są tłuszcze i silne mineralne zasady, dawniej był to głownie potaż otrzymywany ze spalonego drewna, ale też soda z natronu. Tłuszcz z kolei to ester, połączenie kwasów tłuszczowych z będącą alkoholem gliceryną:
Pod wpływem silnej zasady kwasy tłuszczowe odczepiają się od gliceryny i tworzą sole. Na własności i konsystencję mydła wpływa to jakie kwasy tłuszczowe przeważają w danej mieszaninie i jakiej użyto zasady, przykładowo mydła sodowe są twarde, ale już potasowe mają konsystencję bardziej mazistą. Mydła zawierające litowce są rozpuszczalne w wodzie, ale już na przykład wapniowe czy magnezowe rozpuszczają się słabo, i to ona z czasem tworzą osad w umywalkach czy wannach gdy mydło ma kontakt z twardą wodą. Mydło litowe jest twarde i stanowi składnik suchych smarów.
Jak zapewne pamiętacie z lekcji chemii, kwasy można uszeregować wedle mocy, to jest skłonności odszczepiania protonów. Kwasy mocniejsze potrafią wypierać z soli kwasy słabsze i tak dodanie kwasu solnego do kredy wypiera z węglanów kwas węglowy, rozkładający się do dwutlenku węgla, a dodanie kwasu solnego do octanu sodu wytworzy wolny kwas octowy.
W świetle powyższego łatwo się domyśleć, że jeśli poddamy mydło reakcji z jakimś mocniejszym kwasem, wyprzemy z niego wolne kwasy tłuszczowe. Mają one tłustą konsystencję, nie mieszają się z wodą i podobnie jak tłuszcze dobrze się palą. Znana powszechnie stearyna z której robiono kiedyś świece, była produkowana z łoju wołowego lub świńskiego, które najpierw zmydlano a potem zakwaszano oddzielając mieszaninę kwasów tłuszczowych, głownie stearynowego.
I na tym właśnie polegało doświadczenie, jakie przeprowadzałem.
Proces.
Produkcję świecy zacząłem od znalezienia dobrego mydła. Zależało mi na tym, aby miało możliwie najmniej dodatków, które mogłyby przeszkadzać, dlatego kupiłem hipoalergiczne mające w składzie tylko zmydlony olej palmowy i glicerynę.
Należało je teraz rozpuścić w wodzie. Pokroiłem je więc na drobną kostkę i zalałem ciepłą wodą w dużym pojemniku. Z perspektywy czasu sądzę jednak, że być może lepszym rozwiązaniem byłoby zetrzeć je na wiórki, większe bryłki nie chciały się bowiem tak dobrze rozpuszczać, nawet pod sam koniec wydłubywałem nieprzereagowane kawałki z otrzymanej masy.
Z rozpuszczaniem był zresztą problem, bo trzeba było na to dużo wody. Po pewnym czasie w pojemniku powstawała gęsta, kisielowata, ciągnąca się masa, pod którą pozostawało jeszcze dużo nie rozpuszczonych kawałków. Odlewałem ją przez sitko i zalewałem resztki kolejny raz:
I tak kilka razy aż z jednej 200 gramowej kostki zrobiły mi się ponad dwa litry skoncentrowanych mydlin. Ale to nie był jeszcze koniec, bo musiałem przygotować kwas.
Ponieważ w założeniu eksperyment miał być możliwy do powtórzenia w warunkach kuchennych, jako kwasu użyłem kwasku cytrynowego. Jest on mocniejszy od kwasów tłuszczowych i wypiera je z mydeł. Można to przetestować na małą skalę w prostym doświadczeniu z talerzem - bierzemy czysty talerz, moczymy go i smarujemy dno mokrym mydłem. Następnie jedną połowę zalewamy sokiem z cytryny i po chwili spłukujemy. Połowa talerza nie skropiona cytryną spłukuje się łatwo, natomiast druga okaże się tłusta w dotyku, jak nasmarowana smalcem.
Kwasek cytrynowy rozpuszczałem w wodzie, na stłuszczenie kostki mydła zużyłem sześć 20 gramowych opakowań. Mydliny podzieliłem na porcje po około pół litra i dolewałem szklankę roztworu kwasku szybko mieszając. Gęsta, ciągnąca się masa szybko zamieniła się w białe, drobne grudki o tłustym dotyku, lepiące się do ścianek naczynia:
Proces przypominał trochę ścinanie mleka przy produkcji twarogu. Mieszaninę odstawiłem na jakiś czas pozwalając jej do końca przereagować, aż zawiesina rozdzieliła się na warstwy:
Całość należało teraz przesączyć.
Początkowo planowałem zrobić to porządnie, przez papierowy filtr do kawy, złożony i karbowany, w kuchennym lejku, ale nie przewidziałem że wyjdzie tego aż tyle. Gdy wyobraziłem sobie jak siedzę w kuchni i mozolnie przesączam przez mały lejeczek trzy litry zawiesiny, postanowiłem użyć czegoś mniej profesjonalnego - sitka z ręcznikiem papierowym w charakterze filtra. Ma dużą powierzchnię sączenia, więc całość nie powinna była trwać długo.
Osad odsączony od opalizujacego płynu dodatkowo wycisnąłem, otrzymując grudkowatą, tłustą masę, faktycznie podobną do twarogu:
Zawierała ona jednak wciąż dużo wody zamkniętej w strukturze, a ponadto kawałki nieprzereagowanego mydła. Należało ją teraz przetopić. Początkowo używałem do tego małego garnuszka postawionego na słabym grzaniu:
Potem uznałem, że akurat ten pierwszy etap można przeprowadzić zalewając masę wrzątkiem wprost z czajnika. Wolne kwasy tłuszczowe topiły się w żółtą, oleistą ciecz, która nie mieszała się z wodą i wypływała na powierzchnię. Po ostygnięciu wystarczyło przebić skorupę i odlać spod spodu wodę z resztkami mydła:
Masę więc już miałem. Przypominała smalec, była tłusta w dotyku, lepiła się do palców. Zapach miała natomiast nieokreślony, właściwie to mydlany ale też z nutami przypominającymi zapach skór zwierzęcych. Wolne kwasy tłuszczowe często mają zapachy nieprzyjemne, zwłaszcza te małocząsteczkowe, na przykład kapronowy i kaprylowy śmierdzą kozą. Tutaj miałem głównie kwas palmitynowy i oleinowy, o dużych, długich cząsteczkach, zasadniczo więc niemal nielotne, widocznie jednak dostatecznie aby było czuć trudny do sprecyzowania, mdły zapach.
Podczas próby z małą porcją przekonałem się, że masa jest owszem palna i nawet wcale nie śmierdzi ani nie kopci czego się obawiałem, natomiast jest niskotopliwa. Kwas palmitynowy topi się w temperaturze 65°C, a oleinowy w 15°C. Dlatego po zapaleniu mała świeczka szybko całkowicie się rozpływała. Musiałem więc zrobić świeczkę w jakimś pojemniku. Użyłem słoika.
Zebrane wszystkie oczyszczone frakcje stopiłem w kubku wsadzonym do garnka z gotującą się wodą, i przelałem do słoika z knotem z ciemnego bawełnianego sznurka. Lepiej użyć naturalnego włókna, sznurek z czegoś sztucznego mógłby się stopić albo co gorsza zacząć śmierdzieć palonym plastikiem. Na tym ostatnim etapie do jeszcze płynnej masy dodałem olejki eteryczne aby świeczka pachniała i niebieski barwnik spożywczy. To ostatnie okazało się niezbyt dobrym pomysłem, barwnik w ogóle się nie rozpuścił i utworzył ciemne grudki. No ale.
Świeczka pali się dobrze, jasnym płomieniem, bez kopcenia i bez specjalnego zapachu. Obawiałem się, że będzie śmierdziała stearyną albo spalonym olejem. Płomień wygląda na otoczony dodatkową, pomarańczową "aurą", podejrzewam że to skutek dużej ilości soli sodu, widać to dobrze na zdjęciu z pierwszej próby z małą ilością:
Tak więc jak widzicie, było w tym trochę roboty, ale też sporo zabawy, czego też życzę czytelnikom gdyby przyszło im do głowy eksperyment powtórzyć. Z jednej 200 gramowej kostki mydła otrzymałem około 100 ml masy palnej. Spadek objętości to kwestia oddzielenia wody którą mydło na początku zawierało, gliceryny oraz nie zupełne przereagowanie wszystkich kawałeczków.
ps. Tak się składa że to już 250 opublikowany wpis na tym blogu.
piątek, 19 maja 2017
Anegdoty o chemikach i kolorach
Niebieski
Gdy pies nasika chemikowi na ścianę...
Pittakall to prawdopodobnie pierwszy syntetyczny barwnik organiczny*, jaki pojawił się w handlu, choć nie zdobył zbyt dużej popularności i dość szybko zarzucono jego produkcję. Jego przypadkowym odkrywcą był niemiecki chemik Karl Reichenbach. Na początku XIX wieku zarządzając małą fabryką chemiczną zajął się badaniem produktów suchej destylacji drewna, węgla i szczątków organicznych. To on wydzielił ze smoły różne wartościowe frakcje, w tym kreozot, parafinę czy fenol, a także pierwszy olej opałowy nazwany eupinonem.
Kreozot, będący frakcją smoły z drewna drzew liściastych, miał dość charakterystyczną, silną woń oraz dobre właściwości konserwujące, dlatego chemik zaczął stosować go do impregnowania drewna. Do dziś zresztą jest częstym składnikiem impregnatów, na przykład do podkładów kolejowych.
Postanowił wypróbować go także w zastosowaniu dużo bardziej przyziemnym - przeszkadzało mu, że psy sikają mu zewnętrzną ścianę domu, więc posmarował ją kreozotem aby zapach je odstraszał. Psom najwyraźniej było wszystko jedno, bardzo lubiły tam stawać i podnosić nogę, lejąc bezczelnie po wysmarowanej ścianie. Cóż, widocznie nie było to dobry środek na psy.
Przyglądając się ich działalności zauważył jednak ciekawą rzecz - w miejscu gdzie stały plamy moczu, na ziemi pojawiło się wyraźne, niebieskie zabarwienie. A ponieważ był człowiekiem bardzo praktycznym, zaczął czynić próby powtórzenia reakcji. Szybko wykrył, że mocz nie jest w jej potrzebny, stanowił jedynie alkaliczny reagent. Prowadząc destylację surowej smoły stwierdził, że frakcja o temperaturze wrzenia wyższej niż kreozot, po wprowadzeniu do wody wapiennej lub roztworu wodorotlenku baru, po pewnym czasie zamienia się w ciemnogranatowy proszek.
Wprowadził go na rynek jako pigment nadający się do farbowania po rozpuszczeniu w alkaliach. Najwyraźniej jednak nie miał zbyt dobrych właściwości i po pewnym czasie przestał być używany, pojawiając się jedynie od czasu do czasu w historycznych spisach barwników. Dopiero pod koniec XIX wieku ustalono, że jest to związek będący produktem kondensacji pirogallolu, o strukturze podobnej do barwników trifenylometylenowych. W formie anionowej przybierał intensywny kolor. Pigment Reichenbacha był laką, to jest nierozpuszczalną solą barową lub wapniową.
Pittakall jest dziś w zasadzie historyczną ciekawostką. Mam wrażenie, że od ponad stu lat nikt go nie otrzymywał, bo poza wzmiankami w pracach o historii barwników nie znalazłem o nim żadnej dalszej informacji ani tym bardziej zdjęcia próbki. Ponoć miał dość ciemny odcień niebieskiego.[1]
Ftalocyjanina
Kolejny niebieski barwnik także został odkryty niezamierzenie, podczas otrzymywania czegoś innego, i to dwa razy.
W 1927 roku szwajcarscy chemicy Henri Diesbach i Edmond von de Weid zajmowali się znalezieniem lepszej niż już znane metody otrzymywania ftalonitrylu, to jest pochodnej benzenu z dwiema grupami -CN. Znana była już w tym czasie reakcja Sandmeyera, polegająca na podstawieniu soli diazoniowych, gdzie grupa -NN była łatwo zamieniana na inne. Przy jej pomocy otrzymywano ftalonitryl z o-aminobenzonitrylu (a ten z rozkładu termicznego amidu kwasu antranilowego).
Badacze postanowili spróbować nieco innej metody, której substrat był bardziej stabilny i łatwiejszy w otrzymaniu. Była to reakcja Rosenmunda-von Brauna (nie mylić z reakcją Rosenmunda samego, czyli redukcją kwasów do aldehydów) polegająca na podstawieniu halogenku przy pierścieniu aromatycznym, przez anion cyjankowy z cyjanku miedzi.[2]
Jako substratu użyli 1,2-dibromobenzenu. Pomysł był w istocie dosyć prosty, reakcja powinna przebiegać w taki oto sposób:
Produktem powinna być bezbarwna lub nieco żółtawa krystaliczna substancja. Jakież więc było zdziwienie chemików, gdy po reakcji znaleźli w kolbie osad intensywnie niebieski.
Produkt był bardzo trwały, nierozpuszczalny w wodzie i dość trudno w innych rozpuszczalnikach. Po wyznaczeniu przez analizę elementarną składu C26H18N6Cu uznali, że prawdopodobnie mają do czynienia ze związkiem kompleksowym ftalonitrylu i pirydyny, zawierającym jeden atom miedzi i po dwie cząsteczki tych związków [3]. Ale mylili się.
Drugimi odkrywcami byli chemicy w fabryce Scottish Dyes (dziś ICI), którzy w 1928 roku analizowali metodę przemysłowego otrzymywania ftalimidu. Bezwodnik ftalowy był w tej syntezie poddawany reakcji z amoniakiem w stężonym roztworze wodnym, zaś jako reaktorów używano emaliowanych żeliwnych kotłów. Mechaniczne mieszadło powodowało, że emalia z czasem się zdzierała, zaś pilnujący procesu technolodzy zauważyli, że partie produktu z tych najbardziej wytartych kotłów były zanieczyszczone drobnym, niebieskawym osadem. Było zresztą zauważalne, że na niebieskawy kolor zabarwił się odsłonięty metal.
Po zebraniu większej ilości zanieczyszczenia, pracownicy fabryki zdali sobie sprawę z tego, że potencjalnie mógłby to być niezły pigment, miał bowiem niską rozpuszczalność i bardzo dużą siłę barwiącą. Kolejną więc syntezę przeprowadzono dodając do masy wiórki żelazne, był to jednak proces mało wydajny. Należało odpowiedzieć na pytanie, co właściwie zachodzi w reaktorze i jaki związek otrzymano.
Po wpływem silnych alkaliów związek tracił metal, powstała wolna forma nadal była niebieska ale o dużo słabszym odcieniu. Można było połączyć ją z innymi metalami, zwłaszcza ze szczególnie chętnie wiązaną miedzią, tworząc kompleksy bardzo trwałe i intensywnie zabarwione. Analizy pokazały, że związek ma charakter aromatyczny i być może zawiera układ skumulowanych pierścieni. Dopiero w 1933 roku Patrick Linstead zaproponował dla związku budowę makrocykliczną, podobną do porfiryny, z czterema fragmentami benzopirolu połączonymi przez mostkowe azoty, co potwierdziły potem badania rentgenowskie.
Firma ICI zaczęła produkować pigment w 1934 roku po udoskonaleniu metod pod nazwą Monastral Blue, lub błękit ftalocyjaninowy. Był wielkim osiągnięciem. Niebieskich pigmentów było w tym czasie niewiele, w zasadzie istniały tylko nieorganiczne oparte o sole miedzi i ultramarynę, oraz indygo i jego pochodne. Błękit ftalocyjaninowy miał tą zaletę, że będąc barwnikiem organicznym posiadał wysoką odporność na blaknięcie, miał dużą siłę barwiącą, był na tyle słabo rozpuszczalny że nie migrował do innych warstw malarskich, oraz był dosyć odporny na czynniki fizyczne i chemiczne. Związek ten rozkłada się dopiero w temperaturze 600 stopni.
Do dziś jest jednym z najczęściej wykorzystywanych barwników, zwłaszcza do farb do metalu, ale też atramentów czy tuszu do długopisów. Jest na przykład składnikiem standardowego tuszu niebieskiego do drukarek, a ze względu na znikomą toksyczność także pigmentów do tatuażu.
Niezamierzony niebieski pigment
To odkrycie także miało pewien element przypadkowości.
Zespół profesora Subramaniana, na uniwersytecie stanowym w Oregonie, zajmował się badaniami tlenkowych materiałów ceramicznych z solami ziem rzadkich, które mogłyby potencjalnie znaleźć zastosowanie w elektronice. Niektóre mogłyby okazać się magnesami stałymi, inne nadprzewodnikami niskotemperaturowymi, ferroelektrykami czy superopornikami. Studenci profesora biorący udział w pracach testowali więc różne mieszanki tlenków i chlorków metali, które po wymieszaniu w młynie kulowym na bardzo drobny proszek wypalano w odpowiedniej temperaturze.
Doktorant Andrew E. Smith spróbował pewnego razu nietypowej mieszanki tlenku itru, indu i manganu VI. Dwutlenek manganu jest intensywnie czarny, dlatego po zmieleniu uzyskał ciemnoszary proszek. Następnie wsadził go na chwilkę do pieca aby się wygrzał. Temperatura szybko osiągnęła prawie 1100 stopni, a tlenki przereagowały ze sobą, tworząc nowe połączenie. Akurat to konkretne nie miało szczególnie ciekawych własności elektrycznych czy magnetycznych, lecz jedna właściwość rzucała się w oczy od razu po wyjęciu z pieca - otrzymany proszek okazał się niesamowicie niebieski.[4]
Gdy profesor zobaczył próbkę od razu przyszło mu do głowy, że to może znaleźć zastosowanie. Właściwie jeszcze przed publikacją na temat związku zaczęto starania nad komercjalizacją.
Jak się okazało podczas wyprażania powstaje związek zawierający warstwy tlenku manganu o nietypowej koordynacji w formie bipiramidy trygonalnej. W każdej takiej jednostce atom manganu otoczony jest przez pięć atomów tlenu, w tym trzy w płaszczyźnie warstwy i po jednym nad i pod nią. W takim położeniu oddziaływanie ligandów powoduje rozszczepienie poziomów energetycznych orbitali d manganu w taki sposób, że związek pochłania światło czerwone i zielone dając w efekcie niebieski kolor.
Wcześniej znany był pigment oparty o manganian baru, ale miał małą stabilność, nowy pigment nazwany YInMn nie tylko jest odporny na utlenienie czy redukcję, ale też zachowuje kolor w bardzo wysokich temperaturach i nie blaknie pod wpływem wilgoci. Szybko okazało się, że dobrze nadaje się zarówno do farb olejowych jak i wodnych, a także jako pigment do barwienia mas plastycznych. W tych zastosowaniach ważną własnością jest też jego nietoksyczność. Inne pigmenty nieorganiczne podobnej trwałości zwykle zawierają sole rakotwórczego kobaltu lub sole miedzi.
Podczas dalszych badań stwierdzono, że choć związek silnie pochłania światło czerwone, to zarazem silnie odbija podczerwień, osiągając jeden z najwyższych współczynników odbicia dla materiałów niemetalicznych (srebro odbija niemal 100% podczerwieni). Dzięki temu powierzchnie pomalowane farbą z tym pigmentem bardzo mało się nagrzewają, co miałoby znaczenie w przypadku na przykład dachów w cieplejszych krajach
Obecnie pigment zaczyna powoli wchodzić na rynek, niedawno producent kredek świecowych i pasteli Crayola ogłosił wprowadzenie kredki z YInMn, trwa konkurs na wymyślenie nazwy [5].
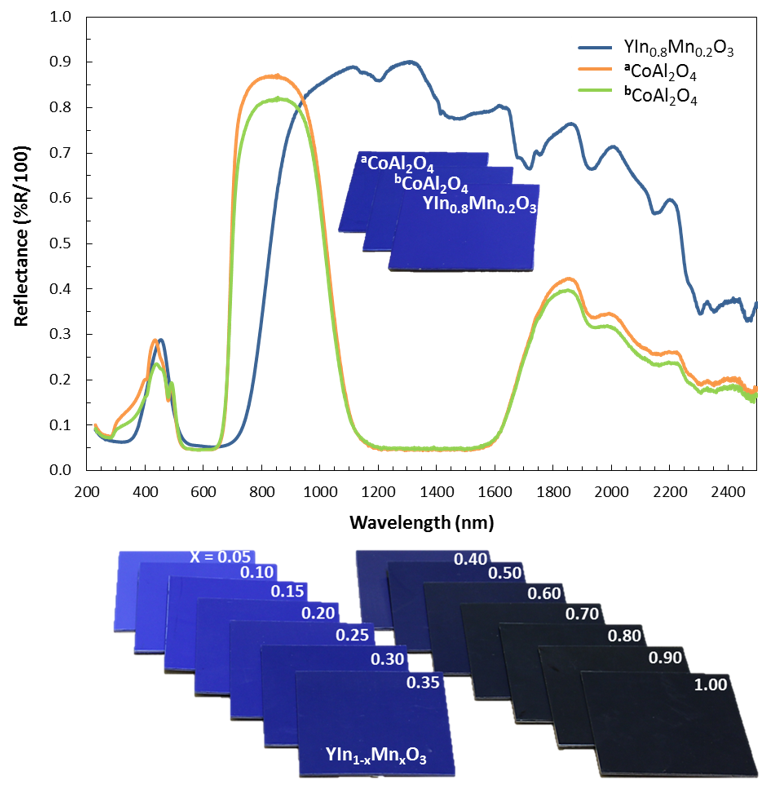
Jednak wbrew temu co piszą media, pigment nie posiada nowego, dopiero teraz odkrytego odcienia niebieskiego. W najbardziej optymalnym składzie YIn0.8Mn0.2O3 , związek ma kolor błękitu kobaltowego lub nieco cieplejszy, mimo zupełnie różnego przebiegu krzywej absorpcji:
Odcień może płynnie zmieniać się w zależności od stosunku itru do manganu. Dodatek innych metali, na przykład tytanu czy cynku może natomiast zmienić kolor na zielony lub fioletowy.[6]
W zespole prof. Subramaniana trwają prace nad uzyskaniem pigmentu czerwonego o odcieniu i intensywności nie stosowanych dziś z powodu toksyczności pigmentów rtęciowych jak cynober.
Może jeszcze kiedyś napiszę coś o projektowaniu barwników aby pokazać, jak takie rzeczy otrzymuje się planowo, bez czekania na szczęśliwy przypadek.
-------
* Aczkolwiek wcześniej niż Pittakall bo w XVIII wieku stworzono kwas pikrynowy, przez pewien czas używany do farbowania wełny, zastosowanie jako barwnik znalazł jednak dużo później. Półsyntetyczny był natomiast otrzymany w podobnym czasie indygokarmin, znany jako błękit saksoński, pozyskiwany przez traktowanie indygo dymiącym kwasem siarkowym.
[1] George B. Kauffman, Pittacal - The first synthetic dyestuff, Journal of Chemical Education (12) 1977 str. 753
[2] Sandmeyer-von Braun reaction
[3] De Diesbach, Henri; von Der Weid, Edmond (1927). "Quelques sels complexes des o-dinitriles avec le cuivre et la pyridine". Helvetica Chimica Acta. 10: 886.
[4] http://oregonstate.edu/ua/ncs/archives/2009/nov/accidental-discovery-produces-durable-new-blue-pigment-multiple-applications-0
[5] http://oregonstate.edu/ua/ncs/archives/2017/may/pigment-discovered-oregon-state-university-inspires-new-crayola-crayon-color
[6] http://chemistry.oregonstate.edu/content/story-yinmn-blue
Gdy pies nasika chemikowi na ścianę...
Pittakall to prawdopodobnie pierwszy syntetyczny barwnik organiczny*, jaki pojawił się w handlu, choć nie zdobył zbyt dużej popularności i dość szybko zarzucono jego produkcję. Jego przypadkowym odkrywcą był niemiecki chemik Karl Reichenbach. Na początku XIX wieku zarządzając małą fabryką chemiczną zajął się badaniem produktów suchej destylacji drewna, węgla i szczątków organicznych. To on wydzielił ze smoły różne wartościowe frakcje, w tym kreozot, parafinę czy fenol, a także pierwszy olej opałowy nazwany eupinonem.
Kreozot, będący frakcją smoły z drewna drzew liściastych, miał dość charakterystyczną, silną woń oraz dobre właściwości konserwujące, dlatego chemik zaczął stosować go do impregnowania drewna. Do dziś zresztą jest częstym składnikiem impregnatów, na przykład do podkładów kolejowych.
Postanowił wypróbować go także w zastosowaniu dużo bardziej przyziemnym - przeszkadzało mu, że psy sikają mu zewnętrzną ścianę domu, więc posmarował ją kreozotem aby zapach je odstraszał. Psom najwyraźniej było wszystko jedno, bardzo lubiły tam stawać i podnosić nogę, lejąc bezczelnie po wysmarowanej ścianie. Cóż, widocznie nie było to dobry środek na psy.
Przyglądając się ich działalności zauważył jednak ciekawą rzecz - w miejscu gdzie stały plamy moczu, na ziemi pojawiło się wyraźne, niebieskie zabarwienie. A ponieważ był człowiekiem bardzo praktycznym, zaczął czynić próby powtórzenia reakcji. Szybko wykrył, że mocz nie jest w jej potrzebny, stanowił jedynie alkaliczny reagent. Prowadząc destylację surowej smoły stwierdził, że frakcja o temperaturze wrzenia wyższej niż kreozot, po wprowadzeniu do wody wapiennej lub roztworu wodorotlenku baru, po pewnym czasie zamienia się w ciemnogranatowy proszek.
Wprowadził go na rynek jako pigment nadający się do farbowania po rozpuszczeniu w alkaliach. Najwyraźniej jednak nie miał zbyt dobrych właściwości i po pewnym czasie przestał być używany, pojawiając się jedynie od czasu do czasu w historycznych spisach barwników. Dopiero pod koniec XIX wieku ustalono, że jest to związek będący produktem kondensacji pirogallolu, o strukturze podobnej do barwników trifenylometylenowych. W formie anionowej przybierał intensywny kolor. Pigment Reichenbacha był laką, to jest nierozpuszczalną solą barową lub wapniową.
Pittakall jest dziś w zasadzie historyczną ciekawostką. Mam wrażenie, że od ponad stu lat nikt go nie otrzymywał, bo poza wzmiankami w pracach o historii barwników nie znalazłem o nim żadnej dalszej informacji ani tym bardziej zdjęcia próbki. Ponoć miał dość ciemny odcień niebieskiego.[1]
Ftalocyjanina
Kolejny niebieski barwnik także został odkryty niezamierzenie, podczas otrzymywania czegoś innego, i to dwa razy.
W 1927 roku szwajcarscy chemicy Henri Diesbach i Edmond von de Weid zajmowali się znalezieniem lepszej niż już znane metody otrzymywania ftalonitrylu, to jest pochodnej benzenu z dwiema grupami -CN. Znana była już w tym czasie reakcja Sandmeyera, polegająca na podstawieniu soli diazoniowych, gdzie grupa -NN była łatwo zamieniana na inne. Przy jej pomocy otrzymywano ftalonitryl z o-aminobenzonitrylu (a ten z rozkładu termicznego amidu kwasu antranilowego).
Badacze postanowili spróbować nieco innej metody, której substrat był bardziej stabilny i łatwiejszy w otrzymaniu. Była to reakcja Rosenmunda-von Brauna (nie mylić z reakcją Rosenmunda samego, czyli redukcją kwasów do aldehydów) polegająca na podstawieniu halogenku przy pierścieniu aromatycznym, przez anion cyjankowy z cyjanku miedzi.[2]
Jako substratu użyli 1,2-dibromobenzenu. Pomysł był w istocie dosyć prosty, reakcja powinna przebiegać w taki oto sposób:
Produktem powinna być bezbarwna lub nieco żółtawa krystaliczna substancja. Jakież więc było zdziwienie chemików, gdy po reakcji znaleźli w kolbie osad intensywnie niebieski.
Produkt był bardzo trwały, nierozpuszczalny w wodzie i dość trudno w innych rozpuszczalnikach. Po wyznaczeniu przez analizę elementarną składu C26H18N6Cu uznali, że prawdopodobnie mają do czynienia ze związkiem kompleksowym ftalonitrylu i pirydyny, zawierającym jeden atom miedzi i po dwie cząsteczki tych związków [3]. Ale mylili się.
Drugimi odkrywcami byli chemicy w fabryce Scottish Dyes (dziś ICI), którzy w 1928 roku analizowali metodę przemysłowego otrzymywania ftalimidu. Bezwodnik ftalowy był w tej syntezie poddawany reakcji z amoniakiem w stężonym roztworze wodnym, zaś jako reaktorów używano emaliowanych żeliwnych kotłów. Mechaniczne mieszadło powodowało, że emalia z czasem się zdzierała, zaś pilnujący procesu technolodzy zauważyli, że partie produktu z tych najbardziej wytartych kotłów były zanieczyszczone drobnym, niebieskawym osadem. Było zresztą zauważalne, że na niebieskawy kolor zabarwił się odsłonięty metal.
Po zebraniu większej ilości zanieczyszczenia, pracownicy fabryki zdali sobie sprawę z tego, że potencjalnie mógłby to być niezły pigment, miał bowiem niską rozpuszczalność i bardzo dużą siłę barwiącą. Kolejną więc syntezę przeprowadzono dodając do masy wiórki żelazne, był to jednak proces mało wydajny. Należało odpowiedzieć na pytanie, co właściwie zachodzi w reaktorze i jaki związek otrzymano.
Po wpływem silnych alkaliów związek tracił metal, powstała wolna forma nadal była niebieska ale o dużo słabszym odcieniu. Można było połączyć ją z innymi metalami, zwłaszcza ze szczególnie chętnie wiązaną miedzią, tworząc kompleksy bardzo trwałe i intensywnie zabarwione. Analizy pokazały, że związek ma charakter aromatyczny i być może zawiera układ skumulowanych pierścieni. Dopiero w 1933 roku Patrick Linstead zaproponował dla związku budowę makrocykliczną, podobną do porfiryny, z czterema fragmentami benzopirolu połączonymi przez mostkowe azoty, co potwierdziły potem badania rentgenowskie.
Firma ICI zaczęła produkować pigment w 1934 roku po udoskonaleniu metod pod nazwą Monastral Blue, lub błękit ftalocyjaninowy. Był wielkim osiągnięciem. Niebieskich pigmentów było w tym czasie niewiele, w zasadzie istniały tylko nieorganiczne oparte o sole miedzi i ultramarynę, oraz indygo i jego pochodne. Błękit ftalocyjaninowy miał tą zaletę, że będąc barwnikiem organicznym posiadał wysoką odporność na blaknięcie, miał dużą siłę barwiącą, był na tyle słabo rozpuszczalny że nie migrował do innych warstw malarskich, oraz był dosyć odporny na czynniki fizyczne i chemiczne. Związek ten rozkłada się dopiero w temperaturze 600 stopni.
Do dziś jest jednym z najczęściej wykorzystywanych barwników, zwłaszcza do farb do metalu, ale też atramentów czy tuszu do długopisów. Jest na przykład składnikiem standardowego tuszu niebieskiego do drukarek, a ze względu na znikomą toksyczność także pigmentów do tatuażu.
Niezamierzony niebieski pigment
To odkrycie także miało pewien element przypadkowości.
Zespół profesora Subramaniana, na uniwersytecie stanowym w Oregonie, zajmował się badaniami tlenkowych materiałów ceramicznych z solami ziem rzadkich, które mogłyby potencjalnie znaleźć zastosowanie w elektronice. Niektóre mogłyby okazać się magnesami stałymi, inne nadprzewodnikami niskotemperaturowymi, ferroelektrykami czy superopornikami. Studenci profesora biorący udział w pracach testowali więc różne mieszanki tlenków i chlorków metali, które po wymieszaniu w młynie kulowym na bardzo drobny proszek wypalano w odpowiedniej temperaturze.
Doktorant Andrew E. Smith spróbował pewnego razu nietypowej mieszanki tlenku itru, indu i manganu VI. Dwutlenek manganu jest intensywnie czarny, dlatego po zmieleniu uzyskał ciemnoszary proszek. Następnie wsadził go na chwilkę do pieca aby się wygrzał. Temperatura szybko osiągnęła prawie 1100 stopni, a tlenki przereagowały ze sobą, tworząc nowe połączenie. Akurat to konkretne nie miało szczególnie ciekawych własności elektrycznych czy magnetycznych, lecz jedna właściwość rzucała się w oczy od razu po wyjęciu z pieca - otrzymany proszek okazał się niesamowicie niebieski.[4]
Gdy profesor zobaczył próbkę od razu przyszło mu do głowy, że to może znaleźć zastosowanie. Właściwie jeszcze przed publikacją na temat związku zaczęto starania nad komercjalizacją.
Jak się okazało podczas wyprażania powstaje związek zawierający warstwy tlenku manganu o nietypowej koordynacji w formie bipiramidy trygonalnej. W każdej takiej jednostce atom manganu otoczony jest przez pięć atomów tlenu, w tym trzy w płaszczyźnie warstwy i po jednym nad i pod nią. W takim położeniu oddziaływanie ligandów powoduje rozszczepienie poziomów energetycznych orbitali d manganu w taki sposób, że związek pochłania światło czerwone i zielone dając w efekcie niebieski kolor.
Wcześniej znany był pigment oparty o manganian baru, ale miał małą stabilność, nowy pigment nazwany YInMn nie tylko jest odporny na utlenienie czy redukcję, ale też zachowuje kolor w bardzo wysokich temperaturach i nie blaknie pod wpływem wilgoci. Szybko okazało się, że dobrze nadaje się zarówno do farb olejowych jak i wodnych, a także jako pigment do barwienia mas plastycznych. W tych zastosowaniach ważną własnością jest też jego nietoksyczność. Inne pigmenty nieorganiczne podobnej trwałości zwykle zawierają sole rakotwórczego kobaltu lub sole miedzi.
Podczas dalszych badań stwierdzono, że choć związek silnie pochłania światło czerwone, to zarazem silnie odbija podczerwień, osiągając jeden z najwyższych współczynników odbicia dla materiałów niemetalicznych (srebro odbija niemal 100% podczerwieni). Dzięki temu powierzchnie pomalowane farbą z tym pigmentem bardzo mało się nagrzewają, co miałoby znaczenie w przypadku na przykład dachów w cieplejszych krajach
Obecnie pigment zaczyna powoli wchodzić na rynek, niedawno producent kredek świecowych i pasteli Crayola ogłosił wprowadzenie kredki z YInMn, trwa konkurs na wymyślenie nazwy [5].
Jednak wbrew temu co piszą media, pigment nie posiada nowego, dopiero teraz odkrytego odcienia niebieskiego. W najbardziej optymalnym składzie YIn0.8Mn0.2O3 , związek ma kolor błękitu kobaltowego lub nieco cieplejszy, mimo zupełnie różnego przebiegu krzywej absorpcji:
Odcień może płynnie zmieniać się w zależności od stosunku itru do manganu. Dodatek innych metali, na przykład tytanu czy cynku może natomiast zmienić kolor na zielony lub fioletowy.[6]
W zespole prof. Subramaniana trwają prace nad uzyskaniem pigmentu czerwonego o odcieniu i intensywności nie stosowanych dziś z powodu toksyczności pigmentów rtęciowych jak cynober.
Może jeszcze kiedyś napiszę coś o projektowaniu barwników aby pokazać, jak takie rzeczy otrzymuje się planowo, bez czekania na szczęśliwy przypadek.
-------
* Aczkolwiek wcześniej niż Pittakall bo w XVIII wieku stworzono kwas pikrynowy, przez pewien czas używany do farbowania wełny, zastosowanie jako barwnik znalazł jednak dużo później. Półsyntetyczny był natomiast otrzymany w podobnym czasie indygokarmin, znany jako błękit saksoński, pozyskiwany przez traktowanie indygo dymiącym kwasem siarkowym.
[1] George B. Kauffman, Pittacal - The first synthetic dyestuff, Journal of Chemical Education (12) 1977 str. 753
[2] Sandmeyer-von Braun reaction
[3] De Diesbach, Henri; von Der Weid, Edmond (1927). "Quelques sels complexes des o-dinitriles avec le cuivre et la pyridine". Helvetica Chimica Acta. 10: 886.
[4] http://oregonstate.edu/ua/ncs/archives/2009/nov/accidental-discovery-produces-durable-new-blue-pigment-multiple-applications-0
[5] http://oregonstate.edu/ua/ncs/archives/2017/may/pigment-discovered-oregon-state-university-inspires-new-crayola-crayon-color
[6] http://chemistry.oregonstate.edu/content/story-yinmn-blue
Subskrybuj:
Komentarze (Atom)