Kwas cytrynowy należy do najczęstszych stosowanych dodatków żywnościowych, również przez nas samych w domowym zakresie. Nic więc dziwnego że znalazł się na celowników internetowych panikarzy, do wszystkiego co oznaczone literką E podchodzących jak diabeł do wody być może święconej. Co zaskakujące, dokładnie przeciwny stosunek mają do obfitujących w ten związek owoców cytrusowych, stanowiących częsty składnik mikstur detoksykacyjnych.
Swoistą kwintesencję krążących po internecie plotek stanowi artykuł z Astromarii, który będę dalej selektywnie cytował:
Kwasy hamują proces utleniania, a więc są naturalnymi konserwantami. Naturalne kwasy występują w wielu produktach spożywczych, takich jak kiszonki oraz przetwory mleczne i owocowe. Ale władza uznała, że tamte kwasy nie wystarczą, konieczny jest jeszcze jeden. Mało tego, według nich zakwaszania wymagają również te wyroby, które z natury kwaśne nie są (a więc praktycznie wszystkie). Mogliby oczywiście wybrać kwas askorbinowy, który nie dość, że jest tani, to jeszcze zdrowy (witamina C), ale dziwnym trafem wybrali nienaturalny i pozbawiony wartości zdrowotnych kwasek cytrynowy i przekonali producentów, że jest on niezbędny i trzeba go sypać wszędzie, nawet tam, gdzie jest już i tak wystarczająco kwaśno. I mimo, że ma on właściwości konserwujące (po to przecież jest dodawany) ładują do wszystkiego jeszcze różne benzoesany i inne konserwanty.A więc dla porządku:
Wbrew ładnie brzmiącej nazwie kwasek cytrynowy nie ma nic wspólnego ani z naturą, ani z cytrynami, chociaż w swojej naturalnej postaci występuje w wielu owocach, w tym również w cytrynach. Spełnia on również ważną rolę w metabolizmie organizmów żywych (cykl Krebsa). Jednak ten stosowany w przemyśle spożywczym jest czysto syntetyczną substancją, otrzymywaną głównie przez fermentację cukru za pomocą kultur kropidlaka Aspergillus niger. Kropidlak ten jest bardzo niebezpieczną dla zdrowia pleśnią, powodującą wiele poważnych chorób.[1]
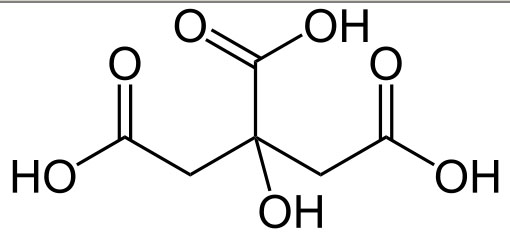
Kwas cytrynowy to stosunkowo pospolity w przyrodzie kwas organiczny, zawierający trzy grupy karboksylowe. Zgodnie z nazwą występuje w cytrynach. Pierwsza wzmianka o kwaśnych właściwościach ich soku pochodzi z VIII wieku z pism Gebera, jednak właściwy związek za to odpowiedzialny, wyizolował dopiero w 1784 Carl Scheele. Przez długi czas produkowano go z soków owocowych, do czasu aż w 1893 roku odkryto, że powstaje jako produkt metabolizmu pewnych gatunków pleśni, podobnie jak kwasy mlekowy, octowy i propionowy w pewnych typach fermentacji. Synteza tą metodą rozpoczęła się jednak niemal trzydzieści lat później. Najczęściej stosowany jest szczep Aspergillus niger, zaś pożywką jest nierafinowany cukier, melasa, syrop kukurydziany lub nawet nieprzetworzony sok z buraków cukrowych.
Gdy stężenie kwasu w pożywce wzrasta do odpowiedniego poziomu, dodaje się do niej mleka wapiennego, wytrącając cytrynian wapnia. Po odsączeniu traktowany jest kwasem siarkowym, zaś z zakwaszonego roztworu krystalizuje czysty kwas cytrynowy.
 |
| Mojej hodowli kryształy kwasu cytrynowego, o czym pisałem tu. |
Dlaczego dodaje się go do jedzenia? Głównie dla uzyskania odpowiedniego smaku, w czym jest o tyle lepszy od octu, że nie posiada własnego zapachu. Zakwaszając produkt przedłuża jego trwałość, i to na dwa sposoby - większość bakterii nie rozwija się w kwaśnym środowisku. Poza tym niskie pH zasadniczo przeszkadza reakcjom utlenienia, a właśnie one odpowiadają za większość reakcji rozkładu żywności. Dodatkowo w przypadku produktów nieprzetworzonych zakwaszenie unieczynnia enzymy degradujące, o czym każdy się nieraz przekonał, próbując powstrzymać brązowienie ziemniaków lub jabłek.
No dobra - a kwas askorbinowy? Witamina C to cenny przeciwutleniacz, w większości przypadków dodaje się ją nie jako środek wzbogacający, ale właśnie dla przedłużenia trwałości, ma jednak dwie wady - jest słabym kwasem i za łatwo się utlenia. Z tego powodu niektóre produkty mogą szybko ją utracić, co zmniejszy ich wartość zdrowotną. Można jednak spowolnić ten proces stwarzając dogodne warunki. Na przykład przez zakwaszenie.
Natomiast co do kwestii naturalności związku - producent który go dodaje może potem napisać na opakowaniu, że produkt nie zawiera sztucznych konserwantów. Związek syntetyczny to taki, który otrzymano drogą przemian chemicznych z prostych substratów, na przykład w tym przypadku z propanu, tymczasem tutaj mamy do czynienia ze związkiem wytworzonym przez pewne organizmy żywe. Nie są to może cytryny ale fabryka chemiczna też nie.
I proszę mi nie mówić, że cytryny są zdrowe. Oczywiście, że są. Zawierają kwas cytrynowy, ale naturalny, a oprócz niego witaminy, enzymy, sole mineralne i inne zdrowe składniki, które razem działają zbawiennie na nasze zdrowie. Owoce są dziełem natury, są harmonijną całością, a zawarte w nich składniki chemiczne są doskonale przyswajane przez nasze organizmy[2]Tylko czymże naturalny kwas, wytworzony przez taki organizm żywy jaki cytryna, różni się od kwasu rzekomo syntetycznego, wytworzonego przez organizm żywy kropidlaka? Związek ten nie ma odmian prawo i lewoskrętnej ani jakiejś unikalnej struktury, na co niekiedy powołują się producenci różnych suplementów.
Dlaczego jest szkodliwy? Z prostej przyczyny – kwas cytrynowy zakłóca przewodnictwo elektrochemiczne w naszych komórkach mózgowych i zmienia w nich reakcje chemiczne. Dodając kwasek do potraw i napojów (również dla niemowląt i małych dzieci) ktoś sprytnie zmienia nas w bezmyślne baranki. Wiemy nie od dziś, że władza nie lubi inteligentnych obywateli, bo takimi trudno jest rządzić, szczególnie, że władza sama nie grzeszy inteligencją i doskonale zdaje sobie z tego sprawę.[3]Kwestia szkodliwego wpływu na mózg, pojawia się w tego typu tekstach co i rusz, nigdzie jednak nie podano kto to zbadał, jak i kiedy. Astromaria powołuje się na jakichś dwóch lekarzy, tylko nie chce podać jakich. Musiałem więc sam grzebnąć.
Wedle raportu SIDS z 2000 roku toksyczność związku jest bardzo niska, LD w badaniach na szczurach wyniosła 1200mg/kg/dzień, czyli 1,2 grama na kilogram masy ciała. Dla człowieka ważącego 60 kg odpowiada to całkowitej dawce 80g związku. Nie wykazano w jego przypadku rakotwórczości ani nie jest o to podejrzewany. To samo tyczy się mutagenności i teratogenności. Nie stwierdzono aby był alergenem, choć wywołuje podrażnienia błon śluzowych i oczu. U osób zawodowo stykających się na co dzień z tym związkiem, podrażnienia mogą rozwinąć się w zapalenie skóry. W dwóch kolejnych pokoleniach szczurów zażywających karmę z 1% związku, nie stwierdzono deformacji. Nefrotoksyczności nie potwierdzono. [4] Jak to już opisywałem, kwas cytrynowy zwiększa wchłanianie aluminium z pożywienia, wygląda jednak że może to działać też w drugą stronę - zażywanie większych dawek prowokuje zwiększone wydalanie glinu z organizmu[5]. Stała obecność kwasu w diecie zapobiega kamicy nerkowej związanej z solami wapnia[6]
Zresztą kwas cytrynowy występuje naturalnie w naszym organizmie. Powstaje podczas metabolizmu jako jeden z elementów Cyklu Krebsa, mającego wytworzyć energię komórce. Każdy go ma w sobie.
Co ciekawsze, obecność kwasu wcale nie przeszkadza wielu specjalistom od alternatywnej medycyny polecać częste spożywanie cytryn. Jest elementem kuracji oczyszczającej Tombaka, podczas której w ciągu dwóch tygodni spożywa się sok z łącznie 200 cytryn[7]. Sam Tombak pisze coś o unikalnych właściwościach soli cytrynowych, ale jak to zwykle u niego, nie wiadomo skąd mu to wiadomo. Inna wersja to zażywanie mieszanki oliwy z sokiem cytrynowym. W dodatku sok z cytryny ma w jakiś paradoksalny sposób sprzyjać powstawaniu w organizmie odczynu zasadowego, co podobno też przynosić jakieś tam korzyści. A to wszystko za sprawą tego całego okropnego kwasu cytrynowego....
Jak się wydaje całe zamieszanie ma swe źródło w krążącej po świecie od połowy lat 70. "liście z Villejuif" - anonimowego tekstu ostrzegającego przed szkodliwymi dodatkami do żywności. Najgorszym, silnie rakotwórczym, miał być E 330 czyli właśnie kwas cytrynowy. Lista, w formie listów-łańcuszków rozlała się na cały świat, rozprzestrzeniana w formie zaraźliwego, bardzo wiarygodnie brzmiącego memu. Wkrótce zresztą objawiła się siła obaw zdrowotnych w społeczeństwie - gdy lekarze zaczęli wydawać oświadczenia, że lista jest fałszywa, wiele osób zaczęło bardziej w nią wierzyć uznając, że gdyby coś nie było na rzeczy, nikt by się tym tak bardzo nie przejmował. Podobne listy można spotkać w polskim internecie, niejednokrotnie poszerzone na wszystkie 1200 dodatków z listy E. Można się tam zresztą spotkać z zabawną niekonsekwencją - za rakotwórczy uznany jest tam kwas cytrynowy, ale jego sole już nie. Nawiasem mówiąc tak wychwalany kwas askorbinowy, znajduje się na tej liście pod nazwą E 300...
-------
[1],[2],[3] http://astromaria.wordpress.com/2009/09/23/kolejna-podstepna-trucizna/
[4] http://www.inchem.org/documents/sids/sids/77929.pdf
[5] Yong‐Hua Yanga & Hong‐Yan Zhanga Effect of citric acid on aluminum toxicity in the growth of mungbean seedlings, Journal of Plant Nutrition Volume 21, Issue 5, 1998
[6] Kang DE , Sur RL , Haleblian GE , Fitzsimons NJ , Borawski KM , Preminger GM .
Long-term lemonade based dietary manipulation in patients with hypocitraturic nephrolithiasis. J Urol. 2007 Apr;177(4):1358-62; discussion 1362; quiz 1591
[7] http://cudownediety.blogspot.com/2012/03/kuracja-cytrynowa-m-tombaka.html