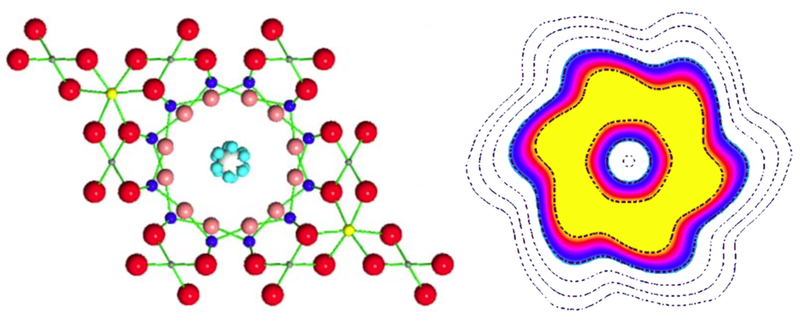
Czterowymiarowy kryształ?
Tlenki żelaza choć znane od wieków, wciąż budzą zainteresowanie technologów i fizyków i niekiedy nadal daje się odkryć nowe, ciekawe ich właściwości. W 2011 roku doniesiono o odkryciu, że mieszanina tleneku żelaza II i żelaza II/III (FeO+Fe3O4) poddany działaniu wysokiego ciśnienia zamienia się w unikalny tlenek Fe4O5. Faza ta wykazywała silne właściwości ferrimagnetyczne podobne do magnetytu.
Wiadomo było już, że magnetyt w niskich temperaturach ulega przejściu fazowemu II rodzaju, w wyniku którego atomy o różnym stopniu utlenienia tworzą równoległe struktury (Wervey phase). W typowym magnetycie atomy żelaza II i żelaza III są przemieszane statystycznie, nie tworząc regularnych struktur, zaś elektrony mogą przeskakiwać od jednego jonu do drugiego dzięki czemu materiał wykazuje przewodność elektryczną. Po przejściu fazowym następuje samoorganizacja - atomy o danym stopniu utlenienia tworzą w sieci krystalicznej struktury liniowe lub płaszczyzny.
W przypadku magnetytu wiązało się to z utrudnieniem ruchu elektronów i wzrostem oporu, ale w innych materiałach może to doprowadzać do pojawiania się nadprzewodnictwa, ferromagnetyczności lub gigantycznego magnetooporu stosowanego dziś w elektronicznych nośnikach danych.
Nic też dziwnego, że postanowiono sprawdzić czy w podobny sposób zachowa się nowy materiał. Rosyjski zespół stwierdził zachodzenie podobnej przemiany poniżej temperatury 150 K. Materiał zmieniał właściwości magnetyczne a opór elektryczny rósł o dwa rzędy wielkości. Problematyczne okazało się natomiast przypisanie mu określonej struktury. Zakładano, że mamy do czynienia z takim samym zjawiskiem organizacji stopni utlenienia, ale wyniki pomiarów nie dawały się złożyć w prosty model. Wyglądało na to, że struktury atomów o jednakowym stopniu utlenienia falują i statystycznie może się wydawać, że są rozmieszczone przypadkowo.
Porządek pojawił się dopiero gdy symulowano rozkład ładunków w przestrzeni czterowymiarowej. Z tego też powodu informacje o tym odkryciu często powtarzają że odkryto "czterowymiarowy kryształ". W tym przypadku chodzi jednak jedynie o matematyczny model rozkładu ładunków, opisywany funkcją nie dającą rozwiązania w normalnej przestrzeni.[1]
Kwantowa woda
Nietypowe zachowanie się wody zamkniętej w wąskich kapilarach odkryli właśnie amerykańscy badacze. Badali oni właściwości wody w kapilarnych kanałach struktury berylu, ważnego minerału magmowego, przy pomocy techniki rozpraszania neutronów. Średnica kanału na tyle ograniczała cząsteczki, że w przekroju mieściła się tylko jedna. Zamiast jednak struktur cząsteczek uzyskali nietypowe, heksagonalne pierścienie. Sygnał obecności atomu tlenu pojawiał się w sześciu miejscach, a każdego z dwóch wodorów także w sześciu. Ponieważ zaś sześć cząsteczek by się w przekroju kanału nie zmieściło, zaś dla tej jednej bariera energetyczna obrotu jest zbyt duża aby wynik wywoływało ustawianie się jej w różnych pozycjach w trakcie badania, jako wyjaśnienie tych obserwacji zaproponowali nietypowy model - jest to w istocie nadal jedna cząsteczka, tylko kwantowo interferująca sama ze sobą.[2]
Jedną z konsekwencji teorii kwantowej była hipoteza de Brogile'a, że każdej cząstce materialnej można przypisać właściwości falowe które wpływają na jej oddziaływania i zachowania. Za sprawą tych właściwości obserwujemy dyfrakcję cząstek na dwóch szczelinach lub siatkach dyfrakcyjnych, powodującą że prawdopodobieństwo znalezienia się cząstki z danym miejscu zależy od wzoru jej "fali materii". Przepuszczając odpowiednio dużo cząstek przez szczeliny i badając w jakie miejsce na detektorze uderzą, otrzymujemy w końcu wzór właściwy interferującym falom.
Jedną ze szczególnie interesujących konsekwencji tego zjawiska są kwantowe miraże, czyli wzory oddziaływań, jakie tworzy cząstka zamknięta w niewiele od niej większym ograniczeniu przestrzennym. Wewnątrz okręgu ułożonego z atomów na podłożu powstaje wzór podobny do fal na wodzie z centralną górką stanowiącą złudzenie istnienia tam jakiegoś atomu:
Po umieszczeniu atomu w jednym z ognisk elipsy, w drugim ognisku pojawia się jego słaby miraż:
Jak się wydaje w opisywanym przypadku zachodzi coś podobnego. Cząsteczka wody wewnątrz niewiele od niej większego, heksagonalnego kanału interferuje. Próby określenia położenia jej atomów kończą się więc stwierdzeniem sześciokątnego wzoru na który składają się zagęszczenia fal prawdopodobieństwa obecności atomu w tej niewielkiej przestrzeni. Poprzednio udało się zmierzyć podobny efekt dla atomów wodoru, ale woda to już zupełnie inna sprawa. Pory tych rozmiarów (4 A) występują w minerałach budujących skorupę ziemską, zatem kwantowy efekt może mieć znaczenie dla modelowania właściwości gleby i skał.
Nowy rodzaj wiązania?
Obliczenia kwantowomechaniczne dokonane przez badaczy z amerykańskiego Southern Methodist University w Dallas wskazują na istnienie jeszcze jednego rzadkiego rodzaju wiązania chemicznego - jest to odmiana wiązania wodorowego z oddziaływaniem między atomem wodoru połączonym z borem a układem aromatycznym. Znane były tego rodzaju połączenia dla układów w których wodór połączony był z węglem i azotem, mające pewne znaczenie w biologii molekularnej, jednak dotychczas wydawało się, że nie powinny zachodzić dla boranów. Bor ma mniejszą elektroujemność niż wodór, toteż wiązanie między nimi jest tak spolaryzowane, że na protonie pojawia się lekki ładunek ujemny. Bardziej naładowany elektronami wodór powinien być więc odpychany przez pełen elektronów pierścień aromatyczny.
Z drugiej strony związki boru są często połączeniami elektrono-deficytowymi, z pojawiającymi się wiązaniami trójcentrowymi a w takiej sytuacji na wodorze powinien pojawić się cząstkowy ładunek dodatni.
 |
| @ American Chemical Society |
---------
[1] Ovsyannikov V. S.; Charge-ordering transition in iron oxide Fe4O5 involving competing dimer and trimer formation. Nature Chemistry, 2016; DOI: 10.1038/NCHEM.2478
[2] Kolesnikov A.I. et al. Quantum Tunneling of Water in Beryl: A New State of the Water Molecule. Physical Review Letters, 2016; 116 (16) DOI: 10.1103/PhysRevLett.116.167802
[3] X Zhang et al, B–H···π Interaction: A New Type of Nonclassical Hydrogen Bonding
J. Am. Chem. Soc., 2016, DOI: 10.1021/jacs.6b01249