Jakiś tydzień temu minęło półtora roku od momentu założenia bloga. Cieszę się, że jak dotychczas nie straciłem ani chęci ani pomysłowości do tego aby wciąż pisać, choć w wakacje nie było łatwo zebrać się w sobie i skończyć rozpoczęte wpisy - liczba tych zaległych i nieukończonych sięgnęła już 10. Teraz więc może nieco statystyk
Ilość wejść na stronę wynosi właśnie 86 806, od czasu rocznicowej notki wzrost wyniósł zatem ok 58 tysięcy wejść. Średnia dzienna przeglądalność utrzymuje się na poziomie 150-200 wejść. Dwie najpopularniejsze nowe notki z tego okresu, to zarazem najbardziej popularne w ogóle. Pierwsza, zaplanowana jako krótka migawka z cyklu obrazków z laboratorium, to:
- Kiedyś w laboratorium 11. - 10 735 wejść, 15 komentarzy. Kwestia tego dlaczego herbata zmienia kolor po dodaniu cytryny okazała się najwyraźniej niezwykle interesująca. Kontynuując temat napisałem więc drugą o zdrwotności picia herbaty, która popularnością niewiele ustępuje tej pierwszej:
- Z cytryną czy bez? - 9889 wejść.
Dwie następne z tego okresu to:
- Ałun - 1670
- Chemik na miejscu zbrodni - próby analityczne na krew - 1055
Najczęściej na bloga wchodzono ze stron: wykop.pl, Blog de Bart, klikd.pl, Facebook (co jest o tyle ciekawe, że blog nie ma prezentacji na tym portalu) i NewChemistry.eu. Najczęstszym słowem kluczowym przez które odnaleziono stronę, było "Znane obrazy" - niewykluczone więc że skrobnę coś jeszcze na temat chemii malarstwa na przykładzie najsłynniejszych dzieł.
Jak widzicie wciąż nie wpuszczam na stronę reklam i nie zamierzam.
A co tam u mnie?
Zaliczyłem pracę licencjacką na temat "Katastrofy Jądrowe" pod kierunkiem dra hab. Krzysztofa Wojciechowskiego. Przyznam szczerze, że nie jestem z niej całkowicie zadowolony; konieczność zmieszczenia wywodów na kilkunastu stronach spowodowała, że musiałem pominąć niektóre kwestie dla mnie wprawdzie ciekawe, ale w zakresie tematu niezbyt ważne. W dodatku wybór tematu w mniejszym stopniu zależał ode mnie, zabrałem się bowiem dosyć późno za jego zaklepywanie i takie jak "Trójniciowe DNA w enzymach" czy "Stereochemia związków siarki" były zajęte gdy już się za to wziąłem.
Z zaliczeniami przedmiotów miałem trochę problemów (jak co roku zresztą) ale poradziłem sobie. Na sam koniec zaliczyłem jeszcze egzamin licencjacki, będący przepytką dotyczącą zagadnień jakich nauczano mnie przez ostatnie trzy lata. Na szczęście zaliczyłem go na 4+ i na dyplomie mam ocenę 4.
Jeśli chodzi o wybór studiów magisterskich, uznałem że właściwie nie ma powodu przenosić się gdzieś dalej i zostałem w Siedlcach. Wybrałem kierunek chemia organiczna, więc spodziewajcie się w następnych miesiącach relacji z co ciekawszych syntez. A cóż poza tym? Spędziłem całkiem miłe wakacje, porobiłem trochę planów i oczywiście nadal będę kontynuował pisanie Nowej Alchemii.
informacje
środa, 26 września 2012
piątek, 21 września 2012
Talidomid
Pisałem już tu o różnych truciznach i związkach szkodliwych. Często ludzie stykają się z nimi przez pomyłkę lub na skutek niecnych działań bliźnich, niestety czasem wskutek zbytniego zawierzenia w cuda medycyny. Jeden z takich przypadków, będący największą pomyłką farmakologii, miał miejsce niemal równo 50 lat temu, ponieważ zaś rzecz zahacza o pewne ciekawe zagadnienia związane z budowa związków chemicznych, myślę że warto jest to tutaj omówić.
Rzecz zaczęła się mniej więcej w 1954 roku w laboratorium niemieckiej firmy farmaceutycznej Grünenthal , gdzie trudniono się otrzymywaniem nowych preparatów. Wiodącą linią poszukiwań było wówczas łączenie antybiotyków z peptydami i aminokwasami poszukując aktywnych połączeń, niektóre z nich, podobne strukturalnie do kwasu barbiturowego, okazywały się bezpieczniejszymi od niego lekami nasennymi i uspokajającymi. Tym razem na warsztat wzięto ftaloiloizoglutaminę - pochodną kwasu glutaminowego, będącego jednym z aminokwasów białkowych, i kwasu ftalowego. Przez proste ogrzewanie w warunkach odwadniających przeprowadzono ten związek w imid z dwoma pierścieniami połączonymi przez azot:
Powstały związek to ftalimidoglutarimid, co wkrótce skrócono do wygodniejszej nazwy Thalidomid. Pierwsze testy medyczne na szczurach, psach i chomikach wykazały niską toksyczność, z LD rzędu 5g/kg masy ciała, dzięki czemu preparat można było zaliczać do nietoksycznych. Początkowo zalecono go epileptykom jako lek przeciwdrgawkowy, nie przynosił jednak oczekiwanych efektów, natomiast zapewniał spokojny sen i nie uzależniał tak jak barbiturany. Zaczęto więc prowadzić badania w tym kierunku, choć działanie uspokajające u zwierząt prawie nie występowało. Wreszcie po pierwszych testach zdecydowano o wprowadzeniu leku na rynek 1 Października 1957 roku.
Thalidomid reklamowano jako pierwszy pozbawiony bromu lek uspokajający i nasenny "bez skutków ubocznych". Rzeczywiście, stosowane dotychczas środki na bazie bromku potasu często wywoływały splątanie, napady senności, zaburzenia mowy i spadek libido (co wykorzystywano w wojsku do obniżania popędu u szeregowych). Ponieważ nadawał się doskonale do leczenia objawów towarzyszących wczesnej ciąży (rozdrażnienie, poranne mdłości, nieregularny sen), zalecano go właśnie ciężarnym. I tak to się zaczęło.
Jeśli przyjrzeć się dokumentom z tamtych czasów, można zobaczyć, że nie zaniedbano badań możliwych działań toksycznych - w przeglądzie z 1960 roku widać, że sprawdzono wpływ na układ nerwowy, moczowy i trawienny, interakcje z alkoholem, barbituranami, wpływy narkotyczne itp.[1] ale nie wzięto pod uwagę jednej rzeczy - teratotoksyczności.
Kwestia wpływu substancji chemicznych na rozwój płodu nie była wówczas specjalnie badana, sam termin teratogenu wprowadzono dopiero w 1960 roku, niemniej już zaczęto ją brać pod uwagę w niektórych krajach. Aby zbadać taki wpływ należało przed wprowadzeniem leku sprawdzić wpływ na ciężarne zwierzęta, zaś już po wprowadzeniu zbierać informacje o skutkach ubocznych. Nie zawsze da się w laboratorium odtworzyć wszystkie możliwe kombinacje, jakie mogą się przydarzyć w prawdziwym życiu, stąd często dopiero po wprowadzeniu leku okazuje się, że na przykład nie można go popijać sokiem z grejpfrutów albo zażywać wraz z aspiryną. Nikomu jednak nie przyszło do głowy, że jeśli nie znamy działania leku na jakąś specyficzną grupę ludzi, to profilaktycznie nie powinna ona go zażywać. A tą grupą były w tym przypadku dojrzewające ludzkie płody.
Jak zapewne pamiętacie z lekcji biologii, rozwój płodu zaczyna się od zapłodnienia, potem powstaje zygota która zaczyna się dzielić na 2, 4, 8,16... i coraz więcej komórek potomnych. Gdy kulka narastających komórek jest odpowiednio duża, zaczynają się one różnicować na grupy, stające się zalążkami różnych grup organów ciała. Z czasem w naszym zlepku komórek daje się zauważać jakaś forma, podział na przód i tył, na główkę i ogonek, na kończyny a u tych z czasem na przedramię i ramię, dalej końce kończyn formują się w ręce i dłonie, z paluszkami, każdy osobno, wykształca się twarz i jej zewnętrzne cechy.
Nie trudno się domyśleć że nawet drobne uszkodzenie w tym wczesnym etapie, może doprowadzić do potwornych deformacji. Śmierć komórki z której w dalszej perspektywie miała się wykształcić połowa jelita grubego spowoduje, że może ono powstać skrócone. Czasem wystarczy aby komórki niewłaściwie ułożyły się na wczesnym etapie. Dla niewielkich zmian owocuje to takimi wadami, jak błoniasta skórka między palcami, świński ogonek czy rozszczep podniebienia, im jednak większe są to zmiany tym większy jest wpływ ostateczny. Duża część takich deformacji jest letalna - jeśli na przykład zaburzony zostanie etap wykształcania się mózgu (bezmózgowie) to rosnący płód może umrzeć z braku kontroli nad funkcjami fizjologicznymi. A Thalidomid?
Począwszy od 1958 roku w Europie zaczęło rodzić się zaskakująco dużo dzieci z wadami rozwoju. W większości dotyczyły kończyn - dochodziło do nie wykształcenia się dłoni, i stóp, ramion i łydek bądź też w ogóle nie wykształcały się kończyny, w dodatku kości innych części ciała rosły zdeformowane lub skrócone; u innych dochodziło do deformacji lub braku uszu zewnętrznych, zarośnięcia przewodu słuchowego, jamy nosowej, deformacji lub braku nosa. Czasem wady pojawiały się dopiero wewnątrz ciała, dotycząc wykształcenia układu pokarmowego, deformacji nerek czy licznych przetok między jamami ciała.
Wzrost liczby takich przypadków był zaskakujący i długo nie udało się powiązać go z konkretnym czynnikiem, brakło jakiegoś centralnego systemu gromadzącego informacje i rzadkich schorzeniach stąd też trudno było dowieść, że wszystkie ciężarne stykały się z jednym, określonym czynnikiem. Ponieważ początkowo epidemia deformacji zachodziła na obszarach objętych działaniami wojennymi sądzono, że mogą to być długofalowe skutki działania gazów bojowych, trujących oparów bomb i pożarów, jednak w miarę narastania liczby przypadków stało się oczywiste, że nie można w ten sposób tłumaczyć zjawiska.
Inni wskazywali na związek ze zwiększonym napromieniowaniem środowiska - w latach 1951-57 przeprowadzono na świecie 175 próbnych wybuchów jądrowych, tylko w 1958 już 116[2] Trudno aby pozostało to bez wpływu na zdrowie. Wadą tej koncepcji było to, że zjawisko nasilało się w środkowej i zachodniej europie, natomiast takiego natężenia takich specyficznych wad nie notowano w USA gdzie przecież przeprowadzano próby (danych z ZSRR nie było).
Od końca lat 50. do początku lat 60. w 46 krajach urodziło się około 10 tysięcy dzieci z wadami rozwojowymi, zaś kilkanaście tysięcy ciąż zakończyło się poronieniem.
Co do tego kto pierwszy zauważył związek trwają spory. Czasem dziennikarze twierdzą, że na trop pierwsza wpadła prasa, jak się jednak wydaje zaczęło się od pewnych dwóch lekarzy.
Niemiecki pediatra Widukind Lenz, pracujący w szpitalu dziecięcym w Hamburgu, na podstawie wywiadów z matkami dzieci z deformacjami doszedł do wniosku, że wszystkie one brały leki nasenne i uspokajające w okresie ciąży a czas w jakim zaczęły się pojawiać pierwsze przypadki zgadzał się z kilkumiesięcznym odstępstwem z czasem wprowadzenia leku na rynek. Będąc pewny swych racji poinformował o nich służby medyczne i zadzwonił do firmy farmaceutycznej Grünenthal aby skłonić ich do natychmiastowego wycofania preparatu. Szefowie firmy nie byli jednak skłonni do współpracy, dlatego dwa dni później, 18 listopada 1961 roku, wygłosił na konferencji pediatrycznej referat opisujący zaobserwowany związek. Oczywiście zaraz zarzucono mu, że wyniki kwestionariuszy u 20 matek to za mało aby mówić o dowodzie. Jeśli podejrzenia okazałyby się niesłuszne, byłby to koniec jego kariery. Stwierdził jednak że nie może z czystym sumieniem milczeć, gdy kolejne kobiety zażywają podejrzane tabletki. O sprawie wkrótce napisała lokalna gazeta. Nazwa podejrzanego leku nie została jeszcze ujawniona.[3]
W międzyczasie australijski położnik Wiliam McBride również powiązał wady rozwojowe u dzieci z faktem, że wszystkim matkom tych dzieci wcześniej sam przepisał Thalidomid, zaś efekt pojawił się w Australii później niż w reszcie świata, po wprowadzeniu na rynek leku. Napisał na ten temat list do prestiżowego czasopisma medycznego The Lancet, które wydrukowało go w grudniu tego samego roku. Trwały już wówczas niejawne rozmowy między przedstawicielami władz medycznych i zarządu firmy Grünenthal. Propozycją firmy było wprowadzenie na opakowania nalepki, informującej że nie może być zażywana przez kobiety w ciąży. Gdy lekarze zasugerowali, że lepiej całkiem wycofać lek, zanim kwestia bezpieczeństwa nie zostanie zbadana, przedstawiciele firmy nie zgodzili się, grożąc konsekwencjami prawnymi w razie prób wprowadzenia takich ograniczeń. Po kilku dniach jednak zmiękli w miarę spływania danych potwierdzających zależność. Ostatecznie na początku grudnia rozpoczęto wycofywanie preparatu i leków które go zawierały - a znalazł się nawet w tabletkach na przeziębienie i syropach na kaszel.
Ciekawą kwestią jest tutaj sprawa niedopuszczenia preparatu na rynek amerykański. Pracująca w ówczesnej agencji do spraw żywności i leków (FDA) Frances Oldham Kelsey, zajmowała się dopuszczaniem leków do obrotu. Gdy w 1960 roku próbowano wprowadzić Thalidomid, podczas przeglądania dokumentacji zauważyła to samo co ja w opisywanym już przeglądzie - brak badań wpływu na kobiety ciężarne. Mając na uwadze obserwowane na świecie objawy, i pamiętając ze studiów dopiero rodzące się badania nad wpływami teratogennymi, zażądała uzupełnienia dokumentacji, czego firma produkująca lek nie mogła zrobić. Nikt nie wymagał od nich przeprowadzenia takich badań, więc ich nie wykonali. Kelsey odpisała im zatem, że FDA może poczekać kilka miesięcy, aż zrobią odpowiednie badania. Oznaczało to późniejsze wprowadzenie leku na przewie 300 milionowy rynek amerykański a co za tym idzie, milionowe straty. Firma zaczęła naciskać zarówno na badaczkę jak i na jej szefostwo, grożąc możliwością zażądania odszkodowania w razie bezpodstawnego zatrzymania leku, ci jednak odpowiadali niezmiennie - bez dodatkowych testów nie przyjmiemy leku na rynek.[4] To przetrzymanie trwało akurat na tyle długo, że zdążyły pojawić się pierwsze doniesienia o szkodliwości leku, dlatego USA obroniły się przez nim. Wiadomo jednak że firma wysyłała lekarzom "darmowe próbki" mając nadzieję, że pozytywne opinie od amerykańskich położników przekonają FDA. Wiadomo o kilkunastu przypadkach dzieci zdeformowanych wskutek zażywania "darmowych próbek" przez ich matki.
Potwierdzeniem związku między lekiem a deformacjami był ich zanik po lipcu 1962 roku, gdy urodziły się ostatnie dzieci, których matki mogły go zażywać. Co dziwniejsze, w Japonii wycofano lek dopiero w 1965 roku. Wprawdzie nie sprowadzano go już z Europy ale nie wydano zakazu sprzedaży preparatu z aptecznych zapasów, toteż jeszcze przez kilka lat zdarzały się tam przypadki zniekształceń płodu. Znanych jest trzystu japońskich "Talidomerów".
Co takiego powodowało uszkodzenia płodu? Mechanizm jest niejasny, jak się wydaje cząsteczka ftalimidoglutarimidu wpasowuje się pomiędzy nici DNA w miejscach purynowych blokując działanie genów odpowiedzialnych za rozwój, głównie przez hamowanie tych odpowiedzialnych za rozwinięcie zalążków kończyn.[5] Jak się wydaje równocześnie działać może mechanizm blokowania tworzenia nowych naczyń krwionośnych w miejscach intensywnego wzrostu.[6] McBride, ten sam australijski położnik, zasugerował zatem wykorzystanie tej substancji do leczenia raka będącego przecież "szybko rosnącym skupieniem komórek". Przypuszczenie okazało się trafne - dziś stosuje się go, pod nazwą Taliomid, do terapii szpiczaka mnogiego, z dosyć wysokim wskaźnikiem remisji. Terapia wymaga jednak, aby osoby niej poddawane nie mogły już posiadać potomstwa - a więc kobiet po 50 roku życia, bezpłodnych lub wysterylizowanych. Jeśli poddać się jej ma kobieta w średnim wieku, to albo musi ona zażywać leki antykoncepcyjne, albo zachować wstrzemięźliwość. Chodzi po prostu o to, aby nie zaszła, nie wiedząc o tym w ciążę w trakcie terapii, co doprowadziłoby do urodzenia zdeformowanego dziecka.
Ze sprawą właściwości związku wiąże się jeszcze jedna kwestia - otóż tak na prawdę mamy do czynienia z dwoma jego odmianami, jedna ma właściwości lecznicze, zaś druga szkodliwe. A rzecz polega jedynie na innym wygięciu cząsteczki.
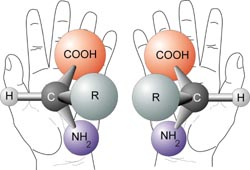
Związki organiczne zbudowane są głównie z węgla o wartościowości IV a więc tworzącego cztery wiązania. Jeśli nie mamy do czynienia z połączeniami wielokrotnymi, wiązania te odsuwają się od siebie tworząc układ tetraedryczny. Jeśli wobec tego zdarzy się, że przy każdym wiązaniu takiego węgla podczepiona będzie inna grupa, to cała cząsteczka będzie asymetryczna, i możliwe będą dwa ustawienia grup wokół takiego węgla, podobne do siebie jak lustrzane odbicia Piękna grafika:
Jeślibyśmy zbudowali takie modele (na przykład z kasztanów) to jakbyśmy ich nie obracali, nie przeprowadzimy jednego w drugi bez rozrywania wiązań (zamieniania kasztanów). O takich lustrzanych figurach mówimy że są chiralne, od greckiego cheir czyli ręka. Dłonie bowiem w zasadzie są swymi lustrzanymi odbiciami, ale bez obracania ich ku sobie nie nałożą się dokładnie jedna na drugą. Chemicy odróżniają takie lustrzane cząsteczki nadając im konfigurację absolutną, zależną od tego w jakiej kolejności ułożone są podstawniki, którym przypisuje się określoną "ważność" Jeśli ruch od najważniejszego podstawnika do po kolei mniej ważnych jest prawoskrętny, to konfigurację oznaczamy literą R a jeśli lewoskrętny to literą S.
Konfiguracja cząsteczki ma duże znaczenie w biochemii - większość aminokwasów w żywych organizmach jest lewoskrętna, z aminokwasów zbudowane są białka skręcające się z tego powodu w określony sposób, z białek zbudowane są receptory i często bardzo selektywnie reagują na cząsteczki o różnej konfiguracji - przykładem karwon, jeden z terpenów występujących w olejkach zapachowych - izomer R pachnie miętą kędzierzawą, izomer S pachnie kminkiem. A jak rzecz się ma z naszą cząsteczką leku?
Przy wiązaniu z azotem jest jeden węgiel o asymetrycznie ułożonych podstawnikach - z jednej strony jest połączony z wodorem, z drugiej z innym pierścieniem, z trzeciej jest połączony z tą częścią pierścienia, gdzie znajdują się dwie grupy karbonylowe, zaś z czwartej strony jest połączony z drugą połową pierścienia, bez tych grup. Otoczenie z każdej strony jest inne, zatem cząsteczka jest asymetryczna i chiralna. Możliwe stają się zatem dwa położenia drugiego pierścienia, połączonego przez azot - w jednym znajduje się on nad płaszczyzną pierścieni w asymetrycznym węgle, a w drugim pod nią:
Te dwie odmiany mają różne właściwości - izomer R ma właściwości przeciwbólowe i uspokajające, zaś izomer S teratogenne. Podczas syntezy produkowano racemat - równomolową mieszaninę obu izomerów, tego szkodliwego i tego niebezpiecznego. Gdy odkryto tę zależność, postanowiono przeprowadzić selektywną syntezę tylko jednej, dobroczynnej odmiany. niestety okazało ię, że po wprowadzeniu do organizmu związek ulega samorzutnej przemianie i połowa dawki zamienia się w szkodliwy izomer. Dlatego właśnie dziś jego zastosowanie ogranicza się już tylko do chemioterapii.
A co z poszkodowanymi?
Mimo ujawnienia przyczyny deformacji jeszcze przez długi czas rodziny poszkodowanych dzieci nie mogły doprosić się pomocy. Firma Grünenthal straszyła sądem każdego kto chciał winić ją o tą sytuację. Na dobrą sprawę odszkodowania jakie wywalczyły rodziny, pochodziły głównie od dostawców lub od rządów państw, które nie wymagały, jak USA, dokładnych badań przed wprowadzeniem na rynek. Dopiero w 1972 roku firma musiała zapłacić 150 mln dolarów rodzinom trzech tysięcy dzieci, jakie urodziły się zdeformowane w Niemczech. Rodziny dzieci urodzonych w innych krajach nie wywalczyły odszkodowań do dziś. Niedawne oficjalne przeprosiny miały od strony firmy jedynie symboliczne znaczenie.
Skandal wokół tej sprawy wywołał duże zmiany w prawie farmaceutycznym, które dotychczas bardzo lekko traktowało procedury dopuszczania nowych leków - zaledwie przecież kilka lat wcześniej, w 1954 roku we Francji lek na czyraki skórne zabił sto osób, bo nikt nie wykonał rzetelnych badań działania na ludzi.
Od teraz wymagane stały się nie tylko kilkufazowe badania kliniczne ale też ścisłe określenie grupy, dla której znane są dane medyczne. Gdy kilka lat temu zachorowałem i przepisano mi antybiotyk, w ulotce pisano, że nie powinny go stosować matki ciężarne i dzieci do 12 lat - czy dlatego że dla nich lek był szkodliwy? Nie, po prostu dla tych grup nie ma informacji medycznych o bezpieczeństwie, lepiej więc traktować go jak szkodliwy i nie podawać, niż narażać się na to, że rzecz wyjdzie dopiero w praniu.
Na koniec rozprawię się może jeszcze z jedną krążącą po świecie informacją - w sporach między przeciwnikami farmakologii a jej zwolennikami, gdy którejś ze stron brakuje argumentów, sięgają do "argumentu z Nazistów" - na zasadzie: "twoja idea jest be bo kiedyś zajmował się nią nazista". W przypadku farmakologii łatwo zadać ten cios po niesławnej sprawie firmy Bayer oskarżonej o silne związki z hitleryzmem. Niekorzy czasem sięgają w historii dalej wywodząc, że talidomid, szkodliwy lek, który okaleczył tysiące dzieci, był produkowany przez nazistę i potem eks-naziści nie dopuszczali do ujawnienia tej informacji.
Faktycznie, dyrektor Grünenthal w tamtym czasie był wcześniej członkiem partii nazistowskiej. Co ma piernik do wiatraka? Właściwie nic, ale warto może przypomnieć biografię lekarza, który ujawnił szkodliwość leku - Widukind Lenz był członkiem hitlerjugen a w czasie wojny pracował w fabrykach syntetycznej benzyny, zaś jego ojciec był założycielem instytutu eugenicznego, propagującego małżeństwa aryjskich par i usuwanie ze społeczeństwa niepełnosprawnych. Jeśli życiorys ma czegokolwiek dowodzić to w tym przypadku pokazuje, że dla niektórych lekarzy dobro pacjentów jest ważniejsze od kariery.
----------
* http://www.fr-online.de/wissenschaft/contergan-skandal-verstuemmelt-durch-eine-arznei,1472788,11219174.html
 [1] SOMERS GF (1960). Pharmacological properties of thalidomide (alpha-phthalimido glutarimide), a new sedative hypnotic drug. British journal of pharmacology and chemotherapy, 15, 111-6 PMID: 13832739
[1] SOMERS GF (1960). Pharmacological properties of thalidomide (alpha-phthalimido glutarimide), a new sedative hypnotic drug. British journal of pharmacology and chemotherapy, 15, 111-6 PMID: 13832739
[2] http://www.nrdc.org/nuclear/nudb/datab15.asp
[3] "Kalte Füße" Der Spiegiel 06.12.1961
[4] http://www.washingtonpost.com/wp-dyn/content/article/2010/09/13/AR2010091306279.html
[5] Koch HP, & Czejka MJ (1986). Evidence for the intercalation of thalidomide into DNA: clue to the molecular mechanism of thalidomide teratogenicity? Zeitschrift fur Naturforschung. C, Journal of biosciences, 41 (11-12), 1057-61 PMID: 2953123
[6] Stephens TD, Bunde CJ, & Fillmore BJ (2000). Mechanism of action in thalidomide teratogenesis. Biochemical pharmacology, 59 (12), 1489-99 PMID: 10799645
Rzecz zaczęła się mniej więcej w 1954 roku w laboratorium niemieckiej firmy farmaceutycznej Grünenthal , gdzie trudniono się otrzymywaniem nowych preparatów. Wiodącą linią poszukiwań było wówczas łączenie antybiotyków z peptydami i aminokwasami poszukując aktywnych połączeń, niektóre z nich, podobne strukturalnie do kwasu barbiturowego, okazywały się bezpieczniejszymi od niego lekami nasennymi i uspokajającymi. Tym razem na warsztat wzięto ftaloiloizoglutaminę - pochodną kwasu glutaminowego, będącego jednym z aminokwasów białkowych, i kwasu ftalowego. Przez proste ogrzewanie w warunkach odwadniających przeprowadzono ten związek w imid z dwoma pierścieniami połączonymi przez azot:
Powstały związek to ftalimidoglutarimid, co wkrótce skrócono do wygodniejszej nazwy Thalidomid. Pierwsze testy medyczne na szczurach, psach i chomikach wykazały niską toksyczność, z LD rzędu 5g/kg masy ciała, dzięki czemu preparat można było zaliczać do nietoksycznych. Początkowo zalecono go epileptykom jako lek przeciwdrgawkowy, nie przynosił jednak oczekiwanych efektów, natomiast zapewniał spokojny sen i nie uzależniał tak jak barbiturany. Zaczęto więc prowadzić badania w tym kierunku, choć działanie uspokajające u zwierząt prawie nie występowało. Wreszcie po pierwszych testach zdecydowano o wprowadzeniu leku na rynek 1 Października 1957 roku.
Thalidomid reklamowano jako pierwszy pozbawiony bromu lek uspokajający i nasenny "bez skutków ubocznych". Rzeczywiście, stosowane dotychczas środki na bazie bromku potasu często wywoływały splątanie, napady senności, zaburzenia mowy i spadek libido (co wykorzystywano w wojsku do obniżania popędu u szeregowych). Ponieważ nadawał się doskonale do leczenia objawów towarzyszących wczesnej ciąży (rozdrażnienie, poranne mdłości, nieregularny sen), zalecano go właśnie ciężarnym. I tak to się zaczęło.
Jeśli przyjrzeć się dokumentom z tamtych czasów, można zobaczyć, że nie zaniedbano badań możliwych działań toksycznych - w przeglądzie z 1960 roku widać, że sprawdzono wpływ na układ nerwowy, moczowy i trawienny, interakcje z alkoholem, barbituranami, wpływy narkotyczne itp.[1] ale nie wzięto pod uwagę jednej rzeczy - teratotoksyczności.
Kwestia wpływu substancji chemicznych na rozwój płodu nie była wówczas specjalnie badana, sam termin teratogenu wprowadzono dopiero w 1960 roku, niemniej już zaczęto ją brać pod uwagę w niektórych krajach. Aby zbadać taki wpływ należało przed wprowadzeniem leku sprawdzić wpływ na ciężarne zwierzęta, zaś już po wprowadzeniu zbierać informacje o skutkach ubocznych. Nie zawsze da się w laboratorium odtworzyć wszystkie możliwe kombinacje, jakie mogą się przydarzyć w prawdziwym życiu, stąd często dopiero po wprowadzeniu leku okazuje się, że na przykład nie można go popijać sokiem z grejpfrutów albo zażywać wraz z aspiryną. Nikomu jednak nie przyszło do głowy, że jeśli nie znamy działania leku na jakąś specyficzną grupę ludzi, to profilaktycznie nie powinna ona go zażywać. A tą grupą były w tym przypadku dojrzewające ludzkie płody.
Jak zapewne pamiętacie z lekcji biologii, rozwój płodu zaczyna się od zapłodnienia, potem powstaje zygota która zaczyna się dzielić na 2, 4, 8,16... i coraz więcej komórek potomnych. Gdy kulka narastających komórek jest odpowiednio duża, zaczynają się one różnicować na grupy, stające się zalążkami różnych grup organów ciała. Z czasem w naszym zlepku komórek daje się zauważać jakaś forma, podział na przód i tył, na główkę i ogonek, na kończyny a u tych z czasem na przedramię i ramię, dalej końce kończyn formują się w ręce i dłonie, z paluszkami, każdy osobno, wykształca się twarz i jej zewnętrzne cechy.
Nie trudno się domyśleć że nawet drobne uszkodzenie w tym wczesnym etapie, może doprowadzić do potwornych deformacji. Śmierć komórki z której w dalszej perspektywie miała się wykształcić połowa jelita grubego spowoduje, że może ono powstać skrócone. Czasem wystarczy aby komórki niewłaściwie ułożyły się na wczesnym etapie. Dla niewielkich zmian owocuje to takimi wadami, jak błoniasta skórka między palcami, świński ogonek czy rozszczep podniebienia, im jednak większe są to zmiany tym większy jest wpływ ostateczny. Duża część takich deformacji jest letalna - jeśli na przykład zaburzony zostanie etap wykształcania się mózgu (bezmózgowie) to rosnący płód może umrzeć z braku kontroli nad funkcjami fizjologicznymi. A Thalidomid?
Począwszy od 1958 roku w Europie zaczęło rodzić się zaskakująco dużo dzieci z wadami rozwoju. W większości dotyczyły kończyn - dochodziło do nie wykształcenia się dłoni, i stóp, ramion i łydek bądź też w ogóle nie wykształcały się kończyny, w dodatku kości innych części ciała rosły zdeformowane lub skrócone; u innych dochodziło do deformacji lub braku uszu zewnętrznych, zarośnięcia przewodu słuchowego, jamy nosowej, deformacji lub braku nosa. Czasem wady pojawiały się dopiero wewnątrz ciała, dotycząc wykształcenia układu pokarmowego, deformacji nerek czy licznych przetok między jamami ciała.
Wzrost liczby takich przypadków był zaskakujący i długo nie udało się powiązać go z konkretnym czynnikiem, brakło jakiegoś centralnego systemu gromadzącego informacje i rzadkich schorzeniach stąd też trudno było dowieść, że wszystkie ciężarne stykały się z jednym, określonym czynnikiem. Ponieważ początkowo epidemia deformacji zachodziła na obszarach objętych działaniami wojennymi sądzono, że mogą to być długofalowe skutki działania gazów bojowych, trujących oparów bomb i pożarów, jednak w miarę narastania liczby przypadków stało się oczywiste, że nie można w ten sposób tłumaczyć zjawiska.
Inni wskazywali na związek ze zwiększonym napromieniowaniem środowiska - w latach 1951-57 przeprowadzono na świecie 175 próbnych wybuchów jądrowych, tylko w 1958 już 116[2] Trudno aby pozostało to bez wpływu na zdrowie. Wadą tej koncepcji było to, że zjawisko nasilało się w środkowej i zachodniej europie, natomiast takiego natężenia takich specyficznych wad nie notowano w USA gdzie przecież przeprowadzano próby (danych z ZSRR nie było).
Od końca lat 50. do początku lat 60. w 46 krajach urodziło się około 10 tysięcy dzieci z wadami rozwojowymi, zaś kilkanaście tysięcy ciąż zakończyło się poronieniem.
Co do tego kto pierwszy zauważył związek trwają spory. Czasem dziennikarze twierdzą, że na trop pierwsza wpadła prasa, jak się jednak wydaje zaczęło się od pewnych dwóch lekarzy.
Niemiecki pediatra Widukind Lenz, pracujący w szpitalu dziecięcym w Hamburgu, na podstawie wywiadów z matkami dzieci z deformacjami doszedł do wniosku, że wszystkie one brały leki nasenne i uspokajające w okresie ciąży a czas w jakim zaczęły się pojawiać pierwsze przypadki zgadzał się z kilkumiesięcznym odstępstwem z czasem wprowadzenia leku na rynek. Będąc pewny swych racji poinformował o nich służby medyczne i zadzwonił do firmy farmaceutycznej Grünenthal aby skłonić ich do natychmiastowego wycofania preparatu. Szefowie firmy nie byli jednak skłonni do współpracy, dlatego dwa dni później, 18 listopada 1961 roku, wygłosił na konferencji pediatrycznej referat opisujący zaobserwowany związek. Oczywiście zaraz zarzucono mu, że wyniki kwestionariuszy u 20 matek to za mało aby mówić o dowodzie. Jeśli podejrzenia okazałyby się niesłuszne, byłby to koniec jego kariery. Stwierdził jednak że nie może z czystym sumieniem milczeć, gdy kolejne kobiety zażywają podejrzane tabletki. O sprawie wkrótce napisała lokalna gazeta. Nazwa podejrzanego leku nie została jeszcze ujawniona.[3]
W międzyczasie australijski położnik Wiliam McBride również powiązał wady rozwojowe u dzieci z faktem, że wszystkim matkom tych dzieci wcześniej sam przepisał Thalidomid, zaś efekt pojawił się w Australii później niż w reszcie świata, po wprowadzeniu na rynek leku. Napisał na ten temat list do prestiżowego czasopisma medycznego The Lancet, które wydrukowało go w grudniu tego samego roku. Trwały już wówczas niejawne rozmowy między przedstawicielami władz medycznych i zarządu firmy Grünenthal. Propozycją firmy było wprowadzenie na opakowania nalepki, informującej że nie może być zażywana przez kobiety w ciąży. Gdy lekarze zasugerowali, że lepiej całkiem wycofać lek, zanim kwestia bezpieczeństwa nie zostanie zbadana, przedstawiciele firmy nie zgodzili się, grożąc konsekwencjami prawnymi w razie prób wprowadzenia takich ograniczeń. Po kilku dniach jednak zmiękli w miarę spływania danych potwierdzających zależność. Ostatecznie na początku grudnia rozpoczęto wycofywanie preparatu i leków które go zawierały - a znalazł się nawet w tabletkach na przeziębienie i syropach na kaszel.
Ciekawą kwestią jest tutaj sprawa niedopuszczenia preparatu na rynek amerykański. Pracująca w ówczesnej agencji do spraw żywności i leków (FDA) Frances Oldham Kelsey, zajmowała się dopuszczaniem leków do obrotu. Gdy w 1960 roku próbowano wprowadzić Thalidomid, podczas przeglądania dokumentacji zauważyła to samo co ja w opisywanym już przeglądzie - brak badań wpływu na kobiety ciężarne. Mając na uwadze obserwowane na świecie objawy, i pamiętając ze studiów dopiero rodzące się badania nad wpływami teratogennymi, zażądała uzupełnienia dokumentacji, czego firma produkująca lek nie mogła zrobić. Nikt nie wymagał od nich przeprowadzenia takich badań, więc ich nie wykonali. Kelsey odpisała im zatem, że FDA może poczekać kilka miesięcy, aż zrobią odpowiednie badania. Oznaczało to późniejsze wprowadzenie leku na przewie 300 milionowy rynek amerykański a co za tym idzie, milionowe straty. Firma zaczęła naciskać zarówno na badaczkę jak i na jej szefostwo, grożąc możliwością zażądania odszkodowania w razie bezpodstawnego zatrzymania leku, ci jednak odpowiadali niezmiennie - bez dodatkowych testów nie przyjmiemy leku na rynek.[4] To przetrzymanie trwało akurat na tyle długo, że zdążyły pojawić się pierwsze doniesienia o szkodliwości leku, dlatego USA obroniły się przez nim. Wiadomo jednak że firma wysyłała lekarzom "darmowe próbki" mając nadzieję, że pozytywne opinie od amerykańskich położników przekonają FDA. Wiadomo o kilkunastu przypadkach dzieci zdeformowanych wskutek zażywania "darmowych próbek" przez ich matki.
Potwierdzeniem związku między lekiem a deformacjami był ich zanik po lipcu 1962 roku, gdy urodziły się ostatnie dzieci, których matki mogły go zażywać. Co dziwniejsze, w Japonii wycofano lek dopiero w 1965 roku. Wprawdzie nie sprowadzano go już z Europy ale nie wydano zakazu sprzedaży preparatu z aptecznych zapasów, toteż jeszcze przez kilka lat zdarzały się tam przypadki zniekształceń płodu. Znanych jest trzystu japońskich "Talidomerów".
Co takiego powodowało uszkodzenia płodu? Mechanizm jest niejasny, jak się wydaje cząsteczka ftalimidoglutarimidu wpasowuje się pomiędzy nici DNA w miejscach purynowych blokując działanie genów odpowiedzialnych za rozwój, głównie przez hamowanie tych odpowiedzialnych za rozwinięcie zalążków kończyn.[5] Jak się wydaje równocześnie działać może mechanizm blokowania tworzenia nowych naczyń krwionośnych w miejscach intensywnego wzrostu.[6] McBride, ten sam australijski położnik, zasugerował zatem wykorzystanie tej substancji do leczenia raka będącego przecież "szybko rosnącym skupieniem komórek". Przypuszczenie okazało się trafne - dziś stosuje się go, pod nazwą Taliomid, do terapii szpiczaka mnogiego, z dosyć wysokim wskaźnikiem remisji. Terapia wymaga jednak, aby osoby niej poddawane nie mogły już posiadać potomstwa - a więc kobiet po 50 roku życia, bezpłodnych lub wysterylizowanych. Jeśli poddać się jej ma kobieta w średnim wieku, to albo musi ona zażywać leki antykoncepcyjne, albo zachować wstrzemięźliwość. Chodzi po prostu o to, aby nie zaszła, nie wiedząc o tym w ciążę w trakcie terapii, co doprowadziłoby do urodzenia zdeformowanego dziecka.
Ze sprawą właściwości związku wiąże się jeszcze jedna kwestia - otóż tak na prawdę mamy do czynienia z dwoma jego odmianami, jedna ma właściwości lecznicze, zaś druga szkodliwe. A rzecz polega jedynie na innym wygięciu cząsteczki.
Związki organiczne zbudowane są głównie z węgla o wartościowości IV a więc tworzącego cztery wiązania. Jeśli nie mamy do czynienia z połączeniami wielokrotnymi, wiązania te odsuwają się od siebie tworząc układ tetraedryczny. Jeśli wobec tego zdarzy się, że przy każdym wiązaniu takiego węgla podczepiona będzie inna grupa, to cała cząsteczka będzie asymetryczna, i możliwe będą dwa ustawienia grup wokół takiego węgla, podobne do siebie jak lustrzane odbicia Piękna grafika:
Jeślibyśmy zbudowali takie modele (na przykład z kasztanów) to jakbyśmy ich nie obracali, nie przeprowadzimy jednego w drugi bez rozrywania wiązań (zamieniania kasztanów). O takich lustrzanych figurach mówimy że są chiralne, od greckiego cheir czyli ręka. Dłonie bowiem w zasadzie są swymi lustrzanymi odbiciami, ale bez obracania ich ku sobie nie nałożą się dokładnie jedna na drugą. Chemicy odróżniają takie lustrzane cząsteczki nadając im konfigurację absolutną, zależną od tego w jakiej kolejności ułożone są podstawniki, którym przypisuje się określoną "ważność" Jeśli ruch od najważniejszego podstawnika do po kolei mniej ważnych jest prawoskrętny, to konfigurację oznaczamy literą R a jeśli lewoskrętny to literą S.
Konfiguracja cząsteczki ma duże znaczenie w biochemii - większość aminokwasów w żywych organizmach jest lewoskrętna, z aminokwasów zbudowane są białka skręcające się z tego powodu w określony sposób, z białek zbudowane są receptory i często bardzo selektywnie reagują na cząsteczki o różnej konfiguracji - przykładem karwon, jeden z terpenów występujących w olejkach zapachowych - izomer R pachnie miętą kędzierzawą, izomer S pachnie kminkiem. A jak rzecz się ma z naszą cząsteczką leku?
Przy wiązaniu z azotem jest jeden węgiel o asymetrycznie ułożonych podstawnikach - z jednej strony jest połączony z wodorem, z drugiej z innym pierścieniem, z trzeciej jest połączony z tą częścią pierścienia, gdzie znajdują się dwie grupy karbonylowe, zaś z czwartej strony jest połączony z drugą połową pierścienia, bez tych grup. Otoczenie z każdej strony jest inne, zatem cząsteczka jest asymetryczna i chiralna. Możliwe stają się zatem dwa położenia drugiego pierścienia, połączonego przez azot - w jednym znajduje się on nad płaszczyzną pierścieni w asymetrycznym węgle, a w drugim pod nią:
A co z poszkodowanymi?
Mimo ujawnienia przyczyny deformacji jeszcze przez długi czas rodziny poszkodowanych dzieci nie mogły doprosić się pomocy. Firma Grünenthal straszyła sądem każdego kto chciał winić ją o tą sytuację. Na dobrą sprawę odszkodowania jakie wywalczyły rodziny, pochodziły głównie od dostawców lub od rządów państw, które nie wymagały, jak USA, dokładnych badań przed wprowadzeniem na rynek. Dopiero w 1972 roku firma musiała zapłacić 150 mln dolarów rodzinom trzech tysięcy dzieci, jakie urodziły się zdeformowane w Niemczech. Rodziny dzieci urodzonych w innych krajach nie wywalczyły odszkodowań do dziś. Niedawne oficjalne przeprosiny miały od strony firmy jedynie symboliczne znaczenie.
Skandal wokół tej sprawy wywołał duże zmiany w prawie farmaceutycznym, które dotychczas bardzo lekko traktowało procedury dopuszczania nowych leków - zaledwie przecież kilka lat wcześniej, w 1954 roku we Francji lek na czyraki skórne zabił sto osób, bo nikt nie wykonał rzetelnych badań działania na ludzi.
Od teraz wymagane stały się nie tylko kilkufazowe badania kliniczne ale też ścisłe określenie grupy, dla której znane są dane medyczne. Gdy kilka lat temu zachorowałem i przepisano mi antybiotyk, w ulotce pisano, że nie powinny go stosować matki ciężarne i dzieci do 12 lat - czy dlatego że dla nich lek był szkodliwy? Nie, po prostu dla tych grup nie ma informacji medycznych o bezpieczeństwie, lepiej więc traktować go jak szkodliwy i nie podawać, niż narażać się na to, że rzecz wyjdzie dopiero w praniu.
Na koniec rozprawię się może jeszcze z jedną krążącą po świecie informacją - w sporach między przeciwnikami farmakologii a jej zwolennikami, gdy którejś ze stron brakuje argumentów, sięgają do "argumentu z Nazistów" - na zasadzie: "twoja idea jest be bo kiedyś zajmował się nią nazista". W przypadku farmakologii łatwo zadać ten cios po niesławnej sprawie firmy Bayer oskarżonej o silne związki z hitleryzmem. Niekorzy czasem sięgają w historii dalej wywodząc, że talidomid, szkodliwy lek, który okaleczył tysiące dzieci, był produkowany przez nazistę i potem eks-naziści nie dopuszczali do ujawnienia tej informacji.
Faktycznie, dyrektor Grünenthal w tamtym czasie był wcześniej członkiem partii nazistowskiej. Co ma piernik do wiatraka? Właściwie nic, ale warto może przypomnieć biografię lekarza, który ujawnił szkodliwość leku - Widukind Lenz był członkiem hitlerjugen a w czasie wojny pracował w fabrykach syntetycznej benzyny, zaś jego ojciec był założycielem instytutu eugenicznego, propagującego małżeństwa aryjskich par i usuwanie ze społeczeństwa niepełnosprawnych. Jeśli życiorys ma czegokolwiek dowodzić to w tym przypadku pokazuje, że dla niektórych lekarzy dobro pacjentów jest ważniejsze od kariery.
----------
* http://www.fr-online.de/wissenschaft/contergan-skandal-verstuemmelt-durch-eine-arznei,1472788,11219174.html
[2] http://www.nrdc.org/nuclear/nudb/datab15.asp
[3] "Kalte Füße" Der Spiegiel 06.12.1961
[4] http://www.washingtonpost.com/wp-dyn/content/article/2010/09/13/AR2010091306279.html
[5] Koch HP, & Czejka MJ (1986). Evidence for the intercalation of thalidomide into DNA: clue to the molecular mechanism of thalidomide teratogenicity? Zeitschrift fur Naturforschung. C, Journal of biosciences, 41 (11-12), 1057-61 PMID: 2953123
[6] Stephens TD, Bunde CJ, & Fillmore BJ (2000). Mechanism of action in thalidomide teratogenesis. Biochemical pharmacology, 59 (12), 1489-99 PMID: 10799645
środa, 12 września 2012
Kiedyś w laboratorium (14.)
Gdy mieliśmy zajęcia z radiochemii, prowadzący pokazał nam pouczającą rzecz - sprawdził stopień zjonizowania wykrywany w pomieszczeniu - wynosił ok. 2 miliremów/h. Po czym wziął opakowanie soli dla nadciśnieniowców, o zawartości sodu obniżonej przez dodatek potasu - i tutaj czujnik pokazał prawie 6 mR/h:
Zatem sól jest promieniotwórcza bardziej niż tło. Z czego to wynika? Oczywiście z dodatku potasu.
Naturalny potas zawiera 0,012% izotopu K-40, będącego izotopem nietrwałym. Rozpada się z wydzieleniem cząstek beta z okresem półtrwania 1,27 mld lat zamieniając się w argon. Sól zawierająca większą ilość potasu jest też bardziej promieniotwórcza, zbyt jednak mało aby nam przez samo to tylko zaszkodziła (na pewno nam zaszkodzi jeśli będziemy jej nadużywali).
Ta właściwość dosyć przecież pospolitego pierwiastka jest używana w radiodatowaniu skał i skamielin - jeśli wiemy jaka powinna być zawartość potasu w skale, to znając różnicę między ilością teoretyczną a rzeczywistą i wiedząc ile argonu nagromadziło się wewnątrz ziaren mineralnych, możemy policzyć wiek próbki w zakresie setek milionów - miliardów lat.
ps. a za niedługo zdaję egzamin licencjacki i będę składał papiery na magisterkę.
ps2. - postanowiłem trochę uporządkować posty i te ze stałego cyklu kiedyś w laboratorium ponumerowałem
ps3. - egzamin zaliczyłem, papiery złożyłem. A że link dawany w komentarzu jest ciekawy, wkleję go w formie aktywnej:
http://xkcd.com/radiation/
infografika porównująca dawki promieniowania z różnych źródeł. Dawka dla zamieszkania 50 mil od elektrowni węglowej jest większa niż dla zamieszkania 50 mil od elektrowni jądrowej.
Zatem sól jest promieniotwórcza bardziej niż tło. Z czego to wynika? Oczywiście z dodatku potasu.
Naturalny potas zawiera 0,012% izotopu K-40, będącego izotopem nietrwałym. Rozpada się z wydzieleniem cząstek beta z okresem półtrwania 1,27 mld lat zamieniając się w argon. Sól zawierająca większą ilość potasu jest też bardziej promieniotwórcza, zbyt jednak mało aby nam przez samo to tylko zaszkodziła (na pewno nam zaszkodzi jeśli będziemy jej nadużywali).
Ta właściwość dosyć przecież pospolitego pierwiastka jest używana w radiodatowaniu skał i skamielin - jeśli wiemy jaka powinna być zawartość potasu w skale, to znając różnicę między ilością teoretyczną a rzeczywistą i wiedząc ile argonu nagromadziło się wewnątrz ziaren mineralnych, możemy policzyć wiek próbki w zakresie setek milionów - miliardów lat.
ps. a za niedługo zdaję egzamin licencjacki i będę składał papiery na magisterkę.
ps2. - postanowiłem trochę uporządkować posty i te ze stałego cyklu kiedyś w laboratorium ponumerowałem
ps3. - egzamin zaliczyłem, papiery złożyłem. A że link dawany w komentarzu jest ciekawy, wkleję go w formie aktywnej:
http://xkcd.com/radiation/
infografika porównująca dawki promieniowania z różnych źródeł. Dawka dla zamieszkania 50 mil od elektrowni węglowej jest większa niż dla zamieszkania 50 mil od elektrowni jądrowej.
wtorek, 4 września 2012
Poison story (4.) - Biały lucyfer
Siostry Ansell od zawsze były trochę dziwne. Jak się wydaje problemy psychiczne były w ich rodzinie stosunkowo częste. Stosunek do zaburzeń psychicznych był w XIX wiecznej Anglii nieco inny niż współczesny. Nie znano dobrych sposobów leczenia, toteż starano się odizolować od społeczeństwa takie osoby. Do sieci Azylów zbudowanych dla takich nieszkodliwych idiotów trafiali zatem ludzie z depresją, opóźnieni w rozwoju, z różnymi maniami czy nawet z nieakceptowanymi poglądami na życie. Nie bardzo wiadomo na czym polegała przypadłość 15-letniej Caroline Ansell, która trafiła do Leavesden Mental Asylum w Buckinghamshire w roku 1895.
Druga spośród sióstr, Marry Ann, była pokojówką. Niestety praca ta była kiepsko opłacalna i gdy zaręczyła się, zabrakło jej nawet na urzędowy ślub, kosztujący półtora szylinga - swoją drogą dobrze o nierównościach społecznych tamtych czasów świadczy, że taniej było sprawić sobie nowego służącego niż nową marynarkę. Siostry utrzymywały dobry kontakt, mimo niezbyt sprzyjającej sytuacji - jedna praktycznie uwięziona, druga na dorobku - dlatego gdy na początku marca 1899 roku 19-letnia Caroline otrzymała domowe ciasto, bardzo się ucieszyła. Był to właściwie nierówno wypieczony placek z dżemem i białym kremem. Ponieważ ciasto było dosyć duże, zjadła tylko połowę a resztą podzieliła się z pacjentami z sali. Niestety niedługo potem wszyscy poczuli pieczenie w ustach i żołądku, pojawiły się wymioty i biegunka, z czasem krwawa, o wyraźnym zapachu czosnku. Białka ich oczu przebarwiły się na żółto, i pojawiła się gorączka. U tych, którzy zjedli tylko po kęsie, objawy cofnęły się po kilku dniach, zaś najmłodsza z sióstr Ansell zapadła w śpiączkę po czym zmarła nie odzyskawszy przytomności.
W zakładzie pojawiał się w tym czasie tyfus, można by więc zrzucić winę na tą chorobę, lecz właśnie z powodu epidemii Caroline zbadano kilka dni przedtem, stwierdziwszy iż jest najzupełniej zdrowa. To wraz z podobnymi objawami u wszystkich, którzy zjedli ciasto obudziło podejrzenia. Sekcja zwłok wykazała, że ofiara zmarła wskutek podania dużej ilości białego fosforu, będącego też składnikiem trutek na szczury...
Historia odkrycia fosforu jest często podawana jako przykład wkładu alchemii w naukę średniowiecznej Europy. Jest to wkład dosyć paradoksalny, bo w dużej mierze niezamierzony. Alchemicy podążając za złudną ideą kamienia filozoficznego, panaceum czy uniwersalnego rozpuszczalnika, upatrywali celu w sprawdzaniu różnych kombinacji naturalnych surowców o pożądanych cechach i prostych działań, często zmieszanych z mistyką i magią. Brali na przykład ołów, którego pożądaną cechą był ciężar, mieszali go z siarką o kolorze żółtym, słonecznym, i srebrem mającym być nośnikiem metalicznego połysku. Wyżarzali tą mieszaninę powoli, przez czterdzieści dni, począwszy od pełni księżyca, umieszczali w "jajku filozoficznym" wygrzewali sto dni w gnoju, wystawiali na światło słońca i planet w odpowiednich kontynuacjach, mając na dzieję że po ostatecznym wyżarzeniu znajdą na dnie tygielka metaliczne, ciężkie, i słonecznie żółte złoto.
Tak się jednak nie działo, więc pomagali sobie dorzucając nieco z mieszka i prezentując potem swym sponsorom jako dowód skuteczności metody.
Często brali na warsztat ciekawie wyglądające minerały, rośliny, zwierzęta, poddawali modyfikacjom, sprawdzali właściwości i oddziaływanie. Przy tylu próbach musiały pojawiać się szczęśliwe trafy, nowe odkrycia dokonane podczas poszukiwania czegoś całkiem innego Nasz Sędziwój ogrzewając saletrę obserwował powstawanie "ducha saletrzanego" nie wiedząc że właśnie wydzielił tlen. Włoch Cascariolo wyżarzając ciężki kamień z węglem i siarką odkrył pierwszy luminofor - "kamień boloński" który wystawiony na słońce świecił w ciemnościach. W podobny sposób odkryto bizmut, uważany pierwotnie za odmianę ołowiu, i Arsen, składnik arszeniku.
Jednym z takich ciekawskich alchemików był Henning Brand z Hamburga. Jego pasją było wykorzystywanie w przemianach wody i rozpuszczalnych substancji, zapewne więc to, wraz z koncepcjami siły życiowej oraz być może teorią humorów sprawiło, że postanowił zająć się wyodrębnieniem właściwej kwintesencji z wody wydalanej przez żywy organizm - z moczu. Brand wziął mocz cielęcy, w bardzo dużej ilości, i gotował go na małym ogniu tak długo, aż pozostał mu na dnie syropowaty, pomarańczowy płyn. Ten przeniósł do retorty i ogrzewał aż do wydzielenia tłustego dymu. Zawartość retorty składała się teraz z szarej, gąbczastej masy i zebranej na dnie soli, tą ostatnią wyrzucał, zaś ciemną pozostałość wyżarzał przez kilka godzin. Trudno powiedzieć, czy oczekiwał że na dnie znajdzie błyszczące złoto, czy też że wyodrębni vis vitalis, w każdym razie w tej ostatniej fazie zauważył, że opary wydzielające się z retorty, świecą w ciemnościach. Gdy zaciekawiony otworzył pokrywkę, całe naczynie rozbłysło wewnętrznym światłem po czym pękło od wysokiej temperatury. Brand złapał jednak nieco jaśniejącego zielonkawo płynu, zestalającego się w woskowatą masę, świecącą w ciemnościach i nagle zapalającą się podczas rozdrabniania. Moment odkrycia, na obrazie Josepha Wrighta "Alchemik w poszukiwaniu kamienia filozoficznego" ozdabia nagłówek bloga.
Było to już coś wielkiego. Substancja wyszła z człowieka i samorzutnie świeciła nie wymagając naświetlania, zatem musiała posiadać jakąś wewnętrzną siłę podobną do materii płomienistej słońca, była łatwo palna, bardziej niż uważana za nośnik żywiołu ognia siarka, można by wręcz sądzić że oto właśnie siła życiowa zmaterializowana i utrwalona. Brand nazwał ją phosphoros co z grecka znaczy tyle co "nośnik światła", po czym zaczął produkować ją w większej ilości, skrzętnie utrzymując w tajemnicy recepturę. Warto zauważyć że łacińską wersją tej pierwotnej nazwy byłoby lucifer zupełnie jak imię pewnego upadłego anioła - stąd być może, wraz z trującymi właściwościami, brały się ówczesne skojarzenia z demonicznym charakterem nowej materii.
Niezwykłe właściwości substancji wzbudzały wówczas, w 1669 roku, żywe zainteresowanie; sądzono że oto alchemicy są już na dobrej drodze do ukończenia "wielkiego dzieła", toteż wielu było chętnych aby zobaczyć ów phosphoros, i kupić go, zaś Brand sprzedawał kawałki po cenach wyższych niż złoto.
Metoda której używał była jednak mało wydajna - z około 5500 litrów moczu uzyskiwał 120 gramów fosforu, nie trudno się zatem domyślić jak potwornie musiała śmierdzieć jego pracownia. Tak długo, jak tylko się dało strzegł tajemnicy, aż wreszcie sprzedał ją innemu alchemikowi za 200 talarów, ten sprzedał ją innemu i powoli zaczęły krążyć pogłoski, że substancję to można wydzielić z "czegoś co należało do ciała człowieka" Tą drogą poszedł sceptyczny alchemik Robert Boyle, który po odkryciu metody i udoskonaleniu jej przez dodatek piasku do tygla w ostatniej fazie, dokonał czegoś co dużo mówi o jego poglądach - opublikował przepis wytwarzania fosforu, tak aby mógł go przeprowadzić każdy chętny.
Boyle był krytykiem mętnych i do niczego nie prowadzących alchemicznych dociekań, atmosfery tajemnicy, widm i cieni. Opierając się na poglądach Paracelsusa na temat alchemii naturalnej, uważał że powinnością badaczy jest nie wymyślać przez nikogo nie widziane cudowne substancje, lecz badać właściwości i przemiany substancji naturalnych, aby znaleźć ich pożyteczne zastosowanie. Jego książkę "Sceptical Chymist" uważa się za początek rozwoju prawdziwej chemii.
Współcześnie możemy odtworzyć zachodzące procesy. Mocz zawiera zawsze pewną ilość fosforanów, zwykle w formie rozpuszczalnego fosforanu amonowo-sodowego. Po odparowaniu, rozłożeniu kwasu moczowego i lotnych składników, na dnie pozostawały fosforany i węgiel ze zwęglonych związków organicznych. Węgiel w wysokiej temperaturze redukował fosforan do wolnego fosforu.:
Ten skraplał się na ściankach naczynia. Niedługo później odkryto, że znaczne ilości fosforanu wapnia znajdują się w kościach, zaczęto więc otrzymywać fosfor z białego popiołu kostnego z całkiem niezłą wydajnością. Obecnie używa się w tym celu apatytów.
Fosfor jest to pierwiastek niemetaliczny położony w grupie V pod azotem. W temperaturze pokojowej ma postać stałą, przy czym przejawia ciekawą i stosunkowo częstą w układzie okresowym skłonność do występowania w różnych odmianach, różniących się wewnętrzną strukturą. Może tworzyć kilka odmian alotropowych, różniących się trwałością, reaktywnością i wyglądem.
Fosfor biały ma wygląd woskowatej masy, zwykle lekko żółtawej wskutek samorzutnej polimeryzacji. Jest najbardziej reaktywną formą pierwiastka, topi się w temperaturze 44 stopni, łatwo sublimuje, samorzutnie zapala się, dla większych grudek powyżej 60 stopni, dla drobnych cząstek w temperaturze pokojowej, a wreszcie świeci w ciemnościach. Aby objaśnić skąd bierze się ta reaktywność, muszę powiedzieć coś na temat geometrii wiązań w atomie.
Każdy atom może tworzyć wiązania z innymi dzięki elektronom, liczba elektronów o najniższej energii, znajdujących się na najbardziej zewnętrznych powłokach, warunkuje maksymalną możliwą ilość wiązań, jakie atom może utworzyć z innymi. Fosfor ma pięć takich elektronów, przy czym trzy są stosunkowo słabiej związane zaś dwa tworzące parę nieco mocniej. Dlatego w związkach najchętniej przyjmuje wartościowość 3+ tworząc trzy wiązania.
Każde wiązanie chemiczne jest utworzone przez elektron lub parę elektronów, związaną między atomami, przyciąganą równocześnie przez oba jądra, spajając je tym samym ze sobą. Poszczególne wiązania wokół atomu starają się przy tym być odsunięte najdalej od innych, na skutek odpychania jednakowych ładunków ujemnych, tak jak to zachodzi dla pasków papieru przyczepionych do kulistego zakończenia maszyny elektrostatycznej. Symetria rozkładu wiązań zależy więc od ich liczby. Dwa wiązania, nie ograniczone innymi czynnikami w otoczeniu, najchętniej będą tworzyły symetrię liniową, będąc ustawione po przeciwnych stronach atomu, trzy wiązania będą kierowały połączone atomy w naroża płaskiego trójkąta - tego więc można się spodziewać dla związków fosforu III. Pozostaje jednak jeszcze ta para elektronów która zaburza ten układ, dlatego w otoczeniu atomu pojawiają się cztery grupy odpychających się ładunków - trzy wiązania i jedna niewiążąca para powiązanych elektronów. Układ powinien zatem przyjąć formę tetraedryczną - to jest końce osi czterech grup stanowią naroża czworościanu foremnego, rozdzielone o kąt ok. 109,5 stopnia. W rzeczywistości czwarta grupa, czyli para dwóch elektronów, odpycha od siebie wiązania mocniej a nasz czworościan wykreślony końcami grup, przybiera postać wydłużonej piramidy o trójkątnej podstawie. Szerzej omawia to teoria VSEPR.
I co z tego? W fosforze białym atomy grupują się w cząsteczki czeroatomowe, gdzie każdy atom łączy się z trzema innymi, mające postać bryły i tą bryłą powinien być czworościan bo w tym kształcie wszystkie oddziaływania się równoważą. Gdyby trzy wiązania miały układ tetraedryczny, nie mogłyby utworzyć tej bryły, bo kąt między wiązaniami jest zbyt szeroki, powinien wynosić ok 70 stopni kątowych. Ponieważ jednak są odpychane, to przybliżają się do siebie, tworząc mniejszy kąt i struktura tetraedru staje się dla nich bardziej prawdopodobna. Kąt między wiązaniami jest bliższy potrzebnemu, ale wciąż nieco szerszy, mimo to tworzy się bryła, zaś wiązania zostają z konieczności "przygięte" . To tak jakbyśmy tworzyli modele z kulek z bolcami i słomek i dla uzyskania właściwego kształtu musielibyśmy stworzyć szkielet z wygiętymi słomkami. Taka struktura nie może być trwała, ma bowiem większą energię ( w modelu jest to siła jaką nagięliśmy słomki) a atomy będą dążyć do struktury bardziej korzystnej.
Właśnie dlatego fosfor biały jest reaktywny dążąc do rozpadu piramidalnej cząsteczki i utworzenia związku, łatwo się zapala, reaguje z metalami itd. Dlaczego jednak fosfor świeci w ciemnościach? Fosfor w dążeniu do utworzenia innych związków, utlenia się pod wpływem powietrza, zachodzi to jednak w stosunkowo niskich temperaturach. Podczas utleniania wysoka energia związana w cząsteczce wprowadza jeden z atomów reagującej cząsteczki tlenu w stan wzbudzony, z którego powraca do stanu podstawowego wypromieniowując energię w formie światła.
Po zapaleniu tworzy jasny płomień o wysokiej temperaturze, rzędu 1000-1200 stopni, spalając się z wydzieleniem białego pięciotlenku, mającego formę gęstego dymu - z tego powodu świece z fosforem bywają używane do wytworzenia sztucznej mgły. Tlenek fosforu V rozpuszcza się w wodzie dając kwas ortofosforowy, będący mocnym kwasem, dlatego też dym tlenku fosforu ma działanie drażniące na oczy i błony śluzowe. Płonącego fosforu nie powinno się gasić wodą - większe grudki będą ją rozkładały, natomiast po zalaniu większą ilością gorące bryłki fosforu rozpadną się na drobne cząstki, które po wyparowaniu wody zapłoną ponownie.
Wysoka temperatura płomienia i łatwość zapalenia powodowała, że dosyć wcześnie został wykorzystany w bombach zapalających - bomba wybuchająca nad ziemią zasypuje wówczas znaczny obszar płonącymi kroplami, wywołującymi pożary i bardzo ciężkie oparzenia, często z wżerami w głąb ciała. Część fosforu wnika wówczas w ranę wywołując rozległe martwice i śmierć w wyniku zakażeń, dlatego już dawno międzynarodowe konwencje zakazały używania tego typu broni wobec cywilów. Ostatnim głośnym przypadkiem ich złamania było użycie bomb zapalających przez wojska Izraelskie, podczas krótkotrwałej wojny z strefie Gazy w 2009 roku.
Jedną z pomysłowych konstrukcji użytych podczas II wojny światowej, były celuloidowe pakiety nasączone roztworem fosforu w dwusiarczku węgla, rozrzucane z samolotów nad miastami. Pakiet taki spadłszy na drewniany budynek, zapalał się po kilku godzinach, gdy rozpuszczalnik odparował, prowokując pożary. Pozostałości powojennych instalacji wciąż jeszcze dają o sobie znać - niedawny przypadek zanieczyszczenia plaży substancją, zapalającą się po trąceniu patykiem, okazał się skażeniem białym fosforem, być może uwolnionym z jakiejś miny która właśnie do cna przerdzewiała. W 2007 roku na Ukrainie po wypadku pociągu przewożącego wojskowe chemikalia, znaczny teren został skazony białym dymem fosforu, który zapłonął w uszkodzonych beczkach; 150 osób trafiło wtedy do szpitali.
I tak też, okrężną jak to zwykle u mnie drogą, doszedłem do kwestii szkodliwego wpływu białego fosforu na człowieka. Należy do najsilniejszych trucizn nieorganicznych, za dawkę śmiertelną uważa się 50-60 mg choć zdarzało się że już jedna trzecia tej ilości powodowała zgon. Śmierć następuje po kilku dniach. Za przyczynę toksyczności uważa się reaktywność i silną zdolność do redukcji, w efekcie fosfor po dostaniu się do komórki zaburza enzymatyczne reakcje utleniania i wytwarzania energii; zakwaszenie ma tu mniejszy wpływ. Ponieważ po wchłonięciu z jelita fosfor biały trafia żyłą wrotną do wątroby, tam głównie następują uszkodzenia, objawiające się marskością i martwicą. Zatrucie może zatem przypominać szybki atak żółtaczki wskutek mechanicznego uszkodzenia wątroby. Podobnym uszkodzeniom ulega też mięsień sercowy i ściany żył, co wraz ze spadkiem krzepliwości prowadzi do wylewów. Wytwarzający się w żołądku fosforowodór uszkadza układ nerwowy. Śmierć następuje wskutek wielonarządowej niewydolności organizmu.[1]
Narażenie na małe dawki rozwija martwicę kości, zwłaszcza szczęki, prowadząc do deformacji, rozpadu kości, tworzenia się dziur i zapalenia okostnej.
Oprócz nagłości objawów, diagnozę zatrucia można postawić też na podstawie fosforyzowania wymiocin. W pierwszych oprócz węgla aktywowanego, odtrutką może być płukanie żołądka wodą utlenioną, gdy jednak trucizna się wchłonie, leczenie może być wyłącznie objawowe. [2]
Dosyć szybko zaczęto używać fosforu, w formie nasączonych nim materiałów, do trucia szczurów i szkodników ogrodowych, powodowało to niestety wiele przypadkowych zatruć a czasem też pożary, niestety także szybko pojęto że wobec tego, fosfor jest stosunkowo łatwo dostępną trucizną na ludzi. Gazety z XIX wieku często notują samobójstwa lub morderstwa przy pomocy "roztworu z zapałek" czy "trucizny na szkodniki". Tak też było w przypadku Caroline Ansell.
Po nagłej śmierci Caroline, matka wraz ze starszą córką zjawiły się w zakładzie, chcąc przygotować się do pogrzebu, wówczas też Marry zapytała portiera kiedy będzie mogła odebrać akt zgonu siostry, ten poinstruował ją gdzie i jakie podanie musi złożyć. Gdy udała się do odpowiedniego urzędu dowiedziała się, że jeszcze nie potwierdzono przyczyny zgonu i musi poczekać. Tymczasem nadinspektor Wood, poinformowany o wyniku sekcji, zainteresował się opakowaniem ciasta. Nadawca podpisał się bardzo niewyraźnie, ale zmarła najwyraźniej uważała, że to prezent od kogoś z domu. Nie była to pierwsza taka dziwna przesyłka. Kilka tygodni wcześniej otrzymała z domu paczkę z herbatą i cukrem, jednak cukier był zawilgotniały a herbata gorzka, dlatego musiała je wyrzucić. Potem dostała list od dawnej przyjaciółki, która zawiadamiała że oboje rodzice Caroline zginęli. Ta głęboko przeżyła tą wiadomość, po czym napisała do domu list prosząc o jakąś rzecz, aby móc opłakiwać rodziców - okazało się jednak że ci żyją, a przyjaciółka nie wysyłała żadnego listu.
Inspektor zwrócił więc uwagę na Marry Ann, która zamiast smutku wyrażała raczej zniecierpliwienie. Rozpytując dowiedział się, że zaraz po przybyciu chciała otrzymać akt zgonu, zapytał więc w bankach i trafił od razu - kilka miesięcy wcześniej Marry Ann wzięła ubezpieczenie na życie siostry, twierdząc że to zabezpieczenie godnego pogrzebu. Wartość ubezpieczenia wynosiła 22,5 funta. Niedługo potem wyszło na jaw, że Marry kupiła w sklepie znaczne ilości trutki na szczury, które podobno stały się plagą w domu w którym służyła. Jej pracodawczyni zaprzeczyła. Ostatecznym dowodem było porównanie pisma na kartkach z życzeniami od siostry, paczce z ciastem i w liście od rzekomej przyjaciółki. Wszystkie napisano tą samą ręką. Niedługo sąd pierwszej instancji skazał ją na śmierć, co wywołało wielkie poruszenie w prasie.
Wracając jednak do tematu typowo chemicznego - fosfor biały jest nietrwały, pod wpływem ciepła i światła żółknie. Światło dostarcza jego cząsteczkom energii potrzebnej do rozerwania jednego z wiązań i polimeryzacji w spiralnie skręcone łańcuchy lub taśmy. Materiał składający się wyłącznie z różnej długości takich łańcuchów, to fosfor czerwony
Ta odmiana jest znacznie mniej reaktywna. Topi się dopiero w temperaturze 260 °C , nie jest toksyczna i nie wywołuje oparzeń, zapala się gwałtownie powyżej temperatury topnienia lub w mieszaninach z silnymi utleniaczami, jest nierozpuszczalna w dwusiarczu węgla. Przemiana odmiany białej w czerwoną dokonuje się w wyniku silnego naświetlania lub ogrzewania w temperaturze 200 stopni przez kilka godzin. Z kolei ogrzewanie czerwonego fosforu do temperatury parowania lub sublimacji i szybkie ochłodzenia par, pozwala zamienić go w odmianę białą. Z powodu większego bezpieczeństwa ta właśnie odmiana jest najczęściej wykorzystywana, na przykład w draskach zapałek.
Jeśli jednak ogrzewanie białej formy przeciągnąć na okres dwóch tygodni w temperaturze 500 stopni, zamiast krótkich fragmentów łańcucha otrzymamy formę włóknistą, składającą się z klatkowych taśm, nazywaną fosforem fioletowym. Inną opcją jest krystalizacja roztworu fosforu w ołowiu rozgrzanym do 500 stopni. Odmiana ta jest mało reaktywna, wolno reaguje z fluorowcami, nie reaguje z silnymi zasadami.
Obliczenia teoretyczne wskazywały na możliwość stworzenia jeszcze jednej odmiany, toteż fosfor potraktowano ciśnieniem 12 tysięcy atmosfer i ogrzewano, otrzymując fosfor czarny. W tej odmianie atomy fosforu łączą się w pofałdowane arkusze, przypominające płaty blachy trapezowej, składające się z sieci o sześciokątnych oczkach. Poszczególne arkusze przyciągają się dzięki siłom Van deer Walsa, całość przypomina zatem grafit. Podobieństwo jest tym większe, że odmiana ta wykazuje cechy metaliczne, a więc dobre przewodnictwo elektryczne i cieplne. Jest to też najtrwalsza z wszystkich odmian, sublimująca dopiero powyżej 550 stopni.
To Boyle pierwszy wpadł na pomysł, aby skłonność fosforu do zapalania się pod wpływem tarcia, wykorzystać do rozniecania ognia. Jeden koniec nasmołowanej szczapy drewnianej pokrywał siarką i umieszczał na niej kawałeczek fosforu. Potarcie nim o jakąkolwiek powierzchnię powodowało zapalenie się drewienka. Bywało jednak, że szczapy zapalały się samoistnie, były nieporęcznie a fosfor kruszył się przy zapalaniu prowokując pożar. Ogółem pomysł uważany był za ciekawostkę bez zastosowania i nie przyjął się, zaś ludzie nadal używali krzesiwek.
Pierwsze zapałki wprowadził w 1805 roku Jean Chancel, asystent sławnego chemika Thenarda. Ich konstrukcja była bardzo niewygodna - drewniane patyczki nasączone woskiem, jeden koniec miały pokryte mieszaniną chloranu potasu i krochmalu. Zapalenie następowało przez zanurzenie końcówki w buteleczce ze stężonym kwasem siarkowym. Nie było to zatem przenośne źródło ognia, w dodatku kwas mógł się wylać po przewróceniu buteleczki lub pryskać podczas zapalania. W późniejszym czasie podobną koncepcję wykorzystano we flarach "Promethean" i "Vesuwius" będących grubymi patykami z impregnowanego drewna, mającymi zapewniać światło podczas robót na zewnątrz, ich główki zawierały saletrę i siarkę oraz szklaną kapsułkę z kwasem; zapalenie następowało po zgnieceniu kapsułki obcęgami.
Pierwsze zapałki w dzisiejszym rozumieniu, a więc zapalane przez potarcie, wprowadził angielski chemik John Walker, który eksperymentując z mieszaninami wybuchowymi znalazł taką, która zapalała się pod wpływem silnego zgniatania. Pokrył więc drzazgi drewniane mieszaniną chloranu potasu, siarki, trójsiarczku antymonu, gumy arabskiej i cukru, które zapalały się po silnym potarciu o papier pokryty mielonym szkłem.
Był to już znaczny postęp, lecz niestety bywało że kawałki płonącej masy tworzyły iskry, grożące zapaleniem ubrania. Nie opatentował wynalazku, dlatego już wkrótce inni wynalazcy zaczęli go ulepszać aż wreszcie w 1829 roku Samuel Jones opatentował "Lucifer match" - były to pierwsze zapałki, które zdobyły uznanie, określenie Lucifers przetrwało zresztą do dziś w Holandii i Belgii jako nazwa zapałek. Wadą ich, oprócz dosyć eksplozywnego zapalania, był niemiły zapach (niedawno znalazłem opowiadanie z końca XIX wieku gdzie bohater wspomina dziadka, zapalającego cygara za pomocą "przedpotopowych śmierdzących zapałek").
Następnym krokiem było wprowadzenie masy białego fosforu, czasem wręcz stanowiącego główny składnik, które zapalały się po potarciu o jakąkolwiek szorstką powierzchnię. Pewien typ, składający się tylko z fosforu, zapalał się nawet w pudełku, przez co przez pewien czas używano zapałek z główką w szklanej ampułce, zapalające się po jej zbiciu. Przez cały XIX wiek zapałki nie podlegały istotnym zmianom, jedynie pod koniec zaczęto nasączać drewienka ałunem, aby powstrzymać żarzenie się po zdmuchnięciu. W międzyczasie węgierski chemik Janos Irinyi wymyślił "bezgłośne zapałki" w których chloran potasu zastąpiono tlenkiem ołowiu, dzięki temu zapaleniu nie towarzyszyło słyszalne "Puf!".
Niestety trujący fosfor szybko dał o sobie znać. Już w 1845 roku pojawiają się doniesienia o zatruciach, potem stają się stosunkowo częste, wystarczyło czasem użyć zapałki zamiast wykałaczki, aby pojawiła się martwica szczęki. Potem często zdarzały się samobójstwa lub zabójstwa przy ich pomocy - pewna gazeta z 1886 roku donosiła o chłopcu, który naśladując bohaterów powieści Dumasa, otruł siostrę kulkami chleba z zeskrobanym z zapałek fosforem uroiwszy sobie, że pozbywa się w ten sposób potencjalnej współspadkobierczyni[3] Postanowiono zatem zamiast fosforu użyć siarczku fosforu, który zapalał się łatwo ale nie był trujący, lecz zapałki tego typu wprowadzono dopiero w 1895 roku. W 1905 roku, na konferencji w Bernie, wydano międzynarodowy zakaz używania pierwiastkowego fosforu w zapałkach.
Zapałki typu współczesnego, nazywane bezpiecznymi, są przykładem jednego z tych rewolucyjnych pomysłów, jakie przychodzą do głowy geniuszom. Wiemy że fosfor w zetknięciu z silnymi utleniaczami zapala się, lecz zarazem wiemy że fosfor w główce zapałki jest kłopotliwy i może prowadzić do zapalenia się jej przy byle potarciu. Szwed Erik Pasch pomyślał zatem, że jeśli fosfor jest potrzebny tylko do zainicjowania zapalenia główki zapałki ale nie jest potrzebny w niej samej, to należy go przenieść na zewnątrz. Gdy w podobnym czasie odkryto bardziej bezpieczny fosfor czerwony, wiedział że jest na dobrym tropie. Wraz z Edwardem Lundströmem sporządził masę cierną, zawierającą tłuczone szkło i fosfor. Gdy użytkownik pocierał o nią zapałkę zawierającą siarkę i chloran potasu, część mieszaniny ścierała się i pod wpływem silnego tarcia zapalała, inicjując zapalenie całej główki lecz za razem wypalając niewielką ilość fosforu w drasce. Pierwsze tego typu zapałki wprowadzono w 1847 roku.[4]
Wracając do sióstr Ansell. Gdy Rozeszła się wieść że 22-letnią kobiete skazano na powieszenie, w społeczeństwie powstało oburzenie. Słano listy do wyższych instytucji wskazując, że w rodzinie Ansell kilka osób doznało chorób psychicznych a jedna z ciotek zmarła w zakładzie dla obłąkanych[5] Obrona podsycała wrzawę w prasie. Sprawa trafiła nawet do Parlamentu, gdzie stu członków podpisało petycję w sprawie ułaskawienia. Pewien mężczyzna, który zakochał się w uwięzionej, zebrał 1000 podpisów w tej sprawie. Jednak sąd pozostawał nieugięty, zarazem nie chcąc ujawniać ustaleń z niejawnej rozprawy na której zapadł wyrok. 19 lipca 1899 Marry Ann Ansell została powieszona na dziedzińcu więzienia st. Abans.
Zbiegiem okoliczności ostatnia kobieta skazana na śmierć w Anglii, również została skazana za otrucie białym fosforem - wdowie Mary Wilson udowodniono w 1957 roku dwa morderstwa, męża i kochanka, w obu przypadkach zmarli zostawili jej spadek. Ponieważ kara śmierci niedługo po tym została wycofana, zamieniono ją jej na dożywotnie więzienie[6].
Te przypadki być może zainspirowały Agathę Christie aby wykorzystać fosfor w jednej z powieści; tytułu oczywiście nie podam ale jej to jedna z tych niezbyt uczciwych książek, gdzie do rozwiązania zagadki potrzebna jest wiedza, jakiej przeciętny czytelnik nie posiada.
Po latach wokół sprawy sióstr Ansell narastały wątpliwości, podnoszono, że mogło dojść do pomyłki sądowej zaś rzeczywistym sprawcą był narzeczony Marry, który zresztą ulotnił się zaraz na początku rozprawy. Dopiero w 2000 roku odtajniono dokumenty z tej sprawy. Podczas zamkniętej rozprawy sądowej oskarżona przyznała, że otruła siostrę dla 22 funtów z ubezpieczenia, oraz że sądziła, że śmierć w zakładzie dla umysłowo chorych nie będzie zbadana. To przesądza sprawę.
-----
Źrodła:
* http://www.stalbansreview.co.uk/nostalgia/crimelibrary/maryansell/deathbypoisoning/
* http://en.wikipedia.org/wiki/Mary_Ansell
* http://en.wikipedia.org/wiki/Phosphorus
* http://en.wikipedia.org/wiki/Allotropes_of_phosphorus
* http://en.wikipedia.org/wiki/Hennig_Brand
[1] http://de.wikipedia.org/wiki/Phosphor
[2] http://es.wikipedia.org/wiki/Intoxicaci%C3%B3n_por_f%C3%B3sforo
[3] Tygodnik Beletrystyczny i naukowy, 19 września 1886. WBC
[4] http://en.wikipedia.org/wiki/Match
[5] http://hansard.millbanksystems.com/commons/1899/jul/17/case-of-mary-ansell
[6] http://www.murderuk.com/poisoners_mary_wilson.html
Druga spośród sióstr, Marry Ann, była pokojówką. Niestety praca ta była kiepsko opłacalna i gdy zaręczyła się, zabrakło jej nawet na urzędowy ślub, kosztujący półtora szylinga - swoją drogą dobrze o nierównościach społecznych tamtych czasów świadczy, że taniej było sprawić sobie nowego służącego niż nową marynarkę. Siostry utrzymywały dobry kontakt, mimo niezbyt sprzyjającej sytuacji - jedna praktycznie uwięziona, druga na dorobku - dlatego gdy na początku marca 1899 roku 19-letnia Caroline otrzymała domowe ciasto, bardzo się ucieszyła. Był to właściwie nierówno wypieczony placek z dżemem i białym kremem. Ponieważ ciasto było dosyć duże, zjadła tylko połowę a resztą podzieliła się z pacjentami z sali. Niestety niedługo potem wszyscy poczuli pieczenie w ustach i żołądku, pojawiły się wymioty i biegunka, z czasem krwawa, o wyraźnym zapachu czosnku. Białka ich oczu przebarwiły się na żółto, i pojawiła się gorączka. U tych, którzy zjedli tylko po kęsie, objawy cofnęły się po kilku dniach, zaś najmłodsza z sióstr Ansell zapadła w śpiączkę po czym zmarła nie odzyskawszy przytomności.
W zakładzie pojawiał się w tym czasie tyfus, można by więc zrzucić winę na tą chorobę, lecz właśnie z powodu epidemii Caroline zbadano kilka dni przedtem, stwierdziwszy iż jest najzupełniej zdrowa. To wraz z podobnymi objawami u wszystkich, którzy zjedli ciasto obudziło podejrzenia. Sekcja zwłok wykazała, że ofiara zmarła wskutek podania dużej ilości białego fosforu, będącego też składnikiem trutek na szczury...
Historia odkrycia fosforu jest często podawana jako przykład wkładu alchemii w naukę średniowiecznej Europy. Jest to wkład dosyć paradoksalny, bo w dużej mierze niezamierzony. Alchemicy podążając za złudną ideą kamienia filozoficznego, panaceum czy uniwersalnego rozpuszczalnika, upatrywali celu w sprawdzaniu różnych kombinacji naturalnych surowców o pożądanych cechach i prostych działań, często zmieszanych z mistyką i magią. Brali na przykład ołów, którego pożądaną cechą był ciężar, mieszali go z siarką o kolorze żółtym, słonecznym, i srebrem mającym być nośnikiem metalicznego połysku. Wyżarzali tą mieszaninę powoli, przez czterdzieści dni, począwszy od pełni księżyca, umieszczali w "jajku filozoficznym" wygrzewali sto dni w gnoju, wystawiali na światło słońca i planet w odpowiednich kontynuacjach, mając na dzieję że po ostatecznym wyżarzeniu znajdą na dnie tygielka metaliczne, ciężkie, i słonecznie żółte złoto.
Tak się jednak nie działo, więc pomagali sobie dorzucając nieco z mieszka i prezentując potem swym sponsorom jako dowód skuteczności metody.
Często brali na warsztat ciekawie wyglądające minerały, rośliny, zwierzęta, poddawali modyfikacjom, sprawdzali właściwości i oddziaływanie. Przy tylu próbach musiały pojawiać się szczęśliwe trafy, nowe odkrycia dokonane podczas poszukiwania czegoś całkiem innego Nasz Sędziwój ogrzewając saletrę obserwował powstawanie "ducha saletrzanego" nie wiedząc że właśnie wydzielił tlen. Włoch Cascariolo wyżarzając ciężki kamień z węglem i siarką odkrył pierwszy luminofor - "kamień boloński" który wystawiony na słońce świecił w ciemnościach. W podobny sposób odkryto bizmut, uważany pierwotnie za odmianę ołowiu, i Arsen, składnik arszeniku.
Jednym z takich ciekawskich alchemików był Henning Brand z Hamburga. Jego pasją było wykorzystywanie w przemianach wody i rozpuszczalnych substancji, zapewne więc to, wraz z koncepcjami siły życiowej oraz być może teorią humorów sprawiło, że postanowił zająć się wyodrębnieniem właściwej kwintesencji z wody wydalanej przez żywy organizm - z moczu. Brand wziął mocz cielęcy, w bardzo dużej ilości, i gotował go na małym ogniu tak długo, aż pozostał mu na dnie syropowaty, pomarańczowy płyn. Ten przeniósł do retorty i ogrzewał aż do wydzielenia tłustego dymu. Zawartość retorty składała się teraz z szarej, gąbczastej masy i zebranej na dnie soli, tą ostatnią wyrzucał, zaś ciemną pozostałość wyżarzał przez kilka godzin. Trudno powiedzieć, czy oczekiwał że na dnie znajdzie błyszczące złoto, czy też że wyodrębni vis vitalis, w każdym razie w tej ostatniej fazie zauważył, że opary wydzielające się z retorty, świecą w ciemnościach. Gdy zaciekawiony otworzył pokrywkę, całe naczynie rozbłysło wewnętrznym światłem po czym pękło od wysokiej temperatury. Brand złapał jednak nieco jaśniejącego zielonkawo płynu, zestalającego się w woskowatą masę, świecącą w ciemnościach i nagle zapalającą się podczas rozdrabniania. Moment odkrycia, na obrazie Josepha Wrighta "Alchemik w poszukiwaniu kamienia filozoficznego" ozdabia nagłówek bloga.
Było to już coś wielkiego. Substancja wyszła z człowieka i samorzutnie świeciła nie wymagając naświetlania, zatem musiała posiadać jakąś wewnętrzną siłę podobną do materii płomienistej słońca, była łatwo palna, bardziej niż uważana za nośnik żywiołu ognia siarka, można by wręcz sądzić że oto właśnie siła życiowa zmaterializowana i utrwalona. Brand nazwał ją phosphoros co z grecka znaczy tyle co "nośnik światła", po czym zaczął produkować ją w większej ilości, skrzętnie utrzymując w tajemnicy recepturę. Warto zauważyć że łacińską wersją tej pierwotnej nazwy byłoby lucifer zupełnie jak imię pewnego upadłego anioła - stąd być może, wraz z trującymi właściwościami, brały się ówczesne skojarzenia z demonicznym charakterem nowej materii.
Niezwykłe właściwości substancji wzbudzały wówczas, w 1669 roku, żywe zainteresowanie; sądzono że oto alchemicy są już na dobrej drodze do ukończenia "wielkiego dzieła", toteż wielu było chętnych aby zobaczyć ów phosphoros, i kupić go, zaś Brand sprzedawał kawałki po cenach wyższych niż złoto.
Metoda której używał była jednak mało wydajna - z około 5500 litrów moczu uzyskiwał 120 gramów fosforu, nie trudno się zatem domyślić jak potwornie musiała śmierdzieć jego pracownia. Tak długo, jak tylko się dało strzegł tajemnicy, aż wreszcie sprzedał ją innemu alchemikowi za 200 talarów, ten sprzedał ją innemu i powoli zaczęły krążyć pogłoski, że substancję to można wydzielić z "czegoś co należało do ciała człowieka" Tą drogą poszedł sceptyczny alchemik Robert Boyle, który po odkryciu metody i udoskonaleniu jej przez dodatek piasku do tygla w ostatniej fazie, dokonał czegoś co dużo mówi o jego poglądach - opublikował przepis wytwarzania fosforu, tak aby mógł go przeprowadzić każdy chętny.
Boyle był krytykiem mętnych i do niczego nie prowadzących alchemicznych dociekań, atmosfery tajemnicy, widm i cieni. Opierając się na poglądach Paracelsusa na temat alchemii naturalnej, uważał że powinnością badaczy jest nie wymyślać przez nikogo nie widziane cudowne substancje, lecz badać właściwości i przemiany substancji naturalnych, aby znaleźć ich pożyteczne zastosowanie. Jego książkę "Sceptical Chymist" uważa się za początek rozwoju prawdziwej chemii.
Współcześnie możemy odtworzyć zachodzące procesy. Mocz zawiera zawsze pewną ilość fosforanów, zwykle w formie rozpuszczalnego fosforanu amonowo-sodowego. Po odparowaniu, rozłożeniu kwasu moczowego i lotnych składników, na dnie pozostawały fosforany i węgiel ze zwęglonych związków organicznych. Węgiel w wysokiej temperaturze redukował fosforan do wolnego fosforu.:
4 Na3PO4 + 4C + 6SiO2 → 6 Na2SiO4 + 4CO + P4
Ten skraplał się na ściankach naczynia. Niedługo później odkryto, że znaczne ilości fosforanu wapnia znajdują się w kościach, zaczęto więc otrzymywać fosfor z białego popiołu kostnego z całkiem niezłą wydajnością. Obecnie używa się w tym celu apatytów.
Fosfor jest to pierwiastek niemetaliczny położony w grupie V pod azotem. W temperaturze pokojowej ma postać stałą, przy czym przejawia ciekawą i stosunkowo częstą w układzie okresowym skłonność do występowania w różnych odmianach, różniących się wewnętrzną strukturą. Może tworzyć kilka odmian alotropowych, różniących się trwałością, reaktywnością i wyglądem.
Fosfor biały ma wygląd woskowatej masy, zwykle lekko żółtawej wskutek samorzutnej polimeryzacji. Jest najbardziej reaktywną formą pierwiastka, topi się w temperaturze 44 stopni, łatwo sublimuje, samorzutnie zapala się, dla większych grudek powyżej 60 stopni, dla drobnych cząstek w temperaturze pokojowej, a wreszcie świeci w ciemnościach. Aby objaśnić skąd bierze się ta reaktywność, muszę powiedzieć coś na temat geometrii wiązań w atomie.
Każdy atom może tworzyć wiązania z innymi dzięki elektronom, liczba elektronów o najniższej energii, znajdujących się na najbardziej zewnętrznych powłokach, warunkuje maksymalną możliwą ilość wiązań, jakie atom może utworzyć z innymi. Fosfor ma pięć takich elektronów, przy czym trzy są stosunkowo słabiej związane zaś dwa tworzące parę nieco mocniej. Dlatego w związkach najchętniej przyjmuje wartościowość 3+ tworząc trzy wiązania.
Każde wiązanie chemiczne jest utworzone przez elektron lub parę elektronów, związaną między atomami, przyciąganą równocześnie przez oba jądra, spajając je tym samym ze sobą. Poszczególne wiązania wokół atomu starają się przy tym być odsunięte najdalej od innych, na skutek odpychania jednakowych ładunków ujemnych, tak jak to zachodzi dla pasków papieru przyczepionych do kulistego zakończenia maszyny elektrostatycznej. Symetria rozkładu wiązań zależy więc od ich liczby. Dwa wiązania, nie ograniczone innymi czynnikami w otoczeniu, najchętniej będą tworzyły symetrię liniową, będąc ustawione po przeciwnych stronach atomu, trzy wiązania będą kierowały połączone atomy w naroża płaskiego trójkąta - tego więc można się spodziewać dla związków fosforu III. Pozostaje jednak jeszcze ta para elektronów która zaburza ten układ, dlatego w otoczeniu atomu pojawiają się cztery grupy odpychających się ładunków - trzy wiązania i jedna niewiążąca para powiązanych elektronów. Układ powinien zatem przyjąć formę tetraedryczną - to jest końce osi czterech grup stanowią naroża czworościanu foremnego, rozdzielone o kąt ok. 109,5 stopnia. W rzeczywistości czwarta grupa, czyli para dwóch elektronów, odpycha od siebie wiązania mocniej a nasz czworościan wykreślony końcami grup, przybiera postać wydłużonej piramidy o trójkątnej podstawie. Szerzej omawia to teoria VSEPR.
I co z tego? W fosforze białym atomy grupują się w cząsteczki czeroatomowe, gdzie każdy atom łączy się z trzema innymi, mające postać bryły i tą bryłą powinien być czworościan bo w tym kształcie wszystkie oddziaływania się równoważą. Gdyby trzy wiązania miały układ tetraedryczny, nie mogłyby utworzyć tej bryły, bo kąt między wiązaniami jest zbyt szeroki, powinien wynosić ok 70 stopni kątowych. Ponieważ jednak są odpychane, to przybliżają się do siebie, tworząc mniejszy kąt i struktura tetraedru staje się dla nich bardziej prawdopodobna. Kąt między wiązaniami jest bliższy potrzebnemu, ale wciąż nieco szerszy, mimo to tworzy się bryła, zaś wiązania zostają z konieczności "przygięte" . To tak jakbyśmy tworzyli modele z kulek z bolcami i słomek i dla uzyskania właściwego kształtu musielibyśmy stworzyć szkielet z wygiętymi słomkami. Taka struktura nie może być trwała, ma bowiem większą energię ( w modelu jest to siła jaką nagięliśmy słomki) a atomy będą dążyć do struktury bardziej korzystnej.
Właśnie dlatego fosfor biały jest reaktywny dążąc do rozpadu piramidalnej cząsteczki i utworzenia związku, łatwo się zapala, reaguje z metalami itd. Dlaczego jednak fosfor świeci w ciemnościach? Fosfor w dążeniu do utworzenia innych związków, utlenia się pod wpływem powietrza, zachodzi to jednak w stosunkowo niskich temperaturach. Podczas utleniania wysoka energia związana w cząsteczce wprowadza jeden z atomów reagującej cząsteczki tlenu w stan wzbudzony, z którego powraca do stanu podstawowego wypromieniowując energię w formie światła.
Po zapaleniu tworzy jasny płomień o wysokiej temperaturze, rzędu 1000-1200 stopni, spalając się z wydzieleniem białego pięciotlenku, mającego formę gęstego dymu - z tego powodu świece z fosforem bywają używane do wytworzenia sztucznej mgły. Tlenek fosforu V rozpuszcza się w wodzie dając kwas ortofosforowy, będący mocnym kwasem, dlatego też dym tlenku fosforu ma działanie drażniące na oczy i błony śluzowe. Płonącego fosforu nie powinno się gasić wodą - większe grudki będą ją rozkładały, natomiast po zalaniu większą ilością gorące bryłki fosforu rozpadną się na drobne cząstki, które po wyparowaniu wody zapłoną ponownie.
Wysoka temperatura płomienia i łatwość zapalenia powodowała, że dosyć wcześnie został wykorzystany w bombach zapalających - bomba wybuchająca nad ziemią zasypuje wówczas znaczny obszar płonącymi kroplami, wywołującymi pożary i bardzo ciężkie oparzenia, często z wżerami w głąb ciała. Część fosforu wnika wówczas w ranę wywołując rozległe martwice i śmierć w wyniku zakażeń, dlatego już dawno międzynarodowe konwencje zakazały używania tego typu broni wobec cywilów. Ostatnim głośnym przypadkiem ich złamania było użycie bomb zapalających przez wojska Izraelskie, podczas krótkotrwałej wojny z strefie Gazy w 2009 roku.
Jedną z pomysłowych konstrukcji użytych podczas II wojny światowej, były celuloidowe pakiety nasączone roztworem fosforu w dwusiarczku węgla, rozrzucane z samolotów nad miastami. Pakiet taki spadłszy na drewniany budynek, zapalał się po kilku godzinach, gdy rozpuszczalnik odparował, prowokując pożary. Pozostałości powojennych instalacji wciąż jeszcze dają o sobie znać - niedawny przypadek zanieczyszczenia plaży substancją, zapalającą się po trąceniu patykiem, okazał się skażeniem białym fosforem, być może uwolnionym z jakiejś miny która właśnie do cna przerdzewiała. W 2007 roku na Ukrainie po wypadku pociągu przewożącego wojskowe chemikalia, znaczny teren został skazony białym dymem fosforu, który zapłonął w uszkodzonych beczkach; 150 osób trafiło wtedy do szpitali.
I tak też, okrężną jak to zwykle u mnie drogą, doszedłem do kwestii szkodliwego wpływu białego fosforu na człowieka. Należy do najsilniejszych trucizn nieorganicznych, za dawkę śmiertelną uważa się 50-60 mg choć zdarzało się że już jedna trzecia tej ilości powodowała zgon. Śmierć następuje po kilku dniach. Za przyczynę toksyczności uważa się reaktywność i silną zdolność do redukcji, w efekcie fosfor po dostaniu się do komórki zaburza enzymatyczne reakcje utleniania i wytwarzania energii; zakwaszenie ma tu mniejszy wpływ. Ponieważ po wchłonięciu z jelita fosfor biały trafia żyłą wrotną do wątroby, tam głównie następują uszkodzenia, objawiające się marskością i martwicą. Zatrucie może zatem przypominać szybki atak żółtaczki wskutek mechanicznego uszkodzenia wątroby. Podobnym uszkodzeniom ulega też mięsień sercowy i ściany żył, co wraz ze spadkiem krzepliwości prowadzi do wylewów. Wytwarzający się w żołądku fosforowodór uszkadza układ nerwowy. Śmierć następuje wskutek wielonarządowej niewydolności organizmu.[1]
Narażenie na małe dawki rozwija martwicę kości, zwłaszcza szczęki, prowadząc do deformacji, rozpadu kości, tworzenia się dziur i zapalenia okostnej.
Oprócz nagłości objawów, diagnozę zatrucia można postawić też na podstawie fosforyzowania wymiocin. W pierwszych oprócz węgla aktywowanego, odtrutką może być płukanie żołądka wodą utlenioną, gdy jednak trucizna się wchłonie, leczenie może być wyłącznie objawowe. [2]
Dosyć szybko zaczęto używać fosforu, w formie nasączonych nim materiałów, do trucia szczurów i szkodników ogrodowych, powodowało to niestety wiele przypadkowych zatruć a czasem też pożary, niestety także szybko pojęto że wobec tego, fosfor jest stosunkowo łatwo dostępną trucizną na ludzi. Gazety z XIX wieku często notują samobójstwa lub morderstwa przy pomocy "roztworu z zapałek" czy "trucizny na szkodniki". Tak też było w przypadku Caroline Ansell.
Po nagłej śmierci Caroline, matka wraz ze starszą córką zjawiły się w zakładzie, chcąc przygotować się do pogrzebu, wówczas też Marry zapytała portiera kiedy będzie mogła odebrać akt zgonu siostry, ten poinstruował ją gdzie i jakie podanie musi złożyć. Gdy udała się do odpowiedniego urzędu dowiedziała się, że jeszcze nie potwierdzono przyczyny zgonu i musi poczekać. Tymczasem nadinspektor Wood, poinformowany o wyniku sekcji, zainteresował się opakowaniem ciasta. Nadawca podpisał się bardzo niewyraźnie, ale zmarła najwyraźniej uważała, że to prezent od kogoś z domu. Nie była to pierwsza taka dziwna przesyłka. Kilka tygodni wcześniej otrzymała z domu paczkę z herbatą i cukrem, jednak cukier był zawilgotniały a herbata gorzka, dlatego musiała je wyrzucić. Potem dostała list od dawnej przyjaciółki, która zawiadamiała że oboje rodzice Caroline zginęli. Ta głęboko przeżyła tą wiadomość, po czym napisała do domu list prosząc o jakąś rzecz, aby móc opłakiwać rodziców - okazało się jednak że ci żyją, a przyjaciółka nie wysyłała żadnego listu.
Inspektor zwrócił więc uwagę na Marry Ann, która zamiast smutku wyrażała raczej zniecierpliwienie. Rozpytując dowiedział się, że zaraz po przybyciu chciała otrzymać akt zgonu, zapytał więc w bankach i trafił od razu - kilka miesięcy wcześniej Marry Ann wzięła ubezpieczenie na życie siostry, twierdząc że to zabezpieczenie godnego pogrzebu. Wartość ubezpieczenia wynosiła 22,5 funta. Niedługo potem wyszło na jaw, że Marry kupiła w sklepie znaczne ilości trutki na szczury, które podobno stały się plagą w domu w którym służyła. Jej pracodawczyni zaprzeczyła. Ostatecznym dowodem było porównanie pisma na kartkach z życzeniami od siostry, paczce z ciastem i w liście od rzekomej przyjaciółki. Wszystkie napisano tą samą ręką. Niedługo sąd pierwszej instancji skazał ją na śmierć, co wywołało wielkie poruszenie w prasie.
Wracając jednak do tematu typowo chemicznego - fosfor biały jest nietrwały, pod wpływem ciepła i światła żółknie. Światło dostarcza jego cząsteczkom energii potrzebnej do rozerwania jednego z wiązań i polimeryzacji w spiralnie skręcone łańcuchy lub taśmy. Materiał składający się wyłącznie z różnej długości takich łańcuchów, to fosfor czerwony
Fosfor biały dla bezpieczeństwa trzymany w wodzie i fosfor czerwony
Ta odmiana jest znacznie mniej reaktywna. Topi się dopiero w temperaturze 260 °C , nie jest toksyczna i nie wywołuje oparzeń, zapala się gwałtownie powyżej temperatury topnienia lub w mieszaninach z silnymi utleniaczami, jest nierozpuszczalna w dwusiarczu węgla. Przemiana odmiany białej w czerwoną dokonuje się w wyniku silnego naświetlania lub ogrzewania w temperaturze 200 stopni przez kilka godzin. Z kolei ogrzewanie czerwonego fosforu do temperatury parowania lub sublimacji i szybkie ochłodzenia par, pozwala zamienić go w odmianę białą. Z powodu większego bezpieczeństwa ta właśnie odmiana jest najczęściej wykorzystywana, na przykład w draskach zapałek.
Jeśli jednak ogrzewanie białej formy przeciągnąć na okres dwóch tygodni w temperaturze 500 stopni, zamiast krótkich fragmentów łańcucha otrzymamy formę włóknistą, składającą się z klatkowych taśm, nazywaną fosforem fioletowym. Inną opcją jest krystalizacja roztworu fosforu w ołowiu rozgrzanym do 500 stopni. Odmiana ta jest mało reaktywna, wolno reaguje z fluorowcami, nie reaguje z silnymi zasadami.
Obliczenia teoretyczne wskazywały na możliwość stworzenia jeszcze jednej odmiany, toteż fosfor potraktowano ciśnieniem 12 tysięcy atmosfer i ogrzewano, otrzymując fosfor czarny. W tej odmianie atomy fosforu łączą się w pofałdowane arkusze, przypominające płaty blachy trapezowej, składające się z sieci o sześciokątnych oczkach. Poszczególne arkusze przyciągają się dzięki siłom Van deer Walsa, całość przypomina zatem grafit. Podobieństwo jest tym większe, że odmiana ta wykazuje cechy metaliczne, a więc dobre przewodnictwo elektryczne i cieplne. Jest to też najtrwalsza z wszystkich odmian, sublimująca dopiero powyżej 550 stopni.
To Boyle pierwszy wpadł na pomysł, aby skłonność fosforu do zapalania się pod wpływem tarcia, wykorzystać do rozniecania ognia. Jeden koniec nasmołowanej szczapy drewnianej pokrywał siarką i umieszczał na niej kawałeczek fosforu. Potarcie nim o jakąkolwiek powierzchnię powodowało zapalenie się drewienka. Bywało jednak, że szczapy zapalały się samoistnie, były nieporęcznie a fosfor kruszył się przy zapalaniu prowokując pożar. Ogółem pomysł uważany był za ciekawostkę bez zastosowania i nie przyjął się, zaś ludzie nadal używali krzesiwek.
Pierwsze zapałki wprowadził w 1805 roku Jean Chancel, asystent sławnego chemika Thenarda. Ich konstrukcja była bardzo niewygodna - drewniane patyczki nasączone woskiem, jeden koniec miały pokryte mieszaniną chloranu potasu i krochmalu. Zapalenie następowało przez zanurzenie końcówki w buteleczce ze stężonym kwasem siarkowym. Nie było to zatem przenośne źródło ognia, w dodatku kwas mógł się wylać po przewróceniu buteleczki lub pryskać podczas zapalania. W późniejszym czasie podobną koncepcję wykorzystano we flarach "Promethean" i "Vesuwius" będących grubymi patykami z impregnowanego drewna, mającymi zapewniać światło podczas robót na zewnątrz, ich główki zawierały saletrę i siarkę oraz szklaną kapsułkę z kwasem; zapalenie następowało po zgnieceniu kapsułki obcęgami.
Pierwsze zapałki w dzisiejszym rozumieniu, a więc zapalane przez potarcie, wprowadził angielski chemik John Walker, który eksperymentując z mieszaninami wybuchowymi znalazł taką, która zapalała się pod wpływem silnego zgniatania. Pokrył więc drzazgi drewniane mieszaniną chloranu potasu, siarki, trójsiarczku antymonu, gumy arabskiej i cukru, które zapalały się po silnym potarciu o papier pokryty mielonym szkłem.
Był to już znaczny postęp, lecz niestety bywało że kawałki płonącej masy tworzyły iskry, grożące zapaleniem ubrania. Nie opatentował wynalazku, dlatego już wkrótce inni wynalazcy zaczęli go ulepszać aż wreszcie w 1829 roku Samuel Jones opatentował "Lucifer match" - były to pierwsze zapałki, które zdobyły uznanie, określenie Lucifers przetrwało zresztą do dziś w Holandii i Belgii jako nazwa zapałek. Wadą ich, oprócz dosyć eksplozywnego zapalania, był niemiły zapach (niedawno znalazłem opowiadanie z końca XIX wieku gdzie bohater wspomina dziadka, zapalającego cygara za pomocą "przedpotopowych śmierdzących zapałek").
Następnym krokiem było wprowadzenie masy białego fosforu, czasem wręcz stanowiącego główny składnik, które zapalały się po potarciu o jakąkolwiek szorstką powierzchnię. Pewien typ, składający się tylko z fosforu, zapalał się nawet w pudełku, przez co przez pewien czas używano zapałek z główką w szklanej ampułce, zapalające się po jej zbiciu. Przez cały XIX wiek zapałki nie podlegały istotnym zmianom, jedynie pod koniec zaczęto nasączać drewienka ałunem, aby powstrzymać żarzenie się po zdmuchnięciu. W międzyczasie węgierski chemik Janos Irinyi wymyślił "bezgłośne zapałki" w których chloran potasu zastąpiono tlenkiem ołowiu, dzięki temu zapaleniu nie towarzyszyło słyszalne "Puf!".
Niestety trujący fosfor szybko dał o sobie znać. Już w 1845 roku pojawiają się doniesienia o zatruciach, potem stają się stosunkowo częste, wystarczyło czasem użyć zapałki zamiast wykałaczki, aby pojawiła się martwica szczęki. Potem często zdarzały się samobójstwa lub zabójstwa przy ich pomocy - pewna gazeta z 1886 roku donosiła o chłopcu, który naśladując bohaterów powieści Dumasa, otruł siostrę kulkami chleba z zeskrobanym z zapałek fosforem uroiwszy sobie, że pozbywa się w ten sposób potencjalnej współspadkobierczyni[3] Postanowiono zatem zamiast fosforu użyć siarczku fosforu, który zapalał się łatwo ale nie był trujący, lecz zapałki tego typu wprowadzono dopiero w 1895 roku. W 1905 roku, na konferencji w Bernie, wydano międzynarodowy zakaz używania pierwiastkowego fosforu w zapałkach.
Zapałki typu współczesnego, nazywane bezpiecznymi, są przykładem jednego z tych rewolucyjnych pomysłów, jakie przychodzą do głowy geniuszom. Wiemy że fosfor w zetknięciu z silnymi utleniaczami zapala się, lecz zarazem wiemy że fosfor w główce zapałki jest kłopotliwy i może prowadzić do zapalenia się jej przy byle potarciu. Szwed Erik Pasch pomyślał zatem, że jeśli fosfor jest potrzebny tylko do zainicjowania zapalenia główki zapałki ale nie jest potrzebny w niej samej, to należy go przenieść na zewnątrz. Gdy w podobnym czasie odkryto bardziej bezpieczny fosfor czerwony, wiedział że jest na dobrym tropie. Wraz z Edwardem Lundströmem sporządził masę cierną, zawierającą tłuczone szkło i fosfor. Gdy użytkownik pocierał o nią zapałkę zawierającą siarkę i chloran potasu, część mieszaniny ścierała się i pod wpływem silnego tarcia zapalała, inicjując zapalenie całej główki lecz za razem wypalając niewielką ilość fosforu w drasce. Pierwsze tego typu zapałki wprowadzono w 1847 roku.[4]
Reklama bezpiecznych zapałek z 1911 roku
Zbiegiem okoliczności ostatnia kobieta skazana na śmierć w Anglii, również została skazana za otrucie białym fosforem - wdowie Mary Wilson udowodniono w 1957 roku dwa morderstwa, męża i kochanka, w obu przypadkach zmarli zostawili jej spadek. Ponieważ kara śmierci niedługo po tym została wycofana, zamieniono ją jej na dożywotnie więzienie[6].
Te przypadki być może zainspirowały Agathę Christie aby wykorzystać fosfor w jednej z powieści; tytułu oczywiście nie podam ale jej to jedna z tych niezbyt uczciwych książek, gdzie do rozwiązania zagadki potrzebna jest wiedza, jakiej przeciętny czytelnik nie posiada.
Po latach wokół sprawy sióstr Ansell narastały wątpliwości, podnoszono, że mogło dojść do pomyłki sądowej zaś rzeczywistym sprawcą był narzeczony Marry, który zresztą ulotnił się zaraz na początku rozprawy. Dopiero w 2000 roku odtajniono dokumenty z tej sprawy. Podczas zamkniętej rozprawy sądowej oskarżona przyznała, że otruła siostrę dla 22 funtów z ubezpieczenia, oraz że sądziła, że śmierć w zakładzie dla umysłowo chorych nie będzie zbadana. To przesądza sprawę.
-----
Źrodła:
* http://www.stalbansreview.co.uk/nostalgia/crimelibrary/maryansell/deathbypoisoning/
* http://en.wikipedia.org/wiki/Mary_Ansell
* http://en.wikipedia.org/wiki/Phosphorus
* http://en.wikipedia.org/wiki/Allotropes_of_phosphorus
* http://en.wikipedia.org/wiki/Hennig_Brand
[1] http://de.wikipedia.org/wiki/Phosphor
[2] http://es.wikipedia.org/wiki/Intoxicaci%C3%B3n_por_f%C3%B3sforo
[3] Tygodnik Beletrystyczny i naukowy, 19 września 1886. WBC
[4] http://en.wikipedia.org/wiki/Match
[5] http://hansard.millbanksystems.com/commons/1899/jul/17/case-of-mary-ansell
[6] http://www.murderuk.com/poisoners_mary_wilson.html
Subskrybuj:
Komentarze (Atom)