Dawno, dawno temu za wieloma latami, uczyłem się bioanalizy i jednym z ćwiczeń było identyfikowanie szczepów bakterii przy pomocy szeregu podłóż różnicujących. Szereg w całości omówię kiedy indziej, natomiast teraz na szybko opowiem o jednym podłożu - agarze TSI czyli trójcukrowy żelazowy.
Jest to podłoże produkowane w formie słupkoskosu - próbówka w części napełniona w całym przekroju, jest to tzw. "słupek", a w części napełniona ukośnie:
Podłoże zawiera barwnik czerwień fenolową, siarczan żelaza, tiosiarczan sodu oraz cukry: laktozę, glukozę i sacharozę. Rozróżnianie bakterii opiera się na strasznie prostej zasadzie - czy bakteria metabolizuje cukry i które i czy przerabia tiosiarczany na siarczki.
Metabolizowanie cukrów powoduje powstanie kwaśnych metabolitów, pod wpływem których czerwień fenolowa robi się żółta. jeśli bakteria fermentuje glukozę, podłoże początkowo będzie żółte, lecz ulatnianie kwaśnych produktów ze skosu spowoduje, że będzie on czerwony a słupek zółty. Metabolizowanie laktozy daje żółte zabarwienie obu części
Jeśli bakteria metabolizuje tiosiarczan do siarkowodoru, zareaguje on z żelazem, dając czarny osad siarczku żelaza. W przypadku badanego szczepu wynik był następujący:
Zmieniona barwa słupka - zatem bakteria metabolizująca glukozę, zapewne enterobakteria. Czarny pierścień - zatem metabolizuje tiosiarczany. W tym przypadku była to salmonella, być może serotypu Typhi, już nie pamiętam.
A teraz na parę dni wyjeżdżam na zlot astronomiczny. Życzcie mi dobrej pogody.
informacje
czwartek, 14 sierpnia 2014
czwartek, 7 sierpnia 2014
Kwas co ma gaz
W letnie, upalne dni, najchętniej nic byśmy nie robili, tylko leżeli w cieniu i popijali coś chłodnego. Na przykład wodę. Taką gazowaną, z bąbelkami i szczypiącym, kwaśnym posmaku. I być może czasem zastanowi nas, jaki to gaz i jaki kwas...
Dwutlenek węgla jest bezbarwnym i w zasadzie bezwonnym gazem cięższym od powietrza, stanowiącym stale niewielki procent składu atmosfery. Został odkryty dosyć wcześnie - już w XVII wieku van Helmont zauważył, że jeśli masa popiołu po spaleniu węgla jest znacząco mniejsza od pierwotnej masy, to reszta musi ulegać zamianie w formę gazową. Ówcześni identyfikowali go z flogistonem - pierwiastkiem palności - i dalej się tą sprawą nie zajmowano. Dopiero w 1750 roku szkocki lekarz Joseph Black, znany też z badań nad ciepłem utajonym, poddał badaniom gaz powstający z potraktowania wapienia kwasem, stwierdzając, że jest różny od powietrza, ciężki i duszący, oraz że wytrąca osad z roztworu wapna gaszonego. Korzystając z tej ostatniej reakcji, stwierdził że występuje normalnie w powietrzu i w większych ilościach w tchnieniu zwierząt i ludzi. Późniejsi badacze doszli do tego, że gaz jest połączeniem tlenu i węgla i że reakcję czasem można odwrócić (przy spalaniu magnezu w dwutlenku węgla powstaje sadza), jednak dla nas istotniejsze jest odkrycie Josepha Priestly'a, trochę teologa a trochę przyrodnika-hobbysty, który badając przebieg fermentacji w miejscowym browarze, zainteresował się "zastałym powietrzem" - warstwą gazową nad fermentującą kadzią, uważaną za pracowników za niezdrową i od której zdychały myszy jeśli dostały się pod jej wpływ.
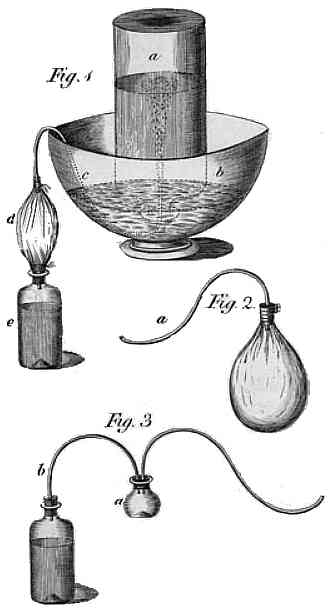
Eksperymentując, umieścił nad kadzią miskę z wodą, chcąc sprawdzić rozpuszczalność tego gazu. Po zlaniu musującego roztworu stwierdził, że woda nabrała przyjemnego, lekko kwaśnego posmaku, a nawet dał go spróbować znajomym, twierdząc że to orzeźwiający napój bez alkoholu. Kilka lat później opisał go w artykule, dodając przepis na sztuczne otrzymanie - po zwilżeniu kredy kwasem siarkowym, powstający gaz przeprowadzał rurką do wody i po przepuszczeniu większej ilości otrzymywał napój, który uważał za bardzo podobny do naturalnych wód mineralnych i polecał na szkorbut. W zasadzie jednak nie traktował odkrycia inaczej jak ciekawostki i nie sądził, że znajdzie zastosowanie. Tymczasem producenci wód mineralnych powinni mu postawić pomnik - odkrycie, że zwykła woda staje się smacznym napojem po rozpuszczeniu w niej pospolitego gazu, do dziś przynosi im ogromne zyski.
Pierwszym, który wpadł na to, że jest to znakomity pomysł na interes, był niejako Jacob Schweppe, który w roku 1783 założył firmę Schweppes, istniejącą zresztą do dziś, produkując wody gazowane mające naśladować wody mineralne z naturalnych źródeł. Nieco później dla polepszenia smaku, do nagazowanej wody zaczęto dodawać nieco sody oczyszczonej, tworząc napój nazywany odtąd wodą sodową. I tak zaczął się przemysł napojów gazowanych.
Szybko jednak chemicy zaczęli się zastanawiać, dlaczego po rozpuszczeniu gazu, woda staje się kwaśna. Musi powstawać jakiś kwas - uznali - i nazwali go kwasem węglowym. W polskiej nomenklaturze dwutlenek węgla zaczął być z tego powodu nazywany niedokwasem węglowym. Taki też stan rzeczy trwał przez długi czas, aż zaczęły się problemy z wyizolowaniem czy choćby wykryciem tego kwasu w wodzie. Badania absorpcji w podczerwieni nie wykryły aby występował w choćby najbardziej nasyconych roztworach. W zamian za to wykrywano jony węglanowe i wodorowęglanowe, stąd też powstała koncepcja wedle której kwas węglowy nie istnieje. Jeszcze ja w technikum byłem upominany aby nie zapisywać jego cząsteczki w równaniu rozpuszczania dwutlenku węgla.
Jest to w pewnym stopniu podobna sytuacja jak z "wodorotlenkiem amonu". Rozpuszczenie amoniaku w wodzie da nam roztwór o zasadowym odczynie, toteż postulowano powstawanie w wodzie wodorotlenku amonu i przez długi czas zapisywano go w ten sposób. Dopiero potem dokładne badania wykazały, że cząsteczka taka nie powstaje - woda wymienia się protonem z amoniakiem, i tworzy się osobny jon wodorotlenkowy i osobny amonowy pozostające w równowadze. Wydawało się zatem, że tu jest podobnie - dwutlenek łączy się z wodą biorąc tlen i wodór do utworzenia jonu wodorowęglanowego, a pozostawiając wolny kation wodorowy; wodorowęglan dysocjuje dalej do anionu węglanowego, zaś kwas węglowy się nie tworzy. I wszystko było w porządku aż nie odkryto, że pogłoski o jego śmierci są mocno przesadzone.
Aby otrzymać czysty i stabilny kwas węglowy, należało zastosować dość specyficzne warunki - mieszaninę wody i dwutlenku węgla zamrożono i umieszczono pod niskim ciśnieniem, po czym napromieniowano - promieniowanie pozwoliło na połączenie dwóch różnych cząsteczek bez ogrzewania. Następnie zastosowano sublimację wody pod niskim ciśnieniem, otrzymując czysty, suchy związek.
Jak się okazało, bezwodny kwas węglowy jest dosyć trwały - obliczenia teoretyczne pokazały że czas połowicznego rozkładu to ponad sto tysięcy lat, ale śladowe ilości wody przyśpieszają ten rozkład gwałtownie, nawet milion razy[1].
Udało się także otrzymać gazowy kwas węglowy, trwały do temperatury -30 stopni, który w takiej fazie chętnie tworzy trwalszy dimer[2]
Skoro kwas ten istnieje, to jak jest z jego obecnością w wodzie mineralnej?
Gdy tylko zaczynamy nasycać wodę dwutlenkiem węgla, zaczyna on być hydratowany. W takiej formie każda cząsteczka tlenku zostaje otoczona cząsteczkami wody, lecz nie następuje pomiędzy nimi reakcja. Ilość rozpuszczającego się w ten sposób gazu zależy od ciśnienia - im wyższe, tym lepsza rozpuszczalność. W takiej formie występuje około 99% rozpuszczonego w wodzie związku.
Część jednak reaguje z wodą dając jako produkt przejściowy kwas węglowy:
Jon wodorowęglanowy może ulegać dalszej dysocjacji, rozpadając się na jon węglanowy:
Wszystkie te procesy są procesami równowagowymi, toteż zachodzą równocześnie w obie strony, choć z różną szybkością, a obserwowany stan jest wypadkową różnie szybkich równoczesnych reakcji. Można to porównać do szeregu naczyń do których woda może wpływać i wypływać, aż zależnie od szybkości wypływu i dopływu stabilizuje się na pewnym poziomie.
Gdy zaczniemy wprowadzać dwutlenek węgla do wody, będzie to czynił niechętnie, jednak gdy się rozpuści większość będzie występować w formie zhydratowanej. Z tej ilości pewna część będzie zamieniać się w kwas węglowy. Ten ma dwie możliwe drogi rozpadu - albo zamieni się z powrotem w dwutlenek węgla, co czyni chętnie, albo w wodorowęglan, co czyni równie szybko. To że w ogóle występuje w roztworze jest wynikiem tego, że wszystkie procesy są pewnymi równowagami odwracalnych reakcji - większe ciśnienie gazu naprodukuje więcej kwasu węglowego który natychmiast rozpada się w wodorowęglan; obniżenie ciśnienia powoduje rozpad obecnego kwasu węglowego ale jest on odtwarzany z wodorowęglanów.
Pod ciśnieniem atmosferycznym w wodzie pozostającej w kontakcie z dwutlenkiem węgla, może się rozpuścić ok. 0,1 mmol, z czego 1% przechodzi w wodorowęglan a 0,01% w kwas węglowy. Jonów węglanowych powstają niewykrywalne ilości. Roztwór taki ma pH=5,6 zatem jest lekko kwaskowaty. Pod ciśnieniem ok. 1-2 atmosfer, jakie to ciśnienia są stosowane w butelkowanej wodzie mineralnej, rozpuszcza się 8,5 mmol gazu, z czego 1% ma postać wodorowęglanu i niemal tyle samo formę kwasu węglowego. Roztwór taki ma pH =3,5 a więc podobne do soku pomarańczowego.
Co więc z tego wynika ostatecznie? Większość rozpuszczonego dwutlenku węgla występuje w wodzie w formie zhydratowanej obojętnej cząsteczki, a z pozostałej części większość w formie wodorowęglanów. A kwas? Występuje ale jako dynamiczna faza przejściowa - nieustannie tworzy się i rozpada istniejąc w ilościach tak niewielkich, że nieistotnych dla określenia kwasowości i trudnych do wykrycia. Ale jest.
------
* http://en.wikipedia.org/wiki/Carbonic_acid
* http://de.wikipedia.org/wiki/Kohlens%C3%A4ure
* http://en.wikipedia.org/wiki/Carbonated_water
* http://en.wikipedia.org/wiki/Joseph_Priestley
[1] Thomas Loerting, Christofer Tautermann, Romano T. Kroemer, Ingrid Kohl , Andreas Hallbrucker , Erwin Mayer. and Klaus R. Liedl, On the Surprising Kinetic Stability of Carbonic Acid (H2CO3), Angewandte Chemie International Edition Volume 39, Issue 5, pages 891–894, March 3, 2000
Dwutlenek węgla jest bezbarwnym i w zasadzie bezwonnym gazem cięższym od powietrza, stanowiącym stale niewielki procent składu atmosfery. Został odkryty dosyć wcześnie - już w XVII wieku van Helmont zauważył, że jeśli masa popiołu po spaleniu węgla jest znacząco mniejsza od pierwotnej masy, to reszta musi ulegać zamianie w formę gazową. Ówcześni identyfikowali go z flogistonem - pierwiastkiem palności - i dalej się tą sprawą nie zajmowano. Dopiero w 1750 roku szkocki lekarz Joseph Black, znany też z badań nad ciepłem utajonym, poddał badaniom gaz powstający z potraktowania wapienia kwasem, stwierdzając, że jest różny od powietrza, ciężki i duszący, oraz że wytrąca osad z roztworu wapna gaszonego. Korzystając z tej ostatniej reakcji, stwierdził że występuje normalnie w powietrzu i w większych ilościach w tchnieniu zwierząt i ludzi. Późniejsi badacze doszli do tego, że gaz jest połączeniem tlenu i węgla i że reakcję czasem można odwrócić (przy spalaniu magnezu w dwutlenku węgla powstaje sadza), jednak dla nas istotniejsze jest odkrycie Josepha Priestly'a, trochę teologa a trochę przyrodnika-hobbysty, który badając przebieg fermentacji w miejscowym browarze, zainteresował się "zastałym powietrzem" - warstwą gazową nad fermentującą kadzią, uważaną za pracowników za niezdrową i od której zdychały myszy jeśli dostały się pod jej wpływ.
Wytwarzanie wody sodowej - rysunek Priestley'a z 1772 roku
Eksperymentując, umieścił nad kadzią miskę z wodą, chcąc sprawdzić rozpuszczalność tego gazu. Po zlaniu musującego roztworu stwierdził, że woda nabrała przyjemnego, lekko kwaśnego posmaku, a nawet dał go spróbować znajomym, twierdząc że to orzeźwiający napój bez alkoholu. Kilka lat później opisał go w artykule, dodając przepis na sztuczne otrzymanie - po zwilżeniu kredy kwasem siarkowym, powstający gaz przeprowadzał rurką do wody i po przepuszczeniu większej ilości otrzymywał napój, który uważał za bardzo podobny do naturalnych wód mineralnych i polecał na szkorbut. W zasadzie jednak nie traktował odkrycia inaczej jak ciekawostki i nie sądził, że znajdzie zastosowanie. Tymczasem producenci wód mineralnych powinni mu postawić pomnik - odkrycie, że zwykła woda staje się smacznym napojem po rozpuszczeniu w niej pospolitego gazu, do dziś przynosi im ogromne zyski.
Pierwszym, który wpadł na to, że jest to znakomity pomysł na interes, był niejako Jacob Schweppe, który w roku 1783 założył firmę Schweppes, istniejącą zresztą do dziś, produkując wody gazowane mające naśladować wody mineralne z naturalnych źródeł. Nieco później dla polepszenia smaku, do nagazowanej wody zaczęto dodawać nieco sody oczyszczonej, tworząc napój nazywany odtąd wodą sodową. I tak zaczął się przemysł napojów gazowanych.
Szybko jednak chemicy zaczęli się zastanawiać, dlaczego po rozpuszczeniu gazu, woda staje się kwaśna. Musi powstawać jakiś kwas - uznali - i nazwali go kwasem węglowym. W polskiej nomenklaturze dwutlenek węgla zaczął być z tego powodu nazywany niedokwasem węglowym. Taki też stan rzeczy trwał przez długi czas, aż zaczęły się problemy z wyizolowaniem czy choćby wykryciem tego kwasu w wodzie. Badania absorpcji w podczerwieni nie wykryły aby występował w choćby najbardziej nasyconych roztworach. W zamian za to wykrywano jony węglanowe i wodorowęglanowe, stąd też powstała koncepcja wedle której kwas węglowy nie istnieje. Jeszcze ja w technikum byłem upominany aby nie zapisywać jego cząsteczki w równaniu rozpuszczania dwutlenku węgla.
Jest to w pewnym stopniu podobna sytuacja jak z "wodorotlenkiem amonu". Rozpuszczenie amoniaku w wodzie da nam roztwór o zasadowym odczynie, toteż postulowano powstawanie w wodzie wodorotlenku amonu i przez długi czas zapisywano go w ten sposób. Dopiero potem dokładne badania wykazały, że cząsteczka taka nie powstaje - woda wymienia się protonem z amoniakiem, i tworzy się osobny jon wodorotlenkowy i osobny amonowy pozostające w równowadze. Wydawało się zatem, że tu jest podobnie - dwutlenek łączy się z wodą biorąc tlen i wodór do utworzenia jonu wodorowęglanowego, a pozostawiając wolny kation wodorowy; wodorowęglan dysocjuje dalej do anionu węglanowego, zaś kwas węglowy się nie tworzy. I wszystko było w porządku aż nie odkryto, że pogłoski o jego śmierci są mocno przesadzone.
Aby otrzymać czysty i stabilny kwas węglowy, należało zastosować dość specyficzne warunki - mieszaninę wody i dwutlenku węgla zamrożono i umieszczono pod niskim ciśnieniem, po czym napromieniowano - promieniowanie pozwoliło na połączenie dwóch różnych cząsteczek bez ogrzewania. Następnie zastosowano sublimację wody pod niskim ciśnieniem, otrzymując czysty, suchy związek.
Jak się okazało, bezwodny kwas węglowy jest dosyć trwały - obliczenia teoretyczne pokazały że czas połowicznego rozkładu to ponad sto tysięcy lat, ale śladowe ilości wody przyśpieszają ten rozkład gwałtownie, nawet milion razy[1].
Udało się także otrzymać gazowy kwas węglowy, trwały do temperatury -30 stopni, który w takiej fazie chętnie tworzy trwalszy dimer[2]
Skoro kwas ten istnieje, to jak jest z jego obecnością w wodzie mineralnej?
Gdy tylko zaczynamy nasycać wodę dwutlenkiem węgla, zaczyna on być hydratowany. W takiej formie każda cząsteczka tlenku zostaje otoczona cząsteczkami wody, lecz nie następuje pomiędzy nimi reakcja. Ilość rozpuszczającego się w ten sposób gazu zależy od ciśnienia - im wyższe, tym lepsza rozpuszczalność. W takiej formie występuje około 99% rozpuszczonego w wodzie związku.
Część jednak reaguje z wodą dając jako produkt przejściowy kwas węglowy:
CO2 + H2O → H2CO3
Jak wykazały badania, związek ten bardzo szybko i łatwo odszczepia jeden proton, przechodząc w jon wodorowęglanowy. Stała równowagi pokazuje, że kwas ten jest nawet mocniejszy od cytrynowego. Silne przesunięcie równowagi w stronę wodorowęglanów powoduje jednak, że niemal natychmiast prawie cały powstający kwas węglowy zamienia się w tą formę:
H2CO3  HCO3− + H+
HCO3− + H+
Jon wodorowęglanowy może ulegać dalszej dysocjacji, rozpadając się na jon węglanowy:
HCO3−  CO32− + H+
CO32− + H+
Jednak reakcja ta następuje powoli, i zaczyna nabierać znaczenia w warunkach silnie zasadowych.Wszystkie te procesy są procesami równowagowymi, toteż zachodzą równocześnie w obie strony, choć z różną szybkością, a obserwowany stan jest wypadkową różnie szybkich równoczesnych reakcji. Można to porównać do szeregu naczyń do których woda może wpływać i wypływać, aż zależnie od szybkości wypływu i dopływu stabilizuje się na pewnym poziomie.
Gdy zaczniemy wprowadzać dwutlenek węgla do wody, będzie to czynił niechętnie, jednak gdy się rozpuści większość będzie występować w formie zhydratowanej. Z tej ilości pewna część będzie zamieniać się w kwas węglowy. Ten ma dwie możliwe drogi rozpadu - albo zamieni się z powrotem w dwutlenek węgla, co czyni chętnie, albo w wodorowęglan, co czyni równie szybko. To że w ogóle występuje w roztworze jest wynikiem tego, że wszystkie procesy są pewnymi równowagami odwracalnych reakcji - większe ciśnienie gazu naprodukuje więcej kwasu węglowego który natychmiast rozpada się w wodorowęglan; obniżenie ciśnienia powoduje rozpad obecnego kwasu węglowego ale jest on odtwarzany z wodorowęglanów.
Pod ciśnieniem atmosferycznym w wodzie pozostającej w kontakcie z dwutlenkiem węgla, może się rozpuścić ok. 0,1 mmol, z czego 1% przechodzi w wodorowęglan a 0,01% w kwas węglowy. Jonów węglanowych powstają niewykrywalne ilości. Roztwór taki ma pH=5,6 zatem jest lekko kwaskowaty. Pod ciśnieniem ok. 1-2 atmosfer, jakie to ciśnienia są stosowane w butelkowanej wodzie mineralnej, rozpuszcza się 8,5 mmol gazu, z czego 1% ma postać wodorowęglanu i niemal tyle samo formę kwasu węglowego. Roztwór taki ma pH =3,5 a więc podobne do soku pomarańczowego.
Co więc z tego wynika ostatecznie? Większość rozpuszczonego dwutlenku węgla występuje w wodzie w formie zhydratowanej obojętnej cząsteczki, a z pozostałej części większość w formie wodorowęglanów. A kwas? Występuje ale jako dynamiczna faza przejściowa - nieustannie tworzy się i rozpada istniejąc w ilościach tak niewielkich, że nieistotnych dla określenia kwasowości i trudnych do wykrycia. Ale jest.
------
* http://en.wikipedia.org/wiki/Carbonic_acid
* http://de.wikipedia.org/wiki/Kohlens%C3%A4ure
* http://en.wikipedia.org/wiki/Carbonated_water
* http://en.wikipedia.org/wiki/Joseph_Priestley
[1] Thomas Loerting, Christofer Tautermann, Romano T. Kroemer, Ingrid Kohl , Andreas Hallbrucker , Erwin Mayer. and Klaus R. Liedl, On the Surprising Kinetic Stability of Carbonic Acid (H2CO3), Angewandte Chemie International Edition Volume 39, Issue 5, pages 891–894, March 3, 2000
[2] Hinrich Grothe et al., Spectroscopic Observation of Matrix-Isolated Carbonic Acid Trapped from the Gas Phase, Angewandte Chemie International Edition Volume 50, Issue 8, pages 1939–1943, February 18, 2011
niedziela, 27 lipca 2014
Poison Story (6.) - Co za dużo, to nie zdrowo
Gdy w 2007 roku stacja radiowa KDND ogłosiła konkurs, w którym do wygrania była najnowsza konsola wideo, zgłosiło się wielu chętnych. Konsola Wii była bardzo popularna, ale najnowszego modelu, kosztującego 250 dolarów, praktycznie nie dało się kupić w amerykańskich sklepach, dlatego możliwość wygrania jej w śmiesznym konkursie była bardzo kusząca. Zgłosiło się kilkanaście osób, w tym 28-letnia Jennifer Strange, matka trójki dzieci, która jak mówiła przed konkursem, chce zdobyć tą konsolę dla nich.
Konkurs "Hold Your Wee of a Wii" był bardzo prosty - wygrywał ten, kto wypije jak najwięcej wody i się nie posika. W innych podobnych konkursach dawano zadania w rodzaju zjedzenia jak największej ilości pączków czy hamburgerów, więc to wydawało się prostym zadaniem. Przygotowano każdemu uczestnikowi małe, ćwierćlitrowe buteleczki wody. Mieli pić po jednej w odstępie dziesięciu minut oraz w każdej chwili mogli zrezygnować, jeśli uznali, że to dla nich zbyt dużo, ale nie mogli wychodzić do łazienki.
Konkurs rozpoczęto nad ranem, nadając relację na antenie. Było wesoło, a kolejne butelki znikały w szybkim tempie. Ktoś się wykruszył po pięciu, ktoś po ośmiu.
W trakcie trwania konkursu, do radia zadzwoniła pielęgniarka, stwierdzając że jego idea jest oburzająca i niebezpieczna, bo ktoś może umrzeć. Prezenter odpowiedział że wiedzą ale wszystko jest pod kontrolą, zresztą uczestnicy podpisali dokument że zgadzają się na ryzyko, więc nie ma się co czepiać. Gdy kolejny słuchacz zaniepokojony konkursem zadzwonił z ostrzeżeniem, rozbawiony prezenter wyjrzał na salę i zawołał "Czy ktoś tam może umiera?". Prezenter wyjaśnił też że ciało składa się w 90% z wody, więc można jej pić ile się chce.
Gdy minęła pierwsza godzina, uczestnikom dano większe, półlitrowe butelki. To wtedy zrezygnowało najwięcej osób. Niektórzy źle się czuli, ktoś zwymiotował do wiadra, ktoś inny stwierdził że jest mu zimno i zaczął drżeć. Jednak dwie zawodniczki okazały się bardzo wytrwałe. Jennifer wypiła już osiem małych butelek i dziesięć większych, łącznie mieszcząc w sobie ponad sześć litrów wody, gdy stwierdziła że brzuch już ją boli, i głowa. Zrezygnowała zajmując drugie miejsce i otrzymując w nagrodę bilety na koncert. Przebiła ją kobieta, która wypiła o pół butelki więcej.
Gdy konkurs się już skończył, DJ zażartował, że brzuch Jennifer wygląda jakby była w ciąży. Przed wręczeniem nagród zawodniczki poszły do łazienki gdzie wysikały się i zwymiotowały. Następnie gorąco je pożegnano i odesłano do domu. Po drodze Jennifer zadzwoniła do współpracownika aby opowiedzieć o konkursie. Skarżyła się wtedy na silny ból głowy. W domu ból głowy się nasilił. Do objawów doszły zapewne też nudności i osłabienie. Po południu zaniepokojona matka odnajduje ją martwą.
Wynik autopsji zaskoczył wszystkich - Jennifer Strange zmarła z powodu zatrucia wodą.
Setki lat temu, pewien przemądrzały lekarz nazywany Paracelsusem, stwierdził paradoksalnie, że wszystko jest trucizną i nie jest nią. Działanie zależy od dawki a w pewnym stopniu też sposobu podania. Wynika stąd wiosek, że o żadnej substancji nie można powiedzieć, że nie jest trująca, można je tylko dzielić na trujące silnie, słabo i bardzo niewiele, co odpowiada wielkości dawki wywołującej negatywne objawy. Niejednokrotnie substancja wywołująca szkodliwe skutki w dużych dawkach, w małych może wykazać własności lecznicze.
Toksyczność substancji określa się zwykle przy pomocy miary LD 50 - jest to dawka w gramach na kilogram masy ciała wywołująca 50% prawdopodobieństwo śmierci, co zwykle wyznacza się badając śmiertelność szczurów lub innych zwierząt. Pewne znaczenie ma też droga podania, substancje mogą wykazywać niską toksyczność podane doustnie a wysoką podane inhalacyjnie, przykładem metaliczna rtęć, która połknięta bardzo trudno się wchłania, natomiast bardzo szkodliwa jest wdychana w postaci par.
W niektórych przypadkach dawka śmiertelna może być skrajnie niska - dla jadu kiełbasianego podaje się dawki rzędu nanogramów, dla cyjanku potasu to ok. 5 mg/kg, a dla siarczanu miedzi to ok. 5 g/kg przez co jego przedawkowanie jest na prawdę trudne.
A woda? Prawdopodobnie jest jedną z najmniej toksycznych substancji, jakich właściwości przebadano, jej dawka śmiertelna to około 90g/kg. Nawet glukoza jest bardziej toksyczna.
Oznacza to że dla dorosłego ważącego 70 kg niebezpieczna jest dawka ok. 6 litrów, ale oczywiście wszystko zależy od sposobu i szybkości podawania.
Ale właściwie dlaczego woda może być niebezpieczna?
Jednym z warunków utrzymania przez nasz organizm homeostazy, jest równowaga między zawartością wody w komórkach i w przestrzeniach między nimi. Stężenie soli mineralnych w osoczu i w płynie wewnątrzkomórkowym musi mieścić się w określonych granicach, przy czym najważniejszą z tych soli jest chlorek sodu, a więc sól kuchenna.
Ogólne prawa fizyki mówią, że przy różnicy stężeń po dwóch stronach półprzepuszczalnej błony, rozpuszczalnik ma skłonność do migracji w miejsce o większym stężeniu. Po prostu po stronie z roztworem bardziej rozcieńczonym cząstki rozpuszczalnika częściej uderzają w błonę i mogą przez nią przeniknąć, niż od strony roztworu bardziej stężonego. To przenikanie trwa tak długo aż nie zahamuje go wytworzone ciśnienie, nazywane osmotycznym, mogące osiągać gigantyczne wartości. To dlatego wiśnie i miękkie owoce zamoczone w wodzie nabrzmiewają i pękają - zwykła woda ma mniejsze stężenie rozpuszczonych substancji niż sok w komórkach owoców, i wnika do wiśni zwiększając ciśnienie.
Wewnątrz organizmu stężenie soli w osoczu i w komórkach jest na różne sposoby regulowane. Najważniejszym mechanizmem jest wydalanie wody i soli mineralnych przez nerki, które z kolei jest regulowane wydzielaniem hormonów, znaczenie ma też transport jonów do i z wnętrza komórek. W normalnej sytuacji gdy wypijemy większą ilość wody, nerki zaczynają wydzielać większą ilość moczu, tak aby zachować równowagę, a sole mineralne w organizmie nieco się rozcieńczają.
Problem może pojawić się gdy ilość wypitej wody przekroczy zdolność wydalniczą nerek, a więc będzie większa niż ok. 1 litr na godzinę, lub też gdy nerki zmniejszą wydzielanie moczu. Osocze krwi się wówczas rozcieńcza a poziom sodu zaczyna opadać poniżej normalnego stężenia, co prowadzi do hiponatremii.
Spadek stężenia soli w osoczu powoduje wzmożone wchłanianie wody do tkanek, człowiek staje się więc obrzęknięty i ociężały. W przypadku większości tkanek mają one pewną swobodę miejsca, mogąc nabrzmiewać bez uszkodzeń. Mózg zamknięty wewnątrz sztywnej czaszki nie ma tak łatwo.
Przy silnej i szybkiej hiponatremii, następuje obrzęk mózgu, a wzrost ciśnienia wewnątrz czaszkowego wywołuje objawy neurologiczne - dreszcze, silne bóle głowy, wymioty, osłabienie, drgawki, zaburzenia oddychania i śpiączkę. Ostatecznie opuchnięcie pnia mózgu wywołuje porażenie ośrodka oddechowego i zatrzymanie oddechu.
Najszybszym sposobem leczenia jest podanie soli mineralnych, tak aby zwiększyć ich stężenie we krwi, oraz podawanie diuretyków zwiększających wydalanie wody.
Zatrucie wodne jest przypadkiem bardzo rzadkim, i najczęściej jest związane z przymusem lub zaburzeniami psychicznymi. W chorobach takich jak schizofrenia nadmierne pragnienie jest dosyć częste - hiponatremia z przewodnienia występuje nawet u 5% leczonych w szpitalach psychiatrycznych, stanowiąc przyczynę do 20% zgonów[1]. Innym przypadkiem są zaburzenia elektrolitowe podczas intensywnego wysiłku - ciało wydala sole mineralne wraz z potem, wypijanie w trakcie płynów nieizotonicznych, czyli mających zbyt mało soli, może doprowadzić do hiponatremii. W dodatku w warunkach dużego zmęczenia, organizm hamuje wydzielanie moczu przez nerki. Stan taki obserwuje się u około 10-15% maratończyków po zakończeniu biegu, i niekiedy może on przybrać niebezpieczne natężenie.
Kilka lat temu z tego powodu zmarł uczestnik maratonu w Londynie.[2] Wiadomość o tym wywołała duże zaskoczenie u biegaczy, którzy dotychczas bardziej obawiali się odwodnienia.
Innym znanym przypadkiem była śmierć rekruta podczas ćwiczeń wytrzymałościowych Sił Powietrznych w 1999 roku, gdzie przyczyną było połączenie udaru cieplnego i przewodnienia.
Niebezpieczne rozcieńczenie płynów może też nastąpić w wyniku tortur lub napojenia wymuszonego. Zanotowano już kilka przypadku śmierci dzieci, które opiekunowie w ramach kary zmusili do wypicia 1-2 litrów wody. W USA głośną sprawą była śmierć Matthewa Carringtona, który w ramach swoistych otrzęsin będących testem wstępnym do studenckiego bractwa Tau Chi był zmuszony do wypicia dużych ilości wody. Jeszcze inną okazją do przewodnienia może być nieprzemyślana dieta lub źle zaplanowane "oczyszczanie organizmu".
Od dawna po świecie krąży mit, iż każdego dnia należy pić 2 litry wody. Tak na prawdę rzecz wywodzi się z badań nad gospodarką wodną organizmu, z których wynikało, że przy przeciętnej aktywności fizycznej i temperaturach, człowiek wydala ok 2 litry wody dziennie, to wobec tego tyle samo powinien przyjmować. Tyle tylko że wlicza się tutaj także woda zawarta w jedzeniu. Jabłko zawiera ponad 80% wody, mięso 50-60%, chleb 10%. Łącznie z jedzeniem przyjmujemy około litra - półtora, co stanowi połowę zalecanego spożycia. Nikt nigdzie nie mówił że musi być to koniecznie taka właśnie ilość wody pitnej.
Niestety, źle zrozumiane wyniki badań poszły w świat w formie "musisz pić 8 szklanek wody dziennie" i to czystej wody a nie napojów, przez co poniektórzy wierząc kolorowym pismom wręcz wmuszali w siebie następne szklanki, bo tak przecież napisali.
Niektórzy "dietetycy" dla uzasadnienia tego mitu posuwają się nawet do twierdzenia, że woda spożyta w innej formie jak czysta, nie będzie się wchłaniała, toteż po zjedzeniu talerza wodnistej zupy i tak musisz wypić te dwa litry. Niestety ludzie dalej w to wierzą, a zwolennicy magicznego "oczyszczania z toksyn" wręcz zwiększają ten limit, pisząc o trzech czy czterech litrach. Przykładem może być pewien rodzaj diety oczyszczająco-odchudzającej, w której mało się je i wypija duże ilości wody. Pozwala bardzo szybko schudnąć, ale zanotowano już kilka zgonów z tego powodu.
Brytyjka Jaqueline Henson wypijała na diecie trzy litry czystej wody na dzień. Pewnego dnia zaczęła od wypicia jednego litra wody źródlanej, a potem siedząc przed telewizorem wypiła dwie półtoralitrowe butelki w ciągu trzech godzin. Nie przejmowała się bólem głowy, bo czytała że to może być objaw oczyszczania organizmu. Po południu zemdlała, dostała drgawek i zatrzymania krążenia.[3]
Inna Brytyjka za namową swej dietetyczki wypijała cztery litry wody dziennie aby "wypłukać toksyny". Gdy zaczęła się źle czuć, dietetyczka powiedziała że to objaw oczyszczania i powinna zwiększyć ilość do sześciu litrów. Po dwóch dniach kobieta straciła przytomność. Wprawdzie ją odratowano ale w wyniku obrzęku doszło do uszkodzenia mózgu[4]
W przypadku Jennifer Strange, na jej stan nałożyło się kilka czynników - była drobna, miała małą wagę, dlatego proporcja ilości wypitej wody była u niej większa niż u innych. Zwyciężczyni konkursu doznała tylko bólu głowy ale nie była hospitalizowana. W dodatku prawdopodobnie Jennifer po przyjściu do domu niczego nie jadła - gdyby zjadła coś bardzo słonego, jak czipsy lub solone frytki, to stężenie elektrolitów mogłoby się wyrównać a przynajmniej nie dojść do tak niebezpiecznie niskiego poziomu. Mąż zmarłej podał stację radiową do sądu. Sprawa ciągnęła się długo, bowiem z jednej strony uczestnicy podpisali dokument iż wiedzą o ryzyku, lecz z drugiej strony nikt im nie powiedział jakie jest to właściwie ryzyko. Ostatecznie w 2009 roku w ramach ugody stacja zapłaciła rodzinie zmarłej 16 mln dolarów.
Historia ta miała jednak chyba zbyt małe rozpowszechnienie, skoro w zeszłym roku brazylijska stacja radiowa ogłosiła podobny konkurs, gdzie nagrodę zdobywał zespół, który wypije najwięcej rozwodnionej yerba mate. W zwycięskim zespole składającym się z 10 osób, który wypił 56 litrów napoju, trzy osoby się rozchorowały a jedna zmarła.[5]
------
* http://en.wikipedia.org/wiki/Water_intoxication
* http://www.pnmedycznych.pl/spnm.php?ktory=138
* http://www.rbs2.com/KDND.pdf
* http://www.protectconsumerjustice.org/a-measure-of-justice-for-a-mother-who-met-a-tragic-end.html
[1] http://fpn.ipin.edu.pl/archiwum/2005/2/t21z2_7.pdf
[2] http://www.maratonypolskie.pl/mp_index.php?dzial=1&action=7&code=4888
[3] http://news.bbc.co.uk/2/hi/uk_news/england/bradford/7779079.stm
[4] http://www.dailymail.co.uk/femail/article-1038829/Water-detox-robbed-wife.html
[5] http://www.campograndenews.com.br/cidades/capital/mulher-de-21-anos-morre-depois-de-passar-mal-em-competicao-de-terere
Konkurs "Hold Your Wee of a Wii" był bardzo prosty - wygrywał ten, kto wypije jak najwięcej wody i się nie posika. W innych podobnych konkursach dawano zadania w rodzaju zjedzenia jak największej ilości pączków czy hamburgerów, więc to wydawało się prostym zadaniem. Przygotowano każdemu uczestnikowi małe, ćwierćlitrowe buteleczki wody. Mieli pić po jednej w odstępie dziesięciu minut oraz w każdej chwili mogli zrezygnować, jeśli uznali, że to dla nich zbyt dużo, ale nie mogli wychodzić do łazienki.
Konkurs rozpoczęto nad ranem, nadając relację na antenie. Było wesoło, a kolejne butelki znikały w szybkim tempie. Ktoś się wykruszył po pięciu, ktoś po ośmiu.
W trakcie trwania konkursu, do radia zadzwoniła pielęgniarka, stwierdzając że jego idea jest oburzająca i niebezpieczna, bo ktoś może umrzeć. Prezenter odpowiedział że wiedzą ale wszystko jest pod kontrolą, zresztą uczestnicy podpisali dokument że zgadzają się na ryzyko, więc nie ma się co czepiać. Gdy kolejny słuchacz zaniepokojony konkursem zadzwonił z ostrzeżeniem, rozbawiony prezenter wyjrzał na salę i zawołał "Czy ktoś tam może umiera?". Prezenter wyjaśnił też że ciało składa się w 90% z wody, więc można jej pić ile się chce.
Gdy minęła pierwsza godzina, uczestnikom dano większe, półlitrowe butelki. To wtedy zrezygnowało najwięcej osób. Niektórzy źle się czuli, ktoś zwymiotował do wiadra, ktoś inny stwierdził że jest mu zimno i zaczął drżeć. Jednak dwie zawodniczki okazały się bardzo wytrwałe. Jennifer wypiła już osiem małych butelek i dziesięć większych, łącznie mieszcząc w sobie ponad sześć litrów wody, gdy stwierdziła że brzuch już ją boli, i głowa. Zrezygnowała zajmując drugie miejsce i otrzymując w nagrodę bilety na koncert. Przebiła ją kobieta, która wypiła o pół butelki więcej.
Gdy konkurs się już skończył, DJ zażartował, że brzuch Jennifer wygląda jakby była w ciąży. Przed wręczeniem nagród zawodniczki poszły do łazienki gdzie wysikały się i zwymiotowały. Następnie gorąco je pożegnano i odesłano do domu. Po drodze Jennifer zadzwoniła do współpracownika aby opowiedzieć o konkursie. Skarżyła się wtedy na silny ból głowy. W domu ból głowy się nasilił. Do objawów doszły zapewne też nudności i osłabienie. Po południu zaniepokojona matka odnajduje ją martwą.
Wynik autopsji zaskoczył wszystkich - Jennifer Strange zmarła z powodu zatrucia wodą.
Setki lat temu, pewien przemądrzały lekarz nazywany Paracelsusem, stwierdził paradoksalnie, że wszystko jest trucizną i nie jest nią. Działanie zależy od dawki a w pewnym stopniu też sposobu podania. Wynika stąd wiosek, że o żadnej substancji nie można powiedzieć, że nie jest trująca, można je tylko dzielić na trujące silnie, słabo i bardzo niewiele, co odpowiada wielkości dawki wywołującej negatywne objawy. Niejednokrotnie substancja wywołująca szkodliwe skutki w dużych dawkach, w małych może wykazać własności lecznicze.
Toksyczność substancji określa się zwykle przy pomocy miary LD 50 - jest to dawka w gramach na kilogram masy ciała wywołująca 50% prawdopodobieństwo śmierci, co zwykle wyznacza się badając śmiertelność szczurów lub innych zwierząt. Pewne znaczenie ma też droga podania, substancje mogą wykazywać niską toksyczność podane doustnie a wysoką podane inhalacyjnie, przykładem metaliczna rtęć, która połknięta bardzo trudno się wchłania, natomiast bardzo szkodliwa jest wdychana w postaci par.
W niektórych przypadkach dawka śmiertelna może być skrajnie niska - dla jadu kiełbasianego podaje się dawki rzędu nanogramów, dla cyjanku potasu to ok. 5 mg/kg, a dla siarczanu miedzi to ok. 5 g/kg przez co jego przedawkowanie jest na prawdę trudne.
A woda? Prawdopodobnie jest jedną z najmniej toksycznych substancji, jakich właściwości przebadano, jej dawka śmiertelna to około 90g/kg. Nawet glukoza jest bardziej toksyczna.
Oznacza to że dla dorosłego ważącego 70 kg niebezpieczna jest dawka ok. 6 litrów, ale oczywiście wszystko zależy od sposobu i szybkości podawania.
Ale właściwie dlaczego woda może być niebezpieczna?
Jednym z warunków utrzymania przez nasz organizm homeostazy, jest równowaga między zawartością wody w komórkach i w przestrzeniach między nimi. Stężenie soli mineralnych w osoczu i w płynie wewnątrzkomórkowym musi mieścić się w określonych granicach, przy czym najważniejszą z tych soli jest chlorek sodu, a więc sól kuchenna.
Ogólne prawa fizyki mówią, że przy różnicy stężeń po dwóch stronach półprzepuszczalnej błony, rozpuszczalnik ma skłonność do migracji w miejsce o większym stężeniu. Po prostu po stronie z roztworem bardziej rozcieńczonym cząstki rozpuszczalnika częściej uderzają w błonę i mogą przez nią przeniknąć, niż od strony roztworu bardziej stężonego. To przenikanie trwa tak długo aż nie zahamuje go wytworzone ciśnienie, nazywane osmotycznym, mogące osiągać gigantyczne wartości. To dlatego wiśnie i miękkie owoce zamoczone w wodzie nabrzmiewają i pękają - zwykła woda ma mniejsze stężenie rozpuszczonych substancji niż sok w komórkach owoców, i wnika do wiśni zwiększając ciśnienie.
Wewnątrz organizmu stężenie soli w osoczu i w komórkach jest na różne sposoby regulowane. Najważniejszym mechanizmem jest wydalanie wody i soli mineralnych przez nerki, które z kolei jest regulowane wydzielaniem hormonów, znaczenie ma też transport jonów do i z wnętrza komórek. W normalnej sytuacji gdy wypijemy większą ilość wody, nerki zaczynają wydzielać większą ilość moczu, tak aby zachować równowagę, a sole mineralne w organizmie nieco się rozcieńczają.
Problem może pojawić się gdy ilość wypitej wody przekroczy zdolność wydalniczą nerek, a więc będzie większa niż ok. 1 litr na godzinę, lub też gdy nerki zmniejszą wydzielanie moczu. Osocze krwi się wówczas rozcieńcza a poziom sodu zaczyna opadać poniżej normalnego stężenia, co prowadzi do hiponatremii.
Spadek stężenia soli w osoczu powoduje wzmożone wchłanianie wody do tkanek, człowiek staje się więc obrzęknięty i ociężały. W przypadku większości tkanek mają one pewną swobodę miejsca, mogąc nabrzmiewać bez uszkodzeń. Mózg zamknięty wewnątrz sztywnej czaszki nie ma tak łatwo.
Przy silnej i szybkiej hiponatremii, następuje obrzęk mózgu, a wzrost ciśnienia wewnątrz czaszkowego wywołuje objawy neurologiczne - dreszcze, silne bóle głowy, wymioty, osłabienie, drgawki, zaburzenia oddychania i śpiączkę. Ostatecznie opuchnięcie pnia mózgu wywołuje porażenie ośrodka oddechowego i zatrzymanie oddechu.
Najszybszym sposobem leczenia jest podanie soli mineralnych, tak aby zwiększyć ich stężenie we krwi, oraz podawanie diuretyków zwiększających wydalanie wody.
Zatrucie wodne jest przypadkiem bardzo rzadkim, i najczęściej jest związane z przymusem lub zaburzeniami psychicznymi. W chorobach takich jak schizofrenia nadmierne pragnienie jest dosyć częste - hiponatremia z przewodnienia występuje nawet u 5% leczonych w szpitalach psychiatrycznych, stanowiąc przyczynę do 20% zgonów[1]. Innym przypadkiem są zaburzenia elektrolitowe podczas intensywnego wysiłku - ciało wydala sole mineralne wraz z potem, wypijanie w trakcie płynów nieizotonicznych, czyli mających zbyt mało soli, może doprowadzić do hiponatremii. W dodatku w warunkach dużego zmęczenia, organizm hamuje wydzielanie moczu przez nerki. Stan taki obserwuje się u około 10-15% maratończyków po zakończeniu biegu, i niekiedy może on przybrać niebezpieczne natężenie.
Kilka lat temu z tego powodu zmarł uczestnik maratonu w Londynie.[2] Wiadomość o tym wywołała duże zaskoczenie u biegaczy, którzy dotychczas bardziej obawiali się odwodnienia.
Innym znanym przypadkiem była śmierć rekruta podczas ćwiczeń wytrzymałościowych Sił Powietrznych w 1999 roku, gdzie przyczyną było połączenie udaru cieplnego i przewodnienia.
Niebezpieczne rozcieńczenie płynów może też nastąpić w wyniku tortur lub napojenia wymuszonego. Zanotowano już kilka przypadku śmierci dzieci, które opiekunowie w ramach kary zmusili do wypicia 1-2 litrów wody. W USA głośną sprawą była śmierć Matthewa Carringtona, który w ramach swoistych otrzęsin będących testem wstępnym do studenckiego bractwa Tau Chi był zmuszony do wypicia dużych ilości wody. Jeszcze inną okazją do przewodnienia może być nieprzemyślana dieta lub źle zaplanowane "oczyszczanie organizmu".
Od dawna po świecie krąży mit, iż każdego dnia należy pić 2 litry wody. Tak na prawdę rzecz wywodzi się z badań nad gospodarką wodną organizmu, z których wynikało, że przy przeciętnej aktywności fizycznej i temperaturach, człowiek wydala ok 2 litry wody dziennie, to wobec tego tyle samo powinien przyjmować. Tyle tylko że wlicza się tutaj także woda zawarta w jedzeniu. Jabłko zawiera ponad 80% wody, mięso 50-60%, chleb 10%. Łącznie z jedzeniem przyjmujemy około litra - półtora, co stanowi połowę zalecanego spożycia. Nikt nigdzie nie mówił że musi być to koniecznie taka właśnie ilość wody pitnej.
Niestety, źle zrozumiane wyniki badań poszły w świat w formie "musisz pić 8 szklanek wody dziennie" i to czystej wody a nie napojów, przez co poniektórzy wierząc kolorowym pismom wręcz wmuszali w siebie następne szklanki, bo tak przecież napisali.
Niektórzy "dietetycy" dla uzasadnienia tego mitu posuwają się nawet do twierdzenia, że woda spożyta w innej formie jak czysta, nie będzie się wchłaniała, toteż po zjedzeniu talerza wodnistej zupy i tak musisz wypić te dwa litry. Niestety ludzie dalej w to wierzą, a zwolennicy magicznego "oczyszczania z toksyn" wręcz zwiększają ten limit, pisząc o trzech czy czterech litrach. Przykładem może być pewien rodzaj diety oczyszczająco-odchudzającej, w której mało się je i wypija duże ilości wody. Pozwala bardzo szybko schudnąć, ale zanotowano już kilka zgonów z tego powodu.
Brytyjka Jaqueline Henson wypijała na diecie trzy litry czystej wody na dzień. Pewnego dnia zaczęła od wypicia jednego litra wody źródlanej, a potem siedząc przed telewizorem wypiła dwie półtoralitrowe butelki w ciągu trzech godzin. Nie przejmowała się bólem głowy, bo czytała że to może być objaw oczyszczania organizmu. Po południu zemdlała, dostała drgawek i zatrzymania krążenia.[3]
Inna Brytyjka za namową swej dietetyczki wypijała cztery litry wody dziennie aby "wypłukać toksyny". Gdy zaczęła się źle czuć, dietetyczka powiedziała że to objaw oczyszczania i powinna zwiększyć ilość do sześciu litrów. Po dwóch dniach kobieta straciła przytomność. Wprawdzie ją odratowano ale w wyniku obrzęku doszło do uszkodzenia mózgu[4]
W przypadku Jennifer Strange, na jej stan nałożyło się kilka czynników - była drobna, miała małą wagę, dlatego proporcja ilości wypitej wody była u niej większa niż u innych. Zwyciężczyni konkursu doznała tylko bólu głowy ale nie była hospitalizowana. W dodatku prawdopodobnie Jennifer po przyjściu do domu niczego nie jadła - gdyby zjadła coś bardzo słonego, jak czipsy lub solone frytki, to stężenie elektrolitów mogłoby się wyrównać a przynajmniej nie dojść do tak niebezpiecznie niskiego poziomu. Mąż zmarłej podał stację radiową do sądu. Sprawa ciągnęła się długo, bowiem z jednej strony uczestnicy podpisali dokument iż wiedzą o ryzyku, lecz z drugiej strony nikt im nie powiedział jakie jest to właściwie ryzyko. Ostatecznie w 2009 roku w ramach ugody stacja zapłaciła rodzinie zmarłej 16 mln dolarów.
Historia ta miała jednak chyba zbyt małe rozpowszechnienie, skoro w zeszłym roku brazylijska stacja radiowa ogłosiła podobny konkurs, gdzie nagrodę zdobywał zespół, który wypije najwięcej rozwodnionej yerba mate. W zwycięskim zespole składającym się z 10 osób, który wypił 56 litrów napoju, trzy osoby się rozchorowały a jedna zmarła.[5]
------
* http://en.wikipedia.org/wiki/Water_intoxication
* http://www.pnmedycznych.pl/spnm.php?ktory=138
* http://www.rbs2.com/KDND.pdf
* http://www.protectconsumerjustice.org/a-measure-of-justice-for-a-mother-who-met-a-tragic-end.html
[1] http://fpn.ipin.edu.pl/archiwum/2005/2/t21z2_7.pdf
[2] http://www.maratonypolskie.pl/mp_index.php?dzial=1&action=7&code=4888
[3] http://news.bbc.co.uk/2/hi/uk_news/england/bradford/7779079.stm
[4] http://www.dailymail.co.uk/femail/article-1038829/Water-detox-robbed-wife.html
[5] http://www.campograndenews.com.br/cidades/capital/mulher-de-21-anos-morre-depois-de-passar-mal-em-competicao-de-terere
środa, 16 lipca 2014
Barwienie bakterii metodą Grama
Dawno, dawno temu, kiedy jeszcze uczyłem się w technikum chemicznym, jednym z przedmiotów była bioanaliza, gdzie uczyliśmy się jak badać mocz, rozpoznawać pod mikroskopem różne limfocyty, albo badać zawartość cholesterolu w osoczu.
Jednym z ciekawszych ćwiczeń była hodowla bakterii z powietrza - sterylną płytkę z podłożem odkrywało się na określony czas w nieruchowym powietrzu pomieszczenia, zakrywało i wstawiało do inkubatora. Bakterie które znajdowały się w powietrzu osiadały na płytce i tworzyły kolonie - jedna bakteria tworzyła jedną kolonię. Zliczając ilość kolonii na powierzchni płytki i znając czas wystawienia płytki, można było policzyć stężenie bakterii w powietrzu - całkiem proste.
Jednak otrzymane bakterie dobrze jest też jakoś zidentyfikować. Oprócz opisanych już kiedyś metod hodowli na podłożu różnicującym, inną techniką jest barwienie metodą Grama. Badanie obejmuje kilka etapów, a wszystkie je sfotografowałem.
Zasadnicza różnica między typami bakterii jaką wykrywa się w tym badaniu, to grubość i przenikliwość ściany komórkowej - w jednym bakteriach jest cienka, w innych stosunkowo gruba. Ma to wpływ na ogólną fizjologię bakterii, zaś dla medycyny znaczenie ma różna wrażliwość na leki - zasadniczo bakterie o grubszej ścianie komórkowej są bardziej odporne, z powodu słabszego wchłaniania antybiotyku do wnętrza. Różna grubość ścian komórkowych wykrywana jest przez selektywne wybarwianie fioletem krystalicznym. W jaki sposób?
Na początek należy sobie wybrać jakąś kolonię z której będziemy robić rozmaz:
Ja akurat wybrałem sobie taką w której na kolonię żółtą naciekała biała, mając nadzieję że uda mi się złapać dwa różne typy. Masę kolonii pobierałem ezą, to jest pętelką z drutu z rączką. Tę jednak należało przedtem wyżarzyć, aby usunąć wszystkie inne bakterie:
Ponieważ kolonia miała postać stałej masy, najpierw nabrałem nieco soli fizjologicznej:
potem nieco kolonii:
i rozmazałem na płytce:
Rozmaz należało teraz wysuszyć i utrwalić, aby bakterie dobrze przylegały do podłoża. Dlatego po podsuszeniu w suszarce przeciągnęliśmy płytki nad płomykiem lampki spirytusowej, tak aby masa bakteryjna "przyschła" do płytki.
Wszystkie płytki należało teraz umieścić nad tacką, założyć rękawiczki i uważać na ubranie, bo można się było nieźle pobrudzić. Najpierw każda płytka została zalana roztworem fioletu krystalicznego:
Następnie czekaliśmy dwie minuty, po czym zlaliśmy barwnik do tacki:
Nie usuwając całej cieczy, zalewaliśmy płytki płynem Lugola - na powierzchni płynu powstawała błyszcząca warstewka, jak podejrzewam był to wydzielający się jod. Płyn dzięki temu błyszczał i opalizował, wyglądając jak odwłok złotego żuka:
Po około trzydziestu sekundach zlaliśmy ciecz i dokładnie przemyliśmy alkoholem:
A następnie wodą:
Na sam koniec zalaliśmy płytki roztworem fuksyny:
Pół minuty potem zlaliśmy ją do tacki, płytki przemyliśmy wodą i osuszyliśmy w suszarce. Tak zabarwione płytki nadawały się do badania mikroskopowego:
Co takiego następowało podczas wybarwiania? Gdy zalewaliśmy płytki roztworem fioletu krystalicznego, wnikał on do bakterii zabarwiając je wszystkie. Dodany potem roztwór jodu dodatkowo przyciemniał zabarwienie poprzez tworzenie kompleksów jodu z barwnikiem. Na tym etapie zabarwione były wszystkie.
Jednak gdy przemywaliśmy płytki alkoholem, zaznaczyła się różnica - łatwo wypłukiwał on barwnik z bakterii o cienkiej ściance, natomiast nie był w stanie odbarwić bakterii o ścianie grubej. W efekcie te pierwsze stawały się bezbarwne, zaś te drugie ciemnofioletowe. Gdy zalaliśmy płytki fuksyną, odbarwione bakterie o cienkiej ścianie zabarwiły się na różowo. Te o grubej także, ale mocniejszy kolor fioletu zagłuszał róż.
W efekcie bakterie o ściance cienkiej zabarwiły się na różowo a te o grubej na ciemno fioletowo. Rożróżnianie bakterii pod mikroskopem jest zatem bardzo łatwe - bakterie Gram+ są fioletowe a Gram- różowe.
Akurat mnie, jako chemika-estetę bardziej zainteresowały kryształy fuksyny, które wykrystalizowały na płytce. Tutaj pęk kryształów w otoczeniu bakterii gram-ujemnych (powiększenie ok. 400X):
A tutaj w otoczeniu gram-dodatnich (pow. ok. 600X):
I na koniec mieszanka dwóch różnych typów bakterii:
Jednym z ciekawszych ćwiczeń była hodowla bakterii z powietrza - sterylną płytkę z podłożem odkrywało się na określony czas w nieruchowym powietrzu pomieszczenia, zakrywało i wstawiało do inkubatora. Bakterie które znajdowały się w powietrzu osiadały na płytce i tworzyły kolonie - jedna bakteria tworzyła jedną kolonię. Zliczając ilość kolonii na powierzchni płytki i znając czas wystawienia płytki, można było policzyć stężenie bakterii w powietrzu - całkiem proste.
Jednak otrzymane bakterie dobrze jest też jakoś zidentyfikować. Oprócz opisanych już kiedyś metod hodowli na podłożu różnicującym, inną techniką jest barwienie metodą Grama. Badanie obejmuje kilka etapów, a wszystkie je sfotografowałem.
Zasadnicza różnica między typami bakterii jaką wykrywa się w tym badaniu, to grubość i przenikliwość ściany komórkowej - w jednym bakteriach jest cienka, w innych stosunkowo gruba. Ma to wpływ na ogólną fizjologię bakterii, zaś dla medycyny znaczenie ma różna wrażliwość na leki - zasadniczo bakterie o grubszej ścianie komórkowej są bardziej odporne, z powodu słabszego wchłaniania antybiotyku do wnętrza. Różna grubość ścian komórkowych wykrywana jest przez selektywne wybarwianie fioletem krystalicznym. W jaki sposób?
Na początek należy sobie wybrać jakąś kolonię z której będziemy robić rozmaz:
Ja akurat wybrałem sobie taką w której na kolonię żółtą naciekała biała, mając nadzieję że uda mi się złapać dwa różne typy. Masę kolonii pobierałem ezą, to jest pętelką z drutu z rączką. Tę jednak należało przedtem wyżarzyć, aby usunąć wszystkie inne bakterie:
Ponieważ kolonia miała postać stałej masy, najpierw nabrałem nieco soli fizjologicznej:
potem nieco kolonii:
i rozmazałem na płytce:
Rozmaz należało teraz wysuszyć i utrwalić, aby bakterie dobrze przylegały do podłoża. Dlatego po podsuszeniu w suszarce przeciągnęliśmy płytki nad płomykiem lampki spirytusowej, tak aby masa bakteryjna "przyschła" do płytki.
Wszystkie płytki należało teraz umieścić nad tacką, założyć rękawiczki i uważać na ubranie, bo można się było nieźle pobrudzić. Najpierw każda płytka została zalana roztworem fioletu krystalicznego:
Następnie czekaliśmy dwie minuty, po czym zlaliśmy barwnik do tacki:
Nie usuwając całej cieczy, zalewaliśmy płytki płynem Lugola - na powierzchni płynu powstawała błyszcząca warstewka, jak podejrzewam był to wydzielający się jod. Płyn dzięki temu błyszczał i opalizował, wyglądając jak odwłok złotego żuka:
Po około trzydziestu sekundach zlaliśmy ciecz i dokładnie przemyliśmy alkoholem:
A następnie wodą:
Na sam koniec zalaliśmy płytki roztworem fuksyny:
Pół minuty potem zlaliśmy ją do tacki, płytki przemyliśmy wodą i osuszyliśmy w suszarce. Tak zabarwione płytki nadawały się do badania mikroskopowego:
Co takiego następowało podczas wybarwiania? Gdy zalewaliśmy płytki roztworem fioletu krystalicznego, wnikał on do bakterii zabarwiając je wszystkie. Dodany potem roztwór jodu dodatkowo przyciemniał zabarwienie poprzez tworzenie kompleksów jodu z barwnikiem. Na tym etapie zabarwione były wszystkie.
Jednak gdy przemywaliśmy płytki alkoholem, zaznaczyła się różnica - łatwo wypłukiwał on barwnik z bakterii o cienkiej ściance, natomiast nie był w stanie odbarwić bakterii o ścianie grubej. W efekcie te pierwsze stawały się bezbarwne, zaś te drugie ciemnofioletowe. Gdy zalaliśmy płytki fuksyną, odbarwione bakterie o cienkiej ścianie zabarwiły się na różowo. Te o grubej także, ale mocniejszy kolor fioletu zagłuszał róż.
W efekcie bakterie o ściance cienkiej zabarwiły się na różowo a te o grubej na ciemno fioletowo. Rożróżnianie bakterii pod mikroskopem jest zatem bardzo łatwe - bakterie Gram+ są fioletowe a Gram- różowe.
Akurat mnie, jako chemika-estetę bardziej zainteresowały kryształy fuksyny, które wykrystalizowały na płytce. Tutaj pęk kryształów w otoczeniu bakterii gram-ujemnych (powiększenie ok. 400X):
A tutaj w otoczeniu gram-dodatnich (pow. ok. 600X):
I na koniec mieszanka dwóch różnych typów bakterii:
Subskrybuj:
Komentarze (Atom)