Nazwy zwyczajowe związków chemicznych mają tą przewagę nad systematycznymi, pełnymi nazwami, że są dużo krótsze a niekiedy mówią nam coś na temat tego związku. Nazwa kwas hydroksybutanodiowy może nam wskazać na pewną strukturę, ale dopiero nazwanie tego związku kwasem jabłkowym nakierowuje nas na związki naturalne.
Wiele związków naturalnych ma nazwy zwyczajowe pochodzące od organizmów w których po raz pierwszy je odkryto, zwykle łacińskich lub angielskich. Te starsze, często spotykane związki, mają też polskie nazwy odnoszące się do polskich nazw tychże organizmów, w przypadku nowszych zwykle spolszcza się nazwę angielską, dlatego znany od dawna succinic acid to kwas bursztynowy a opisany później mało znany pinoleinic acid to kwas pinoleinowy a nie kwas sosnowy.
Nieco inaczej jest z kwasem melisowym, będącym bardzo długim kwasem tłuszczowym (30 węgli) i nazwanym od greckiego "melissa"
czyli pszczoła, jest bowiem składnikiem wosku. Od tego samego greckiego
słowa wywodzi się jednak też nazwa rośliny melisy lekarskiej, znanej z
przywabiania pszczół.
Niektóre jednak nazwy, wskutek zbiegu okoliczności, brzmią dziwnie lub wręcz śmiesznie, zależnie od języka. Dla Polaka butanal nie brzmi tak zabawnie jak dla Anglika czytającego nazwę "but anal".
Minerały
Dość duże zainteresowanie w anglojęzycznym świecie wzbudza minerał Cummingtonit, którego nazwa czyta się podobnie do "coming to night" czyli "dojść nocą". W rzeczywistości nazwa pochodzi od miasta Cummington w USA.
Nieco bardziej interesująca jest historia nazwy Carlsbergitu - ten rzadki minerał będący azotkiem chromu nazwano od Carlsberg Foundation, fundacji wspierającej badania naukowe i fundującej wiele laboratoriów. To dzięki niej sprowadzono i zbadano meteoryt Apailik, będący fragmentem spadku w Cape Town, z którego pochodzi największy na świecie meteoryt żelazny Ahnighito (30 ton). W sprowadzonym do Kopenhagi fragmencie odkryto tenże minerał.
Natomiast sama fundacja została założona przez filantropa i browarnika Jakuba Christiana Jakobsena, tego samego który założył znany wszystkim browar i markę piwa Carlsberg.
Dziwne białka
Niektórzy badacze celowo nadają związkom oryginalne nazwy. Mocno namieszali twórcy nazwy pewnego białka, biorącego udział w organogenezie zarodka, którzy nazwali je Sonic Hedgehog, od bohatera gry komputerowej firmy Sega przypominającego nieco niebieskiego jeża. Badacze twierdzą, że pomysł wziął się stąd, że zarodki muszek owocowych z uszkodzonym genem kodującym to białko przybierały postać kulki z licznymi wypustkami, podobnymi do kolców. Nazwa przyjęła się, nawet na jej bazie utworzono nazwy dwóch innych białek biorących udział w tym procesie (desert hedgehog czyli "jeż pustynny" i indian hedgehog czyli "jeż indyjski"), mimo że niektóry uznają ją za niestosowną, jako że mutacje w genie kodującym białko wywołują choroby u ludzi.[1] Problematyczne jest też przetłumaczenie nazwy związku lub szlaku metabolicznego w którym bierze udział. Z tego co widziałem zwykle nie tłumaczy się nazwy najwyżej ją skracając, stąd w pracach medycznych określenia typu "mutacja białka Sonic Hedgehog" czy "szlak sygnałowy Shh.", inni uogólniają pisząc o "szlaku sygnałowym jeża".
Inspiracje popkulturowe mieli też Japończycy, którzy pewne białko występujące w synapsach fotoreceptorów nazwali Pikachurin.[2] Dalej poszli badacze w Bristol Laboratories którzy kilka odkrytych przez siebie antybiotyków o właściwościach przeciwnowotworowych nazwali od postaci z opery Pucciniego "Cyganeria" stąd związki: alcindoromycin, bohemamine, collinemycin, marcellomycin, mimimycin, musettamycin, rudolphomycin and schaunardimycin. [3]
Nazwa kolejnego specyficznego białka była koniecznością, bo pomimo dziwności dokładnie opisuje jego właściwość. Bierze ono bowiem udział w prawidłowym rozwoju sromu pewnego małego robaka, zarazem ma dość nietypową strukturę. Toteż nazwano je Sex Muscle Abnormal Protein 5. [4]
Kwas kwadratowy
Prosty cykliczny kwas organiczny nie zawierający jednak grup karboksylowych. Nazwa odnosi się do kształtu cząsteczki - są to w zasadzie cztery grupy karbonylowe połączone w kwadrat:
Kwasowość związku wynika z równowagi keto-enolowej - struktura w której grupa hydroksylowa jest połączona z węglem przy wiązaniu podwójnym jest nietrwała. Następuje więc odszczepienie protonu i utworzenie struktury jonowej z ujemnym ładunkiem na tlenie. Podobnie rzecz się ma zresztą z kwasem askorbinowym, czyli witaminą C, który jest kwaśny na tej zasadzie. W tym przypadku odszczepienie dwóch protonów daje kilka możliwych struktur rezonansowych a podwójne wiązanie rozmywa się na cały kwadrat, przez co cząsteczka nabiera właściwości aromatycznych, nadających jej dużą trwałość. Dlatego też odszczepianie protonów następuje dość łatwo, a kwas jest mocny, dysocjuje łatwiej od kwasu fosforowego.[5]
Anion kwasu kwadratowego może być uważany za specyficzną formę tlenku węgla o wzorze C4O42−.
Kwas tyglowy
Prosty nienasycony kwas karboksylowy, będący izomerem kwasu angelikowego. Ma słodko-ostry zapach i wraz z estrami jest składnikiem aromatu rumowego. Polska nazwa nie ma związku z żadnym tygielkiem, to spolszczenie angielskiej Tiglic acid, którą nadano mu od krotonu przeczyszczającego (Croton tiglium) w którego oleju po raz pierwszy go znaleziono.[6]
Scylla i Charybda
Jednym ze związków frazeologicznych pochodzących z mitologii greckiej jest "znaleźć się między Scyllą i Charybdą" co stanowi bardziej intelektualną wersję powiedzenia "być między młotem a kowadłem". Charybda była córką Neptuna, która za chciwość skazano na bycie morskim potworem, który wsysał w głębinę statki i wypluwał z prądem wodnym szczątki. Scylla była nimfą którą za odrzucenie zalotów boga zamieniono w potwora - gdy weszła do zatrutego źródła z jej ciała wyrosły łby sześciu psów z łapami, które zjadały ludzi w pobliżu; gdy zrozpaczona rzuciła się do morza zamieniła się w morskiego potwora, czyhającego na statki. Scylla i Charybda zamieszkały po dwóch stronach cieśniny i jeśli ktoś chciał nią przepłynąć, musiał się liczyć z tym, że albo jeden stwór rozbije mu statek albo drugi zje sześciu członków załogi. W takiej sytuacji znalazł się Odyseusz, który wolał stracić sześciu ludzi niż cały statek.
Mitologiczna historia swoje odbicie w chemii - dwie substancje znalezione w jadzie izraelskiego skopiona Leiurus quinquestriatus hebraeus (Deathsalker) zostały nazwane od potworów. Jedna to scyllatoksyna a druga to charybdotoksyna, obie są krótkimi peptydami blokującymi kanał wapniowy.[7],[8]
Imperatoryna
Furanokumaryna zawarta w olejku eterycznym z arcydzięgla, aczkolwiek po raz pierwszy wyizolowana z ureny łatkowatej (Urena lobata), plennej byliny używanej jako roślina włóknista. Trudno powiedzieć skąd wzięła się taka nazwa - urena jest też nazywana caesarweed czyli "cezar chwastów" i być może stąd inspiracja.[9]
Waginol
Kolejna kumaryna występująca w arcydzięglu, w większości jako składnik glikozydu apteryny (apterin). Nazwa zapewne pochodzi od łacińskiego słowa vagina, które to słowo oprócz części ciała dotyczy też pochewki liściowej. Grube, rozszerzone ogonki listków stanowią charakterystyczną cechę arcydzięgla. Kandyzowane w cukrze są używane jako zielona ozdoba cukiernicza o anyżkowym zapachu, lub do wyrobu konfitury.[10]
P**** ligand
Ten ostatni przypadek jest szczególnie zabawny.
Opisany po raz pierwszy w 2006 roku ligand wielokleszczowy 1-(2″-hydroksylo cykloheksylo)-3′-[aminopropylo]-4-[3′-aminopropylo]piperazina, będący w sumie dość prostym aminoalkoholem, nie zwróciłby niczyjej uwagi gdyby nie to że w pracy z 2008 roku zespół irańskich naukowców użył skrótu, będącego znacznie prostszą nazwą niż pełna nazwa chemiczna. I najwyraźniej nie widząc w tym niczego niestosownego tą aminową pochodną piperyzyny nazwali Pizda.[11]
Budząc tym samym dość oczywistą wesołość u badaczy z krajów słowiańskich.
Polecam jeszcze na koniec artykuł o dziwnych nazwach genów:
http://naukowy.blog.polityka.pl/2007/09/24/gen-pavarottiego/
------------------
Źródła
* Molecules With Silly or Unsual Names
* https://en.wikipedia.org/wiki/List_of_chemical_compounds_with_unusual_names
[1] https://pl.wikipedia.org/wiki/Sonic_hedgehog
[2] https://en.wikipedia.org/wiki/Pikachurin
[3] https://en.wikipedia.org/wiki/Bohemic_acid
[4] http://www.ncbi.nlm.nih.gov/gene/181055
[5] https://en.wikipedia.org/wiki/Squaric_acid
[6] https://pl.wikipedia.org/wiki/Kwas_tyglowy
[7] https://en.wikipedia.org/wiki/Charybdotoxin
[8] https://en.wikipedia.org/wiki/Scyllatoxin
[9] https://en.wikipedia.org/wiki/Imperatorin
[10] https://en.wikipedia.org/wiki/Apterin
[11] http://www.sciencedirect.com/science/article/pii/S1386142507004908
informacje
poniedziałek, 23 listopada 2015
sobota, 7 listopada 2015
Chemiczne wieści (3.)
Tlen na komecie
Misja Rosetta badająca kometę 67/P Churymov-Gerasimenko budzi dziś mniejsze zainteresowanie, zwłaszcza od czasu nieszczęśliwie przedwczesnego końca lądownika, niemniej instrumenty sondy wciąż wysyłają ciekawe dane. Najnowsza publikacja Nature donosi o wykryciu w gazach wytryskujących z powierzchni jądra kometarnego molekularnego tlenu.
Jednym z instrumentów badawczych sondy jest spektrometr masowy ROSINA-DFMS. Przyrząd ten jonizuje gazy i wykrywa masy składających się nań cząsteczek, wykorzystując skłonność jonów do ruchu w polu elektrycznym z prędkością zależną od stosunku masy do ładunku. Dzięki temu możliwa jest szybka identyfikacja składu.
Dzięki niemu wiadomo było, że większość składu gazów emitowanych przez jądro kometarne (do 95%) stanowiła para wodna oraz tlenek i dwutlenek węgla. Bardziej interesujące okazały się składniki stanowiące resztę. Głównym okazał się być cząsteczkowy tlen, po nim elementarna siarka i metanol, ponadto ślady tlenków azotu i hydrazyny.
Skąd jednak tlen na komecie?
Jego zawartość porównano ze stężeniem dwutlenku węgla, tlenku i pary wodnej, wykazując że tylko w tym trzecim przypadku zachodzi wyraźna korelacja stężeń. Jeśli stężenia tlenu są powiązane ze stężeniami wody, to widocznie gazy te uwalniane są razem. Najprawdopodobniej promieniowanie ultrafioletowe wywołuje radiolizę lodu wodnego na powierzchni komety, powodując powstanie tlenu, który miesza się z lodem i wraz z nim sublimuje. Zachodzenie takiej reakcji potwierdzono zresztą eksperymentalnie. [1]
Fraktalne trójkąty
Fraktale to struktury samopodobne. Matematycznie ujmując, strukturę opisuje pewien prosty algorytm, którego nieskończone iteracje tworzą coraz mniejsze elementy, zachowujące podobieństwo do całości. Ta prostota sprawiająca, że rozległy i wydawałoby się skomplikowany wzór da się wywieść z kilku powtarzanych wciąż reguł sprawia, że struktury fraktalne bardzo często pojawiają się w przyrodzie, jako podstawa dla na przykład organizacji kolonii, układu żyłkowania liści, rozkładu pierzastych listków paproci czy form krystalicznych.
Jednym z pierwszych opisanych matematycznie fraktali, jest trójkąt Sierpińskiego. Ten polski matematyk zaproponował w 1915 roku figurę, otrzymaną wedle następującego algorytmu:
- Weź trójkąt równoboczny i łącząc środki boków podziel go na cztery mniejsze trójkąty
- Usuń trójkąt w środku
- Podziel w taki sam sposób trójkąty które pozostały
- Usuń trójkąciki po środku
- Powtórz operację w nieskończoność.
Wydawałoby się że w takiej sytuacji nic na z tego trójkąta powinno nie pozostać, w rzeczywistości jednak, ponieważ operujemy tutaj matematycznie na figurach teoretycznych, po nieskończonych podziałach i usuwaniach trójkątów otrzymamy zbiór punktów matematycznych o charakterystycznym, stałym układzie, który powtarza się w kolejnych powiększeniach w dowolnym miejscu tego trójkąta. Pole takiej figury jest zerowe.
Później wymyślono jeszcze inne podobne figury, jak dywan Sierpińskiego oparty o kwadraty, czy też bardziej dziś znane drzewkowate fraktale używane do tworzenia pięknych grafik komputerowych.
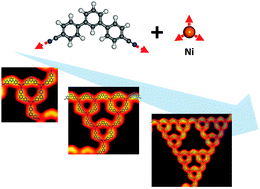
Ale co to ma wspólnego z chemią? Otóż chemicy od dawna zastanawiali się nad produkcją materiałów o strukturze fraktalnej. Jednym z rozwiązań są dendrymery, czyli cząsteczki o wielu rozgałęzieniach, które rozgałęziają się na mniejsze rozgałęzienia a te na jeszcze mniejsze i tak dalej dopóki tylko atomy gałązek jeszcze się w kolejnej warstwie mieszczą. Cząsteczki takie mają formę kulek, których modele przypominają nieco skonfundowanego jeża. Ta oparta jest o etylenodiaminę i amid kwasu propanowego:
Dendrymery bada się obecnie intensywnie pod kątem użycia jako nośniki leków, zewnętrzna warstwa gałązek tworzy bowiem powłoczkę z małymi porami, lecz wewnątrz pojawiają się znaczne, puste przestrzenie w których umieścić można pewną ilość potrzebnej substancji, jaką należy przetransportować w organizmie w pewne określone miejsca.
Tym ciekawsze są próby stworzenia płaskiej cząsteczki o strukturze Trójkąta Sierpińskiego.
Pierwszym takim doniesieniem była obserwacja struktur w pewnym stopniu podobnych do tego fraktala w agregatach DNA na odpowiednim podłożu. Fragmenty DNA ukształtowane w formie molekularnych płytek łączyły się końcami tworząc wzór, który badano mikroskopem sił atomowych.[2]
W zeszłym roku dwaj badacze z UMCS przedstawili symulacje, pokazujące że struktury Trójkąta Sierpińskiego powinny powstawać w warstwach zawierających sztywne cząsteczki organiczne zgięte pod odpowiednim kątem i łączące się na obu końcach za pośrednictwem jonów metalu, jako wynik spontanicznej samoorganizacji.[3]
Pomysł ten okazał się chyba bardzo obiecujący, skoro wyraźnie opierają się na nim najnowsze doniesienia. Najpierw podano informację o tym, że kompleksy terpirydyny z jonami miedzi tworzą struktury stanowiące fragment trójkąta Sierpińskiego.[4] W marcu pojawiła się praca chińskich chemików opisujących tworzenie się rozległych płatów fraktalnego wzoru w wyniku osadzania na powierzchni srebra dwóch podstawowych "cegiełek" - pochodnej terfenylu, z trzema pierścieniami benzenowymi połączonymi wiązaniem w zagiętą cząsteczkę i dwoma atomami bromu na końcach; oraz pochodnej kwaterfenylu zawierającej jeden pierścień benzenu więcej. Cząsteczki te łączyły się ze sobą przez oddziaływania między bromem a wodorem.[5]
Najnowsza praca opisuje płaty kompleksów dwunitrylu terfenylu z niklem na powierzchni srebra, w których pojawiają się płaty wzoru Trójkąta Sierpińskiego. [6]
Barwnik z ery jurajskiej
Skamieniałości dawnych zwierząt i roślin w większości wyglądają jak specyficznie ukształtowana skała, są szare, białe, niekiedy opalizują jak perła. Dlatego zachowanie się pewnych barwników sprzed milionów lat stanowi ciekawy przypadek. Tak jest ze skamieniałościami wymarłych jurajskich alg Solenopora o wapiennych skorupkach, które tworzyły gąbczaste kolonie, z czasem kamieniejące, z przerastającymi rocznymi warstwami. W przypadku niektórych okazów daje się zauważyć wyraźne różowe zabarwienie, będące najwyraźniej pozostałościami pierwotnego pigmentu. W niedawno opublikowanej pracy zbadano właściwości tego barwnika, stwierdzając że to bardzo nietypowa substancja.
Barwnik otrzymany ze skamielin Solenopora jurassica sprzed około 150 milionów lat, składa się z dwóch fragmentów węglowodorowych, stanowiących najwyraźniej nie znaną pochodną antybiotyku klostrubiny A (clostrubin A) i połączonych przez atom boru ugrupowaniem spiroboranowym. Związki organiczne zawierające bor są w naturze ogółem dosyć rzadkie.
Klostrubina jest antybiotykiem wykazującym aktywność przeciwko wielu szczepom odpornych drobnoustrojów i dlatego wzbudza duże nadzieje. Jest substancją poznaną całkiem niedawno, wyizolowaną w zeszłym roku z bakterii z rodzaju Clostridium. Duże podobieństwo struktur nowego antybiotyku i cząsteczki skamieniałego barwnika, nazwanego borolitochromem (czyli dosłownie borowym barwnikiem kamieni) jest o tyle ciekawe, że dotyczy różnych grup organizmów. Najwyraźniej geny odpowiedzialne za syntezę od dawna krążą w ekosystemie, gdzieniegdzie ujawniając się wyraźnie.
[7]
Ile atomów tworzy metal?
Wraz z przyjęciem i potwierdzeniem atomowej teorii budowy materii, chemicy i fizycy o bardziej filozoficznym zacięciu zaczęli zastanawiać się nad w sumie dość oczywistym pytaniem - ile potrzeba atomów bądź cząsteczek, aby z materii utworzyć materiał? Pojedynczy atom węgla ma inne właściwości niż choćby najmniejszy diament, trudno jest jednak wskazać moment, gdy następuje to przejście. Jest to swoisty odpowiednik "paradoksu łysego" - dwa stany skrajne, to jest łysina i pełne owłosienie, są od siebie bardzo wyraźnie różne; zarazem jednak jeśli osobie o pełnym owłosieniu zaczną pojedynczo wypadać włosy, trudno będzie nam wyznaczyć dokładną granicę od kiedy można już mówić o łysinie a kiedy jeszcze jest to tylko przerzedzenie włosów.
Ostatnie badania klastrów atomów metali pokazują jednak, że granicę naszej niepewności można w dużym stopniu zawęzić.
Metale to substancje stałe charakteryzujące się obecnością swobodnych elektronów poruszających się po sieci krystalicznej i tworzących wspólną, dużą chmurę elektronową. Właśnie dlatego metale dobrze przewodzą ciepło i elektryczność oraz odbijają światło ze srebrzystym, metalicznym połyskiem. Odpowiednio duże skupiska atomów metali też będą tworzyły swoją chmurę elektronową ale już pozostałe właściwości metaliczne niekoniecznie mogą być realizowane. Bardzo małe klastry zachowują się jak cząsteczki jakiegoś związku, często wykazując dość nieoczekiwane właściwości, przykładowo klastry 13 atomów glinu zachowują się jakby były atomem halogenku, mogąc oddawać elektrony i tworzyć aniony.
Fińscy chemicy z Uniwersytetu Jyväskylä badali takie właśnie graniczne klastry atomów złota, sprawdzając w jaki sposób reagują ze światłem. Klastry małe, mniejsze niż 102 atomy, zachowywały się jak cząsteczki. Pod wpływem fotonów przybierały pewne stany energetyczne obejmujące cały klaster, a wypromieniowanie i rozproszenie energii następowało stosunkowo (jak na atomową skalę) wolno. Grupy powyżej 144 atomów zachowywały się tak jak makroskopowe kawałki metalu, to jest szybko rozpraszały energię padającego światła, odbijały je zgodnie z prawem odbicia od lustra i nie przyjmowały ogólnoklastrowych stanów energetycznych.
Różnica była dość drastyczna - klastry większe o 42 atomy rozpraszały energię fotonów 100 razy szybciej. Natomiast klastry o wielkościach pośrednich wykazywały pośrednie własności, szybko zmieniające się z dodawaniem kolejnych atomów.
Tym samym w pewnym stopniu możliwe staje się wyznaczenie granicy między światem praw kwantowych a światem zjawisk fizyki klasycznej.[8]
-------------------
Źródła:
[1] A Bieler et al, Nature, 2015, DOI: 10.1038/nature15707
[2] Paul W K Rothemund, Nick Papadakis, Erik Winfree; Algorithmic self-assembly of DNA Sierpinski triangles. PLoS Biol 2004 Dec 7;2(12):e424. Epub 2004 Dec 7. [Open Acces]
[3] D. Nieckarz, P. Szabelski; Simulation of the self-assembly of simple molecular bricks into Sierpiński triangle, Chem. Commun., 2014,50, 6843-6845
[4] Rajarshi S. et al.; One-step multicomponent self-assembly of a first-generation Sierpiński triangle: from fractal design to chemical reality. Angew Chem Int Ed Engl 2014 Nov 11;53(45):12182-5.
[5] Shang J. et al.; Assembling molecular Sierpiński triangle fractals, Nature Chemistry 7, 389–393
On-surface construction of a metal–organic Sierpiński triangle, Chem. Commun., 2015,51, 14164-14166
[7] Klaus Wolkenstein et al. Structure and Absolute Configuration of Jurassic Polyketide-Derived Spiroborate Pigments Obtained from Microgram Quantities, J. Am. Chem. Soc., 2015, 137 (42), pp 13460–13463 (2015).[Open Access]
[8] Mustalhi S. et al.; Molecule-like Photodynamics of Au102(pMBA)44 Nanocluster, ACS Nano, 2015, 9 (3), pp 2328–2335
Misja Rosetta badająca kometę 67/P Churymov-Gerasimenko budzi dziś mniejsze zainteresowanie, zwłaszcza od czasu nieszczęśliwie przedwczesnego końca lądownika, niemniej instrumenty sondy wciąż wysyłają ciekawe dane. Najnowsza publikacja Nature donosi o wykryciu w gazach wytryskujących z powierzchni jądra kometarnego molekularnego tlenu.
Jednym z instrumentów badawczych sondy jest spektrometr masowy ROSINA-DFMS. Przyrząd ten jonizuje gazy i wykrywa masy składających się nań cząsteczek, wykorzystując skłonność jonów do ruchu w polu elektrycznym z prędkością zależną od stosunku masy do ładunku. Dzięki temu możliwa jest szybka identyfikacja składu.
Dzięki niemu wiadomo było, że większość składu gazów emitowanych przez jądro kometarne (do 95%) stanowiła para wodna oraz tlenek i dwutlenek węgla. Bardziej interesujące okazały się składniki stanowiące resztę. Głównym okazał się być cząsteczkowy tlen, po nim elementarna siarka i metanol, ponadto ślady tlenków azotu i hydrazyny.
Skąd jednak tlen na komecie?
Jego zawartość porównano ze stężeniem dwutlenku węgla, tlenku i pary wodnej, wykazując że tylko w tym trzecim przypadku zachodzi wyraźna korelacja stężeń. Jeśli stężenia tlenu są powiązane ze stężeniami wody, to widocznie gazy te uwalniane są razem. Najprawdopodobniej promieniowanie ultrafioletowe wywołuje radiolizę lodu wodnego na powierzchni komety, powodując powstanie tlenu, który miesza się z lodem i wraz z nim sublimuje. Zachodzenie takiej reakcji potwierdzono zresztą eksperymentalnie. [1]
Fraktalne trójkąty
Fraktale to struktury samopodobne. Matematycznie ujmując, strukturę opisuje pewien prosty algorytm, którego nieskończone iteracje tworzą coraz mniejsze elementy, zachowujące podobieństwo do całości. Ta prostota sprawiająca, że rozległy i wydawałoby się skomplikowany wzór da się wywieść z kilku powtarzanych wciąż reguł sprawia, że struktury fraktalne bardzo często pojawiają się w przyrodzie, jako podstawa dla na przykład organizacji kolonii, układu żyłkowania liści, rozkładu pierzastych listków paproci czy form krystalicznych.
Jednym z pierwszych opisanych matematycznie fraktali, jest trójkąt Sierpińskiego. Ten polski matematyk zaproponował w 1915 roku figurę, otrzymaną wedle następującego algorytmu:
- Weź trójkąt równoboczny i łącząc środki boków podziel go na cztery mniejsze trójkąty
- Usuń trójkąt w środku
- Podziel w taki sam sposób trójkąty które pozostały
- Usuń trójkąciki po środku
- Powtórz operację w nieskończoność.
Wydawałoby się że w takiej sytuacji nic na z tego trójkąta powinno nie pozostać, w rzeczywistości jednak, ponieważ operujemy tutaj matematycznie na figurach teoretycznych, po nieskończonych podziałach i usuwaniach trójkątów otrzymamy zbiór punktów matematycznych o charakterystycznym, stałym układzie, który powtarza się w kolejnych powiększeniach w dowolnym miejscu tego trójkąta. Pole takiej figury jest zerowe.
Później wymyślono jeszcze inne podobne figury, jak dywan Sierpińskiego oparty o kwadraty, czy też bardziej dziś znane drzewkowate fraktale używane do tworzenia pięknych grafik komputerowych.
Ale co to ma wspólnego z chemią? Otóż chemicy od dawna zastanawiali się nad produkcją materiałów o strukturze fraktalnej. Jednym z rozwiązań są dendrymery, czyli cząsteczki o wielu rozgałęzieniach, które rozgałęziają się na mniejsze rozgałęzienia a te na jeszcze mniejsze i tak dalej dopóki tylko atomy gałązek jeszcze się w kolejnej warstwie mieszczą. Cząsteczki takie mają formę kulek, których modele przypominają nieco skonfundowanego jeża. Ta oparta jest o etylenodiaminę i amid kwasu propanowego:
Dendrymery bada się obecnie intensywnie pod kątem użycia jako nośniki leków, zewnętrzna warstwa gałązek tworzy bowiem powłoczkę z małymi porami, lecz wewnątrz pojawiają się znaczne, puste przestrzenie w których umieścić można pewną ilość potrzebnej substancji, jaką należy przetransportować w organizmie w pewne określone miejsca.
Tym ciekawsze są próby stworzenia płaskiej cząsteczki o strukturze Trójkąta Sierpińskiego.
Pierwszym takim doniesieniem była obserwacja struktur w pewnym stopniu podobnych do tego fraktala w agregatach DNA na odpowiednim podłożu. Fragmenty DNA ukształtowane w formie molekularnych płytek łączyły się końcami tworząc wzór, który badano mikroskopem sił atomowych.[2]
W zeszłym roku dwaj badacze z UMCS przedstawili symulacje, pokazujące że struktury Trójkąta Sierpińskiego powinny powstawać w warstwach zawierających sztywne cząsteczki organiczne zgięte pod odpowiednim kątem i łączące się na obu końcach za pośrednictwem jonów metalu, jako wynik spontanicznej samoorganizacji.[3]
Pomysł ten okazał się chyba bardzo obiecujący, skoro wyraźnie opierają się na nim najnowsze doniesienia. Najpierw podano informację o tym, że kompleksy terpirydyny z jonami miedzi tworzą struktury stanowiące fragment trójkąta Sierpińskiego.[4] W marcu pojawiła się praca chińskich chemików opisujących tworzenie się rozległych płatów fraktalnego wzoru w wyniku osadzania na powierzchni srebra dwóch podstawowych "cegiełek" - pochodnej terfenylu, z trzema pierścieniami benzenowymi połączonymi wiązaniem w zagiętą cząsteczkę i dwoma atomami bromu na końcach; oraz pochodnej kwaterfenylu zawierającej jeden pierścień benzenu więcej. Cząsteczki te łączyły się ze sobą przez oddziaływania między bromem a wodorem.[5]
Najnowsza praca opisuje płaty kompleksów dwunitrylu terfenylu z niklem na powierzchni srebra, w których pojawiają się płaty wzoru Trójkąta Sierpińskiego. [6]
Barwnik z ery jurajskiej
Skamieniałości dawnych zwierząt i roślin w większości wyglądają jak specyficznie ukształtowana skała, są szare, białe, niekiedy opalizują jak perła. Dlatego zachowanie się pewnych barwników sprzed milionów lat stanowi ciekawy przypadek. Tak jest ze skamieniałościami wymarłych jurajskich alg Solenopora o wapiennych skorupkach, które tworzyły gąbczaste kolonie, z czasem kamieniejące, z przerastającymi rocznymi warstwami. W przypadku niektórych okazów daje się zauważyć wyraźne różowe zabarwienie, będące najwyraźniej pozostałościami pierwotnego pigmentu. W niedawno opublikowanej pracy zbadano właściwości tego barwnika, stwierdzając że to bardzo nietypowa substancja.
Barwnik otrzymany ze skamielin Solenopora jurassica sprzed około 150 milionów lat, składa się z dwóch fragmentów węglowodorowych, stanowiących najwyraźniej nie znaną pochodną antybiotyku klostrubiny A (clostrubin A) i połączonych przez atom boru ugrupowaniem spiroboranowym. Związki organiczne zawierające bor są w naturze ogółem dosyć rzadkie.
Klostrubina jest antybiotykiem wykazującym aktywność przeciwko wielu szczepom odpornych drobnoustrojów i dlatego wzbudza duże nadzieje. Jest substancją poznaną całkiem niedawno, wyizolowaną w zeszłym roku z bakterii z rodzaju Clostridium. Duże podobieństwo struktur nowego antybiotyku i cząsteczki skamieniałego barwnika, nazwanego borolitochromem (czyli dosłownie borowym barwnikiem kamieni) jest o tyle ciekawe, że dotyczy różnych grup organizmów. Najwyraźniej geny odpowiedzialne za syntezę od dawna krążą w ekosystemie, gdzieniegdzie ujawniając się wyraźnie.
[7]
 |
| Borolitochrom i skała z której go otrzymano. |
Ile atomów tworzy metal?
Wraz z przyjęciem i potwierdzeniem atomowej teorii budowy materii, chemicy i fizycy o bardziej filozoficznym zacięciu zaczęli zastanawiać się nad w sumie dość oczywistym pytaniem - ile potrzeba atomów bądź cząsteczek, aby z materii utworzyć materiał? Pojedynczy atom węgla ma inne właściwości niż choćby najmniejszy diament, trudno jest jednak wskazać moment, gdy następuje to przejście. Jest to swoisty odpowiednik "paradoksu łysego" - dwa stany skrajne, to jest łysina i pełne owłosienie, są od siebie bardzo wyraźnie różne; zarazem jednak jeśli osobie o pełnym owłosieniu zaczną pojedynczo wypadać włosy, trudno będzie nam wyznaczyć dokładną granicę od kiedy można już mówić o łysinie a kiedy jeszcze jest to tylko przerzedzenie włosów.
Ostatnie badania klastrów atomów metali pokazują jednak, że granicę naszej niepewności można w dużym stopniu zawęzić.
Metale to substancje stałe charakteryzujące się obecnością swobodnych elektronów poruszających się po sieci krystalicznej i tworzących wspólną, dużą chmurę elektronową. Właśnie dlatego metale dobrze przewodzą ciepło i elektryczność oraz odbijają światło ze srebrzystym, metalicznym połyskiem. Odpowiednio duże skupiska atomów metali też będą tworzyły swoją chmurę elektronową ale już pozostałe właściwości metaliczne niekoniecznie mogą być realizowane. Bardzo małe klastry zachowują się jak cząsteczki jakiegoś związku, często wykazując dość nieoczekiwane właściwości, przykładowo klastry 13 atomów glinu zachowują się jakby były atomem halogenku, mogąc oddawać elektrony i tworzyć aniony.
Fińscy chemicy z Uniwersytetu Jyväskylä badali takie właśnie graniczne klastry atomów złota, sprawdzając w jaki sposób reagują ze światłem. Klastry małe, mniejsze niż 102 atomy, zachowywały się jak cząsteczki. Pod wpływem fotonów przybierały pewne stany energetyczne obejmujące cały klaster, a wypromieniowanie i rozproszenie energii następowało stosunkowo (jak na atomową skalę) wolno. Grupy powyżej 144 atomów zachowywały się tak jak makroskopowe kawałki metalu, to jest szybko rozpraszały energię padającego światła, odbijały je zgodnie z prawem odbicia od lustra i nie przyjmowały ogólnoklastrowych stanów energetycznych.
Różnica była dość drastyczna - klastry większe o 42 atomy rozpraszały energię fotonów 100 razy szybciej. Natomiast klastry o wielkościach pośrednich wykazywały pośrednie własności, szybko zmieniające się z dodawaniem kolejnych atomów.
Tym samym w pewnym stopniu możliwe staje się wyznaczenie granicy między światem praw kwantowych a światem zjawisk fizyki klasycznej.[8]
-------------------
Źródła:
[1] A Bieler et al, Nature, 2015, DOI: 10.1038/nature15707
[2] Paul W K Rothemund, Nick Papadakis, Erik Winfree; Algorithmic self-assembly of DNA Sierpinski triangles. PLoS Biol 2004 Dec 7;2(12):e424. Epub 2004 Dec 7. [Open Acces]
[3] D. Nieckarz, P. Szabelski; Simulation of the self-assembly of simple molecular bricks into Sierpiński triangle, Chem. Commun., 2014,50, 6843-6845
[4] Rajarshi S. et al.; One-step multicomponent self-assembly of a first-generation Sierpiński triangle: from fractal design to chemical reality. Angew Chem Int Ed Engl 2014 Nov 11;53(45):12182-5.
[5] Shang J. et al.; Assembling molecular Sierpiński triangle fractals, Nature Chemistry 7, 389–393
On-surface construction of a metal–organic Sierpiński triangle, Chem. Commun., 2015,51, 14164-14166
[7] Klaus Wolkenstein et al. Structure and Absolute Configuration of Jurassic Polyketide-Derived Spiroborate Pigments Obtained from Microgram Quantities, J. Am. Chem. Soc., 2015, 137 (42), pp 13460–13463 (2015).[Open Access]
[8] Mustalhi S. et al.; Molecule-like Photodynamics of Au102(pMBA)44 Nanocluster, ACS Nano, 2015, 9 (3), pp 2328–2335
czwartek, 15 października 2015
Doktorat
Po różnych zawirowaniach życiowych wreszcie się udało - dostałem się na studia doktoranckie na WCh UW. W związku z czym pozdrawiam czytelników z tej uczelni.
Po tym jak w zeszłym roku nie udało mi się dostać na doktoranckie na IChO PAN musiałem czegoś sobie poszukać. Na krótko, dzięki upierdliwemu obdzwanianiu czy aby nie mają możliwości przyjęcia na staż, zostałem tam przyjęty na wakat za zastępstwo pracownicy która miała wypadek, ale to skończyło się i w lutym zostałem bez dobrych perspektyw na przyszłość. Potem kilka miesięcy szukałem pracy (temat zderzenia nadziei absolwenta z oczekiwaniami pracodawców jest zresztą godny osobnego wpisu) aż w wakacje udało mi się znaleźć etat w małej fabryczce chemicznej, gdzie jednakowoż wykonywałem głównie prace fizyczne. Gdy pod koniec września ponownie nie udało się dostać do PAN-u, studia na Uniwersytecie Warszawskim pozostawały w zasadzie jedyną możliwością aby móc kontynuować pracę naukową i nie stracić kontaktu z dziedziną.
Doktorat wykonywać będę w grupie profesora Czarnockiego zajmującej się chemią związków naturalnych i syntezą stereokontrolowaną, znam już prawdopodobny temat badań, dość ciekawy, trochę podobny do tematu pracy magisterskiej. Mam nadzieję że będę mógł wrzucać tutaj relacje z prowadzonych badań.
Po tym jak w zeszłym roku nie udało mi się dostać na doktoranckie na IChO PAN musiałem czegoś sobie poszukać. Na krótko, dzięki upierdliwemu obdzwanianiu czy aby nie mają możliwości przyjęcia na staż, zostałem tam przyjęty na wakat za zastępstwo pracownicy która miała wypadek, ale to skończyło się i w lutym zostałem bez dobrych perspektyw na przyszłość. Potem kilka miesięcy szukałem pracy (temat zderzenia nadziei absolwenta z oczekiwaniami pracodawców jest zresztą godny osobnego wpisu) aż w wakacje udało mi się znaleźć etat w małej fabryczce chemicznej, gdzie jednakowoż wykonywałem głównie prace fizyczne. Gdy pod koniec września ponownie nie udało się dostać do PAN-u, studia na Uniwersytecie Warszawskim pozostawały w zasadzie jedyną możliwością aby móc kontynuować pracę naukową i nie stracić kontaktu z dziedziną.
Doktorat wykonywać będę w grupie profesora Czarnockiego zajmującej się chemią związków naturalnych i syntezą stereokontrolowaną, znam już prawdopodobny temat badań, dość ciekawy, trochę podobny do tematu pracy magisterskiej. Mam nadzieję że będę mógł wrzucać tutaj relacje z prowadzonych badań.
środa, 14 października 2015
Tajemnice czerni czyli bardzo długie nazwy
Będąc ostatnio w sklepie przeglądałem różne płyny i proszki do płukania tkanin, szukając czegoś do usuwania zafarbowania, bowiem po nieopatrznym wrzuceniu wraz z bielizną czarnych skarpet, okazało się, że wszystkie rzeczy zabarwiły się na kolor szaro-niebieski. Oczywiście zaglądałem na składy bo nie chodziło mi po prostu o wybielacz. Niestety składy środków czyszczących są zwykle nadmiernie ogólnikowe. Nawet mi, jako chemikowi, skład "10% anionowe środki powierzchniowo czynne, 10% kationowe środki czynne, 10% niejonowe środki czynne" nic właściwie nie mówi. Dlatego też w pewnym zdumieniem odczytałem skład środka mającego przywracać czarny kolor, gdzie nie tylko podano główne składniki, ale w dodatku podano ich pełne nazwy chemiczne. A były to nazwy tak długie i skomplikowane, że ledwie się zmieściły. Osobę nie zorientowaną takie nazwy mogą przerazić. Zaś chemika zaciekawić.
Nazwy te to:
* 4-amino-6-[5-(5-chloro-2,6-difluoropirymidyno-4-ylamino)-2-sulfonianofenyloazo]-5-hydroky-3-{4-[2-(sulfonianooksy)etylosulfonylo]fenyloazo} naftaleno-2,7-disulfonian litu-sodu-wodoru
* 7-(4,6-dichloro-1,3,5-triazyn-2-yloamino-4-hydroksy-3-{4-[2(sulfonianoksy)etylsulfonylo] fenyloazo} naftaleno-2-sulfonian disodu;
* kwas 5-naftaleno-disulfonowy,2-[2-8[[4-chloro-6[[4-[[2-(sulfooksy)etylo]sulfonylo]fenylo]amino-1,3,5-triazin-2-yl]amino]-1-hydroksy-3,6-disulfo-2-naftalenylo]diazenylo]-, sól sodowa(1:5)
Zaś aby je prawidłowo odczytać należy dowiedzieć się coś niecoś na temat tego jak właściwie tworzone są nazwy związków chemicznych.
Nazewnictwo związków organicznych podporządkowane jest zasadzie opisania związków tak, aby możliwe było dysponując samą nazwą rozrysować strukturę cząsteczki. Najczęściej używany sposób traktuje strukturę cząsteczki hierarhicznie, to jest wyróżnia pewien rdzeń do którego przyczepione są podstawniki, do tych mogą być dołączone inne poboczne podstawniki zależnie od stopnia rozgałęzienia. Nazwa wymienia więc kolejno podstawniki podczepione do rdzenia, najczęściej w kolejności alfabetycznej aby na końcu przejść do nazwy rdzenia i zakończyć końcówką specyficzną dla grupy funkcyjnej. Podstawnikom przypisywane są liczbowe określenia miejsca w którym są dołączone do rdzenia, liczone począwszy od grupy funkcyjnej rdzenia. Najbardziej optymalna zasada jest taka, aby zaczynać liczenie podstawników od takiego miejsca, aby przypisane im liczby były jak najmniejsze.
Nazwy podstawników są zwykle tworzone od nazw związków z jakich można by je otrzymać. Podstawnik -CH3, będący metanem bez jednego wodoru, to metyl, podstawnik -CH2-CH3 będący etanem bez jednego wodoru to etyl. Czasem nazwy podstawników pochodzą od innej niż zwykle używana nazwy związku wyjściowego, podstawnik będący benzenem bez jednego wodoru to nie benzenyl tylko fenyl. Pewne grupy mają swoje stałe nazwy, przykładowo złożona z pięciu węgli grupa którą można by nazwać dimetyloprolylową, jest nazywana tert-amylową, zaś grupa utworzona z etenu to grupa winylowa.
Zacznijmy więc od najprostszych przypadków:
Rdzeniem cząsteczki jest dwuwęglowy łańcuch etanu. Do niego podłączone są dwa podstawniki - chlorowy i hydroksylowy. Ten drugi można uznać za grupę funkcyjną zaś sam związek za pochodną alkoholu etylowego. Licząc od węgla przy którym jest grupa -OH, chlor jest połączony z drugim, stąd też nazwa 2-chloroetanol. Następny przykład:
Tutaj sytuację możemy potraktować dwojako - albo uznamy, że to nadal pochodna etanolu, tylko że z dodaną grupą metylową -CH3, albo uznamy że to pochodna propanolu. W tym pierwszym przypadku zaczniemy nazwę od podstawnika zaczynającego się na literę wcześniejszą w alfabecie, będzie to 2-chloro-2-metyloetanol. Zwykle jednak w takich sytuacjach preferuje się przedłużenie rdzenia czyli potraktowanie metylu jako dalszej części łańcucha. Związek będzie wtedy pochodną propanolu i nazywać się będzie 2-chloropropanol.
Oba sposoby opisu są w zasadzie równoważne bo z obu można wywnioskować poprawną strukturę, preferowany jest jednak ten drugi, bowiem skutkuje prostszą nazwą. Różnice w sposobie opisu powodują, że często związek na wiele synonimów nazwy.
Tutaj znów sytuację można różnie opisywać. Możemy na przykład uznać, że jest to pochodna etanu, z chlorem przy jednym węglu, dwoma metylami przy drugim i grupą fenylową przy tymże. Wtedy nazwa będzie brzmiała 1-chloro-2,2-dimetylo-2-fenyloetan. Możemy uznać jedną z grup metylowych za przedłużenie łańcucha, tak że będzie to pochodna propanu o nazwie 1-chloro-2-metylo-2-fenylopropan. Ale możemy też uznać, że dwie grupy metylowe i łączący je węgiel to główny rdzeń, wtedy związek będzie się nazywał 2-chlorometylo-2-fenylopropan. Ja preferowałbym tą drugą ale w internecie związek częściej występuje pod tą ostatnią.
Kolejny przypadek zawiera podstawniki połączone przez różne miejsca:
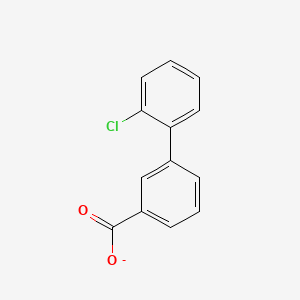
Tą cząsteczkę można opisać na dwa sposoby - albo jako pochodną chlorobenzenu albo jako pochodną kwasu benzoesowego. W tym pierwszym przypadku grupa złożona z kwasu benzoesowego będzie grupą 3-karboksyfenolową albowiem dla tego podstawnika grupą funkcyjną od której liczone są miejsca jest grupa karboksylowa. Podstawnik jest podłączony przez węgiel od którego grupa ta jest przy trzecim stąd nazwa całego podstawnika 3-karboksyfenylowy. Licząc w rdzeniu od chloru, grupa ta znajduje się na drugim miejscu, stąd aby nie pomieszać cyferek, trzeba dodać nawias w którym mieścić się będzie nazwa całej grupy, stąd zapis: 2-(3-karboksyfenlo)-chlorobenzen.
Możemy też potraktować cząsteczkę jak pochodną kwasu benzoesowego, wówczas nazwa będzie brzmiała kwas 3-(2-chlorofenylo)-benzoesowy. Ta druga wersja jest częściej używana.
A teraz podstawnik z podstawnikiem z podstawnikiem:
I trzy możliwości - albo to pochodna chlorobenzenu, albo fenolu albo kwasu benzoesowego. Dla pierwszej wersji nazwa brzmi: 2-{4-[2-(2-karboksylofenylo)fenoksylo]}-metylenochlorobenzen bo jest to chlorobenzen do którego w miejscu 2 podłączono przez mostek metylenowy -CH2- fenol, łączony przez pozycję 4 wobec grupy hydroksylowej i sam mający przy pozycji 2 grupę karboksyfenylową, połączoną przez węgiel w pozycji 2. I tu widać ten hierarchiczny opis.
Dla drugiej opcji będzie to 4-(2-chlorofenylometyleno)-2-(2-karboksyfenylo)-fenol. Dla trzeciej kwas 2-{2-[4-(2-chlorofenylometyleno)-fenoksy]}-benzoesowy. Ta druga wersja jest preferowana bo jest w niej mniej nawiasów.
Skoro już przeszliśmy ten krótki kurs nazewnictwa, zajmijmy się tymi długaśnymi nazwami z doczerniacza.
4-amino-6
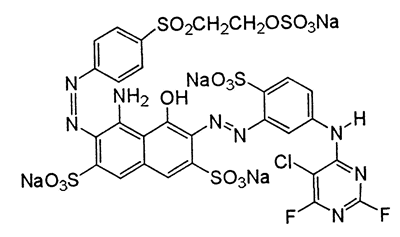
Pierwszy związek jest bardzo długi:
Wiemy, że rdzeń ten zwiera już dwie grupy sulfonowe, a co z resztą? Resztą są cztery podstawniki, w tym dwa bardzo rozbudowane, pierwszy to fragment "4-amino" i jest to grupa aminowa -NH2 podłączona przy pozycji 4 a drugi zaczyna się od "6-[5-(5-chloro-" trzeci to "5-hydroksy" i jest grupą hydroksylową -OH podczepioną przy pozycji 5, czwarty zaczyna się od "3-{4-[2(sulfonianooksy". Nazwę można więc rozbić na części oznaczając je kolorami:
4-amino-6-[5-(5-chloro-2,6-difluoropirymidyno-4-ylamino)-2-sulfonianofenyloazo]-5-hydroksy-3-{4-[2-(sulfonianooksy)etylosulfonylo]fenyloazo} naftaleno-2,7-disulfonian litu-sodu-wodoru
To nadal jest zawiłe ale już widzimy jak to opanować. Teraz rozbierzmy na części podstawniki:
* 6-[5-(5-chloro-2,6-difluoropirymidyno-4-ylamino)-2-sulfonianofenyloazo] - tutaj mamy trzy wyraźne części. Grupa zaczyna się od pirymidyny zawierającej dwa podstawniki fluorowe w pozycjach 2 i 6 wobec azotu od którego zaczynamy liczyć i chlorowy w pozycji 5, i jest połączona przez węgiel 4 z mostkową aminą:
Poprzez tą aminę połączona jest z węglem 5 grupy 2-sulfonianofenyloazowej:
Która poprzez grupę azową połączona jest z rdzeniem naftalenowym w pozycji 6
Drugi podstawnik:
* 3-{4-[2-(sulfonianooksy)etylosulfonylo]fenyloazo} - zaczyna się od grupy sulfonianooksylowej, czyli reszty kwasu siarkowego połączonej przez tlen -OHSO3 z grupą etylową do drugiego węgla. Grupa ta przez pierwszy węgiel etylu jest połączona z sulfonylem poprzez który w pozycji 4 łączy się z grupą fenyloazową:
a przez ugrupowanie azowe z miejscem 3 rdzenia naftalenowego.
Po złożeniu tego do kupy otrzymujemy taki oto związek, tu w wersji soli sodowej:
Czym jest ten skomplikowany związek? Rozpuszczalną formą barwnika azowego. Grupy azowe -N=N- to silne chromofory a więc zapewniają cząsteczce kolor, podstawione wzmacniającymi efekt grupami aromatycznymi z wyciągającymi elektrony podstawnikami halogenowymi dają w efekcie silne zabarwienie. Ten konkretny związek znany jest też pod nazwą handlową Reactive Blue 225 i farbuje na kolor ciemnoniebieski
7-[4-(6-dichloro
Następny związek w składzie to także bardzo rozgałęziona sól sulfoniowa będąca pochodną naftalenu. Zaznaczmy poszczególne części:
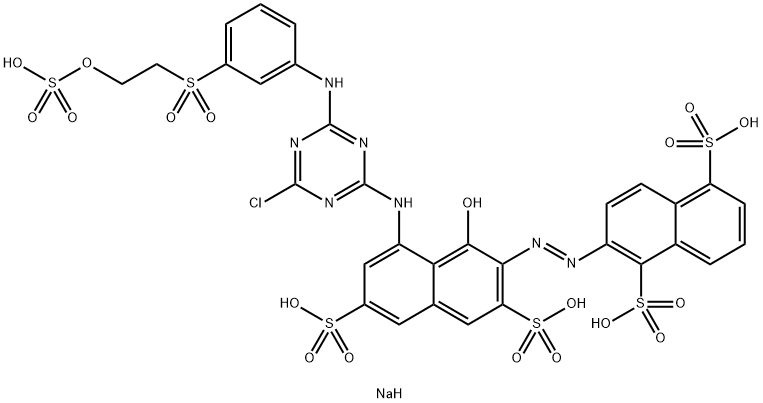
7-(4,6-dichloro-1,3,5-triazyn-2-yloamino-4-hydroksy-3-{4-[2(sulfonianoksy)etylsulfonylo] fenyloazo} naftaleno-2-sulfonian disodu;
Rdzeniem jest naftalen, który w pozycji 4 ma dołączoną grupę hydroksylową a w pozycji 2 sulfonylową. Dwa pozostałe podstawniki są rozbudowane.
Pierwszy to pierścień 1,3,5-triazyny, związku aromatycznego w którym w sześciokątnym pierścieniu co drugi atom stanowi azot. Pierścień w dwóch miejscach podstawiony jest chlorem i poprzez węgiel w pozycji 2 połączony z aminą, a ta z naftalenem w pozycji 7. Drugi jest taki sam jak w poprzednim związku - grupa sulfoksylowa połączona przez tlen z etanem, ten z ugrupowaniem sulfonowym, to z benzenem a ten z grupą azową łączącą go z naftalenem.
Ostateczny wzór przedstawia się zatem następująco:
Związek ma też oznaczenie handlowe Orange HF SNK lub Reactive Orange FD 19969 FW, jest to zatem kolejny barwnik azowy, tym razem zapewne ciemno-pomarańczowy. Znajduje się na listach substancji niebezpiecznych w dziale substancji wywołujących podrażnienia skóry[2] [3]
kwas 5-naftaleno-disulfonowy
Ten związek będzie można już łatwiej rozszyfrować bo pewne jego elementy są podobne do poprzednich.
Zaznaczając poszczególne części, jest to: kwas 2-[2-[8-[[4-chloro-6[[4-[[2-(sulfooksy)etylo]sulfonylo]fenylo]amino-1,3,5-triazin-2-yl]amino]-1-hydroksy-3,6-disulfo-2-naftalenylo]diazenylo]-5-naftaleno-disulfonowy sól sodowa(1:5)
Cząsteczka wygląda zatem następująco:
Nazwa handlowa Reactive Red 195A [4]
I po co to wszystko?
Cóż. Czarne tkaniny szarzeją z powodu spierania lub ścierania ciemnych barwników. Dlatego omawiany doczerniacz po prostu farbuje tkaninę. Są to barwniki reaktywne, to jest wchodzące w reakcję z materiałem włókna i tworzące trwałe połączenia; reakcji ulegają włókna naturalne, dlatego preparat nie nadaje się do tkanin z włókiem całkowicie sztucznych.
Zauważmy, że żaden z wymienionych barwników nie jest czarny. Tak na prawdę nie ma czarnych barwników, czerń oznacza, że dany przedmiot pochłonął na tyle dużo światła, iż nie jesteśmy w stanie określić jego koloru, jednak rozcieńczając czarne tusze możemy się przekonać, że zwykle są one po prostu mieszanką bardzo ciemnych brązów i błękitów (zaś brąz to bardzo ciemny odcień pomarańczy). Czarne tulipany są w rzeczywistości fioletowe, tylko dość intensywnie. Czerń można osiągnąć zatem albo używając jakiegoś barwnika w tak dużym stężeniu, że będzie pochłaniał większość światła, albo mieszankę barwników, z których każdy pochłania jakąś część spektrum.
W tym przypadku zmieszanie barwników intensywnie niebieskiego, pomarańczowego i żółtego, daje czerń. Być może gdybyśmy włożyli do prania białą tkaninę, to okazałaby się ostatecznie raczej szara, ale dla tkanin czarnych które tylko nieco spłowiały i wytarły się wystarczy przyciemnienie jasnych miejsc aby wyglądały na zdecydowanie czarniejsze.
----------
* http://www.auchandirect.pl/sklep/artykuly/1171_1240_1630/99701801/Dla-Domu/Pralnia/Odplamiacze/Renowator-koloru-czarnego-Dylon-2-szt.-1-szt
[2] http://www.pis.gov.pl/userfiles/file/departament%20Higieny%20%C5%9Arodowiska%20JUPIK/chemia%20prawo/elincsk-wykaz%20substancji.pdf pozycja 404-600-07
[3] http://www.chemindustry.com/chemicals/41146.html
[4] http://ofmpub.epa.gov/sor_internet/registry/substreg/searchandretrieve/advancedsearch/externalSearch.do?p_type=CASNO&p_value=77365-64-1
Nazwy te to:
* 4-amino-6-[5-(5-chloro-2,6-difluoropirymidyno-4-ylamino)-2-sulfonianofenyloazo]-5-hydroky-3-{4-[2-(sulfonianooksy)etylosulfonylo]fenyloazo} naftaleno-2,7-disulfonian litu-sodu-wodoru
* 7-(4,6-dichloro-1,3,5-triazyn-2-yloamino-4-hydroksy-3-{4-[2(sulfonianoksy)etylsulfonylo] fenyloazo} naftaleno-2-sulfonian disodu;
* kwas 5-naftaleno-disulfonowy,2-[2-8[[4-chloro-6[[4-[[2-(sulfooksy)etylo]sulfonylo]fenylo]amino-1,3,5-triazin-2-yl]amino]-1-hydroksy-3,6-disulfo-2-naftalenylo]diazenylo]-, sól sodowa(1:5)
Zaś aby je prawidłowo odczytać należy dowiedzieć się coś niecoś na temat tego jak właściwie tworzone są nazwy związków chemicznych.
Nazewnictwo związków organicznych podporządkowane jest zasadzie opisania związków tak, aby możliwe było dysponując samą nazwą rozrysować strukturę cząsteczki. Najczęściej używany sposób traktuje strukturę cząsteczki hierarhicznie, to jest wyróżnia pewien rdzeń do którego przyczepione są podstawniki, do tych mogą być dołączone inne poboczne podstawniki zależnie od stopnia rozgałęzienia. Nazwa wymienia więc kolejno podstawniki podczepione do rdzenia, najczęściej w kolejności alfabetycznej aby na końcu przejść do nazwy rdzenia i zakończyć końcówką specyficzną dla grupy funkcyjnej. Podstawnikom przypisywane są liczbowe określenia miejsca w którym są dołączone do rdzenia, liczone począwszy od grupy funkcyjnej rdzenia. Najbardziej optymalna zasada jest taka, aby zaczynać liczenie podstawników od takiego miejsca, aby przypisane im liczby były jak najmniejsze.
Nazwy podstawników są zwykle tworzone od nazw związków z jakich można by je otrzymać. Podstawnik -CH3, będący metanem bez jednego wodoru, to metyl, podstawnik -CH2-CH3 będący etanem bez jednego wodoru to etyl. Czasem nazwy podstawników pochodzą od innej niż zwykle używana nazwy związku wyjściowego, podstawnik będący benzenem bez jednego wodoru to nie benzenyl tylko fenyl. Pewne grupy mają swoje stałe nazwy, przykładowo złożona z pięciu węgli grupa którą można by nazwać dimetyloprolylową, jest nazywana tert-amylową, zaś grupa utworzona z etenu to grupa winylowa.
Zacznijmy więc od najprostszych przypadków:
Rdzeniem cząsteczki jest dwuwęglowy łańcuch etanu. Do niego podłączone są dwa podstawniki - chlorowy i hydroksylowy. Ten drugi można uznać za grupę funkcyjną zaś sam związek za pochodną alkoholu etylowego. Licząc od węgla przy którym jest grupa -OH, chlor jest połączony z drugim, stąd też nazwa 2-chloroetanol. Następny przykład:
Tutaj sytuację możemy potraktować dwojako - albo uznamy, że to nadal pochodna etanolu, tylko że z dodaną grupą metylową -CH3, albo uznamy że to pochodna propanolu. W tym pierwszym przypadku zaczniemy nazwę od podstawnika zaczynającego się na literę wcześniejszą w alfabecie, będzie to 2-chloro-2-metyloetanol. Zwykle jednak w takich sytuacjach preferuje się przedłużenie rdzenia czyli potraktowanie metylu jako dalszej części łańcucha. Związek będzie wtedy pochodną propanolu i nazywać się będzie 2-chloropropanol.
Oba sposoby opisu są w zasadzie równoważne bo z obu można wywnioskować poprawną strukturę, preferowany jest jednak ten drugi, bowiem skutkuje prostszą nazwą. Różnice w sposobie opisu powodują, że często związek na wiele synonimów nazwy.
Tutaj znów sytuację można różnie opisywać. Możemy na przykład uznać, że jest to pochodna etanu, z chlorem przy jednym węglu, dwoma metylami przy drugim i grupą fenylową przy tymże. Wtedy nazwa będzie brzmiała 1-chloro-2,2-dimetylo-2-fenyloetan. Możemy uznać jedną z grup metylowych za przedłużenie łańcucha, tak że będzie to pochodna propanu o nazwie 1-chloro-2-metylo-2-fenylopropan. Ale możemy też uznać, że dwie grupy metylowe i łączący je węgiel to główny rdzeń, wtedy związek będzie się nazywał 2-chlorometylo-2-fenylopropan. Ja preferowałbym tą drugą ale w internecie związek częściej występuje pod tą ostatnią.
Kolejny przypadek zawiera podstawniki połączone przez różne miejsca:
Tą cząsteczkę można opisać na dwa sposoby - albo jako pochodną chlorobenzenu albo jako pochodną kwasu benzoesowego. W tym pierwszym przypadku grupa złożona z kwasu benzoesowego będzie grupą 3-karboksyfenolową albowiem dla tego podstawnika grupą funkcyjną od której liczone są miejsca jest grupa karboksylowa. Podstawnik jest podłączony przez węgiel od którego grupa ta jest przy trzecim stąd nazwa całego podstawnika 3-karboksyfenylowy. Licząc w rdzeniu od chloru, grupa ta znajduje się na drugim miejscu, stąd aby nie pomieszać cyferek, trzeba dodać nawias w którym mieścić się będzie nazwa całej grupy, stąd zapis: 2-(3-karboksyfenlo)-chlorobenzen.
Możemy też potraktować cząsteczkę jak pochodną kwasu benzoesowego, wówczas nazwa będzie brzmiała kwas 3-(2-chlorofenylo)-benzoesowy. Ta druga wersja jest częściej używana.
A teraz podstawnik z podstawnikiem z podstawnikiem:
I trzy możliwości - albo to pochodna chlorobenzenu, albo fenolu albo kwasu benzoesowego. Dla pierwszej wersji nazwa brzmi: 2-{4-[2-(2-karboksylofenylo)fenoksylo]}-metylenochlorobenzen bo jest to chlorobenzen do którego w miejscu 2 podłączono przez mostek metylenowy -CH2- fenol, łączony przez pozycję 4 wobec grupy hydroksylowej i sam mający przy pozycji 2 grupę karboksyfenylową, połączoną przez węgiel w pozycji 2. I tu widać ten hierarchiczny opis.
Dla drugiej opcji będzie to 4-(2-chlorofenylometyleno)-2-(2-karboksyfenylo)-fenol. Dla trzeciej kwas 2-{2-[4-(2-chlorofenylometyleno)-fenoksy]}-benzoesowy. Ta druga wersja jest preferowana bo jest w niej mniej nawiasów.
Skoro już przeszliśmy ten krótki kurs nazewnictwa, zajmijmy się tymi długaśnymi nazwami z doczerniacza.
4-amino-6
Pierwszy związek jest bardzo długi:
4-amino-6-[5-(5-chloro-2,6-difluoropirymidyno-4-ylamino)-2-sulfonianofenyloazo]-5-hydroksy-3-{4-[2-(sulfonianooksy)etylosulfonylo]fenyloazo} naftaleno-2,7-disulfonian litu-sodu-wodorujednak już z pobieżnego przejrzenia wychwycić można czym jest tutaj rdzeń do którego podczepiono podstawniki - to sama końcówka nazwy "naftaleno-2,7-disulfonian litu-sodu-wodoru". Mamy tu więc do czynienia z rozbudowaną solą sulfonową, zobojętnioną częściowo sodem a częściowo litem, z dwiema grupami sulfonowymi pochodzącymi od kwasu siarkowego w pozycjach 2 i 7. Naftalen to związek złożony z dwóch pierścieni aromatycznych połączonych bokiem i może mieć maksymalnie do ośmiu podstawników liczonych w tej kolejności:
Wiemy, że rdzeń ten zwiera już dwie grupy sulfonowe, a co z resztą? Resztą są cztery podstawniki, w tym dwa bardzo rozbudowane, pierwszy to fragment "4-amino" i jest to grupa aminowa -NH2 podłączona przy pozycji 4 a drugi zaczyna się od "6-[5-(5-chloro-" trzeci to "5-hydroksy" i jest grupą hydroksylową -OH podczepioną przy pozycji 5, czwarty zaczyna się od "3-{4-[2(sulfonianooksy". Nazwę można więc rozbić na części oznaczając je kolorami:
4-amino-6-[5-(5-chloro-2,6-difluoropirymidyno-4-ylamino)-2-sulfonianofenyloazo]-5-hydroksy-3-{4-[2-(sulfonianooksy)etylosulfonylo]fenyloazo} naftaleno-2,7-disulfonian litu-sodu-wodoru
To nadal jest zawiłe ale już widzimy jak to opanować. Teraz rozbierzmy na części podstawniki:
* 6-[5-(5-chloro-2,6-difluoropirymidyno-4-ylamino)-2-sulfonianofenyloazo] - tutaj mamy trzy wyraźne części. Grupa zaczyna się od pirymidyny zawierającej dwa podstawniki fluorowe w pozycjach 2 i 6 wobec azotu od którego zaczynamy liczyć i chlorowy w pozycji 5, i jest połączona przez węgiel 4 z mostkową aminą:
Poprzez tą aminę połączona jest z węglem 5 grupy 2-sulfonianofenyloazowej:
Która poprzez grupę azową połączona jest z rdzeniem naftalenowym w pozycji 6
Drugi podstawnik:
* 3-{4-[2-(sulfonianooksy)etylosulfonylo]fenyloazo} - zaczyna się od grupy sulfonianooksylowej, czyli reszty kwasu siarkowego połączonej przez tlen -OHSO3 z grupą etylową do drugiego węgla. Grupa ta przez pierwszy węgiel etylu jest połączona z sulfonylem poprzez który w pozycji 4 łączy się z grupą fenyloazową:
a przez ugrupowanie azowe z miejscem 3 rdzenia naftalenowego.
Po złożeniu tego do kupy otrzymujemy taki oto związek, tu w wersji soli sodowej:
Czym jest ten skomplikowany związek? Rozpuszczalną formą barwnika azowego. Grupy azowe -N=N- to silne chromofory a więc zapewniają cząsteczce kolor, podstawione wzmacniającymi efekt grupami aromatycznymi z wyciągającymi elektrony podstawnikami halogenowymi dają w efekcie silne zabarwienie. Ten konkretny związek znany jest też pod nazwą handlową Reactive Blue 225 i farbuje na kolor ciemnoniebieski
7-[4-(6-dichloro
Następny związek w składzie to także bardzo rozgałęziona sól sulfoniowa będąca pochodną naftalenu. Zaznaczmy poszczególne części:
7-(4,6-dichloro-1,3,5-triazyn-2-yloamino-4-hydroksy-3-{4-[2(sulfonianoksy)etylsulfonylo] fenyloazo} naftaleno-2-sulfonian disodu;
Rdzeniem jest naftalen, który w pozycji 4 ma dołączoną grupę hydroksylową a w pozycji 2 sulfonylową. Dwa pozostałe podstawniki są rozbudowane.
Pierwszy to pierścień 1,3,5-triazyny, związku aromatycznego w którym w sześciokątnym pierścieniu co drugi atom stanowi azot. Pierścień w dwóch miejscach podstawiony jest chlorem i poprzez węgiel w pozycji 2 połączony z aminą, a ta z naftalenem w pozycji 7. Drugi jest taki sam jak w poprzednim związku - grupa sulfoksylowa połączona przez tlen z etanem, ten z ugrupowaniem sulfonowym, to z benzenem a ten z grupą azową łączącą go z naftalenem.
Ostateczny wzór przedstawia się zatem następująco:
Związek ma też oznaczenie handlowe Orange HF SNK lub Reactive Orange FD 19969 FW, jest to zatem kolejny barwnik azowy, tym razem zapewne ciemno-pomarańczowy. Znajduje się na listach substancji niebezpiecznych w dziale substancji wywołujących podrażnienia skóry[2] [3]
kwas 5-naftaleno-disulfonowy
Ten związek będzie można już łatwiej rozszyfrować bo pewne jego elementy są podobne do poprzednich.
Zaznaczając poszczególne części, jest to: kwas 2-[2-[8-[[4-chloro-6[[4-[[2-(sulfooksy)etylo]sulfonylo]fenylo]amino-1,3,5-triazin-2-yl]amino]-1-hydroksy-3,6-disulfo-2-naftalenylo]diazenylo]-5-naftaleno-disulfonowy sól sodowa(1:5)
Cząsteczka wygląda zatem następująco:
Nazwa handlowa Reactive Red 195A [4]
I po co to wszystko?
Cóż. Czarne tkaniny szarzeją z powodu spierania lub ścierania ciemnych barwników. Dlatego omawiany doczerniacz po prostu farbuje tkaninę. Są to barwniki reaktywne, to jest wchodzące w reakcję z materiałem włókna i tworzące trwałe połączenia; reakcji ulegają włókna naturalne, dlatego preparat nie nadaje się do tkanin z włókiem całkowicie sztucznych.
Zauważmy, że żaden z wymienionych barwników nie jest czarny. Tak na prawdę nie ma czarnych barwników, czerń oznacza, że dany przedmiot pochłonął na tyle dużo światła, iż nie jesteśmy w stanie określić jego koloru, jednak rozcieńczając czarne tusze możemy się przekonać, że zwykle są one po prostu mieszanką bardzo ciemnych brązów i błękitów (zaś brąz to bardzo ciemny odcień pomarańczy). Czarne tulipany są w rzeczywistości fioletowe, tylko dość intensywnie. Czerń można osiągnąć zatem albo używając jakiegoś barwnika w tak dużym stężeniu, że będzie pochłaniał większość światła, albo mieszankę barwników, z których każdy pochłania jakąś część spektrum.
W tym przypadku zmieszanie barwników intensywnie niebieskiego, pomarańczowego i żółtego, daje czerń. Być może gdybyśmy włożyli do prania białą tkaninę, to okazałaby się ostatecznie raczej szara, ale dla tkanin czarnych które tylko nieco spłowiały i wytarły się wystarczy przyciemnienie jasnych miejsc aby wyglądały na zdecydowanie czarniejsze.
----------
* http://www.auchandirect.pl/sklep/artykuly/1171_1240_1630/99701801/Dla-Domu/Pralnia/Odplamiacze/Renowator-koloru-czarnego-Dylon-2-szt.-1-szt
[2] http://www.pis.gov.pl/userfiles/file/departament%20Higieny%20%C5%9Arodowiska%20JUPIK/chemia%20prawo/elincsk-wykaz%20substancji.pdf pozycja 404-600-07
[3] http://www.chemindustry.com/chemicals/41146.html
[4] http://ofmpub.epa.gov/sor_internet/registry/substreg/searchandretrieve/advancedsearch/externalSearch.do?p_type=CASNO&p_value=77365-64-1
Subskrybuj:
Komentarze (Atom)