Gdy jeszcze zajmowałem się syntezami na potrzeby pracy magisterskiej, zaintrygował mnie sposób w jaki wykrystalizowała jedna z otrzymanych oksazolin:
W miarę odparowywana na wyparce, stężenie związku z cienkiej warstwie roztworu rosło, aż od pewnego punktu rozpoczęła się szybka krystalizacja. Jednak zamiast promienistych igieł, kryształy uformowały wyraźne prążki. Musiała nastąpić jakaś specyficzna organizacja, tworząca regularny kształt:
Z innymi oksazolinami czegoś takiego nie obserwowałem. Później zagęszczałem jeszcze jedną frakcję z tym związkiem i w innym naczyniu zachował się identycznie, widocznie to jego właściwość.
ps. znalazłem pracę w IChO PAN w Warszawie, za parę dni opiszę szerzej.
informacje
Pokazywanie postów oznaczonych etykietą magisterskie. Pokaż wszystkie posty
Pokazywanie postów oznaczonych etykietą magisterskie. Pokaż wszystkie posty
środa, 7 stycznia 2015
środa, 9 lipca 2014
Dzisiaj na egzaminie...
... zostałem umagistrzony. I dobrze mi z tym.
Dojechałem do Siedlec nad ranem, aby jeszcze na ostatnią chwilę przejrzeć pytania. Najbardziej obawiałem się pytań o grupy zabezpieczające, bo nie wszystkie pamiętałem, dlatego jeszcze sobie powtarzałem. Pewną obawę wywoływało też pytanie o reakcje sprzęgania, wprawdzie bowiem umiej je objaśnić i podać przykłady, ale mylą mi się ci wszyscy Japończycy, który jest od której.
Z natury jestem osobnikiem łagodnego usposobienia, dlatego denerwować zacząłem się dopiero teraz. Nie byłem pewien jak jest z możliwością poprawki. Pozostało mi czekać tylko na członkow komisji. Równo o 11 wezwano mnie do gabinetu, gdzie siedziała już cała trójka - promotor, recenzent i przewodniczący.
Na początek proszę krótko przedstawić założenia i wyniki pracy.
A więc... (czy zaczyna się zdanie od "a więc"? - przemknęło mi przez myśl). Celem mojej pracy była synteza chiralnych ligandów...
Objaśniłem jakie prace na ten temat były już przeprowadzane, i wobec tego w którym kierunku prowadziłem swoje. Opisałem dwa etapy syntezy. Potem pierwsze sprawdzanie aktywności. Potem wpływ rozpuszczalników i zmiany soli. Na koniec pokazałem tabelkę z wynikami testowania ligandów w reakcji z różnymi aldehydami.
Pytanie - a proszę wobec tego wyjaśnić, dlaczego tu z benzaldehydem reakcja nie zachodzi.
Bo pewnie jest to związek mało reaktywny - strzeliłem z głupia frant.
A co wpływa na reaktywność aldehydów w takiej reakcji? Jakby pan to narysował dla różnych podstawników...
Więc narysowałem tą addycję i cząstkowe ładunki grupy karbonylowej po czym objaśniłem jak na reakcję wpływają podstawniki "wyciągające" i "napychające" ładunek pierścienia. Wszystko zgodnie z wiedzą. Tyle że z tego wynikało, że aldehydy z podstawnikami alkilowymi powinny być jeszcze mniej reaktywne niż benzaldehyd, a było odwrotnie. I oczywiście recenzent o to zapytał.
Chm... No to widocznie jest mało reaktywny w tej konkretnej reakcji? Recenzent pokręcił głową.
Zasadę reaktywności pan zna, ale w tym konkretnym przypadku obstawiam na co innego - benzaldehyd łatwo się zakwasza i neutralizuje zasadę potrzebną do przebiegu reakcji. A teraz proszę wylosować pytania.
Jakoś tak mi się trafiło, że wylosowałem chyba najłatwiejsze - wyjaśnić pojęcia w temacie stereochemii i podać przykłady reakcji alkenów z czynnikami nukleofilowymi, rodnikowymi i utleniającymi. Ucieszyło mnie to bo wcześniej to powtarzałem, przez co do każdego zagadnienia podałem po dwa przykłady. Potrzebne były jeszcze dopytania, bo gdy jako przykład reakcji utleniającej podałem ozonolizę, to zapytano mnie o nazwę cyklicznego związku przejściowego, czego nie pamiętałem.
Na koniec pytanie odnośnie mechanizmu i stereochemii reakcji Henry'ego. To było w zasadzie proste, nie byłem tylko pewien czy proton dodawany na samym końcu reakcji pochodzi ze zprotonowanej zasady czy z będącego medium izopropanolu. No dobrze. Może pan poczekać na zewnątrz.
Toteż z drżącymi kolanami ale już uśmiechem na ustach, wyszedłem. A jaki był wynik? Nie najgorszy. Praca została oceniona zasadniczo dobrze, choć parę pomyłek w bibliografii się ostało (większość nazw czasopism w skrócie, kilka w formie pełnej). To, plus ocena z egzaminu dało mi łącznie ocenę 4,5.
Na koniec profesor zapytał a gdzie się wybieram po tym? Z rozbrajającą mnie samego szczerością wyznałem że nie mam pojęcia, ale myślę o studiach doktoranckich. Gdzieśtam...
To jeśli tak, to we wrześniu będzie nabór w PAN-ie - podsunął. Pomyślę. W zasadzie to ostatnio zainteresowała mnie chemia supramolekularna...
A to by nawet pasowało, bo się tam tym zajmują - objaśnił profesor, i szczerze mówiąc bardzo mnie tym zainteresował....
Dojechałem do Siedlec nad ranem, aby jeszcze na ostatnią chwilę przejrzeć pytania. Najbardziej obawiałem się pytań o grupy zabezpieczające, bo nie wszystkie pamiętałem, dlatego jeszcze sobie powtarzałem. Pewną obawę wywoływało też pytanie o reakcje sprzęgania, wprawdzie bowiem umiej je objaśnić i podać przykłady, ale mylą mi się ci wszyscy Japończycy, który jest od której.
Z natury jestem osobnikiem łagodnego usposobienia, dlatego denerwować zacząłem się dopiero teraz. Nie byłem pewien jak jest z możliwością poprawki. Pozostało mi czekać tylko na członkow komisji. Równo o 11 wezwano mnie do gabinetu, gdzie siedziała już cała trójka - promotor, recenzent i przewodniczący.
Na początek proszę krótko przedstawić założenia i wyniki pracy.
A więc... (czy zaczyna się zdanie od "a więc"? - przemknęło mi przez myśl). Celem mojej pracy była synteza chiralnych ligandów...
Objaśniłem jakie prace na ten temat były już przeprowadzane, i wobec tego w którym kierunku prowadziłem swoje. Opisałem dwa etapy syntezy. Potem pierwsze sprawdzanie aktywności. Potem wpływ rozpuszczalników i zmiany soli. Na koniec pokazałem tabelkę z wynikami testowania ligandów w reakcji z różnymi aldehydami.
Pytanie - a proszę wobec tego wyjaśnić, dlaczego tu z benzaldehydem reakcja nie zachodzi.
Bo pewnie jest to związek mało reaktywny - strzeliłem z głupia frant.
A co wpływa na reaktywność aldehydów w takiej reakcji? Jakby pan to narysował dla różnych podstawników...
Więc narysowałem tą addycję i cząstkowe ładunki grupy karbonylowej po czym objaśniłem jak na reakcję wpływają podstawniki "wyciągające" i "napychające" ładunek pierścienia. Wszystko zgodnie z wiedzą. Tyle że z tego wynikało, że aldehydy z podstawnikami alkilowymi powinny być jeszcze mniej reaktywne niż benzaldehyd, a było odwrotnie. I oczywiście recenzent o to zapytał.
Chm... No to widocznie jest mało reaktywny w tej konkretnej reakcji? Recenzent pokręcił głową.
Zasadę reaktywności pan zna, ale w tym konkretnym przypadku obstawiam na co innego - benzaldehyd łatwo się zakwasza i neutralizuje zasadę potrzebną do przebiegu reakcji. A teraz proszę wylosować pytania.
Jakoś tak mi się trafiło, że wylosowałem chyba najłatwiejsze - wyjaśnić pojęcia w temacie stereochemii i podać przykłady reakcji alkenów z czynnikami nukleofilowymi, rodnikowymi i utleniającymi. Ucieszyło mnie to bo wcześniej to powtarzałem, przez co do każdego zagadnienia podałem po dwa przykłady. Potrzebne były jeszcze dopytania, bo gdy jako przykład reakcji utleniającej podałem ozonolizę, to zapytano mnie o nazwę cyklicznego związku przejściowego, czego nie pamiętałem.
Na koniec pytanie odnośnie mechanizmu i stereochemii reakcji Henry'ego. To było w zasadzie proste, nie byłem tylko pewien czy proton dodawany na samym końcu reakcji pochodzi ze zprotonowanej zasady czy z będącego medium izopropanolu. No dobrze. Może pan poczekać na zewnątrz.
Toteż z drżącymi kolanami ale już uśmiechem na ustach, wyszedłem. A jaki był wynik? Nie najgorszy. Praca została oceniona zasadniczo dobrze, choć parę pomyłek w bibliografii się ostało (większość nazw czasopism w skrócie, kilka w formie pełnej). To, plus ocena z egzaminu dało mi łącznie ocenę 4,5.
Na koniec profesor zapytał a gdzie się wybieram po tym? Z rozbrajającą mnie samego szczerością wyznałem że nie mam pojęcia, ale myślę o studiach doktoranckich. Gdzieśtam...
To jeśli tak, to we wrześniu będzie nabór w PAN-ie - podsunął. Pomyślę. W zasadzie to ostatnio zainteresowała mnie chemia supramolekularna...
A to by nawet pasowało, bo się tam tym zajmują - objaśnił profesor, i szczerze mówiąc bardzo mnie tym zainteresował....
czwartek, 3 lipca 2014
To jest już koniec
I wszystko jest.
Dziś właśnie wydrukowałem pracę magisterską, jutro ją będę składał w dziekanacie. UFF!
Dziś właśnie wydrukowałem pracę magisterską, jutro ją będę składał w dziekanacie. UFF!
sobota, 17 maja 2014
Kiedyś w laboratorium (39.)
W trakcie sprawdzania reaktywności jednego z ligandów, okazało się że daje on z miedzią dosyć trwałe połączenie - na tyle, że wytrącało się z izopropanolu w postaci ciemnobrązowego proszku, możliwego do oddzielenia. Podjąłem się próby wyizolowania kompleksu, i udało mi się odsączyć małą porcję, wyglądem przypominającą kawę rozpuszczalną:
Proszek był bezpostaciowy. Ponieważ połączenie wydawało się dosyć trwałe, postanowiłem je przekrystalizować - otrzymanie kryształów i zbadanie ich rentgenowsko mogłoby potwierdzać teorie na temat struktury kompleksu powstającego podczas reakcji, co było tym bardziej ciekawe, że dla tego typu ligandów jeszcze się to nie udało.
Rozpuściłem więc kompleks w chlorku metylenu, otrzymując żółtobrązowy roztwór:
Po czym wstawiłem całą fiolkę do naczynia z oktanolem. Ten mało lotny alkohol alifatyczny nasycał sobą powietrze w naczyniu, po wstawieniu fiolki część oktanolu z par rozpuszczała się w fiolce, zmniejszając rozpuszczalność związku. Równocześnie część chlorku odparowywała i rozpuszczała się w oktanolu.
Ta wyrafinowana technika miała powoli zatężać roztwór i sprzyjać powstaniu kryształów.
Niestety nie udało się - chlorek po kilku dniach odparował do końca a kompleks zbił się w bezpostaciowe kuleczki. Bywa.
Natomiast pisanie pracy idzie mi jak przez bagna.
Proszek był bezpostaciowy. Ponieważ połączenie wydawało się dosyć trwałe, postanowiłem je przekrystalizować - otrzymanie kryształów i zbadanie ich rentgenowsko mogłoby potwierdzać teorie na temat struktury kompleksu powstającego podczas reakcji, co było tym bardziej ciekawe, że dla tego typu ligandów jeszcze się to nie udało.
Rozpuściłem więc kompleks w chlorku metylenu, otrzymując żółtobrązowy roztwór:
Po czym wstawiłem całą fiolkę do naczynia z oktanolem. Ten mało lotny alkohol alifatyczny nasycał sobą powietrze w naczyniu, po wstawieniu fiolki część oktanolu z par rozpuszczała się w fiolce, zmniejszając rozpuszczalność związku. Równocześnie część chlorku odparowywała i rozpuszczała się w oktanolu.
Ta wyrafinowana technika miała powoli zatężać roztwór i sprzyjać powstaniu kryształów.
Niestety nie udało się - chlorek po kilku dniach odparował do końca a kompleks zbił się w bezpostaciowe kuleczki. Bywa.
Natomiast pisanie pracy idzie mi jak przez bagna.
poniedziałek, 12 maja 2014
Pisząc...
Pisząc sobie właśnie pracę magisterską musiałem pogrzebać w bibliotece:
W sumie najwięcej czasu zajmuje mi robienie rysunków reakcji i wpisywanie danych do tabel, jakoś tak trudno mi się przybrać. Jeśli chodzi o literaturę, irytuje mnie że nie każda praca jest dostępna - uniwersytet ma Tetrahedron Lett. do 1991 roku. Ma też wykupiony dostęp do wersji elektronicznej, ale w formie dokumentów tekstowych prace są dostępne od 1995 roku. W niedostępnym przedziale znajduje się kilka prac w sam raz mi pasujących. Chyba się przejadę do Warszawy i poszukam w PANie.
A. Jeszcze mam poster do zrobienia.
niedziela, 23 marca 2014
Synteza I. - hydroliza i bromowanie
Mocno zaniedbałem opis pracowni, a jestem już faktycznie na półmetku
W poprzednim odcinku opisywałem jak otrzymałem 1,2,4-triazynę z niecyklicznych substratów, była to jednak triazyna podstawiona na miejscu 3 grupą tiometylową -S-Me. Następne dwa etapy, krótsze od tamtego, polegały zatem na zhydrolizowaniu tej grupy do hydroksylowej -OH i jej wymianie na bromkową.
Przyłączona do pierścienia grupa tiometylowa formalnie rzecz biorąc jest drugą połówką tioestru i jako taka ulega hydrolizie w warunkach silnie zasadowych:
Wziąłem więc oczyszczoną triazynę z poprzedniego etapu, a było jej 1,5 g, zalałem 9% roztworem wodorotlenku potasu i mieszałem, ogrzewając pod chłodnicą:
Wylot chłodnicy połączyłem przez rurkę bezpośrednio z kanałem wyciągu, aby ograniczyć rozchodzenie się po pracowni wybitnie śmierdzącego merkaptanu metylu. Niskotopliwa triazyna utworzyła na powierzchni roztworu brązowawy olej, który w miarę postępu reakcji zanikał. Mniej więcej po godzinie olejek zanikł całkowicie, zaś zawartość kolby zmętniała. Odstawiłem ją w chłodne miejsce aby słabo rozpuszczalny produkt się zestalił. Po tym czasie przesączyłem osad na lejku pod próżnią, przemywając niewielką ilością wody i otrzymując 1,2 g jasnokremowej 3-hydroksy-5-fenylo-1,2,4-triazyny. Dla kontroli wykonałem płytkę TLC w układzie chlorek metylenu / metanol 100:1, porównując z próbką tiometylotriazyny:
Jak widać po hydrolizie praktycznie nie pozostało ani trochę substratu, ciemniejsza plamka na początku to zapewne ślady merkaptanu, co jednak nie przeszkadzało w kolejnym etapie
Bromowanie
Trzeci etap polegał na wymianie grupy hydroksylowej na bromkową. Użyłem tutaj jako środka bromującego bromku fosforylu POBr3, mającego postać pomarańczowych, łatwotopliwych kryształków:
Natomiast otrzymana poprzednio i wysuszana hydroksytriazyna, była miałkim, białym proszkiem:
Bromek miał bardzo ostry zapach, jego opary były zresztą trujące. W kontakcie z wilgocią hydrolizował dając białe opary, dlatego odważałem go szybko, zaś chłodnicę podłączoną do kolby dokładnie osuszyłem i zabezpieczyłem rurką ze środkiem suszącym
W tym przypadku nie potrzebny był rozpuszczalnik - po ogrzaniu bromek roztopił się w ciecz, w której rozpuścił się drugi substrat. Całość mieszała się przez godzinę w 120 stopniach:
Po tym czasie przerwałem ogrzewanie a gdy zawartość się ochłodziła, dodałem do środka drobno pokruszonego lodu. Lód topniał w wodę która hydrolizowała bromek. Zawartość kolby ogrzewała się podczas hydrolizy, stąd użycie lodu. Zarazem jednak trzeba było szybko rozetrzeć zawartość na drobno - powstający z hydrolizy bromowodór, uwięziony w porach ziaren, zakwaszał je powodując odwrócenie reakcji, toteż mieszaninę poreakcyjną roztarłem w moździerzu:
i odsączyłem, przemywając osad wodą. Po wysuszeniu zaskakująco przypominał kawę rozpuszczalną. Nie był to jednak jeszcze produkt, lecz dopiero mieszanina do rozdziału. Oczywiście na kolumnie.
Rozdział w czystym chlorku metylenu przebiegał jednak bardzo łatwo, i nie miałem żadnych atrakcji przy wyparce, zakończyłem więc syntezę z 0,66 g produktu, z wydajnością 44 %
3-bromo-5-fenylo-1,2,4-triazyna okazała się mieć właściwości drażniące - gdy podrapałem się po nosie zanieczyszczonym nią palcem, jeszcze długo piekło mnie w tym miejscu.
W poprzednim odcinku opisywałem jak otrzymałem 1,2,4-triazynę z niecyklicznych substratów, była to jednak triazyna podstawiona na miejscu 3 grupą tiometylową -S-Me. Następne dwa etapy, krótsze od tamtego, polegały zatem na zhydrolizowaniu tej grupy do hydroksylowej -OH i jej wymianie na bromkową.
Przyłączona do pierścienia grupa tiometylowa formalnie rzecz biorąc jest drugą połówką tioestru i jako taka ulega hydrolizie w warunkach silnie zasadowych:
Wziąłem więc oczyszczoną triazynę z poprzedniego etapu, a było jej 1,5 g, zalałem 9% roztworem wodorotlenku potasu i mieszałem, ogrzewając pod chłodnicą:
Wylot chłodnicy połączyłem przez rurkę bezpośrednio z kanałem wyciągu, aby ograniczyć rozchodzenie się po pracowni wybitnie śmierdzącego merkaptanu metylu. Niskotopliwa triazyna utworzyła na powierzchni roztworu brązowawy olej, który w miarę postępu reakcji zanikał. Mniej więcej po godzinie olejek zanikł całkowicie, zaś zawartość kolby zmętniała. Odstawiłem ją w chłodne miejsce aby słabo rozpuszczalny produkt się zestalił. Po tym czasie przesączyłem osad na lejku pod próżnią, przemywając niewielką ilością wody i otrzymując 1,2 g jasnokremowej 3-hydroksy-5-fenylo-1,2,4-triazyny. Dla kontroli wykonałem płytkę TLC w układzie chlorek metylenu / metanol 100:1, porównując z próbką tiometylotriazyny:
Jak widać po hydrolizie praktycznie nie pozostało ani trochę substratu, ciemniejsza plamka na początku to zapewne ślady merkaptanu, co jednak nie przeszkadzało w kolejnym etapie
Bromowanie
Trzeci etap polegał na wymianie grupy hydroksylowej na bromkową. Użyłem tutaj jako środka bromującego bromku fosforylu POBr3, mającego postać pomarańczowych, łatwotopliwych kryształków:
Natomiast otrzymana poprzednio i wysuszana hydroksytriazyna, była miałkim, białym proszkiem:
Bromek miał bardzo ostry zapach, jego opary były zresztą trujące. W kontakcie z wilgocią hydrolizował dając białe opary, dlatego odważałem go szybko, zaś chłodnicę podłączoną do kolby dokładnie osuszyłem i zabezpieczyłem rurką ze środkiem suszącym
W tym przypadku nie potrzebny był rozpuszczalnik - po ogrzaniu bromek roztopił się w ciecz, w której rozpuścił się drugi substrat. Całość mieszała się przez godzinę w 120 stopniach:
Po tym czasie przerwałem ogrzewanie a gdy zawartość się ochłodziła, dodałem do środka drobno pokruszonego lodu. Lód topniał w wodę która hydrolizowała bromek. Zawartość kolby ogrzewała się podczas hydrolizy, stąd użycie lodu. Zarazem jednak trzeba było szybko rozetrzeć zawartość na drobno - powstający z hydrolizy bromowodór, uwięziony w porach ziaren, zakwaszał je powodując odwrócenie reakcji, toteż mieszaninę poreakcyjną roztarłem w moździerzu:
i odsączyłem, przemywając osad wodą. Po wysuszeniu zaskakująco przypominał kawę rozpuszczalną. Nie był to jednak jeszcze produkt, lecz dopiero mieszanina do rozdziału. Oczywiście na kolumnie.
Rozdział w czystym chlorku metylenu przebiegał jednak bardzo łatwo, i nie miałem żadnych atrakcji przy wyparce, zakończyłem więc syntezę z 0,66 g produktu, z wydajnością 44 %
3-bromo-5-fenylo-1,2,4-triazyna okazała się mieć właściwości drażniące - gdy podrapałem się po nosie zanieczyszczonym nią palcem, jeszcze długo piekło mnie w tym miejscu.
czwartek, 13 lutego 2014
Pomiar skręcalności optycznej
Jednym z prostych pomiarów fizykochemicznych, które być może były omawiane w szkołach, jest pomiar skręcalności optycznej substancji. Podobny wykonuję też i ja na pracowni, ale sprzętem nieco dokładniejszym. Tylko po co to wszystko?
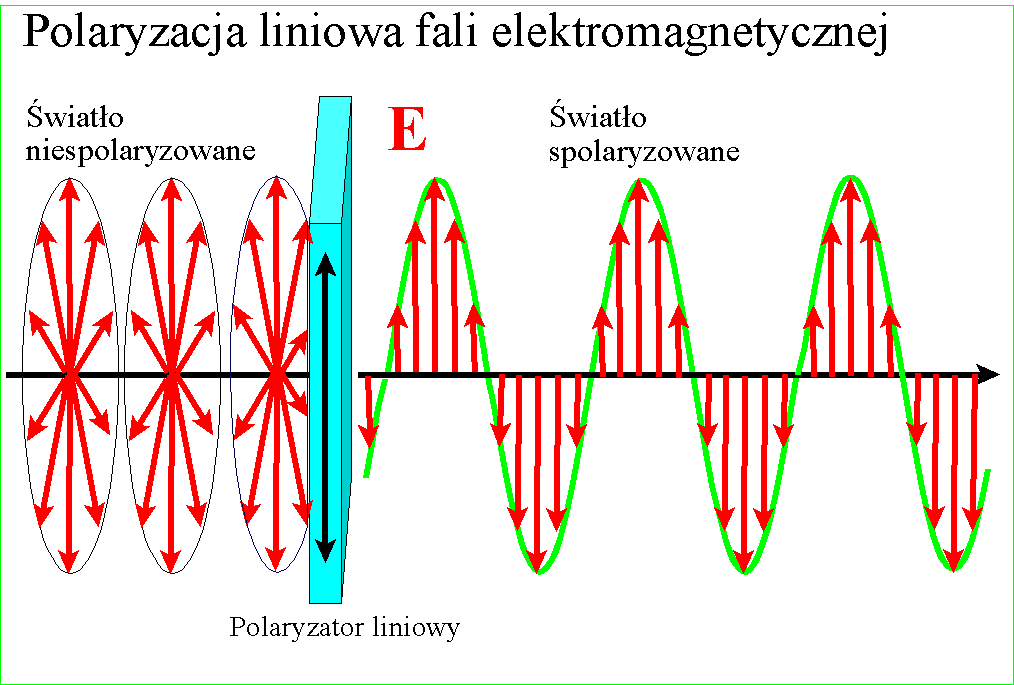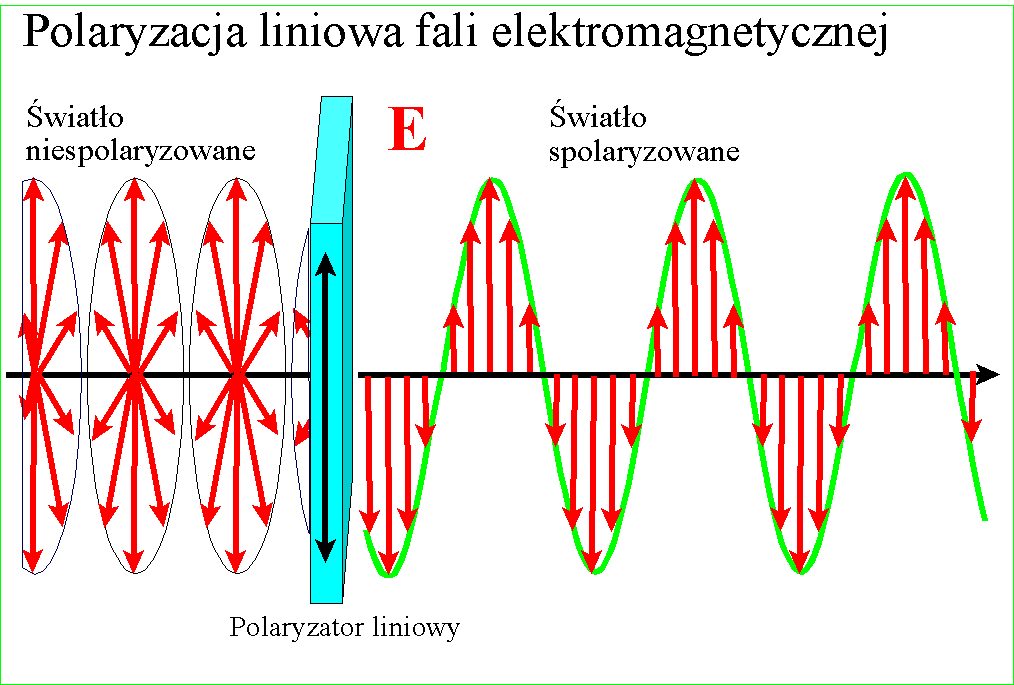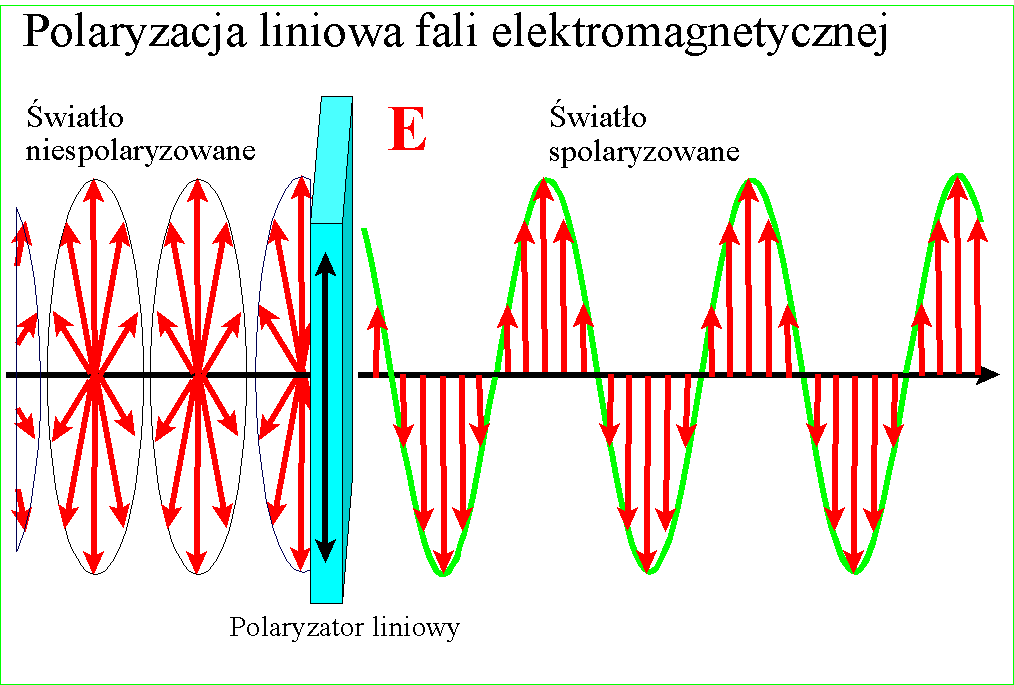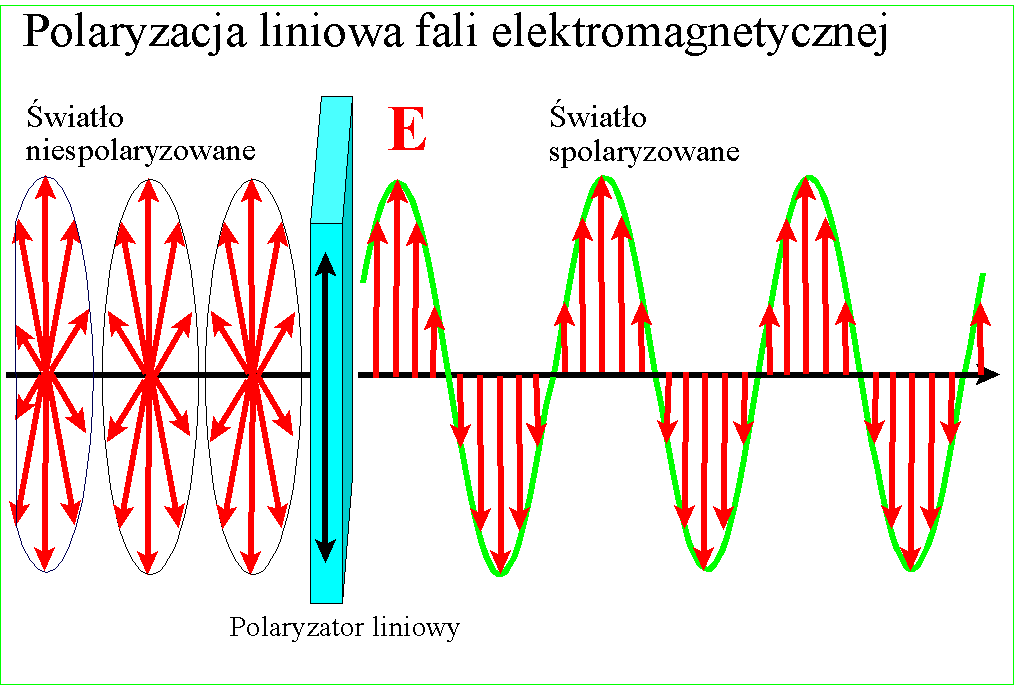
U początków wielkiej naukowej debaty o prawdziwej naturze światła zwrócono uwagę na zjawisko polaryzacji. Przezroczyste kryształy szpatu islandzkiego podwajały obraz jaki przez nie obserwowano, a wpuszczony w nie promień światła rozdzielał się na dwa - normalny, biegnący zgodnie z wartością załamania, i nadzwyczajny o silniejszym załamaniu.
Jeszcze zaś dziwaczniej zachowywały się dwa takie kryształy położone na sobie - w pewnej wzajemnej orientacji pozostawały przezroczyste, po obróceniu o 90 stopni wygaszały obraz. Zjawisko to nazwano polaryzacją i niespecjalnie się nim potem przejmowano, gdy tymczasem trwał spór między fizykami - czy światło to promień czy może wiązka przenikliwych cząstek? Istniało wiele zjawisk które udawało się łatwo wytłumaczyć modelem cząstkowym i on w zasadzie był powszechnie przyjmowany aż do 1801, gdy Thomas Young zaproponował doświadczenie z dwoma szczelinami.
Weźmy źródło światła i ujednolićmy je przepuszczając przez mały otwór. Teraz przepuśćmy nasze spójne światło przez dwa małe otworki, wielkości nakłuć końcem igły, położone blisko siebie. Zgodnie z teorią cząstkowa, powinniśmy zobaczyć dwie jasne plamki. Zamiast tego obserwowano jasną plamę pośrodku i rząd rozchodzących się po bokach mniejszych, kolorowych plamek oddzielonych plamami cienia. W sposób cząstkowy wyjaśnić się tego nie dało. Chyba że światło jest jednak falą:
Dwie szczeliny tworzą dwa źródła rozchodzących się fal, które nakładają się na siebie raz wzmacniając raz wygaszając. Young zainspirował się tu obserwacją fal na powierzchni wody, przy czym z występowania tego zjawiska wynikało, że jeśli już światło faluje, to poprzecznie do kierunku ruchu.
Późniejsza teoria powiązała światło z zaburzeniami w rozprzestrzeniającym się polu elektrycznym i magnetycznym. Pole magnetyczne które zmienia natężenie i kierunek powoduje wygenerowane pola elektrycznego, ale także o zmiennym kierunku. Zmienne pole elektryczne z kolei generuje zmienne pole magnetyczne. Te dwa wzajemnie się indukujące pola łączą się ze sobą tworząc promieniowanie elektro-magnetyczne. Wektor pola magnetycznego jest prostopadły do wektora pola elektrycznego a obydwa do kierunku rozchodzenia się promieni.:
Późniejsza teoria kwantowa zmodyfikowała ten model, wprowadzając podwójną falowo-cząstkowa naturę światła.
W każdym razie gdy Young udowodnił falową naturę światła, znane wcześniej zjawisko polaryzacji stało się zrozumiałe - po postu wektory pól zajmują w przestrzeni jakieś płaszczyzny względem kierunku rozchodzenia, ale w świetle zwykłym są one przemieszane. Gdy światło zostanie spolaryzowane, kierunki te porządkują się :
i wszystkie wektory spolaryzowanego światła leżą w jednej płaszczyźnie. Wyjaśnienie dwójłomności szpatu islandzkiego, powodującej podwojenie obrazu jest w tym kontekście ciekawe - prędkość światła w takim krysztale zależy od kierunku polaryzacji pól składowych. Różnica prędkości światła między kryształem a powietrzem jest przyczyną załamania światła, zatem zależnie od polaryzacji światło będzie się załamywało pod różnym kątem
Gdy wpuścimy do kryształu promień, zostanie on rozdzielony na dwa o połowę słabsze - jeden, normalny, będzie miał jedną polaryzację, a drugi, nadzwyczajny, polaryzację obróconą pod kątem prostym do polaryzacji tamtego. Każdy z promieni ma nieco inny kąt załamania dlatego oddzielają się od siebie:
Niedługo potem Malus odkrył że światło częściowo polaryzuje się przy odbiciu, zaś William Nicol wpadł na pomysł, jak za pomocą dwójłomnego kryształu uzyskać pojedynczą wiązkę spolaryzowanego światła. Wziął on rombowy kryształ szpatu islandzkiego i przeciął na ukos, otrzymując dwa pryzmaty. Połączył je ze sobą cienką warstwą przezroczystego kleju. Wiadomo było wówczas, że promień biegnący wewnątrz przezroczystego materiału może zostać całkowicie odbity, jeśli padnie na jego ścianę pod odpowiednim kątem - z tego prawa korzystają światłowody - połączenie tego z dwójłomnością pozwoliło na oddzielenie powstających dwóch promieni.
Cięcie między dwoma pryzmatami zostało poprowadzone pod takim kątem, że niewiele brakuje aby promień biegnący przez kryształ odbił się całkowicie. Wpuszczamy w kryształ promień zwykłego światła - promień rozdziela się na dwa załamane pod różnym kątem. Mniej załamany normalny biegnie dalej, silniej załamany promień nadzwyczajny odbija się całkowicie i wypada bokiem. Przechodząca wiązka zostaje spolaryzowana.
Dzięki temu urządzeniu można było badać właściwości światła spolaryzowanego, na przykład zabarwianie się minerałów i tworzyw sztucznych wykazujących choć niewielką dwójłomność.
Tym jednak co najbardziej mnie interesuje, jest odkrycie, że po przejściu przez pewne substancje, polaryzacja światła może się zmienić. Aby wygasić całkowicie liniowo spolaryzowane światło, należy umieścić na jego drodze filtr bądź drugi układ pryzmatów, ale obrócony o 90 stopni. Jednak jeśli między nie wsuniemy próbkę jakiejś substancji, jak na przykład roztwór cukru, okaże się że światło już nie jest całkowicie pochłaniane, i aby znów uzyskać ten efekt trzeba obrócić układ o jeszcze pewien kąt.
Zdolność do zmiany płaszczyzny polaryzacji światła to skręcalność optyczna, a substancje które tak robią nazywany czynnymi optycznie. Czynność ta jest związana z budową cząsteczki o asymetrii polaryzacji a co za tym idzie, asymetrią budowy. W związkach organicznych możliwa jest sytuacja, że cząsteczka może posiadać dwie formy przestrzenne, podobne do siebie jak lustrzane odbicia. Są to cząsteczki chiralne. Szersze wytłumaczenie jak to zachodzi i jakie ma znaczenie, już omawiałem w pewnym artykule.
Gdy światło spolaryzowane przejdzie przez roztwór substancji czynnej optycznie, płaszczyzna w której sytuują się wektory fali elektromagnetycznej, przekręci się o pewien kąt. Ilościowa zdolność do skręcania płaszczyzny to skręcalność, zależna od grubości roztworu, rozpuszczalnika, długości fali świetlnej i stężenia.
Własności te znalazły bardzo szerokie zastosowanie do szybkiego mierzenia zawartości cukru w sokach roślinnych. I takie też ćwiczenie wykonywałem kiedyś na pracowni jeszcze w technikum.
Wzięliśmy jabłko, z którego odważyliśmy określoną ilość miąższu, a ten po rozgnieceniu zalaliśmy odmierzoną ilością wody i zagotowaliśmy:
Po odsączeniu wyciągu wlaliśmy go do polarymetru widocznym na pierwszej fotografii - to bardzo proste urządzenie. Lampa sodowa daje intensywne światło o określonej długości fali, wpadające do urządzenia przez wstępny filtr polaryzacyjny. Następnie przechodzi przez szklaną rurkę w tubie przyrządu gdzie wlany został nasz sok. Na jego drodze staje następnie prostokąt drugiego filtru polaryzacyjnego, o polaryzacji takiej samej jak pierwszy. Gdy w urządzeniu była nieaktywna woda, w okularze widać było jednolity krążek światła:
Jednak zawierający czynne optycznie cukry sok jabłkowy skręcał płaszczyznę światła spolaryzowanego przez pierwszy filtr. Takie światło było więc częściowo zatrzymywane przez drugi filtr i na tle jasnego krążka pojawiał się ciemniejszy prostokąt:
Teraz należało przekręcić małą tarczę przy okularze tak, aby obrócić drugi filtr zgodnie z polaryzacją o pewien kąt. Ten kąt to właśnie skręcalność roztworu. Z boku obiektywu przez małą lupę można było obserwować skalę podającą z jednej strony kąt skręcenia a z drugiej stężenie cukru w roztworze.
Podobne pomiary wykonuję czasem na pracowni. Zasadniczy temat pracy magisterskiej polega na wytworzeniu ligandów do asymetrycznej reakcji Henry'ego. W takiej reakcji powinienem otrzymać mieszaninę chiralnych beta nitroalkoholi z przewagą jednej, pożądanej formy
Ale jak poznać z jak dużą przewagą? Każda forma skręca płaszczyznę polaryzacji światła o taką samą wartość ale w przeciwne strony. Mieszanina 1:1 jest wobec tego nie czynna, zaś każda przewaga którejś z form objawia się jakąś skręcalnością wypadkową. Mając porównanie z danymi literaturowymi, gdzie obie formy oddzielono i ustalono konfigurację, i gdzie podana została skręcalność mieszaniny o ustalonym stosunku, mogę przez własny pomiar w identycznych warunkach określić skład swojej otrzymanej mieszaniny wyrażony w jednostce nadmiaru enancjomerycznego - czyli procentowej nadwyżki jednej z form nad drugą.
Jak na razie najlepszy wynik jednej reakcji to nadmiar 88% ee, ale czekam na więcej.
ps. to mój 150 opublikowany wpis.
U początków wielkiej naukowej debaty o prawdziwej naturze światła zwrócono uwagę na zjawisko polaryzacji. Przezroczyste kryształy szpatu islandzkiego podwajały obraz jaki przez nie obserwowano, a wpuszczony w nie promień światła rozdzielał się na dwa - normalny, biegnący zgodnie z wartością załamania, i nadzwyczajny o silniejszym załamaniu.
Jeszcze zaś dziwaczniej zachowywały się dwa takie kryształy położone na sobie - w pewnej wzajemnej orientacji pozostawały przezroczyste, po obróceniu o 90 stopni wygaszały obraz. Zjawisko to nazwano polaryzacją i niespecjalnie się nim potem przejmowano, gdy tymczasem trwał spór między fizykami - czy światło to promień czy może wiązka przenikliwych cząstek? Istniało wiele zjawisk które udawało się łatwo wytłumaczyć modelem cząstkowym i on w zasadzie był powszechnie przyjmowany aż do 1801, gdy Thomas Young zaproponował doświadczenie z dwoma szczelinami.
Weźmy źródło światła i ujednolićmy je przepuszczając przez mały otwór. Teraz przepuśćmy nasze spójne światło przez dwa małe otworki, wielkości nakłuć końcem igły, położone blisko siebie. Zgodnie z teorią cząstkowa, powinniśmy zobaczyć dwie jasne plamki. Zamiast tego obserwowano jasną plamę pośrodku i rząd rozchodzących się po bokach mniejszych, kolorowych plamek oddzielonych plamami cienia. W sposób cząstkowy wyjaśnić się tego nie dało. Chyba że światło jest jednak falą:
Dwie szczeliny tworzą dwa źródła rozchodzących się fal, które nakładają się na siebie raz wzmacniając raz wygaszając. Young zainspirował się tu obserwacją fal na powierzchni wody, przy czym z występowania tego zjawiska wynikało, że jeśli już światło faluje, to poprzecznie do kierunku ruchu.
Późniejsza teoria powiązała światło z zaburzeniami w rozprzestrzeniającym się polu elektrycznym i magnetycznym. Pole magnetyczne które zmienia natężenie i kierunek powoduje wygenerowane pola elektrycznego, ale także o zmiennym kierunku. Zmienne pole elektryczne z kolei generuje zmienne pole magnetyczne. Te dwa wzajemnie się indukujące pola łączą się ze sobą tworząc promieniowanie elektro-magnetyczne. Wektor pola magnetycznego jest prostopadły do wektora pola elektrycznego a obydwa do kierunku rozchodzenia się promieni.:
Późniejsza teoria kwantowa zmodyfikowała ten model, wprowadzając podwójną falowo-cząstkowa naturę światła.
W każdym razie gdy Young udowodnił falową naturę światła, znane wcześniej zjawisko polaryzacji stało się zrozumiałe - po postu wektory pól zajmują w przestrzeni jakieś płaszczyzny względem kierunku rozchodzenia, ale w świetle zwykłym są one przemieszane. Gdy światło zostanie spolaryzowane, kierunki te porządkują się :
i wszystkie wektory spolaryzowanego światła leżą w jednej płaszczyźnie. Wyjaśnienie dwójłomności szpatu islandzkiego, powodującej podwojenie obrazu jest w tym kontekście ciekawe - prędkość światła w takim krysztale zależy od kierunku polaryzacji pól składowych. Różnica prędkości światła między kryształem a powietrzem jest przyczyną załamania światła, zatem zależnie od polaryzacji światło będzie się załamywało pod różnym kątem
Gdy wpuścimy do kryształu promień, zostanie on rozdzielony na dwa o połowę słabsze - jeden, normalny, będzie miał jedną polaryzację, a drugi, nadzwyczajny, polaryzację obróconą pod kątem prostym do polaryzacji tamtego. Każdy z promieni ma nieco inny kąt załamania dlatego oddzielają się od siebie:
Niedługo potem Malus odkrył że światło częściowo polaryzuje się przy odbiciu, zaś William Nicol wpadł na pomysł, jak za pomocą dwójłomnego kryształu uzyskać pojedynczą wiązkę spolaryzowanego światła. Wziął on rombowy kryształ szpatu islandzkiego i przeciął na ukos, otrzymując dwa pryzmaty. Połączył je ze sobą cienką warstwą przezroczystego kleju. Wiadomo było wówczas, że promień biegnący wewnątrz przezroczystego materiału może zostać całkowicie odbity, jeśli padnie na jego ścianę pod odpowiednim kątem - z tego prawa korzystają światłowody - połączenie tego z dwójłomnością pozwoliło na oddzielenie powstających dwóch promieni.
Cięcie między dwoma pryzmatami zostało poprowadzone pod takim kątem, że niewiele brakuje aby promień biegnący przez kryształ odbił się całkowicie. Wpuszczamy w kryształ promień zwykłego światła - promień rozdziela się na dwa załamane pod różnym kątem. Mniej załamany normalny biegnie dalej, silniej załamany promień nadzwyczajny odbija się całkowicie i wypada bokiem. Przechodząca wiązka zostaje spolaryzowana.
Dzięki temu urządzeniu można było badać właściwości światła spolaryzowanego, na przykład zabarwianie się minerałów i tworzyw sztucznych wykazujących choć niewielką dwójłomność.
Tym jednak co najbardziej mnie interesuje, jest odkrycie, że po przejściu przez pewne substancje, polaryzacja światła może się zmienić. Aby wygasić całkowicie liniowo spolaryzowane światło, należy umieścić na jego drodze filtr bądź drugi układ pryzmatów, ale obrócony o 90 stopni. Jednak jeśli między nie wsuniemy próbkę jakiejś substancji, jak na przykład roztwór cukru, okaże się że światło już nie jest całkowicie pochłaniane, i aby znów uzyskać ten efekt trzeba obrócić układ o jeszcze pewien kąt.
Zdolność do zmiany płaszczyzny polaryzacji światła to skręcalność optyczna, a substancje które tak robią nazywany czynnymi optycznie. Czynność ta jest związana z budową cząsteczki o asymetrii polaryzacji a co za tym idzie, asymetrią budowy. W związkach organicznych możliwa jest sytuacja, że cząsteczka może posiadać dwie formy przestrzenne, podobne do siebie jak lustrzane odbicia. Są to cząsteczki chiralne. Szersze wytłumaczenie jak to zachodzi i jakie ma znaczenie, już omawiałem w pewnym artykule.
Gdy światło spolaryzowane przejdzie przez roztwór substancji czynnej optycznie, płaszczyzna w której sytuują się wektory fali elektromagnetycznej, przekręci się o pewien kąt. Ilościowa zdolność do skręcania płaszczyzny to skręcalność, zależna od grubości roztworu, rozpuszczalnika, długości fali świetlnej i stężenia.
Własności te znalazły bardzo szerokie zastosowanie do szybkiego mierzenia zawartości cukru w sokach roślinnych. I takie też ćwiczenie wykonywałem kiedyś na pracowni jeszcze w technikum.
Wzięliśmy jabłko, z którego odważyliśmy określoną ilość miąższu, a ten po rozgnieceniu zalaliśmy odmierzoną ilością wody i zagotowaliśmy:
Po odsączeniu wyciągu wlaliśmy go do polarymetru widocznym na pierwszej fotografii - to bardzo proste urządzenie. Lampa sodowa daje intensywne światło o określonej długości fali, wpadające do urządzenia przez wstępny filtr polaryzacyjny. Następnie przechodzi przez szklaną rurkę w tubie przyrządu gdzie wlany został nasz sok. Na jego drodze staje następnie prostokąt drugiego filtru polaryzacyjnego, o polaryzacji takiej samej jak pierwszy. Gdy w urządzeniu była nieaktywna woda, w okularze widać było jednolity krążek światła:
Jednak zawierający czynne optycznie cukry sok jabłkowy skręcał płaszczyznę światła spolaryzowanego przez pierwszy filtr. Takie światło było więc częściowo zatrzymywane przez drugi filtr i na tle jasnego krążka pojawiał się ciemniejszy prostokąt:
Teraz należało przekręcić małą tarczę przy okularze tak, aby obrócić drugi filtr zgodnie z polaryzacją o pewien kąt. Ten kąt to właśnie skręcalność roztworu. Z boku obiektywu przez małą lupę można było obserwować skalę podającą z jednej strony kąt skręcenia a z drugiej stężenie cukru w roztworze.
Podobne pomiary wykonuję czasem na pracowni. Zasadniczy temat pracy magisterskiej polega na wytworzeniu ligandów do asymetrycznej reakcji Henry'ego. W takiej reakcji powinienem otrzymać mieszaninę chiralnych beta nitroalkoholi z przewagą jednej, pożądanej formy
Ale jak poznać z jak dużą przewagą? Każda forma skręca płaszczyznę polaryzacji światła o taką samą wartość ale w przeciwne strony. Mieszanina 1:1 jest wobec tego nie czynna, zaś każda przewaga którejś z form objawia się jakąś skręcalnością wypadkową. Mając porównanie z danymi literaturowymi, gdzie obie formy oddzielono i ustalono konfigurację, i gdzie podana została skręcalność mieszaniny o ustalonym stosunku, mogę przez własny pomiar w identycznych warunkach określić skład swojej otrzymanej mieszaniny wyrażony w jednostce nadmiaru enancjomerycznego - czyli procentowej nadwyżki jednej z form nad drugą.
Jak na razie najlepszy wynik jednej reakcji to nadmiar 88% ee, ale czekam na więcej.
ps. to mój 150 opublikowany wpis.
poniedziałek, 18 listopada 2013
Synteza I. - etap pierwszy, męczący
Dawno dawno temu... jeszcze przed wakacjami, obiecywałem że zacznę pisać o syntezach wykonywanych w ramach pracowni magisterskiej. Niestety jak widać zrobił mi się w tej kwestii znaczny poślizg, co zresztą dotyczy wszystkich dłuższych postów. Ledwie coś zacznę, tracę zapał do dokańczania i odkładam rzecz na później. To "zatwardzenie pióra" sprawia że wolę już niczego nie obiecywać.
Skoro już w jednym z wcześniejszych wpisów obszernie objaśniłem o co chodzi z tymi syntezami asymetrycznymi, mogę przejść do opisu pierwszej wykonywanej syntezy, jeszcze z poprzedniego roku studiów. Wówczas to, w drugim semestrze czwartego roku, mając czas przeznaczony na laboratorium w wymiarze jednego dnia tygodniowo, raczej wprawiałem się i wdrażałem do pracy laboratoryjnej, toteż to co robiłem było raczej powtórzeniem już przeprowadzanej syntezy, a nie rozpoczynaniem czegoś nowego. Miało to tą dobrą stronę, że w razie wątpliwości mogłem zajrzeć do notatek osoby robiącej to samo w zeszłym roku.
Moim związkiem końcowym miała być 3-bromo-5-fenylo-1,2,4-triazyna, a uzyskać ją miałem z wyjściowych związków niecyklicznych. Całość reakcji powinna wyglądać tak:
Pierwszy etap który omówię w tym wpisie, dotyczył cyklizacji i wyodrębnienia produktu.
Substratami wyjściowymi był fenyloglioksal i karbamohydrazonotioester metylowy (chyba, po angielsku Methyl carbamohydrazonothioate) w formie jodowodorku. Ten drugi jest tu dostarczycielem dwóch azotów połączonych wiązaniem; grupa tioestrowa jest tu sposobem zabezpieczenia grupy hydroksylowej, która w przeciwnym wypadku też mogłaby wchodzić w reakcję. W obecności słabej zasady, jaką jest wodorowęglan sodu następuje kondensacja grup aminowych do węgli karboksylowych, tworząc sześcioczłonowy pierścień:
Możliwy produkt uboczny, z podstawnikami w ustawieniu 3,6 (a więc para-trizyna), nazywany dalej izomerem 6, powstaje gdy cząsteczki połączą się obrócone, jest go jednak mało, o czym później.
Zgodnie z przepisem odważyłem fenylogliokasal, mający w tym przypadku postać żółtawego proszku o bardzo niemiłym zapachu - dosyć ostrym, jakby czosnkowym ale z kwaśną nutą. Podobnie pachniał kiedyś słoik zepsutych kiszonych ogórków.
Drugi związek miał formę białego proszku, przechowywano go w lodówce z uwagi na niestabilność. Glioksal i węglan sodu rozpuściłem w kolbie i dodałem drugi substrat. Całość umieściłem na mieszadle magnetycznym (wcześniej wrzuciłem magnetyczny drops), obłożyłem z zewnątrz lodem i tak to się miało kręcić całą dobę.
Kolejnego dna po ostatnim wykładzie przyszedłem zobaczyć co wyszło. A wyszło mianowicie to, że zastałem w kolbce żółtawą mieszaninę poreakcyjną. Należało ją teraz rozdzielić. Najpierw ekstrahowałem ją chlorkiem metylenu aby oddzielić węglan sodu i częściowo zhydrolizowany hydrazyd, otrzymując brązowy roztwór:
Potem oczywiście nałożyłem na kolumnę i rozdzieliłem chromatograficznie. Wcześniejsze próby na płytce pokazały że w ekstrakcie miałem głównie pożądany produkt i ślady izomeru 6, możliwe do rozdzielenia. Kwestię rozdziału na kolumnie preparatywnej, jej wykonywanie i problemy z tym związane, już tu omawiałem, więc nie będę się u szczegółowo powtarzał. Początkowo użyłem mieszanki CH2Cl2:metanol 100:1 która na płytce dawała dobre rezultaty. Niestety na kolumnie nie specjalnie.
Związek główny strasznie ogonował - za czołem zawierającym główną porcję ciągnął się "ogon" zawierający produkt, co oznaczało że do całkowitego wymycia potrzebne jest przelanie przez kolumnę dużej ilości eluentu. Zdaje się że zużyłem w ten sposób ponad pół butelki chlorku metylenu zbierając 12 frakcji aż prowadząca uznała, że lepiej użyć mieszanki z większa ilością metanolu i dopiero wówczas związek wymył się całkiem.
Kolejnego dnia miałem zająć się przede wszystkim odparowaniem czystych frakcji na wyparce. Jest to przyrząd w którym roztwór umieszczony zostaje w kulistej kolbie zanurzonej w misie z ciepłą wodą i podłączony do chłodnicy pod obniżonym ciśnieniem. Kombinacja niskiego ciśnienia, podgrzewania i rozprowadzania cieczy na ściankach powoduje szybkie odparowanie rozpuszczalnika.
Tak więc nalewałem do kolby kolejne frakcje, i odparowywałem. Pierwsza, drugą, trzecią, czwartą, piątą... a gdy byłem przy dziesiątej zdarzyła się katastrofa.
Kolbka podłączona do wyparki trzyma się obracającego szlifu trochę za sprawą tarcia a trochę za sprawą przyssania. Dla pewności można założyć plastikowy klips. Gdy odparowałem już wszystkie wcześniejsze frakcje, odszedłem na chwilę a przez ten czas z tej samej pompy ssącej skorzystał ktoś inny aby coś sobie przesączyć. I wyłączył pompę. Gdy powróciłem nie zwróciłem na to uwagi - wlałem do kolbki jedenastą frakcję, nasunąłem ją na szlif, zanurzyłem w misie i włączyłem obrót. Kolbka obróciła się kilka razy i wpadła do misy...
Oczywiście nie do końca odparowany roztwór wylał się do środka i będąc cięższym od wody osiadł na dnie. Łatwo sobie wyobrazić moją reakcję. No ale cóż, nie było na co się dalej złościć, trzeba było ratować co się da. Wybrałem wodę z misy po czym odciągnąłem roztwór z dna pipetką. Zanieczyszczony różnymi osadami z dna i wodą roztwór wlałem do kolby i zasypałem środkiem suszącym. I tak skończył się dzień kolejny.
Na następnej pracowni odparowałem ocaloną frakcję produktu, po czym nałożyłem wysuszoną i przesączoną mieszaninę powypadkową, po czym... nałożyłem na kolumnę i rozdzielałem.
Tym razem poszło mi to szybciej za sprawą lepiej dobranego układu, ale też zeszło na to trochę czasu. Na koniec porównałem obie części ze wzorcem produktu i odparowałem wspólnie, w jednej kolbie, otrzymując 1,5 grama związku. Po odparowaniu początkowo utworzył olejek, który ładnie wykrystalizował:
Porządnie mnie wymęczył ten etap.
Skoro już w jednym z wcześniejszych wpisów obszernie objaśniłem o co chodzi z tymi syntezami asymetrycznymi, mogę przejść do opisu pierwszej wykonywanej syntezy, jeszcze z poprzedniego roku studiów. Wówczas to, w drugim semestrze czwartego roku, mając czas przeznaczony na laboratorium w wymiarze jednego dnia tygodniowo, raczej wprawiałem się i wdrażałem do pracy laboratoryjnej, toteż to co robiłem było raczej powtórzeniem już przeprowadzanej syntezy, a nie rozpoczynaniem czegoś nowego. Miało to tą dobrą stronę, że w razie wątpliwości mogłem zajrzeć do notatek osoby robiącej to samo w zeszłym roku.
Moim związkiem końcowym miała być 3-bromo-5-fenylo-1,2,4-triazyna, a uzyskać ją miałem z wyjściowych związków niecyklicznych. Całość reakcji powinna wyglądać tak:
Pierwszy etap który omówię w tym wpisie, dotyczył cyklizacji i wyodrębnienia produktu.
Substratami wyjściowymi był fenyloglioksal i karbamohydrazonotioester metylowy (chyba, po angielsku Methyl carbamohydrazonothioate) w formie jodowodorku. Ten drugi jest tu dostarczycielem dwóch azotów połączonych wiązaniem; grupa tioestrowa jest tu sposobem zabezpieczenia grupy hydroksylowej, która w przeciwnym wypadku też mogłaby wchodzić w reakcję. W obecności słabej zasady, jaką jest wodorowęglan sodu następuje kondensacja grup aminowych do węgli karboksylowych, tworząc sześcioczłonowy pierścień:
Możliwy produkt uboczny, z podstawnikami w ustawieniu 3,6 (a więc para-trizyna), nazywany dalej izomerem 6, powstaje gdy cząsteczki połączą się obrócone, jest go jednak mało, o czym później.
Zgodnie z przepisem odważyłem fenylogliokasal, mający w tym przypadku postać żółtawego proszku o bardzo niemiłym zapachu - dosyć ostrym, jakby czosnkowym ale z kwaśną nutą. Podobnie pachniał kiedyś słoik zepsutych kiszonych ogórków.
Drugi związek miał formę białego proszku, przechowywano go w lodówce z uwagi na niestabilność. Glioksal i węglan sodu rozpuściłem w kolbie i dodałem drugi substrat. Całość umieściłem na mieszadle magnetycznym (wcześniej wrzuciłem magnetyczny drops), obłożyłem z zewnątrz lodem i tak to się miało kręcić całą dobę.
Kolejnego dna po ostatnim wykładzie przyszedłem zobaczyć co wyszło. A wyszło mianowicie to, że zastałem w kolbce żółtawą mieszaninę poreakcyjną. Należało ją teraz rozdzielić. Najpierw ekstrahowałem ją chlorkiem metylenu aby oddzielić węglan sodu i częściowo zhydrolizowany hydrazyd, otrzymując brązowy roztwór:
Potem oczywiście nałożyłem na kolumnę i rozdzieliłem chromatograficznie. Wcześniejsze próby na płytce pokazały że w ekstrakcie miałem głównie pożądany produkt i ślady izomeru 6, możliwe do rozdzielenia. Kwestię rozdziału na kolumnie preparatywnej, jej wykonywanie i problemy z tym związane, już tu omawiałem, więc nie będę się u szczegółowo powtarzał. Początkowo użyłem mieszanki CH2Cl2:metanol 100:1 która na płytce dawała dobre rezultaty. Niestety na kolumnie nie specjalnie.
Związek główny strasznie ogonował - za czołem zawierającym główną porcję ciągnął się "ogon" zawierający produkt, co oznaczało że do całkowitego wymycia potrzebne jest przelanie przez kolumnę dużej ilości eluentu. Zdaje się że zużyłem w ten sposób ponad pół butelki chlorku metylenu zbierając 12 frakcji aż prowadząca uznała, że lepiej użyć mieszanki z większa ilością metanolu i dopiero wówczas związek wymył się całkiem.
Kolejnego dnia miałem zająć się przede wszystkim odparowaniem czystych frakcji na wyparce. Jest to przyrząd w którym roztwór umieszczony zostaje w kulistej kolbie zanurzonej w misie z ciepłą wodą i podłączony do chłodnicy pod obniżonym ciśnieniem. Kombinacja niskiego ciśnienia, podgrzewania i rozprowadzania cieczy na ściankach powoduje szybkie odparowanie rozpuszczalnika.
Tak więc nalewałem do kolby kolejne frakcje, i odparowywałem. Pierwsza, drugą, trzecią, czwartą, piątą... a gdy byłem przy dziesiątej zdarzyła się katastrofa.
Kolbka podłączona do wyparki trzyma się obracającego szlifu trochę za sprawą tarcia a trochę za sprawą przyssania. Dla pewności można założyć plastikowy klips. Gdy odparowałem już wszystkie wcześniejsze frakcje, odszedłem na chwilę a przez ten czas z tej samej pompy ssącej skorzystał ktoś inny aby coś sobie przesączyć. I wyłączył pompę. Gdy powróciłem nie zwróciłem na to uwagi - wlałem do kolbki jedenastą frakcję, nasunąłem ją na szlif, zanurzyłem w misie i włączyłem obrót. Kolbka obróciła się kilka razy i wpadła do misy...
Oczywiście nie do końca odparowany roztwór wylał się do środka i będąc cięższym od wody osiadł na dnie. Łatwo sobie wyobrazić moją reakcję. No ale cóż, nie było na co się dalej złościć, trzeba było ratować co się da. Wybrałem wodę z misy po czym odciągnąłem roztwór z dna pipetką. Zanieczyszczony różnymi osadami z dna i wodą roztwór wlałem do kolby i zasypałem środkiem suszącym. I tak skończył się dzień kolejny.
Na następnej pracowni odparowałem ocaloną frakcję produktu, po czym nałożyłem wysuszoną i przesączoną mieszaninę powypadkową, po czym... nałożyłem na kolumnę i rozdzielałem.
Tym razem poszło mi to szybciej za sprawą lepiej dobranego układu, ale też zeszło na to trochę czasu. Na koniec porównałem obie części ze wzorcem produktu i odparowałem wspólnie, w jednej kolbie, otrzymując 1,5 grama związku. Po odparowaniu początkowo utworzył olejek, który ładnie wykrystalizował:
Porządnie mnie wymęczył ten etap.
poniedziałek, 24 czerwca 2013
Synteza I - Wstęp
Więc...
Dotarłem już w nauce akademickiej do tego momentu, gdy zamiast poprzestawać wyłącznie na powtarzaniu już opisanych i przygotowanych reakcji, muszę zacząć podjąć własną pracę naukową - oczywiście pod bacznym okiem promotora, dr Ewy Wolińskiej.
Dokładnie określonego tematu pracy jeszcze nie mam, ale zasadniczo opierać się będzie ona na syntezie zawierających 1,2,4-triazynę ligandów, do katalizatorów mających posłużyć do syntezy asymetrycznej. Zanim jednak omówię coś z przeprowadzonych syntez, muszę oczywiście objaśnić co też są to te triazyny, ligandy i dlaczego synteza miałaby być asymetryczna; ponieważ jednak objaśnienia te bardzo mi się wydłużyły, uznałem że ten wstęp teoretyczny podam w jednym wpisie, zaś trzy kolejne etapy właściwej syntezy omówię w kolejnych. Teraz więc będzie o tym, czy mogą istnieć "lewe" cząsteczki i jak to się ma do naszego zdrowia:
Jedną z właściwości cząsteczek organicznych, jest posiadanie określonej symetrii. Popatrzcie na swoje ręce; najlepiej wyciągnijcie je przed siebie i połóżcie jedną na drugą, bez obracania ku sobie. Nie nakładają się. Kciuki sterczą w przeciwne strony. Możemy jednak obrócić jedną i złożyć z drugą jak do modlitwy, wtedy ich obrysy będą się nakładały, ale nadal nie będą identyczne, bo ich grzbiety będą skierowane w przeciwne strony. Jak byśmy ich nie obracali, jedna nie stanie się taka jak druga.
To zupełnie oczywiste - jedna jest dłonią lewą a druga prawą. Są do siebie podobne jak lustrzane odbicia. Gdyby ktoś miał idealnie symetryczne dłonie, to lustrzane odbicie jednej wyglądałoby dokładnie tak jak druga.
O bryłach mających tą właściwość, że podobnie jak dłonie, posiadają formę "lewą" i "prawą", które nie dają się na siebie nałożyć przez obrót w przestrzeni, i są do siebie podobne jak lustrzane odbicia, mówimy że są chiralne (od greckiego chira - ręka). Jest wiele takich figur. Istnieją lewe i prawe muszle ślimaków, kwiaty, a z przedmiotów codziennego użytku, nożyczki dla prawo i leworęcznych:
Nie inaczej jest ze związkami chemicznymi. Już na początku XIX wieku skrupulatny badacz Ludwik Pasteur, najbardziej znany z badań nad fermentacją, przyglądając się kryształom soli syntetycznego kwasu winowego zauważył, iż są one asymetryczne, oraż że tworzą dwie odmiany, podobne jak lustrzane odbicia. Gdy zaś oddzielił jedną odmianę od drugiej, po prostu sortując kryształki pincetą, stwierdził że kwas winowy "prawy" zawsze krystalizuje w takiej formie. Uznał więc, że widocznie musi istnieć prawa i lewa odmiana kwasu winowego, które różnią się kształtem cząsteczki. Teoria atomowa była wówczas w powijakach, a co dopiero teoria struktury cząsteczek, toteż przez długi czas ta luźna hipoteza nie znajdowała zainteresowania. Do czasu gdy odkryto wreszcie jak rozłożone są w przestrzeni wiązania z węglem w związkach organicznych.
Węgiel w tych związkach tworzy cztery wiązania z innymi atomami - mogą to być wiązania potrójne, podwójne lub pojedyncze. Ponieważ każde wiązanie stanowi parę elektronową, a każda taka para odpycha się od innej, starają się one rozłożyć w przestrzeni w największym możliwym oddaleniu, co w przypadku czterech wiązań pojedynczych realizuje się w formie rozłożenia tetraedrycznego - to jest atom znajduje się jakby w środku foremnego czworościanu, a wiązania biegną do naroży. Jeśli teraz zdarzy się, że przy każdym z wiązań podczepiona będzie inna grupa, to cała cząsteczka stanie się chiralna, i możliwe staną się dla niej dwie konfiguracje - lewa i prawa, podobne jak lustrzane odbicia, jak to widać na tej pięknej grafice:
Związki chemiczne mające taką właśnie lustrzaną właściwość, to enancjomery, zaś atom węgla (czasem może to być fosfor lub azot, ale rzadziej) wokół którego pojawia się ta szczególna asymetria, nazywany jest atomem asymetrycznym, centrum chiralnym lub też jak zaleca się ostatnio centrum stereogenicznym. Konfigurację podstawników wokół takiego atomu określa się na różne sposoby - najczęściej używana metoda, polega na przypisaniu podstawnikom "ważności", tak że na przykład grupa metylowa jest ważniejsza od podstawnika wodorowego, etylowa od metylowej, a chlorkowa od etylowej. Jeśli teraz tak obrócić nasz asymetryczny atom, aby podstawnik o najmniejszej ważności znalazł się z tyłu, to konfigurację określa kierunek w którym poustawiane są pozostałe - gdy od najważniejszego do najmniej ważnego ruch jest zgodny z kierunkiem wskazówek zegara, to konfiguracja jest określana literą R, gdy jest odwrotnie, konfigurację określamy S. Są też inne typy konfiguracji, na przykład dla cukrów i aminokwasów zwykle używa się oznaczeń D i L.
Gdy związek ma więcej jak jedno takie miejsce, sytuacja się komplikuje, bo wówczas możliwa jest większa liczba kombinacji - każde centrum może mieć dwie konfiguracje. Kwas winowy ma dwa takie miejsca, stąd możliwe są dla niego trzy odmiany: gdy oba centra mają konfigurację R, gdy oba mają S i gdy jedno ma R a drugie S. Glukoza ma cztery takie miejsca i dla niej możliwych jest 16 odmian, cholesterol ma 8 takich miejsc i teoretycznie mógłby mieć ponad 200 odmian, choć niektóre struktury za bardzo deformowałyby cząsteczkę. Takie odmiany wielocentrowe, nazywamy stereoizomerami, i nie są one już swymi lustrzanymi odbiciami.
Natomiast mieszaniny równych ilości R i S izomerów, nazywamy racematami.
I co z tego?
Izomery różniące się konfiguracją, mają takie same właściwości chemiczne, jednak dość istotne różnice zachodzą w ich oddziaływaniu biologicznym, oto bowiem my sami jesteśmy chiralni.
Podstawowymi związkami strukturalnymi organizmów żywych są białka, te zaś zbudowane są z aminokwasów - związków, zawierających grupę aminową i karboksylową, połączonych do tego samego węgla. Jeśli dwa pozostałe podstawniki są różne, to cząsteczka staje się chiralna i tak właśnie jest w przypadku wszystkich biogennych aminokwasów, z wyjątkiem glicyny. Z tych chiralnych cząsteczek zbudowane są białka, a z białek elementy strukturalne, i jak się okazuje, bardzo często konfiguracja substancji wpływa na reakcje jakim ulega w naszym organizmie. Jednym z takich znanych przypadków, jest limonen - izomer D ma zapach pomarańczy i występuje w skórce tego owocu, izomer L ma zapach terpentyny i występuje w roślinach szpilkowych. Będący jego pochodną karwon ma jeszcze wyraźniejsze różnice zapachu - izomer S pachnie anyżkiem, a izomer R miętą. Inny terpenoid, mentol, ma trzy centra i 8 odmian; odmiana występująca w mięcie polnej i mająca najsilniejsze działanie i zapach, ma konfigurację 1R,2S,5R, pozostałe występują rzadko lub zostały otrzymane sztucznie
W podobny sposób różnią się smaki izomerów - lustrzane wersje substancji słodkich mogą mieć smak kwaśny lub gorzki, choć nie zawsze tak jest. Lustrzana wersja glukozy jest tak samo słodka jak oma, ma jednak jedną ciekawą właściwość - nie pasuje do pierwszego enzymu, rozpoczynającego metabolizm. Powoduje to, że nie jest przetwarzana na energię i zostaje w niezmienionej formie wydalona - byłaby zatem idealnym słodzikiem, słodkim ale nie kalorycznym. Niestety jej produkcja jest nieopłacalna.
Dla nas jednak najistotniejszą kwestią nie jest smak czy zapach, lecz działanie na organizm. Nie zawsze, ale jednak bardzo często to, czy dana substancja będzie dla organizmu obojętna, szkodliwa czy lecznicza, zależy od konfiguracji jej centrów stereogenicznych, jeśli takie posiada. Przykładowo lek przeciwbólowy Ibuprofen jest zwykle syntezowany w formie racematu, jednak właściwości lecznicze ma tylko S izomer, co znaczyłoby, że połowa wyprodukowanego związku jest zupełnie niepotrzebna. Okazało się jednak że obie odmiany mogą zamieniać się w siebie w organizmie. Podobnie jest z Naproksenem - tylko jeden izomer ma właściwości przeciwbólowe, a oba są toksyczne dla wątroby.
Niekiedy działanie odmian może być skrajnie różne, zależnie od konfiguracji. D-propoksyfen jest środkiem przeciwbólowym; L-odmiana ma silniejsze działanie przeciwkaszlowe, ale w wysokich dawkach. Obie odmiany wycofano z powodu częstych sercowych skutków ubocznych. Naturalny kwas L-askorbinowy jest witaminą C, i bierze udział w pewnych przemianach enzymatycznych; izomer D jest nieaktywny i nie może być nazywany witaminą - choć też jest przeciwutleniaczem. Dlatego też witaminę syntetyczną produkuje się tak, aby otrzymać tylko L-izomer, w czym biorą udział pewne szczepy bakteryjne.
Amfetamina i metamfetamina też mają dwie odmiany - odmiana D pobudza zarówno obwodowy jak i centralny układ nerwowy, i ma działanie narkotyczne; izomer L pobudza tylko OUN i nie wywołuje odurzenia, dlatego też ten izomer bywa stosowany w inhalatorach donosowych, wywołując skurcz naczyń krwionośnych. Inny środek narkotyczny, nikotyna, w naturze występuje w odmianie S(-). Enancjomer R ma podobne działanie lecznice, ale jest znacznie mniej toksyczny - źródła podają że od 20 do 40 razy.
Skrajnym przypadkiem jest niechlubny Talidomid, którego jeden enancjomer zapobiegał mdłościom, bólom głowy i miał działanie uspokajające, a drugi miał działanie teratogenne, uszkadzające płód. Produkowany preparat był racemiczną mieszanką obu izomerów, i zalecany kobietom w ciąży, co doprowadziło do narodzin tysięcy kalekich dzieci, co kiedyś już opisałem. Obecnie bywa używany w chemioterapii do hamowania rozrostu guza.
Skoro między właściwościami izomerów istnieją na tyle istotne różnice, to chyba najlepiej byłoby wziąć tylko jeden z nich i stosować czysty związek? Jak najbardziej, tyle że nie jest to taka łatwa sprawa gdy mamy je zmieszane. Stereoizomery mają takie same właściwości fizyczne i chemiczne - jedynie czasem różnią się na przykład strukturą krystaliczną, lub szybkością reagowania i można próbować rozdzielać je w ten sposób. Zrobił to choćby Pasteur, sortując kryształki soli kwasu winowego, obie bowiem odmiany tego związku najchętniej tworzą kryształy zawierające tylko jedną z nich. Czynią to na tyle chętnie, że chemikowi udało się przeprowadzić bardzo zabawne doświadczenie - do kuwety z nasyconym racematem kwasu, włożył z jednej strony kryształek odmiany R a z drugiej odmiany S. Kryształy stopniowo rosły, przyjmując do sieci krystalicznej cząsteczki tylko jednej odmiany, takiej samej jak w krysztale zarodkowym, aż otrzymał dwa duże kryształy rozdzielonych izomerów.
Inny pomysł polega na zastosowaniu chiralnych reagentów, tworzących związki o wystarczająco różnych właściwościach. Przykładowo związek nasz w mieszaninie R i S jest lekko zasadową aminą, więc traktujemy go na przykład R,R kwasem winowym. Tworzą się nam dwie sole - RR-winian-R-aminy i RR-winian-S-aminy, które bardzo często różnią się rozpuszczalnością, bo chiralne fragmenty różnie ze sobą reagują. Chwytając kogoś prawą dłonią za prawą, możemy go złapać mocniej, niż prawą za lewą, i podobnie jest w tego typu solach.
Dla tych, gdzie oddziaływania są silniejsze, krystalizacja zachodzi chętniej, więc można je wydzielić przez wielokrotne przekrystalizowanie. Inny pomysł polega na tworzeniu estrów o różnej rozpuszczalności bądź temperaturze wrzenia. Bardziej wyrafinowane sposoby wykorzystują reakcje enzymatyczne - na przykład związek o naturze alkoholu przeprowadzamy w ester kwasu tłuszczowego i traktujemy którąś z esteraz - enzymów trawiennych przywykłych do rozkładania połączeń o jednej konfiguracji. Rozkład na przykład R-estru, daje nam selektywnie wyjściowy alkohol, czysty enancjomerycznie, możliwy do oddzielenia przez ekstrakcję. Jeszcze inna metoda polega na zastosowaniu chromatografii kolumnowej, z wypełnieniem zawierającym chiralne związki - na przykład krystaliczną celulozę - jest to jednak metoda bardzo droga.
A może łatwiej byłoby otrzymywać od razu jeden izomer, a nie mieszaninę dwóch? - w tym właśnie cały ambaras, aby nie powstawały oba na raz. Jeżeli poddajemy reakcjom związki już chiralne, i w trakcie reakcji centrum stereogeniczne nie jest naruszane, to otrzymamy selektywnie czysty izomer produktu, przykładowo redukując naturalne R-aminokwasy, otrzymamy R-aminoalkohole a z tych na przykład pierścieniową R-oksazolinę. Reakcje, gdy wychodząc z substratu o określonej konfiguracji, otrzymujemy produkt o określonej konfiguracji, nazywamy stereoselektywnymi.
Nieco większy problem sprawiają nam reakcje, w których mamy stworzyć nowe centrum, wychodząc ze związku, który takiego nie posiada. Weźmy sobie taki prosty związek jak 1,3-dimetyloheksen, z jednym wiązaniem podwójnym. I poddajmy go reakcji przyłączenia chlorowodoru. Zgodnie z odpowiednimi prawami, wodór przyłączy się z tej strony wiązania, gdzie jest już drugi, a chlor przy grupie metylowej. I powstanie nam centrum stereogeniczne, mające w otoczeniu - przy jednym wiązaniu grupę metylową, przy drugim chlor, przy trzecim pierścień mający grupę metylową za 4 węgle a z czwartej strony ten sam pierścień, ale z grupą metylową za trzy węgle. Tylko jaka będzie konfiguracja? Mieszana.
Gdy atom chloru atakuje wiązanie podwójne, o płaskiej strukturze, może dotrzeć do cząsteczki z dwóch stron - od lewej i od prawej. Ponieważ cząsteczka jest płaska, szanse obu przebiegów są równe, w efekcie otrzymujemy równomolową mieszankę produktów, powstałych a ataku z lewej i z prawej, czyli R:S 1:1 - a zatem racemat.
Wszystkie metody syntezy, mającej zachwiać tą symetrią - a więc syntezy asymetryczne - opierają się na utrudnieniu dostępu z jednej strony, co może być osiągnięte na różne sposoby. Związek może być zaabsorbowany na powierzchni kryształu - jedna strona będzie zasłonięta i będzie się nam tworzył jeden produkt. Największe jednak zastosowanie mają specyficzne, chiralne katalizatory. Jak mogą działać?
Weźmy sobie cząsteczkę bardzo podobną do powyższej, ale z grupą hydroksylową, a więc 1-metyloheksen-3-ol. Grupa hydroksylowa przy trzecim węglu sama tworzy centrum stereogeniczne. Teraz przed dodaniem substraktu, używamy katalizatora - odpowiedniego kompleksu zawierającego jakiś metal, tak dobranego, że jon metalu może tworzyć wiązania koordynacyjne z elektronami Pi wiązania podwójnego, i wolnymi parami elektronowymi tlenu. Będzie zatem łączył się z cząsteczką od tej strony, z której jest grupa OH
zasłoni więc sobą jedną stronę, umożliwiając dostęp z drugiej strony. W tym przykładzie nowe centrum będzie miało konfigurację R. Jest to przykład wymyślony, ale pokazuje jak takie selektywne reakcje mogą zachodzić.
Prawdziwym majstersztykiem jest stosowana na skalę przemysłową synteza 1R,2S,5R-mentolu, a więc takiego samego związku jak naturalny. Związkiem wyjściowym jest terpenoid mircen, po katalitycznej izomeryzacji zamieniany na R-cytronellal a ten cyklizowany do ostatecznej cząsteczki z trzema centrami chiralnymi. Twórca tej metody Ryoji Noyori w roku 2001 dostał nagrodę Nobla za prace nad asymetrycznym uwodornieniem.
Triazyny to związki organiczne, składające się z sześcioczłonowych pierścieni, w których znajdują się trzy atomy azotu. Możliwe są trzy ich ustawienia - w pozycjach 1,2,3, a więc wszystkie obok siebie; 1,2,4 - dwa obok siebie a jeden z odstępem; oraz 1,3,5 czyli symetrycznie rozdzielone. W moim przypadku zajmuję się 1,2,4-triazyną.
Pochodne triazyn dosyć chętnie tworzą kompleksy z jonami metali, i niektóre z nich mają zdolność do takiego katalizowania reakcji tworzących nowe centrum stereogeniczne, aby powstawał nadmiar jednego z izomerów, a co za tym idzie, zamiast racematu 1:1 otrzymujemy mieszaninę na przykład 6:4, 7:3 czy też najchętniej, ale rzadko 9:1 i wyższe.
A tym, czym będę się zajmował na pracowni, będzie tworzenie chiralnych ligandów do kompleksów mających wywoływać taką selektywność.
Dotarłem już w nauce akademickiej do tego momentu, gdy zamiast poprzestawać wyłącznie na powtarzaniu już opisanych i przygotowanych reakcji, muszę zacząć podjąć własną pracę naukową - oczywiście pod bacznym okiem promotora, dr Ewy Wolińskiej.
Dokładnie określonego tematu pracy jeszcze nie mam, ale zasadniczo opierać się będzie ona na syntezie zawierających 1,2,4-triazynę ligandów, do katalizatorów mających posłużyć do syntezy asymetrycznej. Zanim jednak omówię coś z przeprowadzonych syntez, muszę oczywiście objaśnić co też są to te triazyny, ligandy i dlaczego synteza miałaby być asymetryczna; ponieważ jednak objaśnienia te bardzo mi się wydłużyły, uznałem że ten wstęp teoretyczny podam w jednym wpisie, zaś trzy kolejne etapy właściwej syntezy omówię w kolejnych. Teraz więc będzie o tym, czy mogą istnieć "lewe" cząsteczki i jak to się ma do naszego zdrowia:
Jedną z właściwości cząsteczek organicznych, jest posiadanie określonej symetrii. Popatrzcie na swoje ręce; najlepiej wyciągnijcie je przed siebie i połóżcie jedną na drugą, bez obracania ku sobie. Nie nakładają się. Kciuki sterczą w przeciwne strony. Możemy jednak obrócić jedną i złożyć z drugą jak do modlitwy, wtedy ich obrysy będą się nakładały, ale nadal nie będą identyczne, bo ich grzbiety będą skierowane w przeciwne strony. Jak byśmy ich nie obracali, jedna nie stanie się taka jak druga.
To zupełnie oczywiste - jedna jest dłonią lewą a druga prawą. Są do siebie podobne jak lustrzane odbicia. Gdyby ktoś miał idealnie symetryczne dłonie, to lustrzane odbicie jednej wyglądałoby dokładnie tak jak druga.
O bryłach mających tą właściwość, że podobnie jak dłonie, posiadają formę "lewą" i "prawą", które nie dają się na siebie nałożyć przez obrót w przestrzeni, i są do siebie podobne jak lustrzane odbicia, mówimy że są chiralne (od greckiego chira - ręka). Jest wiele takich figur. Istnieją lewe i prawe muszle ślimaków, kwiaty, a z przedmiotów codziennego użytku, nożyczki dla prawo i leworęcznych:
Nie inaczej jest ze związkami chemicznymi. Już na początku XIX wieku skrupulatny badacz Ludwik Pasteur, najbardziej znany z badań nad fermentacją, przyglądając się kryształom soli syntetycznego kwasu winowego zauważył, iż są one asymetryczne, oraż że tworzą dwie odmiany, podobne jak lustrzane odbicia. Gdy zaś oddzielił jedną odmianę od drugiej, po prostu sortując kryształki pincetą, stwierdził że kwas winowy "prawy" zawsze krystalizuje w takiej formie. Uznał więc, że widocznie musi istnieć prawa i lewa odmiana kwasu winowego, które różnią się kształtem cząsteczki. Teoria atomowa była wówczas w powijakach, a co dopiero teoria struktury cząsteczek, toteż przez długi czas ta luźna hipoteza nie znajdowała zainteresowania. Do czasu gdy odkryto wreszcie jak rozłożone są w przestrzeni wiązania z węglem w związkach organicznych.
Węgiel w tych związkach tworzy cztery wiązania z innymi atomami - mogą to być wiązania potrójne, podwójne lub pojedyncze. Ponieważ każde wiązanie stanowi parę elektronową, a każda taka para odpycha się od innej, starają się one rozłożyć w przestrzeni w największym możliwym oddaleniu, co w przypadku czterech wiązań pojedynczych realizuje się w formie rozłożenia tetraedrycznego - to jest atom znajduje się jakby w środku foremnego czworościanu, a wiązania biegną do naroży. Jeśli teraz zdarzy się, że przy każdym z wiązań podczepiona będzie inna grupa, to cała cząsteczka stanie się chiralna, i możliwe staną się dla niej dwie konfiguracje - lewa i prawa, podobne jak lustrzane odbicia, jak to widać na tej pięknej grafice:
Związki chemiczne mające taką właśnie lustrzaną właściwość, to enancjomery, zaś atom węgla (czasem może to być fosfor lub azot, ale rzadziej) wokół którego pojawia się ta szczególna asymetria, nazywany jest atomem asymetrycznym, centrum chiralnym lub też jak zaleca się ostatnio centrum stereogenicznym. Konfigurację podstawników wokół takiego atomu określa się na różne sposoby - najczęściej używana metoda, polega na przypisaniu podstawnikom "ważności", tak że na przykład grupa metylowa jest ważniejsza od podstawnika wodorowego, etylowa od metylowej, a chlorkowa od etylowej. Jeśli teraz tak obrócić nasz asymetryczny atom, aby podstawnik o najmniejszej ważności znalazł się z tyłu, to konfigurację określa kierunek w którym poustawiane są pozostałe - gdy od najważniejszego do najmniej ważnego ruch jest zgodny z kierunkiem wskazówek zegara, to konfiguracja jest określana literą R, gdy jest odwrotnie, konfigurację określamy S. Są też inne typy konfiguracji, na przykład dla cukrów i aminokwasów zwykle używa się oznaczeń D i L.
Gdy związek ma więcej jak jedno takie miejsce, sytuacja się komplikuje, bo wówczas możliwa jest większa liczba kombinacji - każde centrum może mieć dwie konfiguracje. Kwas winowy ma dwa takie miejsca, stąd możliwe są dla niego trzy odmiany: gdy oba centra mają konfigurację R, gdy oba mają S i gdy jedno ma R a drugie S. Glukoza ma cztery takie miejsca i dla niej możliwych jest 16 odmian, cholesterol ma 8 takich miejsc i teoretycznie mógłby mieć ponad 200 odmian, choć niektóre struktury za bardzo deformowałyby cząsteczkę. Takie odmiany wielocentrowe, nazywamy stereoizomerami, i nie są one już swymi lustrzanymi odbiciami.
Natomiast mieszaniny równych ilości R i S izomerów, nazywamy racematami.
I co z tego?
Izomery różniące się konfiguracją, mają takie same właściwości chemiczne, jednak dość istotne różnice zachodzą w ich oddziaływaniu biologicznym, oto bowiem my sami jesteśmy chiralni.
Podstawowymi związkami strukturalnymi organizmów żywych są białka, te zaś zbudowane są z aminokwasów - związków, zawierających grupę aminową i karboksylową, połączonych do tego samego węgla. Jeśli dwa pozostałe podstawniki są różne, to cząsteczka staje się chiralna i tak właśnie jest w przypadku wszystkich biogennych aminokwasów, z wyjątkiem glicyny. Z tych chiralnych cząsteczek zbudowane są białka, a z białek elementy strukturalne, i jak się okazuje, bardzo często konfiguracja substancji wpływa na reakcje jakim ulega w naszym organizmie. Jednym z takich znanych przypadków, jest limonen - izomer D ma zapach pomarańczy i występuje w skórce tego owocu, izomer L ma zapach terpentyny i występuje w roślinach szpilkowych. Będący jego pochodną karwon ma jeszcze wyraźniejsze różnice zapachu - izomer S pachnie anyżkiem, a izomer R miętą. Inny terpenoid, mentol, ma trzy centra i 8 odmian; odmiana występująca w mięcie polnej i mająca najsilniejsze działanie i zapach, ma konfigurację 1R,2S,5R, pozostałe występują rzadko lub zostały otrzymane sztucznie
W podobny sposób różnią się smaki izomerów - lustrzane wersje substancji słodkich mogą mieć smak kwaśny lub gorzki, choć nie zawsze tak jest. Lustrzana wersja glukozy jest tak samo słodka jak oma, ma jednak jedną ciekawą właściwość - nie pasuje do pierwszego enzymu, rozpoczynającego metabolizm. Powoduje to, że nie jest przetwarzana na energię i zostaje w niezmienionej formie wydalona - byłaby zatem idealnym słodzikiem, słodkim ale nie kalorycznym. Niestety jej produkcja jest nieopłacalna.
Dla nas jednak najistotniejszą kwestią nie jest smak czy zapach, lecz działanie na organizm. Nie zawsze, ale jednak bardzo często to, czy dana substancja będzie dla organizmu obojętna, szkodliwa czy lecznicza, zależy od konfiguracji jej centrów stereogenicznych, jeśli takie posiada. Przykładowo lek przeciwbólowy Ibuprofen jest zwykle syntezowany w formie racematu, jednak właściwości lecznicze ma tylko S izomer, co znaczyłoby, że połowa wyprodukowanego związku jest zupełnie niepotrzebna. Okazało się jednak że obie odmiany mogą zamieniać się w siebie w organizmie. Podobnie jest z Naproksenem - tylko jeden izomer ma właściwości przeciwbólowe, a oba są toksyczne dla wątroby.
Niekiedy działanie odmian może być skrajnie różne, zależnie od konfiguracji. D-propoksyfen jest środkiem przeciwbólowym; L-odmiana ma silniejsze działanie przeciwkaszlowe, ale w wysokich dawkach. Obie odmiany wycofano z powodu częstych sercowych skutków ubocznych. Naturalny kwas L-askorbinowy jest witaminą C, i bierze udział w pewnych przemianach enzymatycznych; izomer D jest nieaktywny i nie może być nazywany witaminą - choć też jest przeciwutleniaczem. Dlatego też witaminę syntetyczną produkuje się tak, aby otrzymać tylko L-izomer, w czym biorą udział pewne szczepy bakteryjne.
Amfetamina i metamfetamina też mają dwie odmiany - odmiana D pobudza zarówno obwodowy jak i centralny układ nerwowy, i ma działanie narkotyczne; izomer L pobudza tylko OUN i nie wywołuje odurzenia, dlatego też ten izomer bywa stosowany w inhalatorach donosowych, wywołując skurcz naczyń krwionośnych. Inny środek narkotyczny, nikotyna, w naturze występuje w odmianie S(-). Enancjomer R ma podobne działanie lecznice, ale jest znacznie mniej toksyczny - źródła podają że od 20 do 40 razy.
Skrajnym przypadkiem jest niechlubny Talidomid, którego jeden enancjomer zapobiegał mdłościom, bólom głowy i miał działanie uspokajające, a drugi miał działanie teratogenne, uszkadzające płód. Produkowany preparat był racemiczną mieszanką obu izomerów, i zalecany kobietom w ciąży, co doprowadziło do narodzin tysięcy kalekich dzieci, co kiedyś już opisałem. Obecnie bywa używany w chemioterapii do hamowania rozrostu guza.
Skoro między właściwościami izomerów istnieją na tyle istotne różnice, to chyba najlepiej byłoby wziąć tylko jeden z nich i stosować czysty związek? Jak najbardziej, tyle że nie jest to taka łatwa sprawa gdy mamy je zmieszane. Stereoizomery mają takie same właściwości fizyczne i chemiczne - jedynie czasem różnią się na przykład strukturą krystaliczną, lub szybkością reagowania i można próbować rozdzielać je w ten sposób. Zrobił to choćby Pasteur, sortując kryształki soli kwasu winowego, obie bowiem odmiany tego związku najchętniej tworzą kryształy zawierające tylko jedną z nich. Czynią to na tyle chętnie, że chemikowi udało się przeprowadzić bardzo zabawne doświadczenie - do kuwety z nasyconym racematem kwasu, włożył z jednej strony kryształek odmiany R a z drugiej odmiany S. Kryształy stopniowo rosły, przyjmując do sieci krystalicznej cząsteczki tylko jednej odmiany, takiej samej jak w krysztale zarodkowym, aż otrzymał dwa duże kryształy rozdzielonych izomerów.
Inny pomysł polega na zastosowaniu chiralnych reagentów, tworzących związki o wystarczająco różnych właściwościach. Przykładowo związek nasz w mieszaninie R i S jest lekko zasadową aminą, więc traktujemy go na przykład R,R kwasem winowym. Tworzą się nam dwie sole - RR-winian-R-aminy i RR-winian-S-aminy, które bardzo często różnią się rozpuszczalnością, bo chiralne fragmenty różnie ze sobą reagują. Chwytając kogoś prawą dłonią za prawą, możemy go złapać mocniej, niż prawą za lewą, i podobnie jest w tego typu solach.
Dla tych, gdzie oddziaływania są silniejsze, krystalizacja zachodzi chętniej, więc można je wydzielić przez wielokrotne przekrystalizowanie. Inny pomysł polega na tworzeniu estrów o różnej rozpuszczalności bądź temperaturze wrzenia. Bardziej wyrafinowane sposoby wykorzystują reakcje enzymatyczne - na przykład związek o naturze alkoholu przeprowadzamy w ester kwasu tłuszczowego i traktujemy którąś z esteraz - enzymów trawiennych przywykłych do rozkładania połączeń o jednej konfiguracji. Rozkład na przykład R-estru, daje nam selektywnie wyjściowy alkohol, czysty enancjomerycznie, możliwy do oddzielenia przez ekstrakcję. Jeszcze inna metoda polega na zastosowaniu chromatografii kolumnowej, z wypełnieniem zawierającym chiralne związki - na przykład krystaliczną celulozę - jest to jednak metoda bardzo droga.
A może łatwiej byłoby otrzymywać od razu jeden izomer, a nie mieszaninę dwóch? - w tym właśnie cały ambaras, aby nie powstawały oba na raz. Jeżeli poddajemy reakcjom związki już chiralne, i w trakcie reakcji centrum stereogeniczne nie jest naruszane, to otrzymamy selektywnie czysty izomer produktu, przykładowo redukując naturalne R-aminokwasy, otrzymamy R-aminoalkohole a z tych na przykład pierścieniową R-oksazolinę. Reakcje, gdy wychodząc z substratu o określonej konfiguracji, otrzymujemy produkt o określonej konfiguracji, nazywamy stereoselektywnymi.
Nieco większy problem sprawiają nam reakcje, w których mamy stworzyć nowe centrum, wychodząc ze związku, który takiego nie posiada. Weźmy sobie taki prosty związek jak 1,3-dimetyloheksen, z jednym wiązaniem podwójnym. I poddajmy go reakcji przyłączenia chlorowodoru. Zgodnie z odpowiednimi prawami, wodór przyłączy się z tej strony wiązania, gdzie jest już drugi, a chlor przy grupie metylowej. I powstanie nam centrum stereogeniczne, mające w otoczeniu - przy jednym wiązaniu grupę metylową, przy drugim chlor, przy trzecim pierścień mający grupę metylową za 4 węgle a z czwartej strony ten sam pierścień, ale z grupą metylową za trzy węgle. Tylko jaka będzie konfiguracja? Mieszana.
Gdy atom chloru atakuje wiązanie podwójne, o płaskiej strukturze, może dotrzeć do cząsteczki z dwóch stron - od lewej i od prawej. Ponieważ cząsteczka jest płaska, szanse obu przebiegów są równe, w efekcie otrzymujemy równomolową mieszankę produktów, powstałych a ataku z lewej i z prawej, czyli R:S 1:1 - a zatem racemat.
Wszystkie metody syntezy, mającej zachwiać tą symetrią - a więc syntezy asymetryczne - opierają się na utrudnieniu dostępu z jednej strony, co może być osiągnięte na różne sposoby. Związek może być zaabsorbowany na powierzchni kryształu - jedna strona będzie zasłonięta i będzie się nam tworzył jeden produkt. Największe jednak zastosowanie mają specyficzne, chiralne katalizatory. Jak mogą działać?
Weźmy sobie cząsteczkę bardzo podobną do powyższej, ale z grupą hydroksylową, a więc 1-metyloheksen-3-ol. Grupa hydroksylowa przy trzecim węglu sama tworzy centrum stereogeniczne. Teraz przed dodaniem substraktu, używamy katalizatora - odpowiedniego kompleksu zawierającego jakiś metal, tak dobranego, że jon metalu może tworzyć wiązania koordynacyjne z elektronami Pi wiązania podwójnego, i wolnymi parami elektronowymi tlenu. Będzie zatem łączył się z cząsteczką od tej strony, z której jest grupa OH
zasłoni więc sobą jedną stronę, umożliwiając dostęp z drugiej strony. W tym przykładzie nowe centrum będzie miało konfigurację R. Jest to przykład wymyślony, ale pokazuje jak takie selektywne reakcje mogą zachodzić.
Prawdziwym majstersztykiem jest stosowana na skalę przemysłową synteza 1R,2S,5R-mentolu, a więc takiego samego związku jak naturalny. Związkiem wyjściowym jest terpenoid mircen, po katalitycznej izomeryzacji zamieniany na R-cytronellal a ten cyklizowany do ostatecznej cząsteczki z trzema centrami chiralnymi. Twórca tej metody Ryoji Noyori w roku 2001 dostał nagrodę Nobla za prace nad asymetrycznym uwodornieniem.
Triazyny to związki organiczne, składające się z sześcioczłonowych pierścieni, w których znajdują się trzy atomy azotu. Możliwe są trzy ich ustawienia - w pozycjach 1,2,3, a więc wszystkie obok siebie; 1,2,4 - dwa obok siebie a jeden z odstępem; oraz 1,3,5 czyli symetrycznie rozdzielone. W moim przypadku zajmuję się 1,2,4-triazyną.
Pochodne triazyn dosyć chętnie tworzą kompleksy z jonami metali, i niektóre z nich mają zdolność do takiego katalizowania reakcji tworzących nowe centrum stereogeniczne, aby powstawał nadmiar jednego z izomerów, a co za tym idzie, zamiast racematu 1:1 otrzymujemy mieszaninę na przykład 6:4, 7:3 czy też najchętniej, ale rzadko 9:1 i wyższe.
A tym, czym będę się zajmował na pracowni, będzie tworzenie chiralnych ligandów do kompleksów mających wywoływać taką selektywność.
Subskrybuj:
Komentarze (Atom)