Na zajęciach z chemii fizycznej w zeszłym roku, badaliśmy ruchliwość koloidu w polu elektrycznym:
Był to koloid jodku srebra. Należało nalać go do rurki tak, aby roztwór podzielił się na dwie wyraźnie odgraniczone warstwy - z koloidem i bez. Po włączeniu prądu cząstki koloidu zaczęły migrować zgodnie z ładunkiem potencjału na granicy faz, co dało się zauważyć jako zmiana poziomów. Na trzecim zdjęciu pierwsze cząstki koloidu dotarły już do elektrody.
ps. oczywiście "laboratorium" - nie wiem jak mogłem strzelić takiego babola z "laroratorium"
informacje
poniedziałek, 26 listopada 2012
piątek, 23 listopada 2012
Wykresy
Krzywa miareczkowania
Istnieje wiele typów miareczkowań, wszystkie jednak charakteryzują się bardzo podobnym kształtem wykresu pX od objętości dodawanego odczynnika (owym X może być stężenie jonów wodorowych bądź innych). Wykres zależności logarytmu zmiennej od objętości zwykle przyjmuje postać rozciągniętej litery S, o spłaszczonych końcach i nagłym skoku wartości. Punkt końcowy takiego miareczkowania powinien znajdować się dokładnie w połowie skoku krzywej. Aby ją wyznaczyć należy zastosować dość skomplikowaną konstrukcję matematyczną, którą narysowałem na wykresie z miareczkowania potencjometrycznego, które kiedyś wykonywałem:
 Należy
wybrać z prostoliniowych odcinków wykresu dwie linie równoległe i znaleźć linię do
nich prostopadłą. Od jej środka należy wyprowadzić linię prostopadłą.
Przetnie ona skok krzywej dokładnie w połowie. Powinna przynajmniej.
Można wykonywać te operacje na wydruku, linijką i cyrklem dla lepszej
dokładności. Jak jednak zauważyłem, można uzyskać ten sam efekt w inny
sposób, mianowicie każąc Excelowi narysować linię trendu. Przetnie ona
skok krzywej w połowie, jak to widać na mojej zupełnie wymyślonej
krzywej poniżej:
Należy
wybrać z prostoliniowych odcinków wykresu dwie linie równoległe i znaleźć linię do
nich prostopadłą. Od jej środka należy wyprowadzić linię prostopadłą.
Przetnie ona skok krzywej dokładnie w połowie. Powinna przynajmniej.
Można wykonywać te operacje na wydruku, linijką i cyrklem dla lepszej
dokładności. Jak jednak zauważyłem, można uzyskać ten sam efekt w inny
sposób, mianowicie każąc Excelowi narysować linię trendu. Przetnie ona
skok krzywej w połowie, jak to widać na mojej zupełnie wymyślonej
krzywej poniżej: Sprawdzałem,
że nawet trzykrotne przedłużenie jednego z prostoliniowych odcinków
wykresu, nie przesuwa tego punktu, może to być zatem taki nieklasyczny
sposób wyznaczenie P.K.
Sprawdzałem,
że nawet trzykrotne przedłużenie jednego z prostoliniowych odcinków
wykresu, nie przesuwa tego punktu, może to być zatem taki nieklasyczny
sposób wyznaczenie P.K.Inny sposób to wykreślenie wykresu pochodnej. Pochodna, to taka funkcja, która pokazuje jak szybko zmienia się funkcja dana, albo ściślej, jest to funkcja różnicy Y do X. W tym przypadku może to być delta pH do czasu. Aby zrobić to w Excelu należy wpisać w jedno z okienek taki wzór, aby uzyskać ciąg wyników odejmowań wartości pH od tej która ją poprzedza.
Może objaśnię to na konkretnym przykładzie. Mamy taką oto tabelę danych, na podstawie której stworzyliśmy wykres ze skokiem krzywej:
Po czym należy stworzyć nową tabelę na podstawie otrzymanych wyników:
Jak widać dopóki odejmowane od siebie wyniki mieściły się na prostej, ich pochodna przyjmowała stałą wartość, dopiero w obrębie skoku krzywej zwiększała się. Czubek "piku" pochodnej stanowi środek skoku krzywej a więc też punkt końcowy. Dla pierwszej zmyślonej krzywej:

Jeśliby jednak wartość skoku krzywej była mała a on sam dosyć łagodny, tak że nasza pochodna uzyskałaby kształt mocno zaokrąglony, dla pewności można wyprowadzić pochodną naszej pochodnej, która nam te zmiany zaostrzy. Niestety dla niedokładnych pomiarów, w których krzywa pierwotnego wykresu ma dosyć dużo nagłych załamań, będących punktami szybszej zmiany wartości, wykres drugiej pochodnej może być prawie nieczytelny, jak na tym, będącym drugą pochodną rzeczywistej krzywej z pierwszego obrazka:

Nieco inny kształt ma krzywa dla miareczkowania konduktometrycznego. Tutaj miareczkujemy analit roztworem, zawierającym jony "niwelujące" przewodnictwo związane z jonami analitu. Na przykład miareczkowanie wodorotlenku sodu kwasem solnym.
Roztwór na początku ma dobre przewodnictwo związane z obecnością kationów sodowych ale zdecydowanie mocniej z jonami hydroksylowymi. Gdy dodamy do niego kwasu solnego jony hydroksylowe zareagują z hydroniowymi czyli zobojętnią się i powstanie słabo przewodząca woda. Wprawdzie równocześnie wprowadziliśmy aniony chlorkowe, ale ich wpływ na przewodzenie nie jest duży a całość nam się rozcieńczyła dlatego ogólne przewodnictwo spadło. W miarę dodawania kolejnych porcji kwasu przewodnictwo będzie spadało aż do punktu końcowego, czyli zobojętnienia. Po jego minięciu jony hydroniowe z kwasu będą poprawiały przewodnictwo, które będzie rosło. W dobrych warunkach otrzymamy ładny wykres w kształcie litery V jak na tym z rzeczywistego miareczkowania:
Oczywiście mówię tu o dobrych warunkach, często, zwłaszcza dla miareczkowania słabych elektrolitów, krzywa jest mniej lub bardziej wypłaszczona na dnie.
Krzywa wzorcowa
Dla wielu przypadków nie możemy otrzymać wyniku pomiaru wprost, lecz musimy odnosić go do pewnej skali, wykonanej w tych samych warunkach, na przykład przez pomiar wykonany na roztworach wzorcowych o znanym stężeniu. Z każdego pomiaru otrzymujemy jeden wynik, jeden punkt do umieszczenia na wykresie. Teraz więc powinniśmy wyznaczyć z tego krzywą - albo raczej prostą. Rzecz bowiem w tym że najlepiej gdy nasz wynik mieści się w tym zakresie warunków, w którym zależność stężenie/wynik jest liniowa, wówczas możemy bez problemu przyjąć że nawet jeśli nasz wynik odpowiada położeniu między punktami roztworów wzorcowych, to odpowiada stężeniu leżącemu na wyznaczonej przez nie prostej.
Jeśli wszystko przygotujemy jak trzeba a sprzęt będzie działał bez zarzutu, otrzymamy ładniutką linię jak tu:
Niestety świat nie jest idealny a nasza dokładność ograniczona, toteż zwykle otrzymujemy pewien zbiór punktów które nie bardzo da się na siebie nałożyć. W dodatku wcale nie jest powiedziane, że zależność pomiar/stężenie musi być liniowa dla wszystkich warunków. Weźmy na przykład taki wykres zależności absorbancja/stężenie dla pewnego kompleksu:
Dla niskich stężeń kompleks jest mało trwały i zabarwienie jest słabsze niż by to wynikało z rozcieńczenia; po przekroczeniu pewnej granicy zależność jest liniowa i daje się opisać pewnym wzorem matematycznym, natomiast powyżej pewnego stężenia jony kompleksu tworzą konglomeraty zabarwione silniej. W dodatku w roztworze nie zawierającym kompleksu przyrząd zmierzył jakaś absorbancję i wykres nie zaczyna się w punkcie 0/0. Tak się akurat może zdarzyć i zdarzało się, chociaż powyższy wykres został wymyślony.
Teraz próbujemy za pomocą tego wykresu wyznaczyć z absorbancji trzech próbek ich prawdziwe stężenia - dla punktu 1 jest to łatwe, bo nałożył się na jeden z punktów pomiarowych, w tym przypadku odpowiadając stężeniu 0,09. Dla punktu 2 też nie jest to trudne - zmieścił się w zakresie zaznaczonego na czerwono odcinka liniowego, możemy więc wyznaczyć właściwe stężenie metodą graficzną, zaznaczając punkt na wykresie i sprawdzając jakiemu stężeniu odpowiada (powiedzmy że 0,055), możemy też jednak zrobić rzecz dokładniej.
Możemy wyciąć z wpisanej w Excela tabeli kawałek, odpowiadający liniowej zależności i po stworzeniu na jego podstawie wykresu kazać programowi aby wyrysował linię trendu z równaniem określającym zależność X od Y - w tym przypadku równanie miało postać Y = 8,109x + 0,928. Wiedząc jakie jest Y (absorbancja) możemy wyliczyć X czyli stężenie i równanie będzie pasowało dla wszystkich pomiarów mieszczących się w tym zakresie.
Pozostał nam jednak jeszcze jeden pomiar, który wypadł poza odcinkiem liniowym, w dodatku między punktami pomiarowymi. Możemy wykreślić między nimi odcinek i założyć, że gdy postawimy nasz punkt na tej linii to będziemy mogli odczytać prawidłową wartość, ale któż mógłby nam zaręczyć, że akurat na tym odcinku prawdziwa zależność nie wije się wedle pewnej nieprostej linii, nie poddającej się opisowi przez równania? Na przykład takiej oznaczonej zieloną krzywą. Nikt nie może czegoś takiego przewidzieć, a jeśli nie wiemy dokładnie jaka jest tutaj zależność i jakiemu Y odpowiada jaki X to nie wyznaczymy zależności ani graficznie ani matematycznie zaś wynik który możemy otrzymać będzie obarczony błędem, który może być największym błędem w całej analizie. Dlatego właśnie najlepiej wyznaczyć krzywą przed właściwym badaniem i starać się aby stężenia analizowanych próbek w miarę możliwości mieściły się w odpowiednim zakresie.
Wprowadźmy jednak nieco więcej chaosu. Może się zdarzyć że nasz sprzęt jest stary i zdarzają mu się duże szumy, zafałszowujące wyniki w obie strony i gdy naniesiemy punkty na wykres otrzymamy taką rozsypkę:
No cóż, bywa i tak. Jeśli jednak faktycznie są to przypadkowe szumy, to pamiętajmy że przypadek szumi średnio statystycznie po równo w obie strony - zatem w tym obłoczku jest prawdziwa linia trendu, a tylko złośliwie ktoś po przesuwał część punktów nad i pod nią. W takiej sytuacji musimy albo zdać się na opcję "dodaj linię trendu" albo samemu wyznaczyć jakąś linię, która znajdzie się najbardziej pomiędzy punktami. Dobra linia powinna przechodzić przez możliwie najwięcej punktów oraz umiejscawiać się pośrodku między skrajami grupy, a także mieć w miarę możliwości tyle samo punktów nad co pod nią, jak w tym przypadku:
gdzie linia przechodzi wprawdzie tylko przez trzy punkty, ale ma równo po cztery nad sobą i pod.
Ale oczywiście - powiecie zaraz, chyba łatwiej jest zlecić to Excelowi? Jak najbardziej, tylko że czasem rzucając mu surowe dane otrzymamy linię trendu zupełnie fantazyjną, jak na poniższym przykładzie:
Zdawałoby się że wyszłaby nam ładna linijka z małymi odchyleniami, ale jeden punkt ma wartość prawie dwa razy za dużą, dlaczego? A bo na przykład obluzował się kabelek przy elektrodzie, albo kuweta kolorymetru nie była przetarta i na drodze wiązki znalazła się rozpraszająca kropla. Tak się może zdarzyć, jeśli zauważymy rzecz w porę, będziemy mogli powtórzyć pomiar tej próbki, jeśli tego nie zrobimy pozostaniemy z bardzo dziwnym wynikiem.
Jedną z rzeczy które prowadzący bardzo tępili było takie właśnie bezrefleksyjne działanie, ślepe zawierzenie procedurze, jakie obrazuje powyższy wykres. Nie trzeba wielkiego doświadczenia aby zauważyć, że z linią trendu jest coś nie tak. Wprawdzie program wyrysował ją poprawnie i zgodnie z zasadą "najbardziej wypośrodkowanej linii" ale przecież leży na niej tylko jeden punkt a zupełnie pominięto kilka leżących na wyraźnej prostej. Niestety bywało (a nawet i mi dawniej się przydarzało) że uczeń zgodnie z procedurą w ćwiczeniu tworzył wykres, kazał rysować programowi absurdalny trend, potem równanie i z równania wychodziły mu wyniki z błędem rzędu 150% i więcej. I co teraz z tym zrobić?
Do śmieci. Jeśli widzimy że wynik jest absurdalnie za duży lub za mały i występuje sam jeden dziwak wśród innych normalnych, to pomińmy go jako błąd i wyrysujmy wykres dla pozostałych danych, z czego na przykład otrzymamy coś takiego:
I od razu lepiej. Z reguły w pomiarach posiadających bardzo dużo punktów pomiarowych takie przypadkowe szumy można eliminować odpowiednimi programami, należy jedynie określić jakiś przedział, w ramach którego wyniki uznaje się za błąd, na przykład zależność powinna być liniowa i punkty odbiegające od sąsiednich - poprzedniego i następnego - o więcej niż powiedzmy 5% są eliminowane, zaś te z mniejszym odchyleniem włączane i uwzględniane. W ten sposób wykres się nam wygładza a błąd zmniejsza.
Praktyka ta ma jednak swoją złą stronę - pod pozorem eliminowania punktów błędnych nieuczciwi badacze (i studenci) mogą dopasować dane do z góry powziętej tezy. Jeśli ktoś chce wykazać silną zależność na przykład między dawką leku a spadkiem odczuwalnego stopnia bólu głowy, może wyeliminować z części wykresu dolne punkty, z drugiej górne i prowadząc trend po punktach skrajnych wykazać silne działanie preparatu. Zwykle wykrywa się takie oszustwa przez dokładną analizę - jeśli na przykład w badaniu wykazano silną korelację między podlewaniem krzewów kawowych krowim moczem a spadkiem aflatoksyn w ziarnach, lecz zarazem jako błędne wyeliminowano 40% danych, to coś tu jest nie tak.
Może coś to pomoże.
ps. ponieważ ostatnio ten post miał spore zainteresowanie, dodałem praktyczny przykład postępowania.
sobota, 17 listopada 2012
Co nieco o Jodzie
Wpis początkowo mający być migawką z tego co też zdarzyło mi się kiedyś w laboratorium nieco mi się poszerzył, dlatego będzie ogólnie o jodzie i jego analityce.Na początek opowiem o pewnej często stosowanej próbie analitycznej.
Dla wykrycia w badanym roztworze jodków, za pomocą klasycznej "próbówkowej" analizy jakościowej, zazwyczaj dodaje się do niego wody chlorowej i wytrząsa z chloroformem. Chloroform nie miesza się z wodą i osiada przy dnie jako odrębna warstewka, która po wytrząśnięciu z roztworem zawierającym jod, zabarwia się na różowo:
Dla wykrycia w badanym roztworze jodków, za pomocą klasycznej "próbówkowej" analizy jakościowej, zazwyczaj dodaje się do niego wody chlorowej i wytrząsa z chloroformem. Chloroform nie miesza się z wodą i osiada przy dnie jako odrębna warstewka, która po wytrząśnięciu z roztworem zawierającym jod, zabarwia się na różowo:
W tym przypadku roztwór był dosyć stężony, więc kolor jest bardzo wyraźny. Widać też różnicę między kolorem wodnego i organicznego roztworu jodu. W wodzie, w której rozpuszcza się słabo, daje zabarwienie brunatne, z pomarańczowym odcieniem. Skąd ta różnica?
Aby wyjaśnić takie zachowanie trzeba zacząć od przyczyny fioletowej barwy pierwiastka, widocznej w stanie gazowym. W stanie stały większe grudki przypominają grafit o niebieskawym odcieniu, dopiero w drobnych, prześwitujących ziarnach lub właśnie oparach, widać dobrze intensywny fiolet.
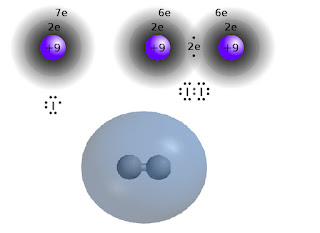
Jod tworzy cząsteczki dwuatomowe, między którymi istnieje wiązanie kowalencyjne. Wiązanie tego typu polega na połączeniu w parę po jednym wolnym elektronie z łączących się pierwiastków i umieszczeniu jej w przestrzeni między atomami. Ta "wiążące para elektronowa" oddziałuje wespół zespół z obydwoma atomami, dlatego jest dla nich "uwspólniona", zaś każdy uzyskuje w ten sposób wrażenie oktetu - najtrwalszej konfiguracji elektronów w otoczeniu. Jednakowoż jeśli opiszemy rzecz metodami mechaniki kwantowej, widzącej elektrony raczej jako rozmyte chmurki aniżeli kulki na orbitach, to rzecz stanie się nieco bardziej zawikłana.
W kwantowym modelu atomu zamiast mknących kulek mamy jak rzekłem chmurkę - a właściwie przestrzeń nazywaną orbitalem. Wiemy że elektron jest w tej przestrzeni, ale z różnym prawdopodobieństwem, co w istocie przekłada się na różne rozłożenie jego ładunku. Wiązanie pomiędzy atomami jodu tworzą zewnętrzne elektrony sigma, których orbitale są kuliste, i przez ich nakładanie się powstaje wspólny orbital molekularny obejmujący całą cząsteczkę z grubsza na kształt piłki do rugby:
Jednak sposobów łączenia się orbitali jest znacznie więcej, każdemu zaś odpowiada nieco inna energia. W tym przypadku najwyższemu rzeczywistemu orbitalowi sigma (HOMO) towarzyszy leżący nad nim najniższy potencjalny orbital (LUMO) nie zapełniony. Poziomy energetyczne tych orbitali leżą na tyle blisko, że stan elektronu może przechodzić z jednej możliwości w drugą, musi jedynie mieć dostarczoną ściśle określoną porcję energii. Na przykład może pochłonąć kwant światła odpowiadający konkretnej barwie.
Jeśli z białego światła, będącego mieszaniną wszystkich kolorów, wyciąć jakiś jeden, to suma reszty będzie widoczna jako kolor przeciwny. W tym przypadku intensywne pochłanianie zieleni, powoduje powstanie koloru fioletowego swobodnych par tego pierwiastka. Nieco inaczej rzecz przedstawia się w roztworach.
Już tu kiedyś pisałem, że w dydaktyce szkolnej opis rozpuszczania przedstawia ten proces tak, jakby zachodził w próżni, w rzeczywistości bowiem rozpuszczalnik zawsze w jakimś stopniu oddziałuje z cząsteczkami rozpuszczanych substancji. Niejednokrotnie cząsteczka zostaje otoczona warstewką silnie przyciągniętych cząsteczek rozpuszczalnika, co nie pozostaje bez wpływu na jej właściwości.
W przypadku Jodu rozpuszczalniki polarne oddziałują na tyle silnie, że tworzą kompleks, przenosząc część ładunku na jod. Poziomy energetyczne orbitali molekularnych rzeczywistego i potencjalnego rozsuwają się, jod zaczyna pochłaniać inną długość fali i zmienia kolor w stronę brunatnej czerwieni. Dlatego w wodzie i acetonie tworzy roztwory o takiej barwie. W rozpuszczalnikach słabiej oddziałujących, jak dichlorometan, jest intensywnie czerwony. W jeszcze słabszych, jak chloroform czy benzen jest różowy, a w najsłabiej oddziałujących jak heksan, tworzy roztwór fioletowy, tak jak w powietrzu. Jest to jeden z najwyraźniejszych przykładów solwatochromizmu.
Tak więc wyjaśniłem już o co chodzi w opisywanej próbie analitycznej. Nie jest ona zbytnio czuła i ma raczej znaczenie historyczne. Jest jednak jeszcze inna próba, bardziej dokładna i nadająca się do wykrywania śladowych ilości - mianowicie reakcja ze skrobią.
Skrobia, jak to już niedawno tłumaczyłem, jest naturalnym polimerem złożonych z połączonych w długie łańcuchy cząsteczek glukozy. Zależnie od typu łańcucha wyróżniamy prostą amylozę i rozgałęzioną amylopektynę - w przypadku tej ostatniej oddziaływania powodują, że łańcuchy te skręcają się w sprężynki.
Jod rozpuszcza się w wodzie bardzo słabo, chyba że obecne będą w niej jony jodkowe - łączy się wówczas w jony trójjodkowe, będące cząsteczkami wydłużonymi. Roztwór taki nazywa się płynem Lugola (natomiast klasyczna jodyna to roztwór w alkoholu). Tak się akurat składa, że rozmiar "sprężynki" amylozy, pasuje do wielkości cząsteczki trójjodkowej, toteż wpasowuje się ona między skręcone zwoje, tworząc dosyć trwały kompleks o intensywnym, granatowym zabarwieniu.
Barwa kompleksu zależy w pewnym stopniu od stężenia jodu - dla bardzo małych, jest granatowy, dla większych staje się brunatny do czerwonego. Barwa jest zauważalna już dla ilości 0,00002 mol/l jodu w roztworze. Tą samą metodą można wykryć jodki - same co prawda nie reagują ze skrobią, ale mogą być przeprowadzone w jod przez utlenienie. Jeśli do badanego roztworu dodamy zawiesinę skrobi i na przykład wodę chlorowa, to część jodków utleni się i powstający kompleks to uwidoczni.
Nie trudno zgadnąć, że skoro możemy skrobią wykryć jod, to i jodem możemy wykryć skrobię - i rzeczywiście, próba jodowa jest używana do sprawdzenia ilości i rozkładu skrobi w roślinach i pożywieniu. Tak można testować na przykład stopień dojrzałości jabłek - młode owoce zawierają głównie skrobię i kwasy owocowe, skąd cierpki smak młodych jabłuszek; w miarę rozwoju skrobia jest zużywana a w jej miejsce pojawia się coraz więcej cukrów, które maskują kwaśny posmak. Po przekrojeniu owocu polewa się powierzchnię płynem Lugola - zależnie od wielkości i rozmieszczenia zabarwienia przypisuje się owocom różną dojrzałość. W ten sposób można też wykryć obecność skrobi (również jej modyfikowanych chemicznie pochodnych, o których pisałem) tam gdzie znaleźć się nie powinna - na przykład przetworach mlecznych co do których producent nie deklaruje dodatków. Opisał to pięknie Stobiński w "Chemii i życiu".
Ale to nie koniec - wiemy że do reakcji potrzebne są na przykład jodki, skrobia i utleniacze, zatem mając te dwa pierwsze, możemy wykryć ten trzeci składnik.
Mogą to być gazy będące silnymi utleniaczami, jak chlor i brom, czy też ozon. Papierek jodoskrobiowy, zawierający jodki i skrobię, po zwilżeniu i przyłożeniu do wylotu próbówki z której jak sądzimy ulatniają się te gazy, pociemnieje. Profesjonalne paski testowe mają często skalę na której można w pewnym zakresie wyznaczać stężenie utleniaczy - w ten sposób sprawdza się na przykład czy ilość chloru w wodzie pitnej i kąpielowej nie przekracza norm.
Mogą to być silne utleniacze w roztworze, na przykład chlorany czy nadtlenek wodoru, tu jednak przy większych ilościach barwa może pojawić się na krótko - wydzielony jod jest dalej utleniony do bezbarwnych jodanów. Mogą to być nawet słabsze utleniacze, jeśli tylko ulegają odpowiedniej reakcji - na przykład azotyny (azotany III), w odróżnieniu od azotanów V. Reakcji z wydzieleniem jodu ulegają też niektóre metale - na przykład kationy miedzi II i żelaza III, będące raczej słabymi utleniaczami - toteż można by zapewne użyć papierków do wykrycia tych metali, ale dla nich znamy inne testy. Tą trójkę powiązaną możliwościami analitycznymi przedstawiłem na grafice:
Tak więc wiemy już jak wykryć jod i co wykryć można za jego pomocą, jest jednak jeszcze jedno zastosowanie jodu w analityce - mianowicie analiza ilościowa za pomocą miareczkowania jodometrycznego.
Cały pomysł polega na prostej zasadzie - pierwiastkowy jod łatwo redukuje się do jodków. Jeśli będziemy miareczkować jego roztwór przy pomocy roztworu reduktora o znanym stężeniu aż do zaniku barwy, to będziemy mogli ze zużytej objętości wyliczyć stężenie analitu, czyli zawartość jodu. Jeśli zaś mamy roztwór substancji reagującej z jodem o nieznanym stężeniu, to możemy dodać do niej znaną ilość jodu tak aby był to nadmiar, i zmiareczkować pozostały jod. wiedząc ile ubyło z pierwotnej ilości dodanego jodu, możemy wyliczyć ile musiało być w roztworze reagującej substancji.
Odwrotny przypadek to sytuacja gdy mamy nieoznaczony roztwór substancji mogącej utlenić jodki do wolnego jodu - dodajemy wówczas znaną ilość jodków i odmiareczkowujemy jod powstały w reakcji.
Jako reduktora zazwyczaj używa się tiosiarczanu sodu, który reaguje szybko wedle reakcji:
I3- + 2 S2O32- → S4O62- + 3 I-
Co zaś można oznaczać? W sposób bezpośredni siarczyny, siarczki, arsen III, glukozę i kwas askorbinowy, w pośredni wolny chlor, chlorany, azotyny, sole miedzi II i żelaza III.Tak się akurat składa, że spośród filmów miareczkowań jakie zrobiłem, najwięcej jest miareczkowań jodometrycznych i jeden z nich niedawno udostępniłem. Wykonałem go podczas praktyk w Siedleckim LOŚP, zaś analizowanym roztworem był wzorzec siarczynów:
Jest to właściwie najistotniejsza minuta miareczkowania. Ilość jodu słabnie a wraz z nią odcień roztworu. Gdy roztwór jest już słomkowy dodaję zawiesinę skrobi - dzięki temu łatwiej będzie mi uchwycić punkt końcowy, gdy zanikają ostatnie tony zabarwienia.
Ot, i tyle.
środa, 7 listopada 2012
Ostatnio w laboratorium (17.)
Na ostatniej przed świętami pracowni z chemii proekologicznej, analizowaliśmy kawałki tworzyw sztucznych, aby móc poznać z jakim konkretnie tworzywem mieliśmy do czynienia. Kawałkami tymi były: pocięta folia z opakowania loda, pocięte opakowanie kremu (z etykiety wyczytałem "do rąk i do stóp"), kawałki miękkiej rurki, kawałki uszczelki, kawałki niebieskiej zakrętki od butelki wody mineralnej i kawałek zielonego plastiku z jakiegoś opakowania z gwintem.
Jednym ze sposobów rozróżnienia tworzyw, było poznanie ich gęstości metodą flotacyjną - przez sprawdzenie pływalności w różnych roztworach. Najpierw więc dzieliliśmy je na te, które pływały w widzie i te które tonęły; z tych pierwszych na te które pływały z 30% etanolu i te które tonęły, zaś z tych pierwszych sprawdzaliśmy jeszcze pływalność w 58% etanolu. I tutaj kawałeczek zielonego plastiku po wrzuceniu do roztworu opadł na dno, potem zaczął wynurzać się aż wreszcie pozostał swobodnie zawieszony mniej więcej pośrodku.:
Znaczyłoby to, że roztwór miał akurat taką samą gęstość jak ten plastik (ok. 0,88g/ml). Z drugiej strony materiał był nieprzezroczysty i zabarwiony, musiał więc zawierać wypełniacze i pigmenty, które nieco go dociążyły. A skoro tak, to bez nich pływałby.
Inne próby dotyczyły rozpuszczalności lub nie w acetonie a nasam koniec została nam próba spalania. Niektóre materiały można dosyć łatwo rozróżnić po tym jak się palą. Poliolefiny (polietylen, polibutylen) zapalają się łatwo, słabo kopcą, kapią i po zgaszeniu pachną podobnie do świecy ze stearyny. Tak też zachował się nasz kawałek zielonego plastiku:
PCW zapala się trudno i kopci, gaśnie po wyjęciu z płomienia i wydziela nieprzyjemny, ostry zapach będący głównie wynikiem wydzielania się chlorowodoru. Polistyren pali się łatwo i silnie kopci. Jeszcze nie podsumowałem notatek i nie zrobiłem sprawozdania, więc na razie nie podam co było czym, a sam już dziś nie pamiętam.
A aspekt proekologiczny? Jeśli będziemy wiedzieli z jakiego plastiku są odpady, będziemy wiedzieli co można zakompostować, co przetopić a co wyrzucić na śmietnisko. Nie wiem jedynie czy w sortowniach stosują takie proste metody - ja bym wolał jakiś spektroskop.
Jednym ze sposobów rozróżnienia tworzyw, było poznanie ich gęstości metodą flotacyjną - przez sprawdzenie pływalności w różnych roztworach. Najpierw więc dzieliliśmy je na te, które pływały w widzie i te które tonęły; z tych pierwszych na te które pływały z 30% etanolu i te które tonęły, zaś z tych pierwszych sprawdzaliśmy jeszcze pływalność w 58% etanolu. I tutaj kawałeczek zielonego plastiku po wrzuceniu do roztworu opadł na dno, potem zaczął wynurzać się aż wreszcie pozostał swobodnie zawieszony mniej więcej pośrodku.:
Znaczyłoby to, że roztwór miał akurat taką samą gęstość jak ten plastik (ok. 0,88g/ml). Z drugiej strony materiał był nieprzezroczysty i zabarwiony, musiał więc zawierać wypełniacze i pigmenty, które nieco go dociążyły. A skoro tak, to bez nich pływałby.
Inne próby dotyczyły rozpuszczalności lub nie w acetonie a nasam koniec została nam próba spalania. Niektóre materiały można dosyć łatwo rozróżnić po tym jak się palą. Poliolefiny (polietylen, polibutylen) zapalają się łatwo, słabo kopcą, kapią i po zgaszeniu pachną podobnie do świecy ze stearyny. Tak też zachował się nasz kawałek zielonego plastiku:
PCW zapala się trudno i kopci, gaśnie po wyjęciu z płomienia i wydziela nieprzyjemny, ostry zapach będący głównie wynikiem wydzielania się chlorowodoru. Polistyren pali się łatwo i silnie kopci. Jeszcze nie podsumowałem notatek i nie zrobiłem sprawozdania, więc na razie nie podam co było czym, a sam już dziś nie pamiętam.
A aspekt proekologiczny? Jeśli będziemy wiedzieli z jakiego plastiku są odpady, będziemy wiedzieli co można zakompostować, co przetopić a co wyrzucić na śmietnisko. Nie wiem jedynie czy w sortowniach stosują takie proste metody - ja bym wolał jakiś spektroskop.
piątek, 2 listopada 2012
Modyfikowana ale nie tak
Pojawia się w zupkach chińskich, budyniach, sosach w proszku, jogurtach, kisielkach i wszelkich innych produktach wymagających zagęszczenia; tym jednak co budzi obawy nie jeśli oznaczenie E lecz rozwinięcie nazwy, mówiące o tym że jest to nie zwyczajna skrobia, ale modyfikowana. A modyfikowane coś w jedzeniu, to na pewno jakiś szkodliwy gen - myśli niezorientowany konsument. I myli się całkowicie.
Temat GMO (genetycznie modyfikowane organizmy) budzi dziś dużo kontrowersji. Kwestii tego na ile roszczenia spierających się grup są zasadne, nie będę tutaj rozstrzygał, niech to robią inni. Kontrowersje z tym związane są jednak często przenoszone na całkiem inne produkty i substancje, które jedynie kojarzą się z GMO. Dziś o modyfikacje podejrzewane jest wszystko co bierze się z soi, z lecytyną sojową włącznie. Na podobnej zasadzie dostaje się też modyfikowanej skrobi, której obecność w pożywieniu jest często powodem skarg na producentów. Przykład mamy tutaj - jako produkty GMO wyliczono wszystkie ze skrobią modyfikowaną. Nieco inną wersję znajdziemy na tym blogu - autorka wprawdzie sprawdziła, że chodzi tu o inną modyfikację, ale uważa termin za kamuflaż dla "skrobi modyfikowanej genetycznie" z której tylko i wyłącznie ma się produkować ten zagęstnik. W czym i kto nie ma racji objaśniam poniżej.
Skrobia, chemicznie rzecz ujmując, jest jednym z najpospolitszych naturalnych polimerów, stanowiąc energetyczny zapas dla roślin. Jej długie łańcuchy są zbudowane z połączonych cząsteczek glukozy:
połączonych wiązaniem α-1,4-glikozydowym. Jedna cząsteczka skrobi może się składać z od kilku setek do ponad tysiąca członów glukozowych. Zasadniczo dzieli się na dwie frakcję - amylozę składającą się wyłącznie z pojedynczych, prostych łańcuchów, i amylopektynę, której łańcuchy są w wielu miejscach rozgałęzione.
Ta różnica budowy ma istotne znaczenie dla właściwości - prosta amyloza jest nierozpuszczalna w zimnej wodzie, natomiast rozpuszcza się w gorącej. Amylopektyna częściowo rozpuszcza się w zimnej wodzie, silnie pęczniejąc i odpowiadając za kleistość mokrej skrobi.
Stanowi podstawowy składnik wielu produktów spożywczych i często jest do nich dodawana jako zagęstnik, jednak jej właściwości nie zawsze są odpowiednie. Dlatego poddaje się ją modyfikacjom, zmieniając długość i kształt cząsteczek, lub doczepiając do nich różne grupy, wpływające na zachowanie się w żywności. Jakie są to przemiany?
Najprostsza polega na częściowej hydrolizie, to jest rozdzieleniu długich łańcuchów na części, pod wpływem enzymów, podwyższonej temperatury lub kwasów. Takie kawałki nazywane dekstrynami, mające po kilkanaście członów glukozy, są już rozpuszczalne w wodzie, tworząc lepkie roztwory i zastępując gumę arabską. Dekstryny powstają między innymi podczas wypieku chleba, odpowiadając za właściwości lekko słodkawej, chrupiącej skórki. Dekstryny są też składnikami klejów, jak choćby używany dawniej klej z prażonych kasztanów. Istnieje kilka typów dekstryn, te hydrolizowane kwasami są oznaczane jako E 1400, hydrolizowane enzymatycznie jako E 1405.
Inne modyfikacje polegają na potraktowaniu skrobi kwasami (E 1401) lub zasadami (E1402) które też rozbijają łańcuchy, ale na dłuższe cząsteczki, mające po kilkadziesiąt do stu członów. Te odmiany są już słabo rozpuszczalne w zimnej wodzie. Działając na skrobię utleniaczami, otrzymuje się s. utlenioną lub bieloną zawierającą grupy karboksylowe, zależnie od użytego utleniacza jest to E 1403 dla wody utlenionej, i E 1404 dla chloranu sodu. Tak zmieniona skrobia tworzy miękkie żele podobne do żelatynowych. Wszystkie te odmiany po spożyciu rozkładają się tak samo jak zwykła skrobia, tworząc glukozę.
Inne modyfikacje polegają na podstawieniu grup wodorotlenowych odpowiednimi podstawnikami. Traktując skrobię kwasem fosforowym, można uzyskać produkt częściowo podstawiony resztą fosforanową (E 1410) lub usieciowany (E 1412) lub usieciowany i podstawiony (E 1413). Ta pierwsza odmiana charakteryzuje się niską skłonnością do retrogradacji - procesu powodującego wypychanie wody z żelu skrobiowego i tworzenie zwartych agregatów o krystalicznej strukturze. Zretrogradowana skrobia jest twarda i gorzej trawiona, dla przemysłu spożywczego większe znaczenie ma jednak to, że proces retrogradacji zmienia właściwości produktu, który staje się mniej sprężysty. Odpowiada między innymi za przemiany powodujące czerstwienie pieczywa. Odmiany usieciowane tworzą żele twarde, rozpływające się w wyższych temperaturach, odporne na przemrożenie.
Jak łatwo się domyśleć, w odróżnieniu od poprzednich odmian, skrobia fosforyzowana rozkłada się z wydzieleniem reszt fosforanowych, te zaś mają już pewien wpływ na organizm. Nadmiar fosforu w takiej formie zaburza wchłanianie wapnia, zwiększając skłonność do osteoporozy. Z drugiej strony zawartość reszt fosforanowych w modyfikowanej skrobi nie może przekraczać 0,04% (ograniczenie prawne) a zazwyczaj osiąga 0,01%, trudno zatem aby doznać nadmiaru tylko tą drogą i więcej zaszkodzić może wypicie coca-coli - choć warto uwzględniać i tę ilość wobec całkowitej ilości w pozostałych produktach. Odgórnie ustalono limit zawartości w produktach dla niemowląt na 20 g/kg produktu.
Kolejne modyfikacje polegają na przyłączeniu do skrobi reszt kwasów organicznych. Jeśli potraktować ją bezwodnikiem octowym, otrzymamy skrobię acetylowaną (E 1420) tworzącą miękkie, przezroczyste żele w niskich temperaturach. Ten podstawowy typ, ma różne odmiany, na przykład acetylowana skrobia utleniona (E 1451), acetylowany fosforan skrobiowy (E 1414), czy acetylowany adypinian skrobiowy (E 1422) tworzący żele w warunkach silnie kwaśnych, podobnie do naturalnych pektyn.
Te odmiany rozkładają się z wydzieleniem kwasu octowego, który jest nieszkodliwy, jednak ze względu na możliwe działanie drażniące ustalono limit zawartości w produktach dla niemowląt na maksymalną zawartość 50g/kg produktu[1]
Najbardziej skomplikowaną nazwę ma E 1450 - oktenylobursztynian skrobiowy - o którym zarazem najtrudniej było mi coś znaleźć. Jest to ester w którym do pierścienia glukozy dołączono kwas zawierający dwie grupy karboksylowe i wyglądający jak pochodna kwasu bursztynowego, podstawionego oktenem - stąd zawiła nazwa (podejrzewam że równie dobrze można by go nazwać kwasem 2-acetylodek-7-enowym)
Tak duża grupa organiczna powoduje że skrobia może przylepiać się do tłuszczu na granicy faz woda-tłuszcz, stąd też używa się jej do zagęszczania majonezów, musztard i kremów. Podczas rozkładu w organizmie cała ta grupa odszczepia się i jak się wydaje, jest wydalana z moczem. Znalałem tylko jeden przegląd badań na ten temat [2], w którym nie stwierdzono negatywnych wpływów na dwa kolejne pokolenia szczurów, których dieta zawierała nawet 30% tej modyfikacji. Jedynym negatywnym wpływem był niedobór magnezu wywołany tak ubogą dietą.
Sole glinowe tego związku są używane w pudrach do ciała i jako stabilizatory w tabletkach.
Kolejną zawiłą modyfikacją jest hydroksypropyloskrobia (E 1440 lub HPS) i jej kombinacje: z fosforanem (E 1442) i z gliceryną( E 1441). Otrzymuje się ją traktując substrat naturalny tlenkiem propylenu - epoksydem z trójkątnym mostkiem tlenowym, który łatwo się otwiera, przyłączając się do innych cząsteczek. Zależnie od stopnia podstawienia otrzymany produkt ma różne właściwości. Odmiany używane w przemyśle spożywczym zawierają do 60% podstawionych grup, tworzą żele o dobrym połysku, wytrzymałe na zamrażanie, stąd niekiedy pokrywa się nimi mrożone owoce aby spowolnić powierzchniowe utlenianie, a ponadto zagęszcza lody i ciasta mrożone. Zwykle też zastępuje się nimi mączkę chleba świętojańskiego. Stanowi też materiał rozpuszczających się w żołądku kapsułek na leki, zastępując używaną wcześniej żelatynę.
Podczas trawienia rozkłada się na glukozę i glikol propylowy - który z kolei utlenia się do nieszkodliwego kwasu pirogronowego lub mlekowego. Mimo to wygląda na to, że może podrażniać jelita, skłaniając je do bardziej intensywnego wydalania. Krótko mówiąc może wywołać rozwolnienie. Potwierdzają to badania - u szczurów które zjadały karmę zawierającą 50% związku pojawiała się biegunka, w innym badaniu pojawiła się przy ilości 30% karmy; w badaniu na ludziach ochotnikach biegunka pojawiała się przy dawce 60 g dziennie. Zarazem nie stwierdzono negatywnych zmian w układzie krążenia, nerwowym i trawiennym u szczurów, psów i świń zjadających ten związek przez okres od kilku do kilkunastu tygodni, podobnie jak u szczurów karmionych nim przez 2 lata, a w pewnym badaniu nie wykazano negatywnych i dziedzicznych zmian u trzech kolejnych pokoleń szczurów karmionych tym związkiem.[3] Zatem właściwie tylko biegunka przy spożyciu dużej ilości, może być uważana za jakiś wpływ zdrowotny.
Nie takie więc te dodatki straszne, jak by to mogło wynikać z długich nazw. Dla mnie bardziej istotne jest jednak to, gdzie są one stosowane i w jakich ilościach. 30 lat temu śmietana utwardzana mąką byłaby brana za oszustwo, a jednak dziś trafiają się produkty tego typu zagęszczane modyfikowaną skrobią, i w zasadzie nikt nie widzi w tym niczego złego. Skrobia dziś zagęszcza kremy, utwardza wędliny, nabłyszcza warzywa, usztywnia mocno rozpulchnione pieczywo, a nawet zastępuje tłuszcz w produktach dietetycznych, i białko w serze do posypywania pizzy. Jest wypełniaczem w jedzeniu, a sama nie ma zbyt dużej wartości dietetycznej.
Natomiast co ze skrobią GMO? No cóż, cząsteczka skrobi nie posiada własnego DNA, zatem nie ma czegoś takiego jak "skrobia genetycznie modyfikowana" - i to skrobia i to, chemicznie cząsteczki z różnych roślin niczym się między sobą nie różnią. Nie wiem zresztą czym miałyby się różnić w przypadku pochodzenia od roślin, których modyfikacje nie dotyczyły skrobi.
Gdyby zaś materiał początkowy był zanieczyszczony na przykład białkiem roślin modyfikowanych, to wszystkie przemiany którym poddaje się skrobię, a więc traktowanie kwasami, temperaturą, bezwodnikami i innymi upochodniaczami, spowodowałyby jego rozkład, a co za tym idzie unieczynnienie. Ot i cała zagadka.
------
* Od strony technicznej modyfikowanie skrobi wygląda tak
[1] http://www.zusatzstoffe-online.de/zusatzstoffe/313.e1420_acetylierte_st%E4rke.html
[2] http://www.inchem.org/documents/jecfa/jecmono/v17je21.htm
[3] http://www.inchem.org/documents/jecfa/jecmono/v05je70.htm
Temat GMO (genetycznie modyfikowane organizmy) budzi dziś dużo kontrowersji. Kwestii tego na ile roszczenia spierających się grup są zasadne, nie będę tutaj rozstrzygał, niech to robią inni. Kontrowersje z tym związane są jednak często przenoszone na całkiem inne produkty i substancje, które jedynie kojarzą się z GMO. Dziś o modyfikacje podejrzewane jest wszystko co bierze się z soi, z lecytyną sojową włącznie. Na podobnej zasadzie dostaje się też modyfikowanej skrobi, której obecność w pożywieniu jest często powodem skarg na producentów. Przykład mamy tutaj - jako produkty GMO wyliczono wszystkie ze skrobią modyfikowaną. Nieco inną wersję znajdziemy na tym blogu - autorka wprawdzie sprawdziła, że chodzi tu o inną modyfikację, ale uważa termin za kamuflaż dla "skrobi modyfikowanej genetycznie" z której tylko i wyłącznie ma się produkować ten zagęstnik. W czym i kto nie ma racji objaśniam poniżej.
Skrobia, chemicznie rzecz ujmując, jest jednym z najpospolitszych naturalnych polimerów, stanowiąc energetyczny zapas dla roślin. Jej długie łańcuchy są zbudowane z połączonych cząsteczek glukozy:
połączonych wiązaniem α-1,4-glikozydowym. Jedna cząsteczka skrobi może się składać z od kilku setek do ponad tysiąca członów glukozowych. Zasadniczo dzieli się na dwie frakcję - amylozę składającą się wyłącznie z pojedynczych, prostych łańcuchów, i amylopektynę, której łańcuchy są w wielu miejscach rozgałęzione.
Ta różnica budowy ma istotne znaczenie dla właściwości - prosta amyloza jest nierozpuszczalna w zimnej wodzie, natomiast rozpuszcza się w gorącej. Amylopektyna częściowo rozpuszcza się w zimnej wodzie, silnie pęczniejąc i odpowiadając za kleistość mokrej skrobi.
Stanowi podstawowy składnik wielu produktów spożywczych i często jest do nich dodawana jako zagęstnik, jednak jej właściwości nie zawsze są odpowiednie. Dlatego poddaje się ją modyfikacjom, zmieniając długość i kształt cząsteczek, lub doczepiając do nich różne grupy, wpływające na zachowanie się w żywności. Jakie są to przemiany?
Najprostsza polega na częściowej hydrolizie, to jest rozdzieleniu długich łańcuchów na części, pod wpływem enzymów, podwyższonej temperatury lub kwasów. Takie kawałki nazywane dekstrynami, mające po kilkanaście członów glukozy, są już rozpuszczalne w wodzie, tworząc lepkie roztwory i zastępując gumę arabską. Dekstryny powstają między innymi podczas wypieku chleba, odpowiadając za właściwości lekko słodkawej, chrupiącej skórki. Dekstryny są też składnikami klejów, jak choćby używany dawniej klej z prażonych kasztanów. Istnieje kilka typów dekstryn, te hydrolizowane kwasami są oznaczane jako E 1400, hydrolizowane enzymatycznie jako E 1405.
Inne modyfikacje polegają na potraktowaniu skrobi kwasami (E 1401) lub zasadami (E1402) które też rozbijają łańcuchy, ale na dłuższe cząsteczki, mające po kilkadziesiąt do stu członów. Te odmiany są już słabo rozpuszczalne w zimnej wodzie. Działając na skrobię utleniaczami, otrzymuje się s. utlenioną lub bieloną zawierającą grupy karboksylowe, zależnie od użytego utleniacza jest to E 1403 dla wody utlenionej, i E 1404 dla chloranu sodu. Tak zmieniona skrobia tworzy miękkie żele podobne do żelatynowych. Wszystkie te odmiany po spożyciu rozkładają się tak samo jak zwykła skrobia, tworząc glukozę.
Inne modyfikacje polegają na podstawieniu grup wodorotlenowych odpowiednimi podstawnikami. Traktując skrobię kwasem fosforowym, można uzyskać produkt częściowo podstawiony resztą fosforanową (E 1410) lub usieciowany (E 1412) lub usieciowany i podstawiony (E 1413). Ta pierwsza odmiana charakteryzuje się niską skłonnością do retrogradacji - procesu powodującego wypychanie wody z żelu skrobiowego i tworzenie zwartych agregatów o krystalicznej strukturze. Zretrogradowana skrobia jest twarda i gorzej trawiona, dla przemysłu spożywczego większe znaczenie ma jednak to, że proces retrogradacji zmienia właściwości produktu, który staje się mniej sprężysty. Odpowiada między innymi za przemiany powodujące czerstwienie pieczywa. Odmiany usieciowane tworzą żele twarde, rozpływające się w wyższych temperaturach, odporne na przemrożenie.
Jak łatwo się domyśleć, w odróżnieniu od poprzednich odmian, skrobia fosforyzowana rozkłada się z wydzieleniem reszt fosforanowych, te zaś mają już pewien wpływ na organizm. Nadmiar fosforu w takiej formie zaburza wchłanianie wapnia, zwiększając skłonność do osteoporozy. Z drugiej strony zawartość reszt fosforanowych w modyfikowanej skrobi nie może przekraczać 0,04% (ograniczenie prawne) a zazwyczaj osiąga 0,01%, trudno zatem aby doznać nadmiaru tylko tą drogą i więcej zaszkodzić może wypicie coca-coli - choć warto uwzględniać i tę ilość wobec całkowitej ilości w pozostałych produktach. Odgórnie ustalono limit zawartości w produktach dla niemowląt na 20 g/kg produktu.
Kolejne modyfikacje polegają na przyłączeniu do skrobi reszt kwasów organicznych. Jeśli potraktować ją bezwodnikiem octowym, otrzymamy skrobię acetylowaną (E 1420) tworzącą miękkie, przezroczyste żele w niskich temperaturach. Ten podstawowy typ, ma różne odmiany, na przykład acetylowana skrobia utleniona (E 1451), acetylowany fosforan skrobiowy (E 1414), czy acetylowany adypinian skrobiowy (E 1422) tworzący żele w warunkach silnie kwaśnych, podobnie do naturalnych pektyn.
Te odmiany rozkładają się z wydzieleniem kwasu octowego, który jest nieszkodliwy, jednak ze względu na możliwe działanie drażniące ustalono limit zawartości w produktach dla niemowląt na maksymalną zawartość 50g/kg produktu[1]
Najbardziej skomplikowaną nazwę ma E 1450 - oktenylobursztynian skrobiowy - o którym zarazem najtrudniej było mi coś znaleźć. Jest to ester w którym do pierścienia glukozy dołączono kwas zawierający dwie grupy karboksylowe i wyglądający jak pochodna kwasu bursztynowego, podstawionego oktenem - stąd zawiła nazwa (podejrzewam że równie dobrze można by go nazwać kwasem 2-acetylodek-7-enowym)
Tak duża grupa organiczna powoduje że skrobia może przylepiać się do tłuszczu na granicy faz woda-tłuszcz, stąd też używa się jej do zagęszczania majonezów, musztard i kremów. Podczas rozkładu w organizmie cała ta grupa odszczepia się i jak się wydaje, jest wydalana z moczem. Znalałem tylko jeden przegląd badań na ten temat [2], w którym nie stwierdzono negatywnych wpływów na dwa kolejne pokolenia szczurów, których dieta zawierała nawet 30% tej modyfikacji. Jedynym negatywnym wpływem był niedobór magnezu wywołany tak ubogą dietą.
Sole glinowe tego związku są używane w pudrach do ciała i jako stabilizatory w tabletkach.
Kolejną zawiłą modyfikacją jest hydroksypropyloskrobia (E 1440 lub HPS) i jej kombinacje: z fosforanem (E 1442) i z gliceryną( E 1441). Otrzymuje się ją traktując substrat naturalny tlenkiem propylenu - epoksydem z trójkątnym mostkiem tlenowym, który łatwo się otwiera, przyłączając się do innych cząsteczek. Zależnie od stopnia podstawienia otrzymany produkt ma różne właściwości. Odmiany używane w przemyśle spożywczym zawierają do 60% podstawionych grup, tworzą żele o dobrym połysku, wytrzymałe na zamrażanie, stąd niekiedy pokrywa się nimi mrożone owoce aby spowolnić powierzchniowe utlenianie, a ponadto zagęszcza lody i ciasta mrożone. Zwykle też zastępuje się nimi mączkę chleba świętojańskiego. Stanowi też materiał rozpuszczających się w żołądku kapsułek na leki, zastępując używaną wcześniej żelatynę.
Podczas trawienia rozkłada się na glukozę i glikol propylowy - który z kolei utlenia się do nieszkodliwego kwasu pirogronowego lub mlekowego. Mimo to wygląda na to, że może podrażniać jelita, skłaniając je do bardziej intensywnego wydalania. Krótko mówiąc może wywołać rozwolnienie. Potwierdzają to badania - u szczurów które zjadały karmę zawierającą 50% związku pojawiała się biegunka, w innym badaniu pojawiła się przy ilości 30% karmy; w badaniu na ludziach ochotnikach biegunka pojawiała się przy dawce 60 g dziennie. Zarazem nie stwierdzono negatywnych zmian w układzie krążenia, nerwowym i trawiennym u szczurów, psów i świń zjadających ten związek przez okres od kilku do kilkunastu tygodni, podobnie jak u szczurów karmionych nim przez 2 lata, a w pewnym badaniu nie wykazano negatywnych i dziedzicznych zmian u trzech kolejnych pokoleń szczurów karmionych tym związkiem.[3] Zatem właściwie tylko biegunka przy spożyciu dużej ilości, może być uważana za jakiś wpływ zdrowotny.
Ziarna skrobi pszenicznej barwione jodem. Powiększenie ok. 500 razy
Nie takie więc te dodatki straszne, jak by to mogło wynikać z długich nazw. Dla mnie bardziej istotne jest jednak to, gdzie są one stosowane i w jakich ilościach. 30 lat temu śmietana utwardzana mąką byłaby brana za oszustwo, a jednak dziś trafiają się produkty tego typu zagęszczane modyfikowaną skrobią, i w zasadzie nikt nie widzi w tym niczego złego. Skrobia dziś zagęszcza kremy, utwardza wędliny, nabłyszcza warzywa, usztywnia mocno rozpulchnione pieczywo, a nawet zastępuje tłuszcz w produktach dietetycznych, i białko w serze do posypywania pizzy. Jest wypełniaczem w jedzeniu, a sama nie ma zbyt dużej wartości dietetycznej.
Natomiast co ze skrobią GMO? No cóż, cząsteczka skrobi nie posiada własnego DNA, zatem nie ma czegoś takiego jak "skrobia genetycznie modyfikowana" - i to skrobia i to, chemicznie cząsteczki z różnych roślin niczym się między sobą nie różnią. Nie wiem zresztą czym miałyby się różnić w przypadku pochodzenia od roślin, których modyfikacje nie dotyczyły skrobi.
Gdyby zaś materiał początkowy był zanieczyszczony na przykład białkiem roślin modyfikowanych, to wszystkie przemiany którym poddaje się skrobię, a więc traktowanie kwasami, temperaturą, bezwodnikami i innymi upochodniaczami, spowodowałyby jego rozkład, a co za tym idzie unieczynnienie. Ot i cała zagadka.
------
* Od strony technicznej modyfikowanie skrobi wygląda tak
[1] http://www.zusatzstoffe-online.de/zusatzstoffe/313.e1420_acetylierte_st%E4rke.html
[2] http://www.inchem.org/documents/jecfa/jecmono/v17je21.htm
[3] http://www.inchem.org/documents/jecfa/jecmono/v05je70.htm
poniedziałek, 29 października 2012
Kiedyś w laboratorium (16.)
Gdy będąc jeszcze w technikum robiliśmy preparat drożdży w różnych roztworach, zwrócił moją uwagę interesujący artefakt - pęcherzyk powietrza między szkiełkami. Wyglądał jak słonecznik, toteż zrobiłem mu zdjęcie:
piątek, 26 października 2012
Otrzymywanie biodiesla
W tym roku (już czwartym) jedną z moich pracowni jest Chemia Proekologiczna, prowadzona przez
dr Teodozję Lipińską. Określenie przedmiotu jest może trochę niezgrabne ale określa jego zakres nieco lepiej niż będące kalkami z angielskiego określenia Zielona Chemia czy Chemia Zrównoważona. Najogólniej mówiąc chodzi tu o takie przeprowadzane procesów chemicznych, aby przyniosło to dla środowiska jak najmniejsze skutki negatywne, co obejmuje metody syntezy z małą ilością odpadów, metody z użyciem małej ilości rozpuszczalników organicznych lub bez nich i procesy zużywające mało energii. Wliczają się tu także wynalazki mające zmniejszyć zanieczyszczenia z innych źródeł, jak katalizatory do spalin czy metody odsiarczania gazu i ropy.
Jednym z takich procesów chemicznych, przynoszącym korzyść dla środowiska, jest przerób olejów roślinnych na paliwo właściwościach podobnych do olejów napędowych. Oleje otrzymuje się z roślin, toteż przy ich produkcji nie trzeba wydobywać kopalin, zatem biodiesel można zaliczyć do odnawialnych źródeł energii. Ponieważ ze spalania takiego paliwa nie dorzucamy do atmosfery nowego dwutlenku węgla, a jedynie odpowiednik tego pochłoniętego dawniej przez olejodajne rośliny, stosowanie paliw odnawialnych powinno przyczynić się do ograniczenia emisji tego gazu.
Jednak czy oleje roślinne rzeczywiście nadają się do takich celów?
Olej, chemicznie rzecz biorąc, jest mieszaniną estrów gliceryny z kwasami tłuszczowymi. Gliceryna posiada trzy grupy wodorotlenowe z którymi może związać trzy łańcuchy kwasów. Natomiast same kwasy tłuszczowe najogólniej można nazwać długimi węglowodorami z grupą karboksylową:
Jeśli więc wyższe kwasy tłuszczowe nie wiele różnią się od węglowodorów, z których składa się ropa i olej napędowy, to powinny być palne. I rzeczywiście, oleje i łoje zwierzęce przez wiele wieków używano w celach oświetleniowych, w tanich lampkach i kagankach. Mało kto wie, że pierwszy model silnika spalinowego Diesla działał na olej arachidowy. Niedługo po tym wprowadzono specjalny model silników przeznaczonych do spalania oleju. Oleje mineralne zaczęto stosować dopiero potem. Mieszanka powietrzno-olejowa zapala się w tym silniku w fazie silnego sprężenia.
Problemem dla takiego stosowania jest jednak ich niedostateczna palność, do czego przyczynia się między innymi przyczepiona do kwasów tłuszczowych gliceryna. Z drugiej strony same wolne kwasy tłuszczowe często krzepną już w stosunkowo wysokich temperaturach, czego przykładem kwas stearynowy używany do wyrobu świec. Należałoby zatem z jednej strony oswobodzić kwasy, a z drugiej nadać im formę płynną.
Pierwszym kto wpadł na pomysł co też należy zrobić był G.Chavanne z Belgii, który w 1937 roku otrzymał patent na metodę zamiany oleju w płynne paliwo pędne.
Pomysł był w zasadzie bardzo prosty - gliceryna przeszkadza, więc usuńmy ją. Wolne grupy karboksylowe za sprawą oddziaływań pomiędzy sobą (głównie wiązania wodorowe) podwyższają temperaturę krzepnięcia, zatem przyłączmy do nich coś, co temu zapobiegnie. Na przykład cząsteczkę alkoholu. Cała tajemnica polega zatem na zamianie jednych estrów (glicerynowych) na inne, na przykład metylowe lub etylowe. Proces tego typu, a więc zamiany podstawników w estrze nazywamy transestyfikacją.
Odpadem jest tutaj gliceryna. Wodorotlenek sodu lub potasu katalizuje reakcję.
Tak więc: surowcem naszym był olej rzepakowy:
 |
| Olej rzepakowy przed reakcją |
Do kolby na 250 ml wlaliśmy olej, metanol i suchy wodorotlenek potasu. Ponieważ potaż jest bardzo żrący każdy musiał mieć założone okulary ochronne. Zanim zdążyliśmy go wsypać zaczął nadżerać kartkę na której był odważany:
 |
| Wodorotlenek potasu |
Następnie zamknęliśmy kolbę korkiem szklanym, nałożyliśmy dodatkowe zabezpieczenie i wytrząsaliśmy na zmianę przez pół godziny:
 |
| Wytrząsanie |
Wytrząsanie musiało być intensywne, tak aby kontakt między nierozpuszczalnym wodorotlenkiem a mieszaniną alkoholu z olejem był jak najlepszy. Od tego etapu głównie zależało to jak dobrze będzie zachodziła reakcja, dlatego trzęśliśmy aż do omdlenia rąk. Następnie wlaliśmy mieszaninę do dużego rozdzielacza i odczekaliśmy aż cięższa gliceryna zbierze się przy dnie:
 |
| Powolny rozdział. Na granicy faz ciemna warstewka zawieszonych kropel gliceryny |
Ostrożnie oddzieliliśmy glicerynę, zlewając do innego naczynia. Nasz produkt nadal zawierał glicerynę, nie przereagowany metanol, a ponadto zawieszony wodorotlenek a może nawet odrobinę mydła, jakie mogło zacząć powstawać w takich warunkach. Ponieważ biodiesel nie miesza się z wodą, należało dokonać ekstrakcji rozpuszczalnych zanieczyszczeń. W tym celu zanurzyliśmy rozdzielacz w zlewce ciepłej wody i dolaliśmy do mieszaniny wody destylowanej, lekko mieszając. Woda opadła na dno, zabarwiając się na mleczny kolor pochodzący zapewne od drobnych kropelek produktu. Tuż przy granicy faz zbierała się warstewka przypominająca zwarzoną śmietankę, podejrzewam że były to cząstki wolnych, nasyconych kwasów tłuszczowych, w tej temperaturze przyjmujących postać stałą. Kwasy te, częściowo rozpuszczalne w wodzie, mogły działać jak emulgatory, dlatego podczas ekstrakcji nie wytrząsaliśmy biodiesla z dodawaną wodą, aby nie musieć długo czekać na rozdział.
 |
| Ekstrakcja z wodą. Resztki gliceryny zebrały się w rurce rozdzielacza |
Po trzech ekstrakcjach uznaliśmy że już wystarczy, choć produkt wciąż był jeszcze dosyć alkaliczny (pH 8) co świadczyło o nie w pełni usuniętym wodorotlenku. Zawiesina wolnych kwasów i być może drobnych kropelek wody sprawiły, że otrzymany produkt był dosyć mętny:
Za tydzień postaram się zrobić zdjęcie produktu po odstaniu się, powinien być bardziej klarowny.
Czy tak otrzymany ester jest lepszym paliwem? W porównaniu z olejem rzepakowym na pewno. Olej ten jest wprawdzie najlepiej dostępnym z uwagi na ogromny areał upraw i najbardziej korzystny stosunek wydajności oleistej do powierzchni uprawy, ale wadą jest dosyć duża lepkość, kilkukrotnie większa niż równie wydajnych olejów mineralnych. W instalacjach wykorzystujących go jako materiał pędny, stosuje się wstępne ogrzewanie, mające go rozrzedzić i ułatwić rozpylenie przy wtrysku. Czasem rozrzedza się go dodając lekkie oleje mineralne lub tworząc mikroemulsję z metanolem. Inną wadą rzepaku jest skłonność do utleniania się i tworzenia nierozpuszczalnych wytrąceń, mogących osadzać się w zakamarkach silnika. Próby wlania oleju do nieprzystosowanego samochodu mogą skończyć się uszkodzeniem instalacji.
Rzepakowy biodiesel jest mniej lepki, przez co zmniejsza się ryzyko zatkania filtrów bądź osadzania częściowo spalonych resztek w silniku. Ponieważ ma właściwości smarne, silnik nie zaciera się i ma dłuższą żywotność. Z drugiej strony w porównaniu z olejami mineralnymi o tej samej liczbie cetanowej, biodiesel ma wyższą temperaturę zapłonu i nieco niższą wartość opałową. W efekcie mogą pojawiać się problemy z rozruchem, gdy silnik nie jest nagrzany, a zużycie paliwa może być nieco większe. Estry metylowe mogą ponadto rozpuszczać lub zmiękczać niektóre tworzywa sztuczne, toteż w przystosowanych samochodach stosuje się inne materiały uszczelek i złączy.
Wydawałoby się, że produkcja takiego paliwa, stosunkowo prosta i tania, powinna być dobrym sposobem odciążenia budżetu. Olej spożywczy jest znacznie tańszy od mineralnego, i mimo nieco droższej metody produkcji różnica w akcyzie powoduje, że produkt wychodzi nieco tańszy od zwykłego paliwa. Z tego co się orientuję prawo zezwala rolnikom produkcję takiego paliwa na własny użytek, po zarejestrowaniu i dla stosunkowo niedużych ilości. Problemem domowych instalacji jest jednak przede wszystkim właściwe oczyszczenie produktu. Resztki gliceryny, metanolu a zwłaszcza stałego wodorotlenku, zwiększają korozyjność i zmniejszają stabilność paliwa. Gliceryna dodatkowo wywołuje niemiły zapach spalin, przypominający palony olej.
Warto zwrócić uwagę na skład spalin z silnika napędzanego takim paliwem. Badania stwierdziły, że są one zdecydowanie mniej toksyczne, zawierając do 30% mniej cząstek stałych, znacznie mniej wielopierścieniowych węglowodorów aromatycznych (WWA) o dobrze potwierdzonej rakotwórczości, oraz prawie w ogóle nie zawierają dwutlenku siarki z uwagi na praktycznie śladowe zasiarczenie - co ma spory wpływ na powstawanie i szkodliwość smogu miejskiego. Z drugiej strony podczas spalania powstaje więcej tlenków azotu. Ponadto odmiany słabo oczyszczone, zawierające domieszki gliceryny i etanolu, dają spaliny z rakotwórczą akroleiną i drażniącym aldehydem octowym. Ostatecznie jednak uznano, że ogólna zawartość szkodliwych związków jest znacząco mniejsza, niż w przypadku olejów napędowych. Efekty cytotoksyczne są w tym przypadku aż cztery razy mniejsze[1]
Teoretycznie takie odnawialne paliwo, powinno przynosić ogólnoświatowe zyski dla środowiska - do atmosfery nie jest uwalniany nowy dwutlenek węgla, nie są uwalniane tlenki siarki i wreszcie jest co zrobić z zanieczyszczonymi, zużytymi tłuszczami. Teoretycznie, bo jak wiadomo, ze wszystkim można przesadzić. Najlepiej widać to w Malezji i Indonezji, gdzie głównym surowcem do biodiesla jest palma olejowa.
Paliwo jest szybko zużywane na krajowym rynku a przede wszystkim eksportowane do Europy, będąc stosunkowo tanie. Ponieważ popyt szybko rośnie, wzrasta też powierzchnia upraw, zaś zarządzający niespecjalnie przejmują się rozwojem zrównoważonym. W efekcie bywa że dziewicze puszcze wycina się po to, aby posadzić w tym miejscu monokulturę palmy olejowej, przez co cały proceder zaczyna przynosić środowisku więcej szkody niż pożytku. W tym roku Amerykańska Agencja Ochrony Środowiska uznała, że z tego powodu, olej palmowy nie powinien być zaliczany do ekologicznych paliw odnawialnych[2]
Popyt na malezyjskie biopaliwa, wraz z wysokimi cenami ropy spowodował, że w wyniku eksportowania większości oleju za granicę, zaczęło go brakować na rynku krajowym, choć jest tu głównym olejem spożywczym[3] Dyskusyjną kwestią jest to na ile zamiana zbiorów rolniczych na paliwa wpływa na globalny wzrost cen żywności, szacuje się że proceder ten odpowiada za jedną trzecią wzrostu cen kukurydzy w USA. Wszystko to pokazuje, że co za dużo, to nie zdrowo i nawet najświetniejsza technologia, wprowadzana bez rozmysłu, może przynieść negatywne skutki.
 |
| Plantacja palmy olejowej na Jawie. W tle lasy tropikalne |
Dodatkowym problemem jaki pojawia się w tym procesie, jest gliceryna, powstająca jako odpad. Szacunkowo z każdej tony oleju powstaje 100 kg gliceryny, z którą trzeba coś zrobić. Część można oczyścić i przetworzyć na kosmetyki lub farmaceutyki, ale popyt na taki surowiec jest ograniczony, stąd próby wykorzystania jej jako surowca w przemyśle chemicznym. Głównym procesem jest konwersja do epichlorohydryny, będącej głównym surowcem do wytwarzania żywic epoksydowych. Powtórna estryfikacja kwasem octowym daje produkt, mogący służyć do zmniejszenia lepkości paliw. Utleniając, można zamienić ją na kwas cytrynowy. Najciekawszym jednak pomysłem jest bezpośrednia konwersja do metanolu - powstały alkohol można by zawrócić do procesu i zwiększyć samowystarczalność instalacji produkcyjnej[4].
I tak minęła mi pierwsza proekologiczna pracownia.
------
[1] Kimberly J. Swanson , 1 Michael C. Madden , 2 i Andrew J. Ghio 2 Biodiesel Exhaust: The Need for Health Effects Research, Environ Health Perspect v.115 (4), kwiecień 2007 PMC1852688
[2] http://thehill.com/blogs/e2-wire/e2-wire/206781-epa-palm-oil-based-fuels-flunk-the-climate-test
[3] http://www.abc.net.au/news/2007-07-19/biofuel-demand-makes-fried-food-expensive-in/2506908
[4] http://www.greencarcongress.com/2008/11/new-process-for.html
piątek, 19 października 2012
Kwasek śmierci i inne bzdury
Kwas cytrynowy należy do najczęstszych stosowanych dodatków żywnościowych, również przez nas samych w domowym zakresie. Nic więc dziwnego że znalazł się na celowników internetowych panikarzy, do wszystkiego co oznaczone literką E podchodzących jak diabeł do wody być może święconej. Co zaskakujące, dokładnie przeciwny stosunek mają do obfitujących w ten związek owoców cytrusowych, stanowiących częsty składnik mikstur detoksykacyjnych.
Swoistą kwintesencję krążących po internecie plotek stanowi artykuł z Astromarii, który będę dalej selektywnie cytował:
Kwasy hamują proces utleniania, a więc są naturalnymi konserwantami. Naturalne kwasy występują w wielu produktach spożywczych, takich jak kiszonki oraz przetwory mleczne i owocowe. Ale władza uznała, że tamte kwasy nie wystarczą, konieczny jest jeszcze jeden. Mało tego, według nich zakwaszania wymagają również te wyroby, które z natury kwaśne nie są (a więc praktycznie wszystkie). Mogliby oczywiście wybrać kwas askorbinowy, który nie dość, że jest tani, to jeszcze zdrowy (witamina C), ale dziwnym trafem wybrali nienaturalny i pozbawiony wartości zdrowotnych kwasek cytrynowy i przekonali producentów, że jest on niezbędny i trzeba go sypać wszędzie, nawet tam, gdzie jest już i tak wystarczająco kwaśno. I mimo, że ma on właściwości konserwujące (po to przecież jest dodawany) ładują do wszystkiego jeszcze różne benzoesany i inne konserwanty.A więc dla porządku:
Wbrew ładnie brzmiącej nazwie kwasek cytrynowy nie ma nic wspólnego ani z naturą, ani z cytrynami, chociaż w swojej naturalnej postaci występuje w wielu owocach, w tym również w cytrynach. Spełnia on również ważną rolę w metabolizmie organizmów żywych (cykl Krebsa). Jednak ten stosowany w przemyśle spożywczym jest czysto syntetyczną substancją, otrzymywaną głównie przez fermentację cukru za pomocą kultur kropidlaka Aspergillus niger. Kropidlak ten jest bardzo niebezpieczną dla zdrowia pleśnią, powodującą wiele poważnych chorób.[1]
Kwas cytrynowy to stosunkowo pospolity w przyrodzie kwas organiczny, zawierający trzy grupy karboksylowe. Zgodnie z nazwą występuje w cytrynach. Pierwsza wzmianka o kwaśnych właściwościach ich soku pochodzi z VIII wieku z pism Gebera, jednak właściwy związek za to odpowiedzialny, wyizolował dopiero w 1784 Carl Scheele. Przez długi czas produkowano go z soków owocowych, do czasu aż w 1893 roku odkryto, że powstaje jako produkt metabolizmu pewnych gatunków pleśni, podobnie jak kwasy mlekowy, octowy i propionowy w pewnych typach fermentacji. Synteza tą metodą rozpoczęła się jednak niemal trzydzieści lat później. Najczęściej stosowany jest szczep Aspergillus niger, zaś pożywką jest nierafinowany cukier, melasa, syrop kukurydziany lub nawet nieprzetworzony sok z buraków cukrowych.
Gdy stężenie kwasu w pożywce wzrasta do odpowiedniego poziomu, dodaje się do niej mleka wapiennego, wytrącając cytrynian wapnia. Po odsączeniu traktowany jest kwasem siarkowym, zaś z zakwaszonego roztworu krystalizuje czysty kwas cytrynowy.
 |
| Mojej hodowli kryształy kwasu cytrynowego, o czym pisałem tu. |
Dlaczego dodaje się go do jedzenia? Głównie dla uzyskania odpowiedniego smaku, w czym jest o tyle lepszy od octu, że nie posiada własnego zapachu. Zakwaszając produkt przedłuża jego trwałość, i to na dwa sposoby - większość bakterii nie rozwija się w kwaśnym środowisku. Poza tym niskie pH zasadniczo przeszkadza reakcjom utlenienia, a właśnie one odpowiadają za większość reakcji rozkładu żywności. Dodatkowo w przypadku produktów nieprzetworzonych zakwaszenie unieczynnia enzymy degradujące, o czym każdy się nieraz przekonał, próbując powstrzymać brązowienie ziemniaków lub jabłek.
No dobra - a kwas askorbinowy? Witamina C to cenny przeciwutleniacz, w większości przypadków dodaje się ją nie jako środek wzbogacający, ale właśnie dla przedłużenia trwałości, ma jednak dwie wady - jest słabym kwasem i za łatwo się utlenia. Z tego powodu niektóre produkty mogą szybko ją utracić, co zmniejszy ich wartość zdrowotną. Można jednak spowolnić ten proces stwarzając dogodne warunki. Na przykład przez zakwaszenie.
Natomiast co do kwestii naturalności związku - producent który go dodaje może potem napisać na opakowaniu, że produkt nie zawiera sztucznych konserwantów. Związek syntetyczny to taki, który otrzymano drogą przemian chemicznych z prostych substratów, na przykład w tym przypadku z propanu, tymczasem tutaj mamy do czynienia ze związkiem wytworzonym przez pewne organizmy żywe. Nie są to może cytryny ale fabryka chemiczna też nie.
I proszę mi nie mówić, że cytryny są zdrowe. Oczywiście, że są. Zawierają kwas cytrynowy, ale naturalny, a oprócz niego witaminy, enzymy, sole mineralne i inne zdrowe składniki, które razem działają zbawiennie na nasze zdrowie. Owoce są dziełem natury, są harmonijną całością, a zawarte w nich składniki chemiczne są doskonale przyswajane przez nasze organizmy[2]Tylko czymże naturalny kwas, wytworzony przez taki organizm żywy jaki cytryna, różni się od kwasu rzekomo syntetycznego, wytworzonego przez organizm żywy kropidlaka? Związek ten nie ma odmian prawo i lewoskrętnej ani jakiejś unikalnej struktury, na co niekiedy powołują się producenci różnych suplementów.
Dlaczego jest szkodliwy? Z prostej przyczyny – kwas cytrynowy zakłóca przewodnictwo elektrochemiczne w naszych komórkach mózgowych i zmienia w nich reakcje chemiczne. Dodając kwasek do potraw i napojów (również dla niemowląt i małych dzieci) ktoś sprytnie zmienia nas w bezmyślne baranki. Wiemy nie od dziś, że władza nie lubi inteligentnych obywateli, bo takimi trudno jest rządzić, szczególnie, że władza sama nie grzeszy inteligencją i doskonale zdaje sobie z tego sprawę.[3]Kwestia szkodliwego wpływu na mózg, pojawia się w tego typu tekstach co i rusz, nigdzie jednak nie podano kto to zbadał, jak i kiedy. Astromaria powołuje się na jakichś dwóch lekarzy, tylko nie chce podać jakich. Musiałem więc sam grzebnąć.
Wedle raportu SIDS z 2000 roku toksyczność związku jest bardzo niska, LD w badaniach na szczurach wyniosła 1200mg/kg/dzień, czyli 1,2 grama na kilogram masy ciała. Dla człowieka ważącego 60 kg odpowiada to całkowitej dawce 80g związku. Nie wykazano w jego przypadku rakotwórczości ani nie jest o to podejrzewany. To samo tyczy się mutagenności i teratogenności. Nie stwierdzono aby był alergenem, choć wywołuje podrażnienia błon śluzowych i oczu. U osób zawodowo stykających się na co dzień z tym związkiem, podrażnienia mogą rozwinąć się w zapalenie skóry. W dwóch kolejnych pokoleniach szczurów zażywających karmę z 1% związku, nie stwierdzono deformacji. Nefrotoksyczności nie potwierdzono. [4] Jak to już opisywałem, kwas cytrynowy zwiększa wchłanianie aluminium z pożywienia, wygląda jednak że może to działać też w drugą stronę - zażywanie większych dawek prowokuje zwiększone wydalanie glinu z organizmu[5]. Stała obecność kwasu w diecie zapobiega kamicy nerkowej związanej z solami wapnia[6]
Zresztą kwas cytrynowy występuje naturalnie w naszym organizmie. Powstaje podczas metabolizmu jako jeden z elementów Cyklu Krebsa, mającego wytworzyć energię komórce. Każdy go ma w sobie.
Co ciekawsze, obecność kwasu wcale nie przeszkadza wielu specjalistom od alternatywnej medycyny polecać częste spożywanie cytryn. Jest elementem kuracji oczyszczającej Tombaka, podczas której w ciągu dwóch tygodni spożywa się sok z łącznie 200 cytryn[7]. Sam Tombak pisze coś o unikalnych właściwościach soli cytrynowych, ale jak to zwykle u niego, nie wiadomo skąd mu to wiadomo. Inna wersja to zażywanie mieszanki oliwy z sokiem cytrynowym. W dodatku sok z cytryny ma w jakiś paradoksalny sposób sprzyjać powstawaniu w organizmie odczynu zasadowego, co podobno też przynosić jakieś tam korzyści. A to wszystko za sprawą tego całego okropnego kwasu cytrynowego....
Jak się wydaje całe zamieszanie ma swe źródło w krążącej po świecie od połowy lat 70. "liście z Villejuif" - anonimowego tekstu ostrzegającego przed szkodliwymi dodatkami do żywności. Najgorszym, silnie rakotwórczym, miał być E 330 czyli właśnie kwas cytrynowy. Lista, w formie listów-łańcuszków rozlała się na cały świat, rozprzestrzeniana w formie zaraźliwego, bardzo wiarygodnie brzmiącego memu. Wkrótce zresztą objawiła się siła obaw zdrowotnych w społeczeństwie - gdy lekarze zaczęli wydawać oświadczenia, że lista jest fałszywa, wiele osób zaczęło bardziej w nią wierzyć uznając, że gdyby coś nie było na rzeczy, nikt by się tym tak bardzo nie przejmował. Podobne listy można spotkać w polskim internecie, niejednokrotnie poszerzone na wszystkie 1200 dodatków z listy E. Można się tam zresztą spotkać z zabawną niekonsekwencją - za rakotwórczy uznany jest tam kwas cytrynowy, ale jego sole już nie. Nawiasem mówiąc tak wychwalany kwas askorbinowy, znajduje się na tej liście pod nazwą E 300...
-------
[1],[2],[3] http://astromaria.wordpress.com/2009/09/23/kolejna-podstepna-trucizna/
[4] http://www.inchem.org/documents/sids/sids/77929.pdf
[5] Yong‐Hua Yanga & Hong‐Yan Zhanga Effect of citric acid on aluminum toxicity in the growth of mungbean seedlings, Journal of Plant Nutrition Volume 21, Issue 5, 1998
[6] Kang DE , Sur RL , Haleblian GE , Fitzsimons NJ , Borawski KM , Preminger GM .
Long-term lemonade based dietary manipulation in patients with hypocitraturic nephrolithiasis. J Urol. 2007 Apr;177(4):1358-62; discussion 1362; quiz 1591
[7] http://cudownediety.blogspot.com/2012/03/kuracja-cytrynowa-m-tombaka.html
poniedziałek, 8 października 2012
Nietypowe nieorganiczne
Kilka ciekawostek z zakresu chemii nieorganicznej:
Tlenek manganu VII
Jest to najprawdopodobniej jedyny tlenek metalu, którzy w temperaturze pokojowej ma postać ciekłą. Powstaje w reakcji stężonego kwasu siarkowego z nadmanganianem (manganianem VII) potasu. Początkowo z takiej mieszaniny powstaje kwas manganianowy, natychmiast jednak odwadnia się tworząc tlenek, mający postać oleistej, ciemnofioletowej cieczy, krzepnącej w niższych temperaturach.
Jest związkiem nietrwałym, rozkłada się z wydzieleniem tlenu i ozonu. Jako silny utleniacz reaguje ze związkami organicznymi w sposób wybuchowy, stąd też jego sporadyczne powstawanie podczas niektórych syntez może się stać bardzo kłopotliwe.
Czterotlenek osmu
Jest to tlenek metalu łatwo lotny w warunkach normalnych. Ma niemiły zapach i powstaje już pod wpływem powietrza na rozdrobniony metal - stąd zresztą nazwa pierwiastka (gr. Osme - zapach). Jego nietypowość wiąże się też ze stopniem utlenienia +8, najwyższym i bardzo rzadkim. Jeszcze tylko iryd i pluton oraz niektóre lantanowce dają takie związki.
Jest związkiem trującym, w większych stężeniach wywołuje obrzęk płuc. Zarazem jednak okazuje się bardzo przydatny w syntezie organicznej, w tym do hydrolizowania wiązań podwójnych. Rozrywając jedno z wiązań i łącząc się z dwoma atomami węgla, tworzy nietrwałe połączenie pierścieniowe. Po jego rozerwaniu otrzymujemy cis-diol:
Jest to jednak drogi odczynnik, czasem zastępuje się go nadmanganianem ale - jak mi tu podpowiadają w komentarzu - nie jest on tu zbyt skuteczny. Zamiast tego można użyć tlenku osmu w ilości katalitycznej wraz z odpowiednim innym utleniaczem regenerującym tlenek po przereagowaniu, na przykład N-metylo-N-tlenkiem morfoliny (NMO). W mieszaninie z nadjodanem służy do rozszczepiania alkenów na dwie połowy.
Dimolibden
Nietrwała cząsteczka składająca się z dwóch atomów molibdenu, połączonych unikalnym wiązaniem sześciokrotnym - są to zarówno wiązania sigma, powstające z nakładania się orbitali S, wiązania pi z nakładania bocznego orbitali P i wiązania delta z bocznego nakładania się orbitali D. Podobne połączenie otrzymano dla wolframu.
Znane są też związki z wiązaniami pięciokrotnymi i poczwórnymi. Do tych ostatnich należy octan chromu II stosunkowo łatwy do wytworzenia. Tam dwa atomu chromu połączone są wiązaniem czterokrotnym i mostkami skompleksowanych grup karboksylowych.
Pentazol
Niezwykła cząsteczka lokująca się na pograniczu związków organicznych i nieorganicznych. Jest logiczną kontynuacją azoli - związków pierścieniowych zawierających jeden lub więcej atomów azotu w pierścieniu. W tym przypadku pierścień jest pięciokątny i zawiera pięć atomów azotu... Czyli że składa się tylko z azotu
Tylko odpowiednio podstawione pochodne są na tyle trwałe, aby dało się je wyizolować. Teoretycznie przewiduje się możliwość powstania heksazyny, składającej się z sześciu atomów azotu, ale dotychczas nie potwierdzono jej otrzymania
Fluorek tlenu
Definicja tlenków mówi, że są to związki tlenu w których tlen przyjmuje elektrony drugiego pierwiastka, zatem dotyczy związków z pierwiastkami o mniejszej elektroujemności niż tlen, czyli prawie wszystkich. Prawie, bo jeszcze większą elektroujemność ma fluor, w związku z czym jest to jedyny pierwiastek który nie tworzy tlenku, choć łączy się z tlenem.
Diflluorek tlenu ma postać gazu, o strukturze cząsteczki podobnej do wody, bardzo nietrwałej. Jest silnym środkiem fluorującym i jednym z najsilniejszych utleniaczy, z tego też powodu jest trujący
Tlenek manganu VII
Jest to najprawdopodobniej jedyny tlenek metalu, którzy w temperaturze pokojowej ma postać ciekłą. Powstaje w reakcji stężonego kwasu siarkowego z nadmanganianem (manganianem VII) potasu. Początkowo z takiej mieszaniny powstaje kwas manganianowy, natychmiast jednak odwadnia się tworząc tlenek, mający postać oleistej, ciemnofioletowej cieczy, krzepnącej w niższych temperaturach.
Jest związkiem nietrwałym, rozkłada się z wydzieleniem tlenu i ozonu. Jako silny utleniacz reaguje ze związkami organicznymi w sposób wybuchowy, stąd też jego sporadyczne powstawanie podczas niektórych syntez może się stać bardzo kłopotliwe.
Czterotlenek osmu
Jest to tlenek metalu łatwo lotny w warunkach normalnych. Ma niemiły zapach i powstaje już pod wpływem powietrza na rozdrobniony metal - stąd zresztą nazwa pierwiastka (gr. Osme - zapach). Jego nietypowość wiąże się też ze stopniem utlenienia +8, najwyższym i bardzo rzadkim. Jeszcze tylko iryd i pluton oraz niektóre lantanowce dają takie związki.
Jest związkiem trującym, w większych stężeniach wywołuje obrzęk płuc. Zarazem jednak okazuje się bardzo przydatny w syntezie organicznej, w tym do hydrolizowania wiązań podwójnych. Rozrywając jedno z wiązań i łącząc się z dwoma atomami węgla, tworzy nietrwałe połączenie pierścieniowe. Po jego rozerwaniu otrzymujemy cis-diol:
Dimolibden
Nietrwała cząsteczka składająca się z dwóch atomów molibdenu, połączonych unikalnym wiązaniem sześciokrotnym - są to zarówno wiązania sigma, powstające z nakładania się orbitali S, wiązania pi z nakładania bocznego orbitali P i wiązania delta z bocznego nakładania się orbitali D. Podobne połączenie otrzymano dla wolframu.
Znane są też związki z wiązaniami pięciokrotnymi i poczwórnymi. Do tych ostatnich należy octan chromu II stosunkowo łatwy do wytworzenia. Tam dwa atomu chromu połączone są wiązaniem czterokrotnym i mostkami skompleksowanych grup karboksylowych.
Pentazol
Niezwykła cząsteczka lokująca się na pograniczu związków organicznych i nieorganicznych. Jest logiczną kontynuacją azoli - związków pierścieniowych zawierających jeden lub więcej atomów azotu w pierścieniu. W tym przypadku pierścień jest pięciokątny i zawiera pięć atomów azotu... Czyli że składa się tylko z azotu
Tylko odpowiednio podstawione pochodne są na tyle trwałe, aby dało się je wyizolować. Teoretycznie przewiduje się możliwość powstania heksazyny, składającej się z sześciu atomów azotu, ale dotychczas nie potwierdzono jej otrzymania
Fluorek tlenu
Definicja tlenków mówi, że są to związki tlenu w których tlen przyjmuje elektrony drugiego pierwiastka, zatem dotyczy związków z pierwiastkami o mniejszej elektroujemności niż tlen, czyli prawie wszystkich. Prawie, bo jeszcze większą elektroujemność ma fluor, w związku z czym jest to jedyny pierwiastek który nie tworzy tlenku, choć łączy się z tlenem.
Diflluorek tlenu ma postać gazu, o strukturze cząsteczki podobnej do wody, bardzo nietrwałej. Jest silnym środkiem fluorującym i jednym z najsilniejszych utleniaczy, z tego też powodu jest trujący
niedziela, 30 września 2012
Kiedyś w laboratorium (15.)
Na zakończenie września, tuż przed rozpoczęciem zajęć, podam tu taką ciekawostkę. Jednym z kryteriów rozróżniania pierwiastków jest ich reaktywność. Najbardziej reaktywne metale, jak potas czy sód, to takie, które zapalają się w suchym powietrzu tworząc nadtlenki, i gwałtownie reagują z wodą (cez reaguje wręcz wybuchowo); mniej reaktywne, jak lit czy wapń, to takie które utleniają się na powietrzu ale nie gwałtownie i reagują z wodą na zimno, następną klasą są te które reagują tylko z wodą, potem te które reagują z gorącą wodą lub parą i następnie te które z wodą nie reagują.
Podręczniki zazwyczaj umieszczają magnez w tej czwartej klasie, to jest wśród metali reagujących z wodą gorącą lub z parą wodną. Co więcej temperatura spalania się magnezu jest tak wysoka, iż rozkłada wodę i powstający tlen zużywa na dalsze palenie się, dlatego magnez może płonąć pod wodą. Tak piszą we wszystkich podręcznikach szkolnych, dlatego na studiach byłem zaskoczony gdy podczas prób reaktywności metali na zajęciach z chemii nieorganicznej, okazało się, że nie jest to taka prosta sprawa. Gdy bowiem wrzuciłem kawałki odtłuszczonej wstążki magnezowej do wody z fenoloftaleiną, wokół nich pojawiło się wyraźne różowe zabarwienie:
Różowe zabarwienie świadczy o zasadowym odczynie, a więc reakcji z wodą:
Podręczniki zazwyczaj umieszczają magnez w tej czwartej klasie, to jest wśród metali reagujących z wodą gorącą lub z parą wodną. Co więcej temperatura spalania się magnezu jest tak wysoka, iż rozkłada wodę i powstający tlen zużywa na dalsze palenie się, dlatego magnez może płonąć pod wodą. Tak piszą we wszystkich podręcznikach szkolnych, dlatego na studiach byłem zaskoczony gdy podczas prób reaktywności metali na zajęciach z chemii nieorganicznej, okazało się, że nie jest to taka prosta sprawa. Gdy bowiem wrzuciłem kawałki odtłuszczonej wstążki magnezowej do wody z fenoloftaleiną, wokół nich pojawiło się wyraźne różowe zabarwienie:
Różowe zabarwienie świadczy o zasadowym odczynie, a więc reakcji z wodą:
Mg + 2 H2O → Mg(OH)2 + H2
Powstający wodorotlenek jest wprawdzie słabo rozpuszczalny w wodzie, ale najwyraźniej wystarcza aby podwyższyć pH powyżej 8 i zabarwić wskaźnik. Co do wodoru - zdjęcie robiłem jakieś pół godziny po wrzuceniu magnezu i kilka bąbelków widać ale małych, dlatego bez wskaźnika reakcja byłaby niezauważalna. Stąd zapewne błędne przekonanie, że do reakcji magnezu trzeba wodę podgrzać - wtedy reakcja przyspiesza i jest zauważalna.
Ale co innego pisać o reakcji niezauważalnej a co innego o braku reakcji. W książkach dla studentów ta różnica jest uwzględniona. Ciekawe ile jeszcze takich zbytnich uproszczeń pojawia się w książkach dla gimnazjalistów i licealistów?
środa, 26 września 2012
Półtora roku, licencjat i inne zdarzenia
Jakiś tydzień temu minęło półtora roku od momentu założenia bloga. Cieszę się, że jak dotychczas nie straciłem ani chęci ani pomysłowości do tego aby wciąż pisać, choć w wakacje nie było łatwo zebrać się w sobie i skończyć rozpoczęte wpisy - liczba tych zaległych i nieukończonych sięgnęła już 10. Teraz więc może nieco statystyk
Ilość wejść na stronę wynosi właśnie 86 806, od czasu rocznicowej notki wzrost wyniósł zatem ok 58 tysięcy wejść. Średnia dzienna przeglądalność utrzymuje się na poziomie 150-200 wejść. Dwie najpopularniejsze nowe notki z tego okresu, to zarazem najbardziej popularne w ogóle. Pierwsza, zaplanowana jako krótka migawka z cyklu obrazków z laboratorium, to:
- Kiedyś w laboratorium 11. - 10 735 wejść, 15 komentarzy. Kwestia tego dlaczego herbata zmienia kolor po dodaniu cytryny okazała się najwyraźniej niezwykle interesująca. Kontynuując temat napisałem więc drugą o zdrwotności picia herbaty, która popularnością niewiele ustępuje tej pierwszej:
- Z cytryną czy bez? - 9889 wejść.
Dwie następne z tego okresu to:
- Ałun - 1670
- Chemik na miejscu zbrodni - próby analityczne na krew - 1055
Najczęściej na bloga wchodzono ze stron: wykop.pl, Blog de Bart, klikd.pl, Facebook (co jest o tyle ciekawe, że blog nie ma prezentacji na tym portalu) i NewChemistry.eu. Najczęstszym słowem kluczowym przez które odnaleziono stronę, było "Znane obrazy" - niewykluczone więc że skrobnę coś jeszcze na temat chemii malarstwa na przykładzie najsłynniejszych dzieł.
Jak widzicie wciąż nie wpuszczam na stronę reklam i nie zamierzam.
A co tam u mnie?
Zaliczyłem pracę licencjacką na temat "Katastrofy Jądrowe" pod kierunkiem dra hab. Krzysztofa Wojciechowskiego. Przyznam szczerze, że nie jestem z niej całkowicie zadowolony; konieczność zmieszczenia wywodów na kilkunastu stronach spowodowała, że musiałem pominąć niektóre kwestie dla mnie wprawdzie ciekawe, ale w zakresie tematu niezbyt ważne. W dodatku wybór tematu w mniejszym stopniu zależał ode mnie, zabrałem się bowiem dosyć późno za jego zaklepywanie i takie jak "Trójniciowe DNA w enzymach" czy "Stereochemia związków siarki" były zajęte gdy już się za to wziąłem.
Z zaliczeniami przedmiotów miałem trochę problemów (jak co roku zresztą) ale poradziłem sobie. Na sam koniec zaliczyłem jeszcze egzamin licencjacki, będący przepytką dotyczącą zagadnień jakich nauczano mnie przez ostatnie trzy lata. Na szczęście zaliczyłem go na 4+ i na dyplomie mam ocenę 4.
Jeśli chodzi o wybór studiów magisterskich, uznałem że właściwie nie ma powodu przenosić się gdzieś dalej i zostałem w Siedlcach. Wybrałem kierunek chemia organiczna, więc spodziewajcie się w następnych miesiącach relacji z co ciekawszych syntez. A cóż poza tym? Spędziłem całkiem miłe wakacje, porobiłem trochę planów i oczywiście nadal będę kontynuował pisanie Nowej Alchemii.
Ilość wejść na stronę wynosi właśnie 86 806, od czasu rocznicowej notki wzrost wyniósł zatem ok 58 tysięcy wejść. Średnia dzienna przeglądalność utrzymuje się na poziomie 150-200 wejść. Dwie najpopularniejsze nowe notki z tego okresu, to zarazem najbardziej popularne w ogóle. Pierwsza, zaplanowana jako krótka migawka z cyklu obrazków z laboratorium, to:
- Kiedyś w laboratorium 11. - 10 735 wejść, 15 komentarzy. Kwestia tego dlaczego herbata zmienia kolor po dodaniu cytryny okazała się najwyraźniej niezwykle interesująca. Kontynuując temat napisałem więc drugą o zdrwotności picia herbaty, która popularnością niewiele ustępuje tej pierwszej:
- Z cytryną czy bez? - 9889 wejść.
Dwie następne z tego okresu to:
- Ałun - 1670
- Chemik na miejscu zbrodni - próby analityczne na krew - 1055
Najczęściej na bloga wchodzono ze stron: wykop.pl, Blog de Bart, klikd.pl, Facebook (co jest o tyle ciekawe, że blog nie ma prezentacji na tym portalu) i NewChemistry.eu. Najczęstszym słowem kluczowym przez które odnaleziono stronę, było "Znane obrazy" - niewykluczone więc że skrobnę coś jeszcze na temat chemii malarstwa na przykładzie najsłynniejszych dzieł.
Jak widzicie wciąż nie wpuszczam na stronę reklam i nie zamierzam.
A co tam u mnie?
Zaliczyłem pracę licencjacką na temat "Katastrofy Jądrowe" pod kierunkiem dra hab. Krzysztofa Wojciechowskiego. Przyznam szczerze, że nie jestem z niej całkowicie zadowolony; konieczność zmieszczenia wywodów na kilkunastu stronach spowodowała, że musiałem pominąć niektóre kwestie dla mnie wprawdzie ciekawe, ale w zakresie tematu niezbyt ważne. W dodatku wybór tematu w mniejszym stopniu zależał ode mnie, zabrałem się bowiem dosyć późno za jego zaklepywanie i takie jak "Trójniciowe DNA w enzymach" czy "Stereochemia związków siarki" były zajęte gdy już się za to wziąłem.
Z zaliczeniami przedmiotów miałem trochę problemów (jak co roku zresztą) ale poradziłem sobie. Na sam koniec zaliczyłem jeszcze egzamin licencjacki, będący przepytką dotyczącą zagadnień jakich nauczano mnie przez ostatnie trzy lata. Na szczęście zaliczyłem go na 4+ i na dyplomie mam ocenę 4.
Jeśli chodzi o wybór studiów magisterskich, uznałem że właściwie nie ma powodu przenosić się gdzieś dalej i zostałem w Siedlcach. Wybrałem kierunek chemia organiczna, więc spodziewajcie się w następnych miesiącach relacji z co ciekawszych syntez. A cóż poza tym? Spędziłem całkiem miłe wakacje, porobiłem trochę planów i oczywiście nadal będę kontynuował pisanie Nowej Alchemii.
Subskrybuj:
Posty (Atom)