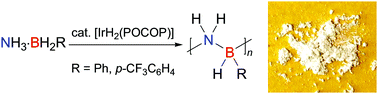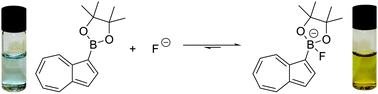Wykorzystanie żywych organizmów do wytwarzania energii jest jak na razie raczkującym działem technologii. Pewnym krokiem na przód jest doniesienie badaczy z Birmingham University o stworzeniu lekkiej minibaterii, której podstawowym materiałem jest zadrukowany papier. Na papierowe podłoże naniesiono warstwę przewodzącego polimeru z akceptorem elektronów, a na drugą stronę tusz zawierający cząstki metalu. Sam papier został ponadto pokryty przetrwalnikami wysuszonych bakterii elektrogennych.
Są to bakterie które potrafią tworzyć ładunki elektryczne generując niewielkie prądy. Nie tak dawno odkryto, że w kolonii tworzą między sobą połączenia przekazując sobie wzajemnie energię, oraz że mogą być pobudzane do wzrostu przez zewnętrzne napięcie.
W tym przypadku bakterie zostały użyte jako źródło prądu. Po nasyceniu papieru elektrolitem, którym może być na przykład ślina, woda pitna czy sok roślinny, bakterie zaczynają metabolizować i generować prąd. Drobne ładunki zebrane z zestawu wielu połączonych ogniw, na arkuszu złożonym w harmonijkę, wystarczyły aby po kilkunastu minutach od nawilżenia dało się tym prądem zapalić diodę czy zasilić kalkulator elektroniczny.
 |
| Credit: Seokheun Choi |
Badacze celują tym urządzeniem w przenośne urządzenia analityczne, na przykład do wykrywania substancji we krwi czy moczu, albo zanieczyszczeń w wodzie pitnej. Urządzenie nie potrzebowałoby zasilania, byłoby lekkie, a badany płyn byłby równocześnie elektrolitem.[1]
Nadmierne wzburzenie chmielonego piwa wyjaśnione
W najczęściej używanej technice warzenia piwa, głównym surowcem jest słód, otrzymywany z ziaren zbóż poddanych przeprocesowaniu, w którym namoczone ziarna rozciera się uwalniając enzymy rozkładające skrobię do prostych cukrów. Następnie mieszanina ta jest gotowana z chmielem, co zabija przeszkadzające bakterie i dzikie drożdżaki, oraz uwalnia z chmielu aromaty i goryczki. Następnie mieszanina jest poddawana fermentacji przy pomocy odpowiednio dobranych gatunków drożdży, a po zakończeniu fermentacji, gdy proste cukry zostaną rozłożone, piwo może zostać zabutelkowane.
W ostatnich latach coraz większą popularność zdobywa sobie technika chmielenia na zimno, polegająca na macerowaniu piwa z chmielem już po ustaniu fermentacji burzliwej. Dzięki temu piwo zyskuje wyraźniejszy i mocniejszy aromat chmielu, bez przesadnej ilości goryczki. Część bowiem substancji aromatycznych zwyczajnie odparowuje podczas warzenia, lub jest usuwana z bąbelkami.
Technika ta bywa jednak nieco kłopotliwa - piwowarzy częściej niż zwykle obserwowali w tak zrobionym piwie pojawienie się dodatkowej, nie kończącej się szybko fermentacji. Jeśli po pozornym spadku ilości cukrów i zaprzestaniu fermentacji piwo nachmielono i za szybko zabutelkowano, następująca w butelce dalsza fermentacja powodowała przy otwarciu gushing (fontanna piany pod ciśnieniem) a nawet pękanie butelek w trakcie leżakowania. Dodatkowym problemem mogła być za wysoka zawartość alkoholu.
Zwykle za przyczynę tego zjawiska uznawano natlenienie piwa powietrzem zawartym w chmielu, zanieczyszczenie dzikimi drożdżami czy obecność cukrów prostych w samym chmielu, co dostarczyło drożdżom dodatkowego pokarmu. Ostatnie badanie zespołu z Oregon State University dorzuca jeszcze jedną możliwość.
 |
| Credit: American Chemical Society |
Naukowcy poddali powtórnemu chmieleniu komercyjne piwa, a więc takie, w których co się miało przefermentować, to już przereagowało. Okazało się, że zawartość alkoholu i dwutlenku węgla ponownie się zwiększyła, zupełnie jakby w piwie pojawiły się dodatkowe cukry proste. Dokładne przeanalizowanie składu pozwoliło odnaleźć źródło.
Podczas produkcji słodu oraz dalszego warzenia, nie cała skrobia ulega rozkładowi do fermentowalnych cukrów prostych. Część łańcuchów skrobi ulega tylko podziałowi na dekstryny - fragmenty zawierające kilka - kilkanaście reszt glukozowych, które są rozpuszczalne w wodzie i nie da się ich oddzielić filtrowaniem. Drożdże nie za bardzo mogą się nimi pożywić, pozostają więc w piwie jako niefermentowalne węglowodany. Jak się jednak okazuje, sam chmiel zawiera enzymy mogące rozkładać dekstryny. W wyciągu z suszu oznaczono aktywność amyloglukozydazy, alfa i beta amylaz i dekstrynazy. Ich zawartość wystarcza aby rozłożyć dekstryny i dostarczyć dodatkowych porcji fermentowalnych cukrów prostych.
Podczas dalszych eksperymentów badacze sprawdzili, że stopień przereagowania można kontrolować temperaturą, czasem i ilością macerowanego chmielu, potencjalnie więc możliwe by było takie dobranie warunków procesu, aby przykre efekty uboczne pojawiały się rzadziej. [2]
Pasek do sprawdzania antybiotyków
Antybiotyki należą do najczęściej fałszowanych leków. Podróbki nie zawierające właściwego leku, lub z substancją właściwą rozmieszaną z czymś nieaktywnym, krążą po sklepach, pojawiają się na aukcjach internetowych oraz bywają sprzedawane do krajów trzeciego świata. Zespół badaczy z Carolina State University opracował prosty test kolorymetryczny, który może wykazać czy tabletka zawiera antybiotyk, oparty zasadą działania o testy ciążowe.
Fragment badanej tabletki rozpuszcza się w wodzie a roztwór nakłada na koniec papierowego paska. Gdy pasek nasiąknie, zawarty w nim związek, nitrocefina, może reagować z drugim składnikiem, enzymem betalaktamazą. Przy nieobecności antybiotyku, reakcja spowoduje powstanie produktu o czerwonym kolorze. Antybiotyk z grupy beta-laktamów (głównie penicyliny) będzie natomiast sam reagował z laktamazą, zmniejszając szybkość reakcji ze wskaźnikiem i powodując, że pasek pozostanie żółty.
Podczas ślepej próby z przemieszanymi próbkami z i bez antybiotyków test prawidłowo oznaczył zawartość penicylin w 29 z 32 próbek.[3]
 |
| Copyright © 2018 American Chemical Society |
---------
[1] Yang Gao Seokheun Choi, Merging Electric Bacteria with Paper, Adw. Mat. Tech. vol 3 issue 8
[2] Kaylyn R. Kirkpatrick and Thomas H. Shellhammer, Evidence of Dextrin Hydrolyzing Enzymes in Cascade Hops (Humulus lupulus), J. Agric. Food Chem., 2018, 66 (34), pp 9121–9126
[3] Katherine E. Boehle et al, Paper-Based Enzyme Competition Assay for Detecting Falsified β-Lactam Antibiotics, ACS Sens., 2018, 3 (7), pp 1299–1307