Dwutlenek siarki w atmosferze egzoplanety
Pojawia się coraz więcej danych na temat składu atmosfery egzoplanet i tutaj jedna taka ciekawostka. Astronomowie korzystający z obserwacji nowego Teleskopu Webba zauważyli w atmosferze planety WASP-39b o typie Gorącego Jowisza ślady wskazujące na obecność dwutlenku siarki. Zarazem jednak atmosfera tej planety ma charakter redukujący, więc tlenek wyrzucany przez wulkany powinien zostać zredukowany i nie być wykryty. Przedstawiają więc teorię, że tlenek powstaje w atmosferze w wyniku procesów fotochemicznych. W wysokich partiach atmosfery występujący tam też siarkowodór ulega rozbiciu z wytworzeniem rodników siarki. Te reagują z innymi cząsteczkami zabierając z nich tlen i tworząc tlenek siarki.
Byłby to zatem pierwszy przypadek wykrycia dowodów na fotochemiczną modyfikację składu atmosfery planety pozasłonecznej. Dotychczas obserwowano składniki trwałe, które mogły się tam znaleźć z przyczyn geologicznych lub spaść z materią kosmiczną. Czasem takie fotochemiczne modyfikacje są bardzo ważne i dużo mówią o warunkach na planecie - takim składnikiem pojawiającym się w wyniku działania światła jest w przypadku Ziemi ozon, którego warstwa tworzy warunki bardziej sprzyjające życiu.
Ponieważ linie spektralne tlenku siarki są charakterystyczne, może to być niezła wskazówka tego na ile "metaliczna" jest atmosfera takiej planety, czyli ile zawiera cięższych pierwiastków a to już stanowi podpowiedź co do procesów formowania planet.
Meteoryty żelazne katalizują niebiologiczny cykl Krebsa
Zagadka powstania życia na ziemi jest wciąż ciekawym tematem dla biochemików. W jakiś sposób w pierwotnej atmosferze Ziemi powstały związki chemiczne, z nich struktury micelarne, a wewnątrz nich układy reakcji chemicznych produkujących substraty do powstawania kolejnych miceli i tak w pewnym momencie cząsteczka polimeryczna zyskała zdolność zapisywania w swojej strukturze informacji wpływającej na rozwój takich struktur. A potem zaczęła działać ewolucja i tak powstało to co dziś znamy jako życie.
Ale jakie to były reakcje? Dlaczego podstawowy cykl oddychania, jaki pomaga dziś organizmom wytwarzać energię, ma takie a nie inne substraty? Proponowanym wyjaśnieniem jest zachodzenie tego cyklu przemian lub jego części w sposób czysto chemiczny. Potem reakcje były przyspieszane przez pomoc białek działających enzymatycznie, aż nieorganiczne reagenty zostały całkiem zastąpione białkami
Tutaj badacze opisują możliwość niebiologicznego przeprowadzenia fragmentu cyklu Krebsa o odwróconym kierunku, w łagodnych warunkach, możliwych do uzyskania w pierwotnych organizmach. Jest o w sumie dość prosta reakcja redukcji kwasu szczawiooctowego w bursztynowy. Czynnikiem redukującym jest wodór, który musiał być obecny w pierwotnej atmosferze Ziemi. Katalizatorem są śladowe ilości platynowców lub nikiel. Oba te pierwiastki zawierają meteoryty żelazowo-niklowe, toteż wykonano test ze sproszkowanym meteorytem - i rzeczywiście, meteoryt był w stanie katalizować tę reakcję. Skoro tak, to możliwe było niebiologiczne powstawanie szeregu substratów do przebiegu cyklu. Jeśli istniały układy katalityczne działające w jedną stronę, to mogły też powstać odwrotne. Wystarczała zaś choćby częściowa reakcja utleniania aby zachodziło uwalnianie energii chemicznej, podtrzymującej procesy.
Rodniki borowe produkują amoniak z azotu w roztworze
Produkcja amoniaku to jeden z najważniejszych procesów w technologii chemicznej. Pospolicie występujący w atmosferze Azot jest zamieniany w amoniak, który daje się wykorzystać w takiej formie, lub może został utleniony do azotanów. Sole amonowe oraz azotany to podstawa nawozów sztucznych, materiałów wybuchowych i leków.
Opracowana sto lat temu metoda Habera-Bosha była ogromnym krokiem do przodu, który umożliwił rozwój wydajnego rolnictwa, i wciąż jest to najlepsza metoda do produkcji na bardzo duża skalę. Z drugiej jednak strony zwraca się uwagę na to, że jest metodą ogromnie energożerną i bardzo emisyjną. Znaczący procent ludzkich emisji CO2 pochodzi ze spalania węgla aby zapoczątkować reakcje syntezy. Dlatego szukane są usprawnienia tego procesu, lub procesy zupełnie nowe, pozwalające wytworzyć amoniak w sposób mniej obciążający środowisko.
Jeden z takich procesów opisuje w najnowszej publikacji zespół chemików z Francji.
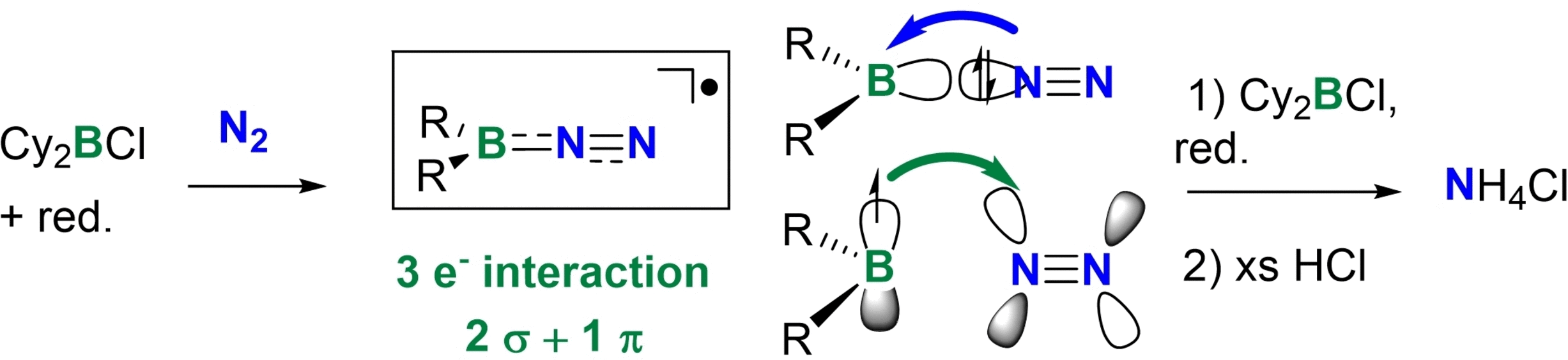
W tej reakcji stosuje się prekursor, chlorek boru podstawionego dwiema stabilizującymi grupami. Reakcja zaczyna się od dodania odpowiednio silnego reduktora jednoelektronowego. Reakcja jest prowadzona w rozpuszczalnikach aprotycznych, może to być eter lub dioksan. Badacze wypróbowali z powodzeniem różne odczynniki redukujące, na przykład metaliczny sód i grafitek potasu. Związek boru traci w tym procesie chlor i tworzy rodnik, z niesparowanym elektronem na borze. Ten związek łączy się z cząsteczką azotu początkowo niezbyt mocnym, wiązaniem pojedynczym. Ładunek niesparowanego elektronu przesuwa się na koniec z azotem. Ten ciekawy rodnik rekombinuje z drugim rodnikiem borowym, który przyłącza się do drugiego końca cząsteczki. Ostatecznie jedna z par elektronowych tworzących między azotami wiązanie potrójne, rozpada się, bo elektrony są przyciągane przez mający deficyt bor. Powstaje interesujące połączenie podobne do skumulowanego allenu B=N=N=B
W tak powstałym połączeniu wiązanie między azotami jest dużo słabsze oraz bardziej podatne na rozerwanie. Zarazem jest to niezbyt stabilna struktura. Reaguje z kolejnymi rodnikami borowymi tworząc strukturę podobną do etenu, z dwiema grupami borkowymi dołączonymi do azotów połączonych wiązaniem pojedynczym, bo na utworzenie dodatkowych dwóch wiązań z rodnikami zużyta została kolejna para elektronowa. W tym momencie wiązanie między azotami jest już bardzo słabe i łatwo dysocjuje, tworząc borki azotu. Po przereagowaniu mieszanina jest zakwaszana jakimś kwasem, na przykład solnym i w tym momencie następuje zwykła protonoliza. Dopiero ten kwas jest dawcą protonów, w całym procesie nie jest potrzebny gazowy wodór jak to było w innych syntezach.
 |
| © Wiley-VCH |
Na koniec w mieszaninie poreakcyjnej zostają sole amonowe, te można oczyścić i użyć do wytworzenia potrzebnych innych soli, lub też zalkalizować do amoniaku gazowego.
Jak łatwo zauważyć podstawowy problem z wydajnością energetyczną i emisjami wiąże się tutaj z wytworzeniem reduktora, który jest zużywany w nadmiarze, jednak dla sodu i potasu znamy procesy elektrolityczne, które mogą być niskoemisyjne przy niskoemisyjnym źródle. Jednym z testowanych reduktorów był jodek samaru który można regenerować.
* Dr. Nicolas Mézailles et al. Ammonia Synthesis at Room Temperature and Atmospheric Pressure from N2: A Boron-Radical Approach, Angewandte Chemie International Edition, 26, 2022
https://onlinelibrary.wiley.com/doi/10.1002/anie.202209102

Brak komentarzy:
Prześlij komentarz