Co w minionym roku chemicy dokonali najciekawszego, wartego uwagi czy choćby nietypowego? Lista odkryć o których nie pisałem w poprzednich wieściach, opracowana częściowo na podstawie tego co zapamiętałem, a częściowo na podstawie innych takich podsumowań zauważonych na zagranicznych portalach (linki na końcu artykułu). Nie pojawia się tu uznanie odkryć i nazwanie czterech nowych pierwiastków, bo już o tym pisałem i nie dotyczyło to odkryć z tego roku. Podobnie jest z tegoroczną nagrodą Nobla, ale tutaj artykuł o niej jeszcze czeka na napisanie.
Najbardziej polarny związek organiczny
Polarność to cecha cząsteczek mówiąca o nierównym rozłożeniu ładunku elektrycznego. Atomy tworzące cząsteczki otoczone są przez elektrony, te jednak są dość ruchliwe. Jeśli w cząsteczce pojawią się rozłożone niesymetrycznie atomy o bardzo różnej elektroujemności (zdolności do przyciągania elektronów), lub grupy z różnych przyczyn odpychające lub przeciągające elektrony, to cząsteczka taka nabierze momentu dipolowego, pokazującego która strona cząsteczki jest nieco bardziej dodatnia a która nieco bardziej ujemna.
Takie polarne właściwości ma choćby woda, składająca się z silnie elektroujemnego tlenu po jednej stronie i słabo elektroujemnych wodorów do drugiej stronie. dzięki tej właściwości woda może łatwiej rozpuszczać sole mineralne i wiele polarnych związków organicznych.
Moment dipolowy jest własnością wektorową, drobne oddziaływania różnych części cząsteczki sumują się do momentu ogólnego.
Silny moment dipolowy posiadają cząsteczki ulegające jonizacji, a więc aniony kwasów karboksylowych, kationy fosfoniowe a szczególnie posiadające fragment anionowy i fragment kationowy betainy. Jednak w opisanym nie tak dawno przypadku wyjątkowo silne oddziaływanie udało się otrzymać dla cząsteczki elektrycznie obojętnej.
Jest to w sumie dość prosty związek 5,5-diamino-1,2,3,4-tatracarbonitrylobenzen , benzen z różnymi podstawnikami - cztery grupy nitrylowe po jednej stronie i dwie aminowe po drugiej. Efekty elektronowe powodują, że grupy aminowe ściągają w swoją stronę elektrony, zaś grupy nitrylowe odpychają. Wskutek dodania się wektorów polaryzacji tych sześciu leżących na jednej płaszczyźnie grup tworzy się moment dipolowy, którego zmierzona wartość osiągnęła 14,1 D. [1] To nawet więcej niż wartość dla niektórych soli nieorganicznych w stanie gazowym. Dla porównania dla cząsteczki wody moment ten ma wartość 1,85 D
Zaproponowano już jednak cząsteczki o potencjale na jeszcze większą polarność, więc rekord jest raczej zagrożony. [2]
Najmocniejsza zasada organiczna
Kolejny rekord odnosi się do innej właściwości cząsteczek organicznych - skłonności do wiązania kationu wodorowego. Związki które chętnie proton oddają, to kwasy, związki które chętnie go przyjmują, to zasady. Niedawno opublikowane obliczenia pokazały, że dianion otro-dietynylobenzenu przyjmuje protony najchętniej, z energią 1834 kJ/mol.[3]
Sześciowiązalny węgiel
Nic tak bardzo nie cieszy chemików, jak odkrycie że coś uznawanego dawniej za pewnik, nim nie jest. I tak jest w tym przypadku.
Heksametylobenzen to dość prosty związek organiczny - benzen zupełnie podstawiony grupami metylowymi. W latach 70. podczas badań nad jego aktywnością zwrócono uwagę na szczególną formę - potraktowanie związku "kwasem magicznym", mieszaniną kwasu fluorosulfonowego i fluorku antymonu o bardzo dużej mocy, spowodowało powstanie dość trwałego dikationu który zachował właściwości aromatyczne, mimo że wydawało się to niemożliwe. Aby to wyjaśnić zaproponowano kilka struktur kationu, wśród nich ekstremalną w formie piramidy pentagonalnej, ale ta wydawała się niemożliwa. Dopiero niedawno udało się uzyskać kryształ soli tego dikationu i zbadać strukturę metodami rentgenowskimi. Dokładne pomiary potwierdziły, że z pozoru nieprawdopodobna propozycja jest prawdziwa.
Po zjonizowaniu cząsteczka ulega przearanżowaniu w formę z jednym pierścieniem pięciokątnym, pięcioma grupami metylowymi po bokach. Jeden węgiel z dawnego pierścienia jest połączony z kolejną grupą metylową i z wszystkimi atomami pierścienia po jednym wiązaniu.
W czym problem? Atomy tworzą wiązania poprzez uwspólnienie elektronów z zewnętrznej, niezapełnionej powłoki, po jednym od każdego, dwa na jedno wiązanie, dążąc do trwalszego energetycznie układu ośmiu elektronów w otoczeniu. Obojętnemu atomowi węgla brakuje do tego stanu 4 elektronów, toteż tworzy maksymalnie 4 wiązania. Wprawdzie znane były związki hiperwalencyjne dla niektórych pierwiastków, gdzie atom tworzył więcej wiązań niż mu starczyło elektronów ale odkrycie, że może je tworzyć też węgiel było dość zaskakujące. Jak na niemetale ma stosunkowo wysoką elektroujemność co powinno przeszkadzać takim połączeniom. Czterowiązalny węgiel to jedno z podstawowych założeń w chemii organicznej.
Prawdopodobnie wiązania są w tym przypadku utworzone poprzez utworzenie orbitalu wielocentrowego, a więc będącego "wiązaniem" łączącym jedną parą elektronową więcej jak dwa atomy, w efekcie węgiel na wierzchołku wprawdzie jest powiązany z sześcioma innymi, ale uzyskuje oktet.[4]
Lek na zatrucie czadem
Tlenek węgla i zatrucia nim kiedyś już omawiałem (link). Wdychany łączy się z hemoglobiną czerwonych krwinek i wypiera z nich tlen, w dodatku połączenie to jest bardzo trwałe, przez co zatruta krwinka nie może już przenosić tlenu. Wraz z kolejnymi wdechami coraz większa ilość krwi ulega zatruciu, zaś człowiek traci przytomność i umiera z powodu niedotlenienia. Ponieważ czad jest bezwonny a niedotlenienie póki jest lekkie nie wywołuje alarmujących objawów, zatrucia nim stają się co roku przyczyną tysięcy zgonów.
Odratowanie częściowo zatrutego jest trudne, najczęściej polega na podawaniu tlenu pod zwiększonym ciśnieniem, czasem próbuje się przetaczania krwi. Dlatego odkrycie, że istnieć może bardziej bezpośrednio działające antidotum, jest bardzo ważne.
Mark Bladwin badał właściwości neuroglobiny, związku podobnego do hemoglobiny występującego w mózgu, mającego pomagać w natlenianiu neuronów Stwierdził podczas analiz, że neuroglobina bardzo silnie wiąże się także z tlenkiem węgla, i to wręcz silniej niż jej kuzynka z krwinek. Dla przebiegu zatrucia miało to o tyle istotne znaczenie, że wskazywało na znacznie silniejszy wpływ nawet małych dawek na mózg, niż na resztę organów. Możliwe, że utrzymywanie się w mózgu tego trwałego połączenia odpowiada za późne neurologiczne objawy zatrucia.
Potem jednak Bladwin skontaktował się z badaczami szukającymi związku, który mógłby usuwać czad z krwi, i zaproponował użycie właśnie tej proteiny. Idea była dość prosta - gdy zatruta hemoglobina z krwinki zetknie się z neuroglobiną, która tworzy z tlenkiem połączenie jeszcze chętniej, nastąpi między nimi wymiana. Neuroglobina utworzy bardzo trwały kompleks z czadem, a hemoglobina z krwinki zostanie odblokowana i zacznie normalnie przenosić tlen.
Pierwsze próby na zwierzętach były bardzo obiecujące, toteż wykorzystano biotechnologię testując wersje neuroglobiny z drobnymi mutacjami. Po wielu próbach i dalszej optymalizacji otrzymano odmianę Ngb H64Q wiążącą się z tlenkiem węgla 500 razy mocniej niż hemoglobina. Podanie jej dożylnie myszom narażonym na śmiertelną dawkę czadu pozwoliło na uratowanie 86% z nich.[5]
Jedwabniki karmione grafenem wytwarzają supernić
To doniesienie brzmi tak dziwacznie, że wciąż czekam czy nie okaże się przemyślnym żartem. Jedwabniki nakarmione liśćmi morwy z dodatkiem węglowych nanorurek i grafenu, wytworzyły jedwab bardziej wytrzymały od naturalnego. Prawdopodobnie cząsteczki białka utworzyły na powierzchni węgla bardziej zbite struktury warstwowe podobne do beta-harmonijki, co zwiększyło ich wytrzymałość.
Po zwęgleniu takiej przędzy powstawało włókno węglowe o zwiększonej przewodności elektrycznej, dlatego dość w sumie prosta technika może znaleźć zastosowanie na przykład do budowy węglowych elektrod.[6]
Chiralne cząstki w kosmosie.
Życie jest chiralne. Organizmy żywe składają się w dużym stopniu ze związków mających tą właściwość, iż ich cząsteczki mogą tworzyć dwie odmiany przestrzenne, nie identyczne lecz podobne jak lustrzane odbicia. Takimi cząsteczkami są aminokwasy, całe białka czy DNA. Co jednak najbardziej interesujące, spośród dwóch lustrzanych form w organizmach żywych występuje tylko jedna - aminokwasy budujące wszystkie białka organizmu mają konfigurację L, izomery w odmianie D są w naturze rzadkością.
Lustrzane izomery aminokwasów niczym się nie różnią pod względem trwałości czy reaktywności, a ponieważ w reakcjach niebiologicznej syntezy zwykle powstaje mieszanina po równo obu izomerów, powstaje pytanie, czemu ziemskie organizmy ostatecznie wykorzystały tylko jedną z wersji tych cząsteczek? Jedną z propozycji jest założenie, że chiralne cząsteczki z nadmiarem jednej z form były obecne w obłoku z którego powstał układ słoneczny, w związku z czym gdy na Ziemi powstało życie, w praoceanie istniała już przewaga związków o jednej konfiguracji. Z kolei nadmiar jednego z izomerów w pierwotnym obłoku miałby wynikać z oświetlenia go błyskiem promieniowania spolaryzowanego kołowo tak, że cząsteczki o różnej konfiguracji a zatem i różnej czynności optycznej, w różnym stopniu pochłaniały energię i w różnym stopniu się rozkładały.
Aby to potwierdzić należałoby najpierw potwierdzić, że w kosmosie istnieją chiralne cząsteczki, a potem że zachodzi nierównowaga między zawartością lustrzanych form L i D. To pierwsze udało się w minionym roku - w obłoku pyłu i gazu Sagittarius B Północny w pobliżu centrum naszej galaktyki, wykryto spektroskopowo sygnał pochodzący od tlenku propylenu, będący takim właśnie chiralnym związkiem.[7]
Karbinowe nanodruty
Były już nanorurki, fullereny i grafen. Czas więc na następną odmianę węgla - karbiny. Chodzi o cząsteczki będące w zasadzie spolimeryzowanym acetylenem, z naprzemiennym układem wiązań pojedynczych i potrójnych (choć ze względu na delokalizację można też opisać je jako łańcuch atomów węgla połączonych wiązaniami podwójnymi).
Przewidziany teoretycznie materiał powinien mieć potencjalnie interesujące właściwości - niezwykle wysoką właściwą wytrzymałość na zerwanie, sztywność większą niż diament, dobre przewodnictwo elektryczne i cieplne. Problemem było natomiast jego otrzymanie - dotychczasowe techniki oparte o redukcję acetylenków metali czy alkenów zwykle prowadziły do otrzymania krótkich odcinków, zakończonych dużymi grupami innego rodzaju, posplatanych i posklejanych na różne sposoby. Jeśli jakiś zespół wymyślił metodę kontrolowanego otrzymania nici 40-50 atomowej, to już tym to sukces.
Dlatego ostatnie odkrycie jest potężnym skokiem technologicznym - przy pomocy odpowiednio dobranych warunków udało się otrzymać węglowe nanorurki z "wkładem" z łańcuchów karbinowych o długości do 6000 atomów. [8]
-------
* Chemistry & Engeenering 10 najbardziej poczytnych artykułów 2016 roku
* Compound Interest Biggest chemistry stories
[1] J. Wudarczyk et. al. Hexasubstituted Benzenes with Ultrastrong Dipole Moments, Angewandte Chemie International Edition, vol. 55, pp. 3220-3223, 2016.
[2] http://www.rzepa.net/blog/?p=17205
[3] Leo Radom et.al. Preparation of an ion with the highest calculated proton affinity: ortho-diethynylbenzene dianion, Chem. Sci., 2016,7, 6245-6250
[4] Moritz Malischewski, K. Seppelt "Crystal Structure Determination of the Pentagonal-Pyramidal Hexamethyl benzene Dication", Angew. Chem. Int.Ed. 56 (1): 368–370.
[5] Mark T. Bladwin et.al. Five-coordinate H64Q neuroglobin as a ligand-trap antidote for carbon monoxide poisoning, Science Translational Medicine 8, 368, pp. 368-173
[6] Qi Wang et al. Feeding Single-Walled Carbon Nanotubes or Graphene to Silkworms for Reinforced Silk Fibers, Nano Letters (2016) 16 (10), pp 6695–6700
[7] B McGuire et al, Discovery of the interstellar chiral molecule propylene oxide (CH3CHCH2O)
Science, 2016, 352, 1449
[8] Thomas Pichler et al. Confined linear carbon chains as a route to bulk carbyne, Nature Materials,15, 634–639
informacje
niedziela, 5 lutego 2017
środa, 1 lutego 2017
Witamina lewa i prawa
Na temat witaminy C krąży bardzo wiele mitów i przekłamań. A ponieważ mają one w dużym stopniu oparcie w chemii, warto jest je tutaj szczegółowo rozjaśnić. Czy zatem może być tak, że witamina może być prawa i lewa? Może i to w dodatku na bardzo różne sposoby.
Kwas askorbinowy to związek szczególny. Jest kofaktorem regulującym działanie wielu enzymów. Pomaga przy produkcji kolagenu, wpływając na stan naczyń krwionośnych i skóry. Jest ważnym przeciwutleniaczem neutralizującym wolne rodniki. A przy tym jest substancją jakiej nasz organizm nie może sam wytwarzać, co zresztą stanowi wśród zwierząt wyjątek. Takie na przykład szczury same go sobie wytwarzają i nigdy nie doznają niedoboru.
Jego brak wywołuje przykre i na dłuższą metę śmiertelne choroby, jak choćby szkorbut, nazywany też obrazowo gnilcem, co zanim poznano jego rolę w żywieniu stanowiło częstą przyczyną zgonów marynarzy, pozbawionych dostępu do świeżej żywności. Nic więc dziwnego, że witamina C została nazwana kwasem a-skorbinowym, to jest antyszkorbutowym.
Człowiek wynalazł kilka prostych sposobów jego syntezy tak, aby otrzymać cząsteczkę o budowie takiej samej jak naturalna. Zwykle surowcem jest cukier glukoza, która zostaje zredukowana wodorem, poddana fermentacji przez bakterie octowe, selektywnie utleniona i odwodniona. W ten sposób, bądź metodami z większym udziałem bakterii, produkuje się ją w ilościach niemal przemysłowych i zużywa głownie jako przeciwutleniacz w żywności, środek zapobiegający brązowieniu mrożonek czy ulepszacz do pieczywa.
Zasadniczo dobrze zbilansowana dieta powinna dostarczać go nam wręcz w nadmiarze, jednak niektórzy wolą go sobie dodatkowo uzupełniać w większych dawkach. I często wpadają w pułapkę marketingu. Specjaliści od suplementów mówią im "Nie kupujcie pigułek w aptece bo w ogóle nie działają, bierzcie wyciąg z X albo tabletki dla których specjalnie potwierdzono że to jest ten właściwy, przypadkiem mamy je w ofercie. Bierz tylko nasze".
Czemu tabletkowa witamina ma nie działać? Bo "prawdziwa" i naturalna jest ta lewoskrętna, więc jeśli na opakowaniu nie zostanie wprost to napisane, to niechybnie tabletki zawierają tą nieczynną prawoskrętną.
Każdy kto ma trochę większe pojęcie o chemii, wie jak zbudowana jest cząsteczka witaminy C i wie o co chodzi z tą skrętnością, czy lewością, uśmieje się słysząc takie rzeczy. Ale niestety przeciętny konsument nie wie. Więc ja mu rzecz krótko wyjaśnię
Asymetria
Asymetria to własność obiektu, która powoduje, że obracając go w przestrzeni, odbijając w wyimaginowanym "lustrze kształtów" czy przekształcając przez punkt nie otrzymamy identycznie wyglądającej bryły. No chyba, że obrócimy go o 360 stopni czy powtórzymy odbicia dwa razy, ale to tak jakbyśmy go z miejsca nie ruszali.
Chemicy już dawno odkryli, że cząsteczki związków chemicznych, będące ułożonymi w przestrzeniami skupiskami atomów, mogą bądź posiadać jakąś symetrię, bądź nie posiadać żadnej, i to właśnie te ostatnie okazały się najciekawsze. Jeśli cząsteczka związku jest asymetryczna, to bardzo często możliwe jest, że mogą istnieć jej dwie formy, podobne do siebie jak lustrzane odbicia ale nie nakładające się na siebie.
Obiektami o takich własnościach z jakimi często mamy do czynienia, są nasze ręce - jedna dłoń jest lustrzanie podobna do drugiej, ale jedna nie nałoży się na kształt drugiej, bo kciuki odchylają się w różne strony. Jeśli złożymy dłonie jak do modlitwy sytuacja będzie podobna, bo w różne strony będą zwrócone ich grzbiety. Z tego powodu matematycy bryły o takich właściwościach, a więc posiadające lustrzanie podobne formy "lewą" i "prawą" jak dłonie, nazwali chiralnymi, od greckiego "chira" to jest ręka. (a wróżenie z dłoni to chiromancja).
Jeśli cząsteczka związku chemicznego nie będzie posiadała elementów symetrii, takich jak środek symetrii, płaszczyzna czy osie inwersyjne, to także i dla niej możliwe będzie dla niej istnienie w dwóch formach, nazywanych izomerami optycznymi. Zazwyczaj dotyczy to związków organicznych, w których atom węgla tworzy cztery wiązania ułożone nie płasko, i wystarczy aby w którymkolwiek z węgli cząsteczki zdarzyło się, że do każdego wiązania będzie przyczepione coś innego.
Aby ten fakt opisać i jakoś odróżniać poza tym we wszystkim identyczne izomery, chemicy stworzyli szereg systemów klasyfikujących
R czy S?
Ten sposób klasyfikacji opiera się na rzeczywistej budowie związku. Aby sprawdzić jaka jest jego konfiguracja, sprowadzamy go do tego właśnie interesującego nas węgla, mającego cztery różne podstawniki, nazywanego asymetrycznym. Podstawnikom tym nadajemy pewne rangi, zależne od stopnia rozbudowania, całkowitej masy atomowej czy obecności cięższych atomów. No i otóż, jeśli ustawimy naszą cząsteczkę tak, że podstawnik najniższej rangi znajdzie się z tyłu, a trzy pozostałe będą skierowane w naszą stronę, to gdy przechodząc od podstawnika ważniejszego do mniej ważnych wykonujemy obrót w prawo, konfiguracja dla tego węgla wynosi R a gdy w lewo wynosi S.
Ten sposób klasyfikacji jest bardzo ścisły, po samej nazwie możemy ustalić jak przestrzennie są poustawiane grupy wokół tego atomu.
W jednej cząsteczce może być zawartych wiele takich atomów, ponieważ zaś każdy ma dwie możliwe konfiguracje, możliwych staje się wiele izomerów. Przykładowo glukoza ma cztery takie atomy o konfiguracji 2R,3S,4R,5R, będąc jednym z 16 możliwych izomerów aldoheksozy. Symetria takich cząsteczek jest bardziej skomplikowana i niekoniecznie chiralna, przykładowo związki w odmianie mezo zawierają asymetryczne atomy węgla ale o przeciwnej konfiguracji, co powoduje że cała cząsteczka nabiera symetrii i nie jest czynna optycznie.
D czy L?
Klasyfikacja D/L jest używana właściwie tylko do cukrów, polialkoholi i aminokwasów, także dla witaminy C. Jest to klasyfikacja względna, w której przypisanie związku do danej kategorii odbywa się poprzez porównanie konfiguracji z pewnym wzorcem.
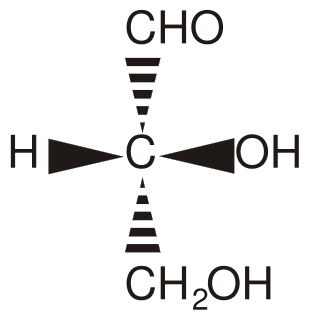
Tą cząsteczką wzorcową był naturalnie występujący aldehyd glicerynowy, uznany z najprostszy przypadek, składał się bowiem z trzech węgli z czym jeden tylko był asymetryczny. Klasyfikacja odbywa się następująco - ustawiamy naszą cząsteczkę aby łańcuch węglowy był ustawiony pionowo, grupa aldehydowa lub ketonowa znalazła się na górze, a grupy boczne sterczały na boki, będąc zwrócone lekko w naszą stronę (co rysuje się w ten sposób, że ich wiązania wyglądają jak czarne trójkąty):
Jeśli w takim ustawieniu grupa -OH znajdzie się po prawej, to cząsteczkę zaliczymy do szeregu D a jeśli po lewej to do szeregu L. Jeśli nasza cząsteczka zawiera więcej węgli asymetrycznych, wtedy bierzemy pod uwagę tylko ten ostatni na dole.
Jak widzicie jest to klasyfikacja bardzo arbitralna.
+ czy -?
Ostatni sposób klasyfikacji nie jest wprost związany z budową cząsteczki, a bardziej z tym jak oddziałuje ze światłem. Otóż izomery geometryczne związków wpływają na światło spolaryzowane. Jeśli przez fiolkę ze związkiem przepuścimy światło spolaryzowane przy pomocy polaryzatora ustawionego w określonym kierunku, to po przejściu przez związek kierunek polaryzacji światła trochę się przekręci. Poznajemy to po tym, że ustawiając za fiolką drugi polaryzator widzimy że część światła z fiolki jest zatrzymywana i aby uzyskać pełną przepuszczalność, musimy drugi polaryzator trochę obrócić.
Obejrzyjcie świetną demonstrację tego zjawiska dla dwóch izomerów karwonu:
.
I teraz najważniejsze. Uznano, że jeśli płaszczyzna polaryzacji obróciła się w prawo, to mówimy o związku że jest prawoskrętny i przypisujemy mu znaczek plus (+) a jeśli w lewo to jest lewoskrętny i przypisujemy mu znaczek minus (-). Dwa izomery optyczne tej samej substancji skręcają światło spolaryzowane o taki sam kąt w przeciwne strony, dlatego zawsze jeden jest (+) a drugi (-). Ich mieszanina pół na pół jest nieaktywna bo przeciwne oddziaływania się znoszą.
Przy czym nie koniecznie znak skręcalności powiązany jest z konfiguracją R/S czy D/L. Wprawdzie dany określony izomer geometryczny ma zawsze dany określony znak skręcalności, ale różne związki o konfiguracji D czy R mogą skręcać światło spolaryzowane w różne strony. Na przykład D-glukoza jest prawoskrętna a D-fruktoza lewoskrętna.
A jaka jest witamina?
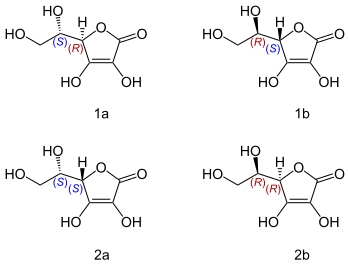
Kwas askorbinowy zawiera dwa węgle asymetryczne, w związku z czym możliwe są dla niego cztery izomery; kwas (R,S)-L-askorbinowy, (S,R)-D-askorbinowy; (S,S)-L-izoaskorbinowy i (R,R)-D-izoaskorbinowy
Aktywność biologiczną witaminy ma tylko jeden z nich, występujący naturalnie kwas (R,S) L-askorbinowy. Pozostałe nie mogą być nazywane witaminami, choć są podobnymi do niej przeciwutleniaczami..
A jak wygląda czynność optyczna? Otóż będący witaminą C naturalny kwas L-askorbinowy jest prawoskrętny. Czyli ma znaczek (+).
Zatem specjaliści od wciskania ludziom suplementów, którzy twierdzą, że witamina C powinna być lewoskrętna, pewnie pomylili się widząc znaczek L mówiący o względnej konfiguracji związku. Który to mówi nam jedynie, że jeśli zapiszemy cząsteczkę związku w określony sposób to grupa -OH na ostatnim węglu asymetrycznym będzie po lewej stronie rysunku, a to nie ma nic do skrętności.
...bo jak nie napisali L to na pewno jest D
Gdy świat alternatywnej medycyny pojął wreszcie istnienie dwóch odmian kwasu askorbinowego, zaczął przekonywać, że z pewnością absolutnie ta tabletkowa witamina, to jest właśnie ta nienaturalna D. Ze jeśli nie napiszą "kwas L-askorbinowy" to znaczy, że to musi być ten drugi. Ci którzy się na to nabierają zamawiają w hurtowniach wielkie wory kwasu L, nie ufając tabletkom, no bo przecież kto wie co sobie producenci napisali.
Dlaczego to bzdura?
Jak to już powyżej napisałem, kwas L-askorbinowy produkuje się z naturalnej glukozy otrzymując właściwą "naturalną" konfigurację. Wobec tego związek jest dosyć tani i dlatego bardziej opłaca się pchać go do tabletek, niż drugi izomer, produkowany w mniejszych ilościach przy pomocy innych, bardziej skomplikowanych metod. Kwas D-askorbinowy nie występuje w naturze a organizmy nie są przystosowane do jego wytwarzania, odpada więc bardzo ułatwiający produkcję mikrobiologiczny etap syntezy. Aby go otrzymać należałoby więc albo użyć drogich katalizatorów albo szeregu przemian dających mieszaninę izomerów, którą następnie należałoby rozdzielać. Ponieważ jednak izomer D nie jest wykorzystywany w medycynie, nikt go specjalnie nie produkuje. Czemu więc tabletki miałyby zawierać nie produkowany, znacznie droższy, nieaktywny izomer, gdy w zasięgu jest produkowany na dużą skalę aktywny L-izomer?
Inna kwestia to dozwolone nazewnictwo obu odmian. Nazwa handlowa "witamina C" oraz nazwa "kwas askorbinowy" są na mocy międzynarodowych przepisów zastrzeżone tylko dla kwasu L-(+)-askorbinowego, takiego jak naturalny. Producent nie może wsadzać w preparat inny stereoizomer i nazwać go witaminą. Ponieważ w świetle przepisów jest to w sumie jasne, producent tabletek nie musi pisać na opakowaniu, że tabletka zawiera kwas L-(+)-(4R,5S)-askorbinowy abyśmy byli pewni, że jest to taka cząsteczka jak naturalna, działająca biologicznie.
ps. 03.02 Dowiedziałem się, że w lutowym numerze Wiedzy i Życia także pojawił się artykuł o witaminie C. Jest dużo obszerniejszy i skupia się głównie na zastosowaniach medycznych ale o skrętności też wspomina. Polecam zajrzeć.
Kwas askorbinowy to związek szczególny. Jest kofaktorem regulującym działanie wielu enzymów. Pomaga przy produkcji kolagenu, wpływając na stan naczyń krwionośnych i skóry. Jest ważnym przeciwutleniaczem neutralizującym wolne rodniki. A przy tym jest substancją jakiej nasz organizm nie może sam wytwarzać, co zresztą stanowi wśród zwierząt wyjątek. Takie na przykład szczury same go sobie wytwarzają i nigdy nie doznają niedoboru.
Jego brak wywołuje przykre i na dłuższą metę śmiertelne choroby, jak choćby szkorbut, nazywany też obrazowo gnilcem, co zanim poznano jego rolę w żywieniu stanowiło częstą przyczyną zgonów marynarzy, pozbawionych dostępu do świeżej żywności. Nic więc dziwnego, że witamina C została nazwana kwasem a-skorbinowym, to jest antyszkorbutowym.
Człowiek wynalazł kilka prostych sposobów jego syntezy tak, aby otrzymać cząsteczkę o budowie takiej samej jak naturalna. Zwykle surowcem jest cukier glukoza, która zostaje zredukowana wodorem, poddana fermentacji przez bakterie octowe, selektywnie utleniona i odwodniona. W ten sposób, bądź metodami z większym udziałem bakterii, produkuje się ją w ilościach niemal przemysłowych i zużywa głownie jako przeciwutleniacz w żywności, środek zapobiegający brązowieniu mrożonek czy ulepszacz do pieczywa.
Zasadniczo dobrze zbilansowana dieta powinna dostarczać go nam wręcz w nadmiarze, jednak niektórzy wolą go sobie dodatkowo uzupełniać w większych dawkach. I często wpadają w pułapkę marketingu. Specjaliści od suplementów mówią im "Nie kupujcie pigułek w aptece bo w ogóle nie działają, bierzcie wyciąg z X albo tabletki dla których specjalnie potwierdzono że to jest ten właściwy, przypadkiem mamy je w ofercie. Bierz tylko nasze".
Czemu tabletkowa witamina ma nie działać? Bo "prawdziwa" i naturalna jest ta lewoskrętna, więc jeśli na opakowaniu nie zostanie wprost to napisane, to niechybnie tabletki zawierają tą nieczynną prawoskrętną.
Każdy kto ma trochę większe pojęcie o chemii, wie jak zbudowana jest cząsteczka witaminy C i wie o co chodzi z tą skrętnością, czy lewością, uśmieje się słysząc takie rzeczy. Ale niestety przeciętny konsument nie wie. Więc ja mu rzecz krótko wyjaśnię
Asymetria
Asymetria to własność obiektu, która powoduje, że obracając go w przestrzeni, odbijając w wyimaginowanym "lustrze kształtów" czy przekształcając przez punkt nie otrzymamy identycznie wyglądającej bryły. No chyba, że obrócimy go o 360 stopni czy powtórzymy odbicia dwa razy, ale to tak jakbyśmy go z miejsca nie ruszali.
Chemicy już dawno odkryli, że cząsteczki związków chemicznych, będące ułożonymi w przestrzeniami skupiskami atomów, mogą bądź posiadać jakąś symetrię, bądź nie posiadać żadnej, i to właśnie te ostatnie okazały się najciekawsze. Jeśli cząsteczka związku jest asymetryczna, to bardzo często możliwe jest, że mogą istnieć jej dwie formy, podobne do siebie jak lustrzane odbicia ale nie nakładające się na siebie.
Obiektami o takich własnościach z jakimi często mamy do czynienia, są nasze ręce - jedna dłoń jest lustrzanie podobna do drugiej, ale jedna nie nałoży się na kształt drugiej, bo kciuki odchylają się w różne strony. Jeśli złożymy dłonie jak do modlitwy sytuacja będzie podobna, bo w różne strony będą zwrócone ich grzbiety. Z tego powodu matematycy bryły o takich właściwościach, a więc posiadające lustrzanie podobne formy "lewą" i "prawą" jak dłonie, nazwali chiralnymi, od greckiego "chira" to jest ręka. (a wróżenie z dłoni to chiromancja).
Jeśli cząsteczka związku chemicznego nie będzie posiadała elementów symetrii, takich jak środek symetrii, płaszczyzna czy osie inwersyjne, to także i dla niej możliwe będzie dla niej istnienie w dwóch formach, nazywanych izomerami optycznymi. Zazwyczaj dotyczy to związków organicznych, w których atom węgla tworzy cztery wiązania ułożone nie płasko, i wystarczy aby w którymkolwiek z węgli cząsteczki zdarzyło się, że do każdego wiązania będzie przyczepione coś innego.
Aby ten fakt opisać i jakoś odróżniać poza tym we wszystkim identyczne izomery, chemicy stworzyli szereg systemów klasyfikujących
R czy S?
Ten sposób klasyfikacji opiera się na rzeczywistej budowie związku. Aby sprawdzić jaka jest jego konfiguracja, sprowadzamy go do tego właśnie interesującego nas węgla, mającego cztery różne podstawniki, nazywanego asymetrycznym. Podstawnikom tym nadajemy pewne rangi, zależne od stopnia rozbudowania, całkowitej masy atomowej czy obecności cięższych atomów. No i otóż, jeśli ustawimy naszą cząsteczkę tak, że podstawnik najniższej rangi znajdzie się z tyłu, a trzy pozostałe będą skierowane w naszą stronę, to gdy przechodząc od podstawnika ważniejszego do mniej ważnych wykonujemy obrót w prawo, konfiguracja dla tego węgla wynosi R a gdy w lewo wynosi S.
Ten sposób klasyfikacji jest bardzo ścisły, po samej nazwie możemy ustalić jak przestrzennie są poustawiane grupy wokół tego atomu.
W jednej cząsteczce może być zawartych wiele takich atomów, ponieważ zaś każdy ma dwie możliwe konfiguracje, możliwych staje się wiele izomerów. Przykładowo glukoza ma cztery takie atomy o konfiguracji 2R,3S,4R,5R, będąc jednym z 16 możliwych izomerów aldoheksozy. Symetria takich cząsteczek jest bardziej skomplikowana i niekoniecznie chiralna, przykładowo związki w odmianie mezo zawierają asymetryczne atomy węgla ale o przeciwnej konfiguracji, co powoduje że cała cząsteczka nabiera symetrii i nie jest czynna optycznie.
D czy L?
Klasyfikacja D/L jest używana właściwie tylko do cukrów, polialkoholi i aminokwasów, także dla witaminy C. Jest to klasyfikacja względna, w której przypisanie związku do danej kategorii odbywa się poprzez porównanie konfiguracji z pewnym wzorcem.
Tą cząsteczką wzorcową był naturalnie występujący aldehyd glicerynowy, uznany z najprostszy przypadek, składał się bowiem z trzech węgli z czym jeden tylko był asymetryczny. Klasyfikacja odbywa się następująco - ustawiamy naszą cząsteczkę aby łańcuch węglowy był ustawiony pionowo, grupa aldehydowa lub ketonowa znalazła się na górze, a grupy boczne sterczały na boki, będąc zwrócone lekko w naszą stronę (co rysuje się w ten sposób, że ich wiązania wyglądają jak czarne trójkąty):
Jeśli w takim ustawieniu grupa -OH znajdzie się po prawej, to cząsteczkę zaliczymy do szeregu D a jeśli po lewej to do szeregu L. Jeśli nasza cząsteczka zawiera więcej węgli asymetrycznych, wtedy bierzemy pod uwagę tylko ten ostatni na dole.
Jak widzicie jest to klasyfikacja bardzo arbitralna.
+ czy -?
Ostatni sposób klasyfikacji nie jest wprost związany z budową cząsteczki, a bardziej z tym jak oddziałuje ze światłem. Otóż izomery geometryczne związków wpływają na światło spolaryzowane. Jeśli przez fiolkę ze związkiem przepuścimy światło spolaryzowane przy pomocy polaryzatora ustawionego w określonym kierunku, to po przejściu przez związek kierunek polaryzacji światła trochę się przekręci. Poznajemy to po tym, że ustawiając za fiolką drugi polaryzator widzimy że część światła z fiolki jest zatrzymywana i aby uzyskać pełną przepuszczalność, musimy drugi polaryzator trochę obrócić.
Obejrzyjcie świetną demonstrację tego zjawiska dla dwóch izomerów karwonu:
.
I teraz najważniejsze. Uznano, że jeśli płaszczyzna polaryzacji obróciła się w prawo, to mówimy o związku że jest prawoskrętny i przypisujemy mu znaczek plus (+) a jeśli w lewo to jest lewoskrętny i przypisujemy mu znaczek minus (-). Dwa izomery optyczne tej samej substancji skręcają światło spolaryzowane o taki sam kąt w przeciwne strony, dlatego zawsze jeden jest (+) a drugi (-). Ich mieszanina pół na pół jest nieaktywna bo przeciwne oddziaływania się znoszą.
Przy czym nie koniecznie znak skręcalności powiązany jest z konfiguracją R/S czy D/L. Wprawdzie dany określony izomer geometryczny ma zawsze dany określony znak skręcalności, ale różne związki o konfiguracji D czy R mogą skręcać światło spolaryzowane w różne strony. Na przykład D-glukoza jest prawoskrętna a D-fruktoza lewoskrętna.
A jaka jest witamina?
Kwas askorbinowy zawiera dwa węgle asymetryczne, w związku z czym możliwe są dla niego cztery izomery; kwas (R,S)-L-askorbinowy, (S,R)-D-askorbinowy; (S,S)-L-izoaskorbinowy i (R,R)-D-izoaskorbinowy
Aktywność biologiczną witaminy ma tylko jeden z nich, występujący naturalnie kwas (R,S) L-askorbinowy. Pozostałe nie mogą być nazywane witaminami, choć są podobnymi do niej przeciwutleniaczami..
A jak wygląda czynność optyczna? Otóż będący witaminą C naturalny kwas L-askorbinowy jest prawoskrętny. Czyli ma znaczek (+).
Zatem specjaliści od wciskania ludziom suplementów, którzy twierdzą, że witamina C powinna być lewoskrętna, pewnie pomylili się widząc znaczek L mówiący o względnej konfiguracji związku. Który to mówi nam jedynie, że jeśli zapiszemy cząsteczkę związku w określony sposób to grupa -OH na ostatnim węglu asymetrycznym będzie po lewej stronie rysunku, a to nie ma nic do skrętności.
...bo jak nie napisali L to na pewno jest D
Gdy świat alternatywnej medycyny pojął wreszcie istnienie dwóch odmian kwasu askorbinowego, zaczął przekonywać, że z pewnością absolutnie ta tabletkowa witamina, to jest właśnie ta nienaturalna D. Ze jeśli nie napiszą "kwas L-askorbinowy" to znaczy, że to musi być ten drugi. Ci którzy się na to nabierają zamawiają w hurtowniach wielkie wory kwasu L, nie ufając tabletkom, no bo przecież kto wie co sobie producenci napisali.
Dlaczego to bzdura?
Jak to już powyżej napisałem, kwas L-askorbinowy produkuje się z naturalnej glukozy otrzymując właściwą "naturalną" konfigurację. Wobec tego związek jest dosyć tani i dlatego bardziej opłaca się pchać go do tabletek, niż drugi izomer, produkowany w mniejszych ilościach przy pomocy innych, bardziej skomplikowanych metod. Kwas D-askorbinowy nie występuje w naturze a organizmy nie są przystosowane do jego wytwarzania, odpada więc bardzo ułatwiający produkcję mikrobiologiczny etap syntezy. Aby go otrzymać należałoby więc albo użyć drogich katalizatorów albo szeregu przemian dających mieszaninę izomerów, którą następnie należałoby rozdzielać. Ponieważ jednak izomer D nie jest wykorzystywany w medycynie, nikt go specjalnie nie produkuje. Czemu więc tabletki miałyby zawierać nie produkowany, znacznie droższy, nieaktywny izomer, gdy w zasięgu jest produkowany na dużą skalę aktywny L-izomer?
Inna kwestia to dozwolone nazewnictwo obu odmian. Nazwa handlowa "witamina C" oraz nazwa "kwas askorbinowy" są na mocy międzynarodowych przepisów zastrzeżone tylko dla kwasu L-(+)-askorbinowego, takiego jak naturalny. Producent nie może wsadzać w preparat inny stereoizomer i nazwać go witaminą. Ponieważ w świetle przepisów jest to w sumie jasne, producent tabletek nie musi pisać na opakowaniu, że tabletka zawiera kwas L-(+)-(4R,5S)-askorbinowy abyśmy byli pewni, że jest to taka cząsteczka jak naturalna, działająca biologicznie.
ps. 03.02 Dowiedziałem się, że w lutowym numerze Wiedzy i Życia także pojawił się artykuł o witaminie C. Jest dużo obszerniejszy i skupia się głównie na zastosowaniach medycznych ale o skrętności też wspomina. Polecam zajrzeć.
Subskrybuj:
Posty (Atom)