Jak uczono was w szkołach, ostatnia po prawej kolumna układu okresowego, to pierwiastki nazywane gazami szlachetnymi. Nazwa ta zaś wynika stąd, że nie tworzą one związków chemicznych z innymi pierwiastkami.
Tylko, że akurat to ostatnie, to nie do końca prawda.
Pierwsze gazy szlachetne odkryto w kosmosie.
Obserwując widmo korony słonecznej podczas zaćmienia w roku 1868 roku, chemicy Janssen i Lockyer zauważyli nietypową żółtą linię emisyjną, której nie dało się przyporządkować żadnym znanym wówczas pierwiastkom. Ponieważ już wówczas zdawano sobie sprawę, że każdy pierwiastek po pobudzeniu świeci światłem zawierającym inny zestaw linii, było oczywistym wnioskiem że ta obserwowana, odpowiada obecności nowego pierwiastka.
Od greckiej nazwy słońca ów kosmiczny pierwiastek nazwano Helium, ponieważ zaś nie odnaleziono go na ziemi, długi czas sądzono, że występuje tylko w gwiazdach. Było tak do czasu, gdy pewien geolog stwierdził jego obecność w gazach uwięzionych w zastygłej lawie wulkanicznej. Zaczęto więc sprawdzać pod tym kątem gazy uwalniane z różnych minerałów, aż 12 marca 1895 roku William Ramsay wydzielił go rozpuszczając w kwasie Clevelit - rudę uranu i pierwiastków ziem rzadkich.
Nieco wcześniej dokonano jednak innej zastanawiającej obserwacji - lord Cavendish zauważył pod koniec XVIII wieku, że azot otrzymany z powietrza zawiera niewielką ilość niereaktywnej substancji. Przeprowadzał amatorsko próby łączenia azotu z tlenem w obecności iskier elektrycznych, i po wyłapaniu powstających tlenków azotu w wodzie pozostała mu niewielka objętość gazu. W zasadzie przez długi czas nikt nie zwracał na to uwagi, dopóki postępy w wyznaczaniu masy atomowej pierwiastków nie ujawniły tajemniczej niezgodności - masa atomowa azotu otrzymanego drogą syntezy chemicznej była nieco niższa, niż azotu otrzymanego z powietrza, drogą usuwania kolejnych składników.
Zwykle produkcję azotu z powietrza przeprowadzano w ten sposób, iż najpierw przepuszczano powietrze nad rozżarzonymi opiłkami żelaza, które zabierało z niego Tlen, stanowiący piątą część objętości. Potem przeprowadzano pozostałość przez stężony roztwór zasady, aby wyłapać cały dwutlenek węgla. Na końcu gaz osuszano, otrzymując niereaktywną pozostałość, uznawaną za czysty azot.
Jeśli jednak azot z powietrza był cięższy od tego z minerałów, to wobec obserwacji Cavendisha nasuwał się dość oczywisty wniosek - azot z powietrza nie jest czysty, i zawiera domieszki równie niereaktywne jak on sam. Ramsay zaproponował dla tej substancji nazwę Argon, od greckiego argos, czyli leniwy. Należało go zatem wydzielić. W 1894 roku wraz z lordem Rayleygh'em przepuścił powietrze nad rozżarzoną miedzią, usuwając cały tlen. Pozostałość wpuścił do naczynia z płonącym magnezem. Magnez miał tak wysoką temperaturę ognia, że pochłaniał ślady tlenu, pary wodnej, dwutlenku węgla i wreszcie łączył się bezpośrednio z azotem atmosferycznym. Po przepuszczeniu kilka razy tej samej pozostałości otrzymał wreszcie gaz stanowiący 1% objętości powietrza, który nie reagował z magnezem a widmo światła po wzbudzeniu wyładowaniami elektrycznymi wykazywało oprócz śladów azotu obecność jeszcze nie opisanych, nowych linii emisyjnych. Był to zatem czysty argon. O rok późniejsze wykrycie helu w rudach uranu było związane z próbą znalezienia argonu w formie mineralnej.
Ramsay nie spoczął jednak na laurach - opisując nowy pierwiastek stwierdził, że ma właściwości podobne do Helu a w układzie okresowym należy umieścić go na prawo od wszystkich pozostałych, oraz że pod nim pojawia się wobec tego nowa kolumna, która dobrze pasuje do odstępu między ostatnią i pierwszą kolumną układu. Zatem prawdopodobnie musiały istnieć jeszcze inne pierwiastki, o podobnych właściwościach fizycznych, to jest będące niereaktywnymi gazami, i co wydawało się najbardziej prawdopodobne, występujące także w powietrzu, w śladowych ilościach.
Niedługo wcześniej polscy chemicy Karol Olszewski i Zygmunt Wróblewski dokonali skroplenia powietrza i innych gazów. Udało im się też skroplić i zestalić świeżo odkryty argon, który okazał się skraplać w temperaturze niższej niż azot. Nasuwało to na myśl pomysł, aby próbować wydzielić te pierwiastki przez destylację z powietrza.
Wraz z swym asystentem Morrisem Traversem zbudował w swej pracowni ogromną aparaturę do skraplania, uruchamiając ją na początku 1898 roku. Drugim równolegle prowadzonym eksperymentem było oczyszczane argonu otrzymanego drogą chemiczną, a więc najpierw pochłaniając tlen nad rozgrzaną miedzią a potem azot nad płonącym magnezem; po poddaniu tej procedurze 1930 litrów powietrza otrzymali 18 litrów argonu, co wydawało się rozsądną ilością.
W jednym z pierwszych doświadczeń ochładzali oni argon aż do skroplenia, stwierdzając że po wykropleniu 14 litrów pozostało im 50 mililitrów gazowej pozostałości. Badania spektralne wykazały pojawienie się w widmie linii emisyjnych, których nie obserwowano w innych pierwiastkach. Przy okazji zwrócono uwagę na intensywny, czerwono-pomarańczowy kolor światła wzbudzonego elektrycznością gazu.
Po wyznaczeniu masy i gęstości tej pozostałości w maju 1898 roku ogłosił wykrycie nowego pierwiastka, nazwanego neonem, był bowiem nowy. [1]
Równocześnie trwał dalej eksperyment ze skraplaniem powietrza. Po wykropleniu odpowiedniej ilości, powoli ogrzewano zbiornik, zbierając kilka frakcji zawierających tlen, azot i argon, Najcięższa frakcja zawierała gaz o charakterystycznym widmie, nazwany kryptonem od greckiego słowa "ukryty". Po zbadaniu jego właściwości zgłoszono jego odkrycie na początku czerwca 1898 roku
Po oczyszczeniu ostatniej frakcji badacze otrzymali jeszcze jeszcze jeden gaz, nazwany ksenonem, od greckiego słowa "obcy" lub "dziwny". Zgłoszenie odkrycia nastąpiło we wrześniu tego samego roku. Na sam koniec badacze stwierdzili jeszcze, że po oddzieleniu od ogromnej ilości ciekłego powietrza wszystkich poznanych gazów, otrzymali niewielką pozostałość, która okazała się być helem, potwierdzając tym samym jego obecność w powietrzu.[2]
Odkrycie trzech nowych pierwiastków w ciągu kilku miesięcy, odkrycie argonu stanowiącego 1% objętości powietrza i odkrycie na ziemi znanego z kosmosu helu, to całkiem niezłe osiągnięcie. Nic więc dziwnego że w 1904 roku William Ramsay zostaje uhonorowany Nagrodą Nobla. W późniejszym okresie włączył się też w badania "emanacji" czyli gazów powstających przy rozkładzie pierwiastków promieniotwórczych, wykazując iż gazy wydzielane przez uran, rad i tor zawierają ten sam gazowy pierwiastek, dziś znany jako radon.
Wszystkie helowce są gazami o niskiej temperaturze wrzenia, bezbarwnymi i pozbawionymi zapachu. Nie tworzą cząsteczek tak jak inne gazy, zaś bardzo słabe oddziaływania wzajemne atomów powodują, że właściwościami bardzo zbliżają się do gazu doskonałego. Hel jest drugim najlżejszym pierwiastkiem po wodorze, stąd wykorzystanie do napełniania balonów. Ma też najniższą temperaturę wrzenia wynoszącą 4 kelwiny, i pod normalnym ciśnieniem nie krzepnie przy dalszym ochładzaniu, zamiast tego przyjmując stan nadciekły, w którym zanika lepkość a pewne efekty kwantowe stają się zauważalne w dużej skali.
Na skalę przemysłową hel otrzymuje się z gazu ziemnego któremu towarzyszy; jednym z miejsc gdzie jest produkowany jest zakład przetwarzania gazu w Odolanowie.
Neon jest używany w lampach neonowych, dając intensywne, czerwone światło, bywa używany jako chłodziwo. Ma bardzo wąski zakres płynności - skrapla się przy 27 K a krzepnie przy 25 K.
Argon jest używany głównie do wytworzenia atmosfery obojętnej przy spawaniu i hutnictwie, w żarówkach i lampach iskrowych, a dzięki niskiej przewodności cieplnej także do gazowej izolacji na przykład w szczelnych oknach. Spośród wszystkich gazów szlachetnych jest najtańszy, otrzymuje się go z powierza.
Krypton jest często używany w oświetleniu - to nim najczęściej napełnia się neony, dające białe światło, którego kolor łatwo zmienić malując szklaną rurę.
Ksenon jest używany w lampach błyskowych dających jasne, białoniebieskie światło, ma też ciekawe zastosowania medyczne - jako środek do znieczulenia, a nawet środek dopingujący (w mieszance z tlenem wywołuje w organizmie reakcję podobną do tej wywołanej przebywaniem na dużej wysokości, stymulując zwiększoną produkcję czerwonych krwinek).
Radon jest szkodliwym, promieniotwórczym gazem zbierającym się w piwnicach i przedostającym się do wody, co już kiedyś opisałem.
I tak oto odkryto po kolei wszystkie helowce, przekonując się że są bardzo niereaktywne. Gdy zaś stworzono teorię powstawania wiązań, mówiącą między innymi, że atomy tworzą wiązania dążąc do oktetu elektronowego na ostatniej powłoce, dla wszystkich było jasne ze posiadające taki układ helowce nie mają po co wiązać się z innymi pierwiastkami. I chyba tylko tym przekonaniem można tłumaczyć brak badań w tym kierunku, oraz zaskoczenie, że jest to jednak możliwe.
W 1962 roku amerykański chemik Neil Bartlett zajmujący się chemią fluoru, przygotował sześciofluorek platyny, stabilny i lotny związek z platyną na +6 stopniu utlenienia, najwyższym możliwym i bardzo niestabilnym. Platyna w tym związku bardzo chętnie dąży do tego aby zredukować się do niższych stopni, a więc aby pobrać skądś elektron. Cząsteczka z której sześciofluorek zabrałby elektron, uległaby więc utlenieniu, dlatego sześciofluorek platyny jest mocnym utleniaczem.
O tym jak mocnym, Bartlett przekonał się badając czerwony osad zbierający się na dnie kolb z mieszaniną badanego związku i powietrza. Nie była to zredukowana forma związku, lecz sól w której sześciofluorek platyny stanowił anion, zaś kationem była cząsteczka tlenu, z której zabrano jeden elektron bez rozrywania wiązania. Tlen został utleniony.
Z badań jonizacji pod wpływem pola elektrycznego było wiadomo że utlenienie cząsteczki tlenu wymagało bardzo dużej energii 1175 kJ/mol, co wskazywało na siłę nowego utleniacza. Wyniki takich badań jonizacji były już znane i stabelaryzowane, toteż gdy Bartlett zaglądał do literatury aby znaleźć tą wartość, zauważył obok w tabeli pozycję o podobnej wartości. Energia jonizacji ksenonu wynosiła 1170 kJ/mol, a więc była nawet niższa niż dla cząsteczki tlenu. Jeśli reakcja z tlenem zachodziła tak łatwo - pomyślał badacz - to może mogłaby zajść z ksenonem? Oczywiście dobrze wiedział, że gazy szlachetne są szlachetne i związków nie tworzą, jeśli jednak udałoby się zjonizować ksenon, to mógłby mimo wszystko utworzyć jakieś połączenie.
Pożyczył od kolegów próbkę ksenonu i umieścił w butli szklanej. W drugiej umieścił gazowy sześcioplatynian i obie butle połączył rurką przedzieloną przesłoną. Gdy obie butle były napełnione, wyciągnął przesłonę, umożliwiając obu gazom mieszanie się. Jak sam potem opisywał, reakcja zachodziła "pięknie" - w pobliżu łączenia w ciągu kilkunastu sekund zaczął się zbierać żółty osad.
O ile sama reakcja zachodziła łatwo, to największą trudność sprawiło Bartlettowi przekonanie kolegów że otrzymał niemożliwy związek. Spotykał się z niedowierzaniem i podejrzeniem pomyłki, ponieważ jednak doświadczenie udawało się powtórzyć a z rozkładu krystalicznego związku powstawał ksenon, musiano uznać że związek gazu szlachetnego jest faktem. Gdy w czerwcu 1963 roku opublikował pracę na ten temat, inni chemicy ochoczo rzucili się na poszukiwanie innych takich związków, których dotychczas nie badano.
Już we wrześniu doniesiono o tworzeniu się czterofluorku ksenonu w mieszaninie obu gazów podgrzewanej do wysokich temperatur, w październiku wykryto jeszcze dwufluorek, który powstawał tak łatwo, iż reakcja zachodziła w suchej szklanej bańce z mieszanką gazów, po wystawieniu na słońce. Co ciekawsze, reakcję taką próbowano przeprowadzić 50 lat wcześniej, gdy szlachetność pierwiastka nie była jeszcze ugruntowana. Usiłowano wtedy zainicjować reakcję iskrą elektryczną, ale o wystawieniu na słońce nikt nie pomyślał i żadnej reakcji nie zaobserwowano.
Obecnie chemia ksenonu jest dość szeroka. W reakcji z tlenem w odpowiednich warunkach tworzy trójtlenek. Ten po rozpuszczeniu w wodzie daje kwas ksenonowy, którego sole stanowią bardzo silne utleniacze. Z kwasu można uzyskać czterotlenek ksenonu, nietypowy związek z ksenonem na +8 stopniu utlenienia, gdzie w tworzenie wiązań zaangażowane są wszystkie elektrony oktetu. Swoistą ironią wobec dawnych chemików jest jon czteroksenonozłota - połączenie dwóch pierwiastków nazywanych szlachetnymi z powodu niereaktywności.
Mniej obszerna jest chemia lżejszego gazu szlachetnego, kryptonu. Już w 1963 udało się zsyntetyzować dwufluorek poddając działaniu iskry elektrycznej mieszaninę gazów. Jest to bardzo silny utleniacz i środek fluoryzujący. Może tworzyć połączenia z azotem, ale mniej trwałe, na przykład HCN-Kr. Udało się też otrzymać czterofluorek, ale bardzo nietrwały, rozkładający się powyżej -70 st. C.
Dość mało poznana jest chemia radonu - wiadomo że w temperaturze pokojowej reaguje z fluorem, ulegając z czasem samorozkładowi pod wpływem własnego promieniowania. Ze względu na krótki czas półtrwania izotopów radonu i problemy wywołane przez jego promieniotwórczość nie zbadano dużej ilości połączeń - znane są większe fluorki, potwierdzono trójtlenek, podejrzewa się tworzenie kwasu radonowego. W sumie szkoda, bo może udałoby się stworzyć chemiczny pochłaniacz tego szkodliwego gazu.
Im bardziej w górę układu okresowego tym większa jest energia jonizacji gazów szlachetnych. Dla argonu udało się otrzymać tylko jeden związek, wodorofluorek, trwały poniżej 40 kelwinów. A pozostałe helowce? Dla Helu i Neonu związków jak na razie nie otrzymano. Znane są jedynie pewne jony, mające pewną trwałość w stanach wzbudzonych, lecz nie zaliczane formalnie do związków z powodu ładunku. Takim przypadkiem jest jon wodorku helu HeH+, możliwy do wytworzenia w próżni i stosunkowo trwały tylko w stanie wzbudzonym. Bardzo łatwo się rozpada, a jego skłonność do oddawania protonu jest tak duża, że formalnie rzecz biorąc stanowi najsilniejszy znany kwas z wyliczoną wartością pK=63. Efekty elektronowe uniemożliwiają tworzenie cząsteczek He2.
Jak właściwie jest z tymi gazami szlachetnymi - reguła oktetu nie działa skoro mogą tworzyć związki? Działa, ale nie jest jedyna. Wszystkie atomy tworząc połączenia dążą do stanu najbardziej stabilnego energetycznie. Jednym z tych stanów, najłatwiejszym do osiągnięcia, jest oktet elektronowy. Jeśli jednak atom zawierający oktet zostanie zjonizowany mocnym utleniaczem, będzie musiał dążyć do innego stanu.
Związki gazów szlachetnych należą w tym przypadku do grupy związków hiperwalencyjnych, to jest zawierających więcej elektronów niż orbitali. Na przykład w difluorku ksenonu uznaje się że wszystkie trzy atomy połączone są wspólnym wiązaniem trójcentrowym czteroelektronowym, w którym dwa elektrony są niewiążące a dwa wiążące. Taki układ ma niższą energię niż dwa wiązania kowalencyjne lub jonowe.
-----
[1] On the Companions of Argon. Proceedings of the Royal Society of London 63 (1): 437–440.
[2] William Ramsay , Morris W. Travers (1898). "On a New Constituent of Atmospheric Air". Proceedings of the Royal Society of London 63 (1): 405–408
*http://en.wikipedia.org/wiki/Noble_gas
*http://en.wikipedia.org/wiki/Noble_gas_compound
*http://en.wikipedia.org/wiki/Helium_hydride_ion
* http://www.acs.org/content/acs/en/education/whatischemistry/landmarks/bartlettnoblegases.html
* http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1904/ramsay-lecture.html
informacje
sobota, 30 sierpnia 2014
czwartek, 14 sierpnia 2014
Kiedyś w laboratorium (42.)
Dawno, dawno temu za wieloma latami, uczyłem się bioanalizy i jednym z ćwiczeń było identyfikowanie szczepów bakterii przy pomocy szeregu podłóż różnicujących. Szereg w całości omówię kiedy indziej, natomiast teraz na szybko opowiem o jednym podłożu - agarze TSI czyli trójcukrowy żelazowy.
Jest to podłoże produkowane w formie słupkoskosu - próbówka w części napełniona w całym przekroju, jest to tzw. "słupek", a w części napełniona ukośnie:
Podłoże zawiera barwnik czerwień fenolową, siarczan żelaza, tiosiarczan sodu oraz cukry: laktozę, glukozę i sacharozę. Rozróżnianie bakterii opiera się na strasznie prostej zasadzie - czy bakteria metabolizuje cukry i które i czy przerabia tiosiarczany na siarczki.
Metabolizowanie cukrów powoduje powstanie kwaśnych metabolitów, pod wpływem których czerwień fenolowa robi się żółta. jeśli bakteria fermentuje glukozę, podłoże początkowo będzie żółte, lecz ulatnianie kwaśnych produktów ze skosu spowoduje, że będzie on czerwony a słupek zółty. Metabolizowanie laktozy daje żółte zabarwienie obu części
Jeśli bakteria metabolizuje tiosiarczan do siarkowodoru, zareaguje on z żelazem, dając czarny osad siarczku żelaza. W przypadku badanego szczepu wynik był następujący:
Zmieniona barwa słupka - zatem bakteria metabolizująca glukozę, zapewne enterobakteria. Czarny pierścień - zatem metabolizuje tiosiarczany. W tym przypadku była to salmonella, być może serotypu Typhi, już nie pamiętam.
A teraz na parę dni wyjeżdżam na zlot astronomiczny. Życzcie mi dobrej pogody.
Jest to podłoże produkowane w formie słupkoskosu - próbówka w części napełniona w całym przekroju, jest to tzw. "słupek", a w części napełniona ukośnie:
Podłoże zawiera barwnik czerwień fenolową, siarczan żelaza, tiosiarczan sodu oraz cukry: laktozę, glukozę i sacharozę. Rozróżnianie bakterii opiera się na strasznie prostej zasadzie - czy bakteria metabolizuje cukry i które i czy przerabia tiosiarczany na siarczki.
Metabolizowanie cukrów powoduje powstanie kwaśnych metabolitów, pod wpływem których czerwień fenolowa robi się żółta. jeśli bakteria fermentuje glukozę, podłoże początkowo będzie żółte, lecz ulatnianie kwaśnych produktów ze skosu spowoduje, że będzie on czerwony a słupek zółty. Metabolizowanie laktozy daje żółte zabarwienie obu części
Jeśli bakteria metabolizuje tiosiarczan do siarkowodoru, zareaguje on z żelazem, dając czarny osad siarczku żelaza. W przypadku badanego szczepu wynik był następujący:
Zmieniona barwa słupka - zatem bakteria metabolizująca glukozę, zapewne enterobakteria. Czarny pierścień - zatem metabolizuje tiosiarczany. W tym przypadku była to salmonella, być może serotypu Typhi, już nie pamiętam.
A teraz na parę dni wyjeżdżam na zlot astronomiczny. Życzcie mi dobrej pogody.
czwartek, 7 sierpnia 2014
Kwas co ma gaz
W letnie, upalne dni, najchętniej nic byśmy nie robili, tylko leżeli w cieniu i popijali coś chłodnego. Na przykład wodę. Taką gazowaną, z bąbelkami i szczypiącym, kwaśnym posmaku. I być może czasem zastanowi nas, jaki to gaz i jaki kwas...
Dwutlenek węgla jest bezbarwnym i w zasadzie bezwonnym gazem cięższym od powietrza, stanowiącym stale niewielki procent składu atmosfery. Został odkryty dosyć wcześnie - już w XVII wieku van Helmont zauważył, że jeśli masa popiołu po spaleniu węgla jest znacząco mniejsza od pierwotnej masy, to reszta musi ulegać zamianie w formę gazową. Ówcześni identyfikowali go z flogistonem - pierwiastkiem palności - i dalej się tą sprawą nie zajmowano. Dopiero w 1750 roku szkocki lekarz Joseph Black, znany też z badań nad ciepłem utajonym, poddał badaniom gaz powstający z potraktowania wapienia kwasem, stwierdzając, że jest różny od powietrza, ciężki i duszący, oraz że wytrąca osad z roztworu wapna gaszonego. Korzystając z tej ostatniej reakcji, stwierdził że występuje normalnie w powietrzu i w większych ilościach w tchnieniu zwierząt i ludzi. Późniejsi badacze doszli do tego, że gaz jest połączeniem tlenu i węgla i że reakcję czasem można odwrócić (przy spalaniu magnezu w dwutlenku węgla powstaje sadza), jednak dla nas istotniejsze jest odkrycie Josepha Priestly'a, trochę teologa a trochę przyrodnika-hobbysty, który badając przebieg fermentacji w miejscowym browarze, zainteresował się "zastałym powietrzem" - warstwą gazową nad fermentującą kadzią, uważaną za pracowników za niezdrową i od której zdychały myszy jeśli dostały się pod jej wpływ.
Eksperymentując, umieścił nad kadzią miskę z wodą, chcąc sprawdzić rozpuszczalność tego gazu. Po zlaniu musującego roztworu stwierdził, że woda nabrała przyjemnego, lekko kwaśnego posmaku, a nawet dał go spróbować znajomym, twierdząc że to orzeźwiający napój bez alkoholu. Kilka lat później opisał go w artykule, dodając przepis na sztuczne otrzymanie - po zwilżeniu kredy kwasem siarkowym, powstający gaz przeprowadzał rurką do wody i po przepuszczeniu większej ilości otrzymywał napój, który uważał za bardzo podobny do naturalnych wód mineralnych i polecał na szkorbut. W zasadzie jednak nie traktował odkrycia inaczej jak ciekawostki i nie sądził, że znajdzie zastosowanie. Tymczasem producenci wód mineralnych powinni mu postawić pomnik - odkrycie, że zwykła woda staje się smacznym napojem po rozpuszczeniu w niej pospolitego gazu, do dziś przynosi im ogromne zyski.
Pierwszym, który wpadł na to, że jest to znakomity pomysł na interes, był niejako Jacob Schweppe, który w roku 1783 założył firmę Schweppes, istniejącą zresztą do dziś, produkując wody gazowane mające naśladować wody mineralne z naturalnych źródeł. Nieco później dla polepszenia smaku, do nagazowanej wody zaczęto dodawać nieco sody oczyszczonej, tworząc napój nazywany odtąd wodą sodową. I tak zaczął się przemysł napojów gazowanych.
Szybko jednak chemicy zaczęli się zastanawiać, dlaczego po rozpuszczeniu gazu, woda staje się kwaśna. Musi powstawać jakiś kwas - uznali - i nazwali go kwasem węglowym. W polskiej nomenklaturze dwutlenek węgla zaczął być z tego powodu nazywany niedokwasem węglowym. Taki też stan rzeczy trwał przez długi czas, aż zaczęły się problemy z wyizolowaniem czy choćby wykryciem tego kwasu w wodzie. Badania absorpcji w podczerwieni nie wykryły aby występował w choćby najbardziej nasyconych roztworach. W zamian za to wykrywano jony węglanowe i wodorowęglanowe, stąd też powstała koncepcja wedle której kwas węglowy nie istnieje. Jeszcze ja w technikum byłem upominany aby nie zapisywać jego cząsteczki w równaniu rozpuszczania dwutlenku węgla.
Jest to w pewnym stopniu podobna sytuacja jak z "wodorotlenkiem amonu". Rozpuszczenie amoniaku w wodzie da nam roztwór o zasadowym odczynie, toteż postulowano powstawanie w wodzie wodorotlenku amonu i przez długi czas zapisywano go w ten sposób. Dopiero potem dokładne badania wykazały, że cząsteczka taka nie powstaje - woda wymienia się protonem z amoniakiem, i tworzy się osobny jon wodorotlenkowy i osobny amonowy pozostające w równowadze. Wydawało się zatem, że tu jest podobnie - dwutlenek łączy się z wodą biorąc tlen i wodór do utworzenia jonu wodorowęglanowego, a pozostawiając wolny kation wodorowy; wodorowęglan dysocjuje dalej do anionu węglanowego, zaś kwas węglowy się nie tworzy. I wszystko było w porządku aż nie odkryto, że pogłoski o jego śmierci są mocno przesadzone.
Aby otrzymać czysty i stabilny kwas węglowy, należało zastosować dość specyficzne warunki - mieszaninę wody i dwutlenku węgla zamrożono i umieszczono pod niskim ciśnieniem, po czym napromieniowano - promieniowanie pozwoliło na połączenie dwóch różnych cząsteczek bez ogrzewania. Następnie zastosowano sublimację wody pod niskim ciśnieniem, otrzymując czysty, suchy związek.
Jak się okazało, bezwodny kwas węglowy jest dosyć trwały - obliczenia teoretyczne pokazały że czas połowicznego rozkładu to ponad sto tysięcy lat, ale śladowe ilości wody przyśpieszają ten rozkład gwałtownie, nawet milion razy[1].
Udało się także otrzymać gazowy kwas węglowy, trwały do temperatury -30 stopni, który w takiej fazie chętnie tworzy trwalszy dimer[2]
Skoro kwas ten istnieje, to jak jest z jego obecnością w wodzie mineralnej?
Gdy tylko zaczynamy nasycać wodę dwutlenkiem węgla, zaczyna on być hydratowany. W takiej formie każda cząsteczka tlenku zostaje otoczona cząsteczkami wody, lecz nie następuje pomiędzy nimi reakcja. Ilość rozpuszczającego się w ten sposób gazu zależy od ciśnienia - im wyższe, tym lepsza rozpuszczalność. W takiej formie występuje około 99% rozpuszczonego w wodzie związku.
Część jednak reaguje z wodą dając jako produkt przejściowy kwas węglowy:
Jon wodorowęglanowy może ulegać dalszej dysocjacji, rozpadając się na jon węglanowy:
Wszystkie te procesy są procesami równowagowymi, toteż zachodzą równocześnie w obie strony, choć z różną szybkością, a obserwowany stan jest wypadkową różnie szybkich równoczesnych reakcji. Można to porównać do szeregu naczyń do których woda może wpływać i wypływać, aż zależnie od szybkości wypływu i dopływu stabilizuje się na pewnym poziomie.
Gdy zaczniemy wprowadzać dwutlenek węgla do wody, będzie to czynił niechętnie, jednak gdy się rozpuści większość będzie występować w formie zhydratowanej. Z tej ilości pewna część będzie zamieniać się w kwas węglowy. Ten ma dwie możliwe drogi rozpadu - albo zamieni się z powrotem w dwutlenek węgla, co czyni chętnie, albo w wodorowęglan, co czyni równie szybko. To że w ogóle występuje w roztworze jest wynikiem tego, że wszystkie procesy są pewnymi równowagami odwracalnych reakcji - większe ciśnienie gazu naprodukuje więcej kwasu węglowego który natychmiast rozpada się w wodorowęglan; obniżenie ciśnienia powoduje rozpad obecnego kwasu węglowego ale jest on odtwarzany z wodorowęglanów.
Pod ciśnieniem atmosferycznym w wodzie pozostającej w kontakcie z dwutlenkiem węgla, może się rozpuścić ok. 0,1 mmol, z czego 1% przechodzi w wodorowęglan a 0,01% w kwas węglowy. Jonów węglanowych powstają niewykrywalne ilości. Roztwór taki ma pH=5,6 zatem jest lekko kwaskowaty. Pod ciśnieniem ok. 1-2 atmosfer, jakie to ciśnienia są stosowane w butelkowanej wodzie mineralnej, rozpuszcza się 8,5 mmol gazu, z czego 1% ma postać wodorowęglanu i niemal tyle samo formę kwasu węglowego. Roztwór taki ma pH =3,5 a więc podobne do soku pomarańczowego.
Co więc z tego wynika ostatecznie? Większość rozpuszczonego dwutlenku węgla występuje w wodzie w formie zhydratowanej obojętnej cząsteczki, a z pozostałej części większość w formie wodorowęglanów. A kwas? Występuje ale jako dynamiczna faza przejściowa - nieustannie tworzy się i rozpada istniejąc w ilościach tak niewielkich, że nieistotnych dla określenia kwasowości i trudnych do wykrycia. Ale jest.
------
* http://en.wikipedia.org/wiki/Carbonic_acid
* http://de.wikipedia.org/wiki/Kohlens%C3%A4ure
* http://en.wikipedia.org/wiki/Carbonated_water
* http://en.wikipedia.org/wiki/Joseph_Priestley
[1] Thomas Loerting, Christofer Tautermann, Romano T. Kroemer, Ingrid Kohl , Andreas Hallbrucker , Erwin Mayer. and Klaus R. Liedl, On the Surprising Kinetic Stability of Carbonic Acid (H2CO3), Angewandte Chemie International Edition Volume 39, Issue 5, pages 891–894, March 3, 2000
Dwutlenek węgla jest bezbarwnym i w zasadzie bezwonnym gazem cięższym od powietrza, stanowiącym stale niewielki procent składu atmosfery. Został odkryty dosyć wcześnie - już w XVII wieku van Helmont zauważył, że jeśli masa popiołu po spaleniu węgla jest znacząco mniejsza od pierwotnej masy, to reszta musi ulegać zamianie w formę gazową. Ówcześni identyfikowali go z flogistonem - pierwiastkiem palności - i dalej się tą sprawą nie zajmowano. Dopiero w 1750 roku szkocki lekarz Joseph Black, znany też z badań nad ciepłem utajonym, poddał badaniom gaz powstający z potraktowania wapienia kwasem, stwierdzając, że jest różny od powietrza, ciężki i duszący, oraz że wytrąca osad z roztworu wapna gaszonego. Korzystając z tej ostatniej reakcji, stwierdził że występuje normalnie w powietrzu i w większych ilościach w tchnieniu zwierząt i ludzi. Późniejsi badacze doszli do tego, że gaz jest połączeniem tlenu i węgla i że reakcję czasem można odwrócić (przy spalaniu magnezu w dwutlenku węgla powstaje sadza), jednak dla nas istotniejsze jest odkrycie Josepha Priestly'a, trochę teologa a trochę przyrodnika-hobbysty, który badając przebieg fermentacji w miejscowym browarze, zainteresował się "zastałym powietrzem" - warstwą gazową nad fermentującą kadzią, uważaną za pracowników za niezdrową i od której zdychały myszy jeśli dostały się pod jej wpływ.
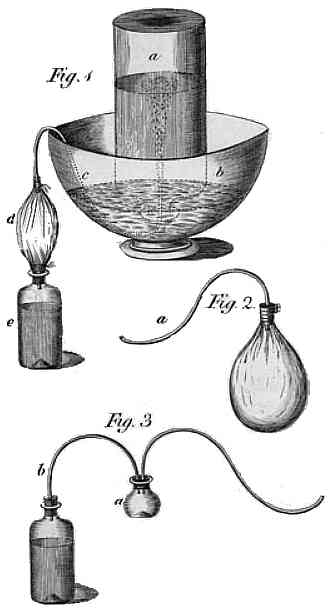
Wytwarzanie wody sodowej - rysunek Priestley'a z 1772 roku
Eksperymentując, umieścił nad kadzią miskę z wodą, chcąc sprawdzić rozpuszczalność tego gazu. Po zlaniu musującego roztworu stwierdził, że woda nabrała przyjemnego, lekko kwaśnego posmaku, a nawet dał go spróbować znajomym, twierdząc że to orzeźwiający napój bez alkoholu. Kilka lat później opisał go w artykule, dodając przepis na sztuczne otrzymanie - po zwilżeniu kredy kwasem siarkowym, powstający gaz przeprowadzał rurką do wody i po przepuszczeniu większej ilości otrzymywał napój, który uważał za bardzo podobny do naturalnych wód mineralnych i polecał na szkorbut. W zasadzie jednak nie traktował odkrycia inaczej jak ciekawostki i nie sądził, że znajdzie zastosowanie. Tymczasem producenci wód mineralnych powinni mu postawić pomnik - odkrycie, że zwykła woda staje się smacznym napojem po rozpuszczeniu w niej pospolitego gazu, do dziś przynosi im ogromne zyski.
Pierwszym, który wpadł na to, że jest to znakomity pomysł na interes, był niejako Jacob Schweppe, który w roku 1783 założył firmę Schweppes, istniejącą zresztą do dziś, produkując wody gazowane mające naśladować wody mineralne z naturalnych źródeł. Nieco później dla polepszenia smaku, do nagazowanej wody zaczęto dodawać nieco sody oczyszczonej, tworząc napój nazywany odtąd wodą sodową. I tak zaczął się przemysł napojów gazowanych.
Szybko jednak chemicy zaczęli się zastanawiać, dlaczego po rozpuszczeniu gazu, woda staje się kwaśna. Musi powstawać jakiś kwas - uznali - i nazwali go kwasem węglowym. W polskiej nomenklaturze dwutlenek węgla zaczął być z tego powodu nazywany niedokwasem węglowym. Taki też stan rzeczy trwał przez długi czas, aż zaczęły się problemy z wyizolowaniem czy choćby wykryciem tego kwasu w wodzie. Badania absorpcji w podczerwieni nie wykryły aby występował w choćby najbardziej nasyconych roztworach. W zamian za to wykrywano jony węglanowe i wodorowęglanowe, stąd też powstała koncepcja wedle której kwas węglowy nie istnieje. Jeszcze ja w technikum byłem upominany aby nie zapisywać jego cząsteczki w równaniu rozpuszczania dwutlenku węgla.
Jest to w pewnym stopniu podobna sytuacja jak z "wodorotlenkiem amonu". Rozpuszczenie amoniaku w wodzie da nam roztwór o zasadowym odczynie, toteż postulowano powstawanie w wodzie wodorotlenku amonu i przez długi czas zapisywano go w ten sposób. Dopiero potem dokładne badania wykazały, że cząsteczka taka nie powstaje - woda wymienia się protonem z amoniakiem, i tworzy się osobny jon wodorotlenkowy i osobny amonowy pozostające w równowadze. Wydawało się zatem, że tu jest podobnie - dwutlenek łączy się z wodą biorąc tlen i wodór do utworzenia jonu wodorowęglanowego, a pozostawiając wolny kation wodorowy; wodorowęglan dysocjuje dalej do anionu węglanowego, zaś kwas węglowy się nie tworzy. I wszystko było w porządku aż nie odkryto, że pogłoski o jego śmierci są mocno przesadzone.
Aby otrzymać czysty i stabilny kwas węglowy, należało zastosować dość specyficzne warunki - mieszaninę wody i dwutlenku węgla zamrożono i umieszczono pod niskim ciśnieniem, po czym napromieniowano - promieniowanie pozwoliło na połączenie dwóch różnych cząsteczek bez ogrzewania. Następnie zastosowano sublimację wody pod niskim ciśnieniem, otrzymując czysty, suchy związek.
Jak się okazało, bezwodny kwas węglowy jest dosyć trwały - obliczenia teoretyczne pokazały że czas połowicznego rozkładu to ponad sto tysięcy lat, ale śladowe ilości wody przyśpieszają ten rozkład gwałtownie, nawet milion razy[1].
Udało się także otrzymać gazowy kwas węglowy, trwały do temperatury -30 stopni, który w takiej fazie chętnie tworzy trwalszy dimer[2]
Skoro kwas ten istnieje, to jak jest z jego obecnością w wodzie mineralnej?
Gdy tylko zaczynamy nasycać wodę dwutlenkiem węgla, zaczyna on być hydratowany. W takiej formie każda cząsteczka tlenku zostaje otoczona cząsteczkami wody, lecz nie następuje pomiędzy nimi reakcja. Ilość rozpuszczającego się w ten sposób gazu zależy od ciśnienia - im wyższe, tym lepsza rozpuszczalność. W takiej formie występuje około 99% rozpuszczonego w wodzie związku.
Część jednak reaguje z wodą dając jako produkt przejściowy kwas węglowy:
CO2 + H2O → H2CO3
Jak wykazały badania, związek ten bardzo szybko i łatwo odszczepia jeden proton, przechodząc w jon wodorowęglanowy. Stała równowagi pokazuje, że kwas ten jest nawet mocniejszy od cytrynowego. Silne przesunięcie równowagi w stronę wodorowęglanów powoduje jednak, że niemal natychmiast prawie cały powstający kwas węglowy zamienia się w tą formę:
H2CO3  HCO3− + H+
HCO3− + H+
Jon wodorowęglanowy może ulegać dalszej dysocjacji, rozpadając się na jon węglanowy:
HCO3−  CO32− + H+
CO32− + H+
Jednak reakcja ta następuje powoli, i zaczyna nabierać znaczenia w warunkach silnie zasadowych.Wszystkie te procesy są procesami równowagowymi, toteż zachodzą równocześnie w obie strony, choć z różną szybkością, a obserwowany stan jest wypadkową różnie szybkich równoczesnych reakcji. Można to porównać do szeregu naczyń do których woda może wpływać i wypływać, aż zależnie od szybkości wypływu i dopływu stabilizuje się na pewnym poziomie.
Gdy zaczniemy wprowadzać dwutlenek węgla do wody, będzie to czynił niechętnie, jednak gdy się rozpuści większość będzie występować w formie zhydratowanej. Z tej ilości pewna część będzie zamieniać się w kwas węglowy. Ten ma dwie możliwe drogi rozpadu - albo zamieni się z powrotem w dwutlenek węgla, co czyni chętnie, albo w wodorowęglan, co czyni równie szybko. To że w ogóle występuje w roztworze jest wynikiem tego, że wszystkie procesy są pewnymi równowagami odwracalnych reakcji - większe ciśnienie gazu naprodukuje więcej kwasu węglowego który natychmiast rozpada się w wodorowęglan; obniżenie ciśnienia powoduje rozpad obecnego kwasu węglowego ale jest on odtwarzany z wodorowęglanów.
Pod ciśnieniem atmosferycznym w wodzie pozostającej w kontakcie z dwutlenkiem węgla, może się rozpuścić ok. 0,1 mmol, z czego 1% przechodzi w wodorowęglan a 0,01% w kwas węglowy. Jonów węglanowych powstają niewykrywalne ilości. Roztwór taki ma pH=5,6 zatem jest lekko kwaskowaty. Pod ciśnieniem ok. 1-2 atmosfer, jakie to ciśnienia są stosowane w butelkowanej wodzie mineralnej, rozpuszcza się 8,5 mmol gazu, z czego 1% ma postać wodorowęglanu i niemal tyle samo formę kwasu węglowego. Roztwór taki ma pH =3,5 a więc podobne do soku pomarańczowego.
Co więc z tego wynika ostatecznie? Większość rozpuszczonego dwutlenku węgla występuje w wodzie w formie zhydratowanej obojętnej cząsteczki, a z pozostałej części większość w formie wodorowęglanów. A kwas? Występuje ale jako dynamiczna faza przejściowa - nieustannie tworzy się i rozpada istniejąc w ilościach tak niewielkich, że nieistotnych dla określenia kwasowości i trudnych do wykrycia. Ale jest.
------
* http://en.wikipedia.org/wiki/Carbonic_acid
* http://de.wikipedia.org/wiki/Kohlens%C3%A4ure
* http://en.wikipedia.org/wiki/Carbonated_water
* http://en.wikipedia.org/wiki/Joseph_Priestley
[1] Thomas Loerting, Christofer Tautermann, Romano T. Kroemer, Ingrid Kohl , Andreas Hallbrucker , Erwin Mayer. and Klaus R. Liedl, On the Surprising Kinetic Stability of Carbonic Acid (H2CO3), Angewandte Chemie International Edition Volume 39, Issue 5, pages 891–894, March 3, 2000
[2] Hinrich Grothe et al., Spectroscopic Observation of Matrix-Isolated Carbonic Acid Trapped from the Gas Phase, Angewandte Chemie International Edition Volume 50, Issue 8, pages 1939–1943, February 18, 2011
niedziela, 27 lipca 2014
Poison Story (6.) - Co za dużo, to nie zdrowo
Gdy w 2007 roku stacja radiowa KDND ogłosiła konkurs, w którym do wygrania była najnowsza konsola wideo, zgłosiło się wielu chętnych. Konsola Wii była bardzo popularna, ale najnowszego modelu, kosztującego 250 dolarów, praktycznie nie dało się kupić w amerykańskich sklepach, dlatego możliwość wygrania jej w śmiesznym konkursie była bardzo kusząca. Zgłosiło się kilkanaście osób, w tym 28-letnia Jennifer Strange, matka trójki dzieci, która jak mówiła przed konkursem, chce zdobyć tą konsolę dla nich.
Konkurs "Hold Your Wee of a Wii" był bardzo prosty - wygrywał ten, kto wypije jak najwięcej wody i się nie posika. W innych podobnych konkursach dawano zadania w rodzaju zjedzenia jak największej ilości pączków czy hamburgerów, więc to wydawało się prostym zadaniem. Przygotowano każdemu uczestnikowi małe, ćwierćlitrowe buteleczki wody. Mieli pić po jednej w odstępie dziesięciu minut oraz w każdej chwili mogli zrezygnować, jeśli uznali, że to dla nich zbyt dużo, ale nie mogli wychodzić do łazienki.
Konkurs rozpoczęto nad ranem, nadając relację na antenie. Było wesoło, a kolejne butelki znikały w szybkim tempie. Ktoś się wykruszył po pięciu, ktoś po ośmiu.
W trakcie trwania konkursu, do radia zadzwoniła pielęgniarka, stwierdzając że jego idea jest oburzająca i niebezpieczna, bo ktoś może umrzeć. Prezenter odpowiedział że wiedzą ale wszystko jest pod kontrolą, zresztą uczestnicy podpisali dokument że zgadzają się na ryzyko, więc nie ma się co czepiać. Gdy kolejny słuchacz zaniepokojony konkursem zadzwonił z ostrzeżeniem, rozbawiony prezenter wyjrzał na salę i zawołał "Czy ktoś tam może umiera?". Prezenter wyjaśnił też że ciało składa się w 90% z wody, więc można jej pić ile się chce.
Gdy minęła pierwsza godzina, uczestnikom dano większe, półlitrowe butelki. To wtedy zrezygnowało najwięcej osób. Niektórzy źle się czuli, ktoś zwymiotował do wiadra, ktoś inny stwierdził że jest mu zimno i zaczął drżeć. Jednak dwie zawodniczki okazały się bardzo wytrwałe. Jennifer wypiła już osiem małych butelek i dziesięć większych, łącznie mieszcząc w sobie ponad sześć litrów wody, gdy stwierdziła że brzuch już ją boli, i głowa. Zrezygnowała zajmując drugie miejsce i otrzymując w nagrodę bilety na koncert. Przebiła ją kobieta, która wypiła o pół butelki więcej.
Gdy konkurs się już skończył, DJ zażartował, że brzuch Jennifer wygląda jakby była w ciąży. Przed wręczeniem nagród zawodniczki poszły do łazienki gdzie wysikały się i zwymiotowały. Następnie gorąco je pożegnano i odesłano do domu. Po drodze Jennifer zadzwoniła do współpracownika aby opowiedzieć o konkursie. Skarżyła się wtedy na silny ból głowy. W domu ból głowy się nasilił. Do objawów doszły zapewne też nudności i osłabienie. Po południu zaniepokojona matka odnajduje ją martwą.
Wynik autopsji zaskoczył wszystkich - Jennifer Strange zmarła z powodu zatrucia wodą.
Setki lat temu, pewien przemądrzały lekarz nazywany Paracelsusem, stwierdził paradoksalnie, że wszystko jest trucizną i nie jest nią. Działanie zależy od dawki a w pewnym stopniu też sposobu podania. Wynika stąd wiosek, że o żadnej substancji nie można powiedzieć, że nie jest trująca, można je tylko dzielić na trujące silnie, słabo i bardzo niewiele, co odpowiada wielkości dawki wywołującej negatywne objawy. Niejednokrotnie substancja wywołująca szkodliwe skutki w dużych dawkach, w małych może wykazać własności lecznicze.
Toksyczność substancji określa się zwykle przy pomocy miary LD 50 - jest to dawka w gramach na kilogram masy ciała wywołująca 50% prawdopodobieństwo śmierci, co zwykle wyznacza się badając śmiertelność szczurów lub innych zwierząt. Pewne znaczenie ma też droga podania, substancje mogą wykazywać niską toksyczność podane doustnie a wysoką podane inhalacyjnie, przykładem metaliczna rtęć, która połknięta bardzo trudno się wchłania, natomiast bardzo szkodliwa jest wdychana w postaci par.
W niektórych przypadkach dawka śmiertelna może być skrajnie niska - dla jadu kiełbasianego podaje się dawki rzędu nanogramów, dla cyjanku potasu to ok. 5 mg/kg, a dla siarczanu miedzi to ok. 5 g/kg przez co jego przedawkowanie jest na prawdę trudne.
A woda? Prawdopodobnie jest jedną z najmniej toksycznych substancji, jakich właściwości przebadano, jej dawka śmiertelna to około 90g/kg. Nawet glukoza jest bardziej toksyczna.
Oznacza to że dla dorosłego ważącego 70 kg niebezpieczna jest dawka ok. 6 litrów, ale oczywiście wszystko zależy od sposobu i szybkości podawania.
Ale właściwie dlaczego woda może być niebezpieczna?
Jednym z warunków utrzymania przez nasz organizm homeostazy, jest równowaga między zawartością wody w komórkach i w przestrzeniach między nimi. Stężenie soli mineralnych w osoczu i w płynie wewnątrzkomórkowym musi mieścić się w określonych granicach, przy czym najważniejszą z tych soli jest chlorek sodu, a więc sól kuchenna.
Ogólne prawa fizyki mówią, że przy różnicy stężeń po dwóch stronach półprzepuszczalnej błony, rozpuszczalnik ma skłonność do migracji w miejsce o większym stężeniu. Po prostu po stronie z roztworem bardziej rozcieńczonym cząstki rozpuszczalnika częściej uderzają w błonę i mogą przez nią przeniknąć, niż od strony roztworu bardziej stężonego. To przenikanie trwa tak długo aż nie zahamuje go wytworzone ciśnienie, nazywane osmotycznym, mogące osiągać gigantyczne wartości. To dlatego wiśnie i miękkie owoce zamoczone w wodzie nabrzmiewają i pękają - zwykła woda ma mniejsze stężenie rozpuszczonych substancji niż sok w komórkach owoców, i wnika do wiśni zwiększając ciśnienie.
Wewnątrz organizmu stężenie soli w osoczu i w komórkach jest na różne sposoby regulowane. Najważniejszym mechanizmem jest wydalanie wody i soli mineralnych przez nerki, które z kolei jest regulowane wydzielaniem hormonów, znaczenie ma też transport jonów do i z wnętrza komórek. W normalnej sytuacji gdy wypijemy większą ilość wody, nerki zaczynają wydzielać większą ilość moczu, tak aby zachować równowagę, a sole mineralne w organizmie nieco się rozcieńczają.
Problem może pojawić się gdy ilość wypitej wody przekroczy zdolność wydalniczą nerek, a więc będzie większa niż ok. 1 litr na godzinę, lub też gdy nerki zmniejszą wydzielanie moczu. Osocze krwi się wówczas rozcieńcza a poziom sodu zaczyna opadać poniżej normalnego stężenia, co prowadzi do hiponatremii.
Spadek stężenia soli w osoczu powoduje wzmożone wchłanianie wody do tkanek, człowiek staje się więc obrzęknięty i ociężały. W przypadku większości tkanek mają one pewną swobodę miejsca, mogąc nabrzmiewać bez uszkodzeń. Mózg zamknięty wewnątrz sztywnej czaszki nie ma tak łatwo.
Przy silnej i szybkiej hiponatremii, następuje obrzęk mózgu, a wzrost ciśnienia wewnątrz czaszkowego wywołuje objawy neurologiczne - dreszcze, silne bóle głowy, wymioty, osłabienie, drgawki, zaburzenia oddychania i śpiączkę. Ostatecznie opuchnięcie pnia mózgu wywołuje porażenie ośrodka oddechowego i zatrzymanie oddechu.
Najszybszym sposobem leczenia jest podanie soli mineralnych, tak aby zwiększyć ich stężenie we krwi, oraz podawanie diuretyków zwiększających wydalanie wody.
Zatrucie wodne jest przypadkiem bardzo rzadkim, i najczęściej jest związane z przymusem lub zaburzeniami psychicznymi. W chorobach takich jak schizofrenia nadmierne pragnienie jest dosyć częste - hiponatremia z przewodnienia występuje nawet u 5% leczonych w szpitalach psychiatrycznych, stanowiąc przyczynę do 20% zgonów[1]. Innym przypadkiem są zaburzenia elektrolitowe podczas intensywnego wysiłku - ciało wydala sole mineralne wraz z potem, wypijanie w trakcie płynów nieizotonicznych, czyli mających zbyt mało soli, może doprowadzić do hiponatremii. W dodatku w warunkach dużego zmęczenia, organizm hamuje wydzielanie moczu przez nerki. Stan taki obserwuje się u około 10-15% maratończyków po zakończeniu biegu, i niekiedy może on przybrać niebezpieczne natężenie.
Kilka lat temu z tego powodu zmarł uczestnik maratonu w Londynie.[2] Wiadomość o tym wywołała duże zaskoczenie u biegaczy, którzy dotychczas bardziej obawiali się odwodnienia.
Innym znanym przypadkiem była śmierć rekruta podczas ćwiczeń wytrzymałościowych Sił Powietrznych w 1999 roku, gdzie przyczyną było połączenie udaru cieplnego i przewodnienia.
Niebezpieczne rozcieńczenie płynów może też nastąpić w wyniku tortur lub napojenia wymuszonego. Zanotowano już kilka przypadku śmierci dzieci, które opiekunowie w ramach kary zmusili do wypicia 1-2 litrów wody. W USA głośną sprawą była śmierć Matthewa Carringtona, który w ramach swoistych otrzęsin będących testem wstępnym do studenckiego bractwa Tau Chi był zmuszony do wypicia dużych ilości wody. Jeszcze inną okazją do przewodnienia może być nieprzemyślana dieta lub źle zaplanowane "oczyszczanie organizmu".
Od dawna po świecie krąży mit, iż każdego dnia należy pić 2 litry wody. Tak na prawdę rzecz wywodzi się z badań nad gospodarką wodną organizmu, z których wynikało, że przy przeciętnej aktywności fizycznej i temperaturach, człowiek wydala ok 2 litry wody dziennie, to wobec tego tyle samo powinien przyjmować. Tyle tylko że wlicza się tutaj także woda zawarta w jedzeniu. Jabłko zawiera ponad 80% wody, mięso 50-60%, chleb 10%. Łącznie z jedzeniem przyjmujemy około litra - półtora, co stanowi połowę zalecanego spożycia. Nikt nigdzie nie mówił że musi być to koniecznie taka właśnie ilość wody pitnej.
Niestety, źle zrozumiane wyniki badań poszły w świat w formie "musisz pić 8 szklanek wody dziennie" i to czystej wody a nie napojów, przez co poniektórzy wierząc kolorowym pismom wręcz wmuszali w siebie następne szklanki, bo tak przecież napisali.
Niektórzy "dietetycy" dla uzasadnienia tego mitu posuwają się nawet do twierdzenia, że woda spożyta w innej formie jak czysta, nie będzie się wchłaniała, toteż po zjedzeniu talerza wodnistej zupy i tak musisz wypić te dwa litry. Niestety ludzie dalej w to wierzą, a zwolennicy magicznego "oczyszczania z toksyn" wręcz zwiększają ten limit, pisząc o trzech czy czterech litrach. Przykładem może być pewien rodzaj diety oczyszczająco-odchudzającej, w której mało się je i wypija duże ilości wody. Pozwala bardzo szybko schudnąć, ale zanotowano już kilka zgonów z tego powodu.
Brytyjka Jaqueline Henson wypijała na diecie trzy litry czystej wody na dzień. Pewnego dnia zaczęła od wypicia jednego litra wody źródlanej, a potem siedząc przed telewizorem wypiła dwie półtoralitrowe butelki w ciągu trzech godzin. Nie przejmowała się bólem głowy, bo czytała że to może być objaw oczyszczania organizmu. Po południu zemdlała, dostała drgawek i zatrzymania krążenia.[3]
Inna Brytyjka za namową swej dietetyczki wypijała cztery litry wody dziennie aby "wypłukać toksyny". Gdy zaczęła się źle czuć, dietetyczka powiedziała że to objaw oczyszczania i powinna zwiększyć ilość do sześciu litrów. Po dwóch dniach kobieta straciła przytomność. Wprawdzie ją odratowano ale w wyniku obrzęku doszło do uszkodzenia mózgu[4]
W przypadku Jennifer Strange, na jej stan nałożyło się kilka czynników - była drobna, miała małą wagę, dlatego proporcja ilości wypitej wody była u niej większa niż u innych. Zwyciężczyni konkursu doznała tylko bólu głowy ale nie była hospitalizowana. W dodatku prawdopodobnie Jennifer po przyjściu do domu niczego nie jadła - gdyby zjadła coś bardzo słonego, jak czipsy lub solone frytki, to stężenie elektrolitów mogłoby się wyrównać a przynajmniej nie dojść do tak niebezpiecznie niskiego poziomu. Mąż zmarłej podał stację radiową do sądu. Sprawa ciągnęła się długo, bowiem z jednej strony uczestnicy podpisali dokument iż wiedzą o ryzyku, lecz z drugiej strony nikt im nie powiedział jakie jest to właściwie ryzyko. Ostatecznie w 2009 roku w ramach ugody stacja zapłaciła rodzinie zmarłej 16 mln dolarów.
Historia ta miała jednak chyba zbyt małe rozpowszechnienie, skoro w zeszłym roku brazylijska stacja radiowa ogłosiła podobny konkurs, gdzie nagrodę zdobywał zespół, który wypije najwięcej rozwodnionej yerba mate. W zwycięskim zespole składającym się z 10 osób, który wypił 56 litrów napoju, trzy osoby się rozchorowały a jedna zmarła.[5]
------
* http://en.wikipedia.org/wiki/Water_intoxication
* http://www.pnmedycznych.pl/spnm.php?ktory=138
* http://www.rbs2.com/KDND.pdf
* http://www.protectconsumerjustice.org/a-measure-of-justice-for-a-mother-who-met-a-tragic-end.html
[1] http://fpn.ipin.edu.pl/archiwum/2005/2/t21z2_7.pdf
[2] http://www.maratonypolskie.pl/mp_index.php?dzial=1&action=7&code=4888
[3] http://news.bbc.co.uk/2/hi/uk_news/england/bradford/7779079.stm
[4] http://www.dailymail.co.uk/femail/article-1038829/Water-detox-robbed-wife.html
[5] http://www.campograndenews.com.br/cidades/capital/mulher-de-21-anos-morre-depois-de-passar-mal-em-competicao-de-terere
Konkurs "Hold Your Wee of a Wii" był bardzo prosty - wygrywał ten, kto wypije jak najwięcej wody i się nie posika. W innych podobnych konkursach dawano zadania w rodzaju zjedzenia jak największej ilości pączków czy hamburgerów, więc to wydawało się prostym zadaniem. Przygotowano każdemu uczestnikowi małe, ćwierćlitrowe buteleczki wody. Mieli pić po jednej w odstępie dziesięciu minut oraz w każdej chwili mogli zrezygnować, jeśli uznali, że to dla nich zbyt dużo, ale nie mogli wychodzić do łazienki.
Konkurs rozpoczęto nad ranem, nadając relację na antenie. Było wesoło, a kolejne butelki znikały w szybkim tempie. Ktoś się wykruszył po pięciu, ktoś po ośmiu.
W trakcie trwania konkursu, do radia zadzwoniła pielęgniarka, stwierdzając że jego idea jest oburzająca i niebezpieczna, bo ktoś może umrzeć. Prezenter odpowiedział że wiedzą ale wszystko jest pod kontrolą, zresztą uczestnicy podpisali dokument że zgadzają się na ryzyko, więc nie ma się co czepiać. Gdy kolejny słuchacz zaniepokojony konkursem zadzwonił z ostrzeżeniem, rozbawiony prezenter wyjrzał na salę i zawołał "Czy ktoś tam może umiera?". Prezenter wyjaśnił też że ciało składa się w 90% z wody, więc można jej pić ile się chce.
Gdy minęła pierwsza godzina, uczestnikom dano większe, półlitrowe butelki. To wtedy zrezygnowało najwięcej osób. Niektórzy źle się czuli, ktoś zwymiotował do wiadra, ktoś inny stwierdził że jest mu zimno i zaczął drżeć. Jednak dwie zawodniczki okazały się bardzo wytrwałe. Jennifer wypiła już osiem małych butelek i dziesięć większych, łącznie mieszcząc w sobie ponad sześć litrów wody, gdy stwierdziła że brzuch już ją boli, i głowa. Zrezygnowała zajmując drugie miejsce i otrzymując w nagrodę bilety na koncert. Przebiła ją kobieta, która wypiła o pół butelki więcej.
Gdy konkurs się już skończył, DJ zażartował, że brzuch Jennifer wygląda jakby była w ciąży. Przed wręczeniem nagród zawodniczki poszły do łazienki gdzie wysikały się i zwymiotowały. Następnie gorąco je pożegnano i odesłano do domu. Po drodze Jennifer zadzwoniła do współpracownika aby opowiedzieć o konkursie. Skarżyła się wtedy na silny ból głowy. W domu ból głowy się nasilił. Do objawów doszły zapewne też nudności i osłabienie. Po południu zaniepokojona matka odnajduje ją martwą.
Wynik autopsji zaskoczył wszystkich - Jennifer Strange zmarła z powodu zatrucia wodą.
Setki lat temu, pewien przemądrzały lekarz nazywany Paracelsusem, stwierdził paradoksalnie, że wszystko jest trucizną i nie jest nią. Działanie zależy od dawki a w pewnym stopniu też sposobu podania. Wynika stąd wiosek, że o żadnej substancji nie można powiedzieć, że nie jest trująca, można je tylko dzielić na trujące silnie, słabo i bardzo niewiele, co odpowiada wielkości dawki wywołującej negatywne objawy. Niejednokrotnie substancja wywołująca szkodliwe skutki w dużych dawkach, w małych może wykazać własności lecznicze.
Toksyczność substancji określa się zwykle przy pomocy miary LD 50 - jest to dawka w gramach na kilogram masy ciała wywołująca 50% prawdopodobieństwo śmierci, co zwykle wyznacza się badając śmiertelność szczurów lub innych zwierząt. Pewne znaczenie ma też droga podania, substancje mogą wykazywać niską toksyczność podane doustnie a wysoką podane inhalacyjnie, przykładem metaliczna rtęć, która połknięta bardzo trudno się wchłania, natomiast bardzo szkodliwa jest wdychana w postaci par.
W niektórych przypadkach dawka śmiertelna może być skrajnie niska - dla jadu kiełbasianego podaje się dawki rzędu nanogramów, dla cyjanku potasu to ok. 5 mg/kg, a dla siarczanu miedzi to ok. 5 g/kg przez co jego przedawkowanie jest na prawdę trudne.
A woda? Prawdopodobnie jest jedną z najmniej toksycznych substancji, jakich właściwości przebadano, jej dawka śmiertelna to około 90g/kg. Nawet glukoza jest bardziej toksyczna.
Oznacza to że dla dorosłego ważącego 70 kg niebezpieczna jest dawka ok. 6 litrów, ale oczywiście wszystko zależy od sposobu i szybkości podawania.
Ale właściwie dlaczego woda może być niebezpieczna?
Jednym z warunków utrzymania przez nasz organizm homeostazy, jest równowaga między zawartością wody w komórkach i w przestrzeniach między nimi. Stężenie soli mineralnych w osoczu i w płynie wewnątrzkomórkowym musi mieścić się w określonych granicach, przy czym najważniejszą z tych soli jest chlorek sodu, a więc sól kuchenna.
Ogólne prawa fizyki mówią, że przy różnicy stężeń po dwóch stronach półprzepuszczalnej błony, rozpuszczalnik ma skłonność do migracji w miejsce o większym stężeniu. Po prostu po stronie z roztworem bardziej rozcieńczonym cząstki rozpuszczalnika częściej uderzają w błonę i mogą przez nią przeniknąć, niż od strony roztworu bardziej stężonego. To przenikanie trwa tak długo aż nie zahamuje go wytworzone ciśnienie, nazywane osmotycznym, mogące osiągać gigantyczne wartości. To dlatego wiśnie i miękkie owoce zamoczone w wodzie nabrzmiewają i pękają - zwykła woda ma mniejsze stężenie rozpuszczonych substancji niż sok w komórkach owoców, i wnika do wiśni zwiększając ciśnienie.
Wewnątrz organizmu stężenie soli w osoczu i w komórkach jest na różne sposoby regulowane. Najważniejszym mechanizmem jest wydalanie wody i soli mineralnych przez nerki, które z kolei jest regulowane wydzielaniem hormonów, znaczenie ma też transport jonów do i z wnętrza komórek. W normalnej sytuacji gdy wypijemy większą ilość wody, nerki zaczynają wydzielać większą ilość moczu, tak aby zachować równowagę, a sole mineralne w organizmie nieco się rozcieńczają.
Problem może pojawić się gdy ilość wypitej wody przekroczy zdolność wydalniczą nerek, a więc będzie większa niż ok. 1 litr na godzinę, lub też gdy nerki zmniejszą wydzielanie moczu. Osocze krwi się wówczas rozcieńcza a poziom sodu zaczyna opadać poniżej normalnego stężenia, co prowadzi do hiponatremii.
Spadek stężenia soli w osoczu powoduje wzmożone wchłanianie wody do tkanek, człowiek staje się więc obrzęknięty i ociężały. W przypadku większości tkanek mają one pewną swobodę miejsca, mogąc nabrzmiewać bez uszkodzeń. Mózg zamknięty wewnątrz sztywnej czaszki nie ma tak łatwo.
Przy silnej i szybkiej hiponatremii, następuje obrzęk mózgu, a wzrost ciśnienia wewnątrz czaszkowego wywołuje objawy neurologiczne - dreszcze, silne bóle głowy, wymioty, osłabienie, drgawki, zaburzenia oddychania i śpiączkę. Ostatecznie opuchnięcie pnia mózgu wywołuje porażenie ośrodka oddechowego i zatrzymanie oddechu.
Najszybszym sposobem leczenia jest podanie soli mineralnych, tak aby zwiększyć ich stężenie we krwi, oraz podawanie diuretyków zwiększających wydalanie wody.
Zatrucie wodne jest przypadkiem bardzo rzadkim, i najczęściej jest związane z przymusem lub zaburzeniami psychicznymi. W chorobach takich jak schizofrenia nadmierne pragnienie jest dosyć częste - hiponatremia z przewodnienia występuje nawet u 5% leczonych w szpitalach psychiatrycznych, stanowiąc przyczynę do 20% zgonów[1]. Innym przypadkiem są zaburzenia elektrolitowe podczas intensywnego wysiłku - ciało wydala sole mineralne wraz z potem, wypijanie w trakcie płynów nieizotonicznych, czyli mających zbyt mało soli, może doprowadzić do hiponatremii. W dodatku w warunkach dużego zmęczenia, organizm hamuje wydzielanie moczu przez nerki. Stan taki obserwuje się u około 10-15% maratończyków po zakończeniu biegu, i niekiedy może on przybrać niebezpieczne natężenie.
Kilka lat temu z tego powodu zmarł uczestnik maratonu w Londynie.[2] Wiadomość o tym wywołała duże zaskoczenie u biegaczy, którzy dotychczas bardziej obawiali się odwodnienia.
Innym znanym przypadkiem była śmierć rekruta podczas ćwiczeń wytrzymałościowych Sił Powietrznych w 1999 roku, gdzie przyczyną było połączenie udaru cieplnego i przewodnienia.
Niebezpieczne rozcieńczenie płynów może też nastąpić w wyniku tortur lub napojenia wymuszonego. Zanotowano już kilka przypadku śmierci dzieci, które opiekunowie w ramach kary zmusili do wypicia 1-2 litrów wody. W USA głośną sprawą była śmierć Matthewa Carringtona, który w ramach swoistych otrzęsin będących testem wstępnym do studenckiego bractwa Tau Chi był zmuszony do wypicia dużych ilości wody. Jeszcze inną okazją do przewodnienia może być nieprzemyślana dieta lub źle zaplanowane "oczyszczanie organizmu".
Od dawna po świecie krąży mit, iż każdego dnia należy pić 2 litry wody. Tak na prawdę rzecz wywodzi się z badań nad gospodarką wodną organizmu, z których wynikało, że przy przeciętnej aktywności fizycznej i temperaturach, człowiek wydala ok 2 litry wody dziennie, to wobec tego tyle samo powinien przyjmować. Tyle tylko że wlicza się tutaj także woda zawarta w jedzeniu. Jabłko zawiera ponad 80% wody, mięso 50-60%, chleb 10%. Łącznie z jedzeniem przyjmujemy około litra - półtora, co stanowi połowę zalecanego spożycia. Nikt nigdzie nie mówił że musi być to koniecznie taka właśnie ilość wody pitnej.
Niestety, źle zrozumiane wyniki badań poszły w świat w formie "musisz pić 8 szklanek wody dziennie" i to czystej wody a nie napojów, przez co poniektórzy wierząc kolorowym pismom wręcz wmuszali w siebie następne szklanki, bo tak przecież napisali.
Niektórzy "dietetycy" dla uzasadnienia tego mitu posuwają się nawet do twierdzenia, że woda spożyta w innej formie jak czysta, nie będzie się wchłaniała, toteż po zjedzeniu talerza wodnistej zupy i tak musisz wypić te dwa litry. Niestety ludzie dalej w to wierzą, a zwolennicy magicznego "oczyszczania z toksyn" wręcz zwiększają ten limit, pisząc o trzech czy czterech litrach. Przykładem może być pewien rodzaj diety oczyszczająco-odchudzającej, w której mało się je i wypija duże ilości wody. Pozwala bardzo szybko schudnąć, ale zanotowano już kilka zgonów z tego powodu.
Brytyjka Jaqueline Henson wypijała na diecie trzy litry czystej wody na dzień. Pewnego dnia zaczęła od wypicia jednego litra wody źródlanej, a potem siedząc przed telewizorem wypiła dwie półtoralitrowe butelki w ciągu trzech godzin. Nie przejmowała się bólem głowy, bo czytała że to może być objaw oczyszczania organizmu. Po południu zemdlała, dostała drgawek i zatrzymania krążenia.[3]
Inna Brytyjka za namową swej dietetyczki wypijała cztery litry wody dziennie aby "wypłukać toksyny". Gdy zaczęła się źle czuć, dietetyczka powiedziała że to objaw oczyszczania i powinna zwiększyć ilość do sześciu litrów. Po dwóch dniach kobieta straciła przytomność. Wprawdzie ją odratowano ale w wyniku obrzęku doszło do uszkodzenia mózgu[4]
W przypadku Jennifer Strange, na jej stan nałożyło się kilka czynników - była drobna, miała małą wagę, dlatego proporcja ilości wypitej wody była u niej większa niż u innych. Zwyciężczyni konkursu doznała tylko bólu głowy ale nie była hospitalizowana. W dodatku prawdopodobnie Jennifer po przyjściu do domu niczego nie jadła - gdyby zjadła coś bardzo słonego, jak czipsy lub solone frytki, to stężenie elektrolitów mogłoby się wyrównać a przynajmniej nie dojść do tak niebezpiecznie niskiego poziomu. Mąż zmarłej podał stację radiową do sądu. Sprawa ciągnęła się długo, bowiem z jednej strony uczestnicy podpisali dokument iż wiedzą o ryzyku, lecz z drugiej strony nikt im nie powiedział jakie jest to właściwie ryzyko. Ostatecznie w 2009 roku w ramach ugody stacja zapłaciła rodzinie zmarłej 16 mln dolarów.
Historia ta miała jednak chyba zbyt małe rozpowszechnienie, skoro w zeszłym roku brazylijska stacja radiowa ogłosiła podobny konkurs, gdzie nagrodę zdobywał zespół, który wypije najwięcej rozwodnionej yerba mate. W zwycięskim zespole składającym się z 10 osób, który wypił 56 litrów napoju, trzy osoby się rozchorowały a jedna zmarła.[5]
------
* http://en.wikipedia.org/wiki/Water_intoxication
* http://www.pnmedycznych.pl/spnm.php?ktory=138
* http://www.rbs2.com/KDND.pdf
* http://www.protectconsumerjustice.org/a-measure-of-justice-for-a-mother-who-met-a-tragic-end.html
[1] http://fpn.ipin.edu.pl/archiwum/2005/2/t21z2_7.pdf
[2] http://www.maratonypolskie.pl/mp_index.php?dzial=1&action=7&code=4888
[3] http://news.bbc.co.uk/2/hi/uk_news/england/bradford/7779079.stm
[4] http://www.dailymail.co.uk/femail/article-1038829/Water-detox-robbed-wife.html
[5] http://www.campograndenews.com.br/cidades/capital/mulher-de-21-anos-morre-depois-de-passar-mal-em-competicao-de-terere
Subskrybuj:
Komentarze (Atom)