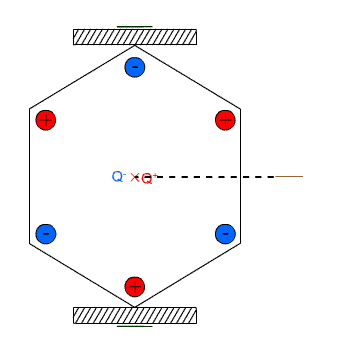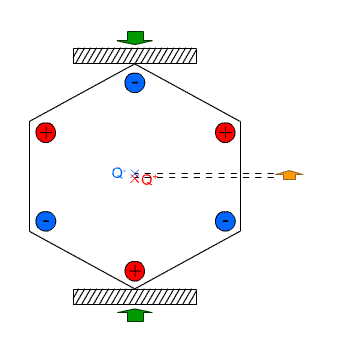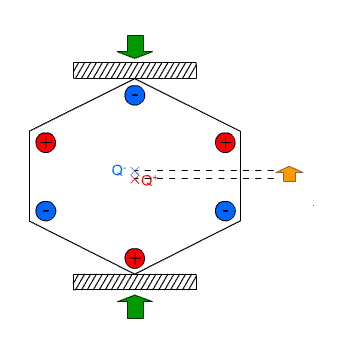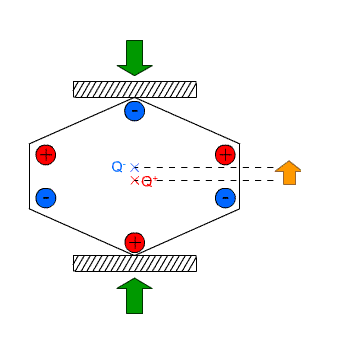
Na drugim blogu pisałem na wiosnę o tym jak robi się syropek z kwiatów mniszka, bardzo podobny do miodu. Stopniowo zużywam zapasik a otwierając słoiki zauważyłem że część cukru wykrystalizowała na dnie w formie bardzo grubych kryształów. Te niestety mocno przyrosły do dna i trudno jest je oderwać bez skruszenia. Ostatnio jednak udało mi się oderwać dwa kryształki przyrosłe do ścianki i jak na takie warunki bardzo kształtne:
Ten największy ma 3 cm długości. Cukiereczek...
Duże skupiska kryształów cukru na patyczku nazywane są Candy Rock, można je stosunkowo łatwo zrobić, podstawową instrukcję macie tutaj:
Powstające pałeczki kryształów mogą posłużyć za oryginalny smakołyk. Będę musiał spróbować sam, ale na razie zajmę się syropkiem.
A tu poniżej jeszcze jeden pomysł wykorzystania dużych kryształów cukru - po pokryciu lakierem jako część biżuterii: http://www.dezeen.com/2007/06/25/unsustainable-by-greetje-van-helmond/
informacje
piątek, 22 listopada 2013
poniedziałek, 18 listopada 2013
Synteza I. - etap pierwszy, męczący
Dawno dawno temu... jeszcze przed wakacjami, obiecywałem że zacznę pisać o syntezach wykonywanych w ramach pracowni magisterskiej. Niestety jak widać zrobił mi się w tej kwestii znaczny poślizg, co zresztą dotyczy wszystkich dłuższych postów. Ledwie coś zacznę, tracę zapał do dokańczania i odkładam rzecz na później. To "zatwardzenie pióra" sprawia że wolę już niczego nie obiecywać.
Skoro już w jednym z wcześniejszych wpisów obszernie objaśniłem o co chodzi z tymi syntezami asymetrycznymi, mogę przejść do opisu pierwszej wykonywanej syntezy, jeszcze z poprzedniego roku studiów. Wówczas to, w drugim semestrze czwartego roku, mając czas przeznaczony na laboratorium w wymiarze jednego dnia tygodniowo, raczej wprawiałem się i wdrażałem do pracy laboratoryjnej, toteż to co robiłem było raczej powtórzeniem już przeprowadzanej syntezy, a nie rozpoczynaniem czegoś nowego. Miało to tą dobrą stronę, że w razie wątpliwości mogłem zajrzeć do notatek osoby robiącej to samo w zeszłym roku.
Moim związkiem końcowym miała być 3-bromo-5-fenylo-1,2,4-triazyna, a uzyskać ją miałem z wyjściowych związków niecyklicznych. Całość reakcji powinna wyglądać tak:
Pierwszy etap który omówię w tym wpisie, dotyczył cyklizacji i wyodrębnienia produktu.
Substratami wyjściowymi był fenyloglioksal i karbamohydrazonotioester metylowy (chyba, po angielsku Methyl carbamohydrazonothioate) w formie jodowodorku. Ten drugi jest tu dostarczycielem dwóch azotów połączonych wiązaniem; grupa tioestrowa jest tu sposobem zabezpieczenia grupy hydroksylowej, która w przeciwnym wypadku też mogłaby wchodzić w reakcję. W obecności słabej zasady, jaką jest wodorowęglan sodu następuje kondensacja grup aminowych do węgli karboksylowych, tworząc sześcioczłonowy pierścień:
Możliwy produkt uboczny, z podstawnikami w ustawieniu 3,6 (a więc para-trizyna), nazywany dalej izomerem 6, powstaje gdy cząsteczki połączą się obrócone, jest go jednak mało, o czym później.
Zgodnie z przepisem odważyłem fenylogliokasal, mający w tym przypadku postać żółtawego proszku o bardzo niemiłym zapachu - dosyć ostrym, jakby czosnkowym ale z kwaśną nutą. Podobnie pachniał kiedyś słoik zepsutych kiszonych ogórków.
Drugi związek miał formę białego proszku, przechowywano go w lodówce z uwagi na niestabilność. Glioksal i węglan sodu rozpuściłem w kolbie i dodałem drugi substrat. Całość umieściłem na mieszadle magnetycznym (wcześniej wrzuciłem magnetyczny drops), obłożyłem z zewnątrz lodem i tak to się miało kręcić całą dobę.
Kolejnego dna po ostatnim wykładzie przyszedłem zobaczyć co wyszło. A wyszło mianowicie to, że zastałem w kolbce żółtawą mieszaninę poreakcyjną. Należało ją teraz rozdzielić. Najpierw ekstrahowałem ją chlorkiem metylenu aby oddzielić węglan sodu i częściowo zhydrolizowany hydrazyd, otrzymując brązowy roztwór:
Potem oczywiście nałożyłem na kolumnę i rozdzieliłem chromatograficznie. Wcześniejsze próby na płytce pokazały że w ekstrakcie miałem głównie pożądany produkt i ślady izomeru 6, możliwe do rozdzielenia. Kwestię rozdziału na kolumnie preparatywnej, jej wykonywanie i problemy z tym związane, już tu omawiałem, więc nie będę się u szczegółowo powtarzał. Początkowo użyłem mieszanki CH2Cl2:metanol 100:1 która na płytce dawała dobre rezultaty. Niestety na kolumnie nie specjalnie.
Związek główny strasznie ogonował - za czołem zawierającym główną porcję ciągnął się "ogon" zawierający produkt, co oznaczało że do całkowitego wymycia potrzebne jest przelanie przez kolumnę dużej ilości eluentu. Zdaje się że zużyłem w ten sposób ponad pół butelki chlorku metylenu zbierając 12 frakcji aż prowadząca uznała, że lepiej użyć mieszanki z większa ilością metanolu i dopiero wówczas związek wymył się całkiem.
Kolejnego dnia miałem zająć się przede wszystkim odparowaniem czystych frakcji na wyparce. Jest to przyrząd w którym roztwór umieszczony zostaje w kulistej kolbie zanurzonej w misie z ciepłą wodą i podłączony do chłodnicy pod obniżonym ciśnieniem. Kombinacja niskiego ciśnienia, podgrzewania i rozprowadzania cieczy na ściankach powoduje szybkie odparowanie rozpuszczalnika.
Tak więc nalewałem do kolby kolejne frakcje, i odparowywałem. Pierwsza, drugą, trzecią, czwartą, piątą... a gdy byłem przy dziesiątej zdarzyła się katastrofa.
Kolbka podłączona do wyparki trzyma się obracającego szlifu trochę za sprawą tarcia a trochę za sprawą przyssania. Dla pewności można założyć plastikowy klips. Gdy odparowałem już wszystkie wcześniejsze frakcje, odszedłem na chwilę a przez ten czas z tej samej pompy ssącej skorzystał ktoś inny aby coś sobie przesączyć. I wyłączył pompę. Gdy powróciłem nie zwróciłem na to uwagi - wlałem do kolbki jedenastą frakcję, nasunąłem ją na szlif, zanurzyłem w misie i włączyłem obrót. Kolbka obróciła się kilka razy i wpadła do misy...
Oczywiście nie do końca odparowany roztwór wylał się do środka i będąc cięższym od wody osiadł na dnie. Łatwo sobie wyobrazić moją reakcję. No ale cóż, nie było na co się dalej złościć, trzeba było ratować co się da. Wybrałem wodę z misy po czym odciągnąłem roztwór z dna pipetką. Zanieczyszczony różnymi osadami z dna i wodą roztwór wlałem do kolby i zasypałem środkiem suszącym. I tak skończył się dzień kolejny.
Na następnej pracowni odparowałem ocaloną frakcję produktu, po czym nałożyłem wysuszoną i przesączoną mieszaninę powypadkową, po czym... nałożyłem na kolumnę i rozdzielałem.
Tym razem poszło mi to szybciej za sprawą lepiej dobranego układu, ale też zeszło na to trochę czasu. Na koniec porównałem obie części ze wzorcem produktu i odparowałem wspólnie, w jednej kolbie, otrzymując 1,5 grama związku. Po odparowaniu początkowo utworzył olejek, który ładnie wykrystalizował:
Porządnie mnie wymęczył ten etap.
Skoro już w jednym z wcześniejszych wpisów obszernie objaśniłem o co chodzi z tymi syntezami asymetrycznymi, mogę przejść do opisu pierwszej wykonywanej syntezy, jeszcze z poprzedniego roku studiów. Wówczas to, w drugim semestrze czwartego roku, mając czas przeznaczony na laboratorium w wymiarze jednego dnia tygodniowo, raczej wprawiałem się i wdrażałem do pracy laboratoryjnej, toteż to co robiłem było raczej powtórzeniem już przeprowadzanej syntezy, a nie rozpoczynaniem czegoś nowego. Miało to tą dobrą stronę, że w razie wątpliwości mogłem zajrzeć do notatek osoby robiącej to samo w zeszłym roku.
Moim związkiem końcowym miała być 3-bromo-5-fenylo-1,2,4-triazyna, a uzyskać ją miałem z wyjściowych związków niecyklicznych. Całość reakcji powinna wyglądać tak:
Pierwszy etap który omówię w tym wpisie, dotyczył cyklizacji i wyodrębnienia produktu.
Substratami wyjściowymi był fenyloglioksal i karbamohydrazonotioester metylowy (chyba, po angielsku Methyl carbamohydrazonothioate) w formie jodowodorku. Ten drugi jest tu dostarczycielem dwóch azotów połączonych wiązaniem; grupa tioestrowa jest tu sposobem zabezpieczenia grupy hydroksylowej, która w przeciwnym wypadku też mogłaby wchodzić w reakcję. W obecności słabej zasady, jaką jest wodorowęglan sodu następuje kondensacja grup aminowych do węgli karboksylowych, tworząc sześcioczłonowy pierścień:
Możliwy produkt uboczny, z podstawnikami w ustawieniu 3,6 (a więc para-trizyna), nazywany dalej izomerem 6, powstaje gdy cząsteczki połączą się obrócone, jest go jednak mało, o czym później.
Zgodnie z przepisem odważyłem fenylogliokasal, mający w tym przypadku postać żółtawego proszku o bardzo niemiłym zapachu - dosyć ostrym, jakby czosnkowym ale z kwaśną nutą. Podobnie pachniał kiedyś słoik zepsutych kiszonych ogórków.
Drugi związek miał formę białego proszku, przechowywano go w lodówce z uwagi na niestabilność. Glioksal i węglan sodu rozpuściłem w kolbie i dodałem drugi substrat. Całość umieściłem na mieszadle magnetycznym (wcześniej wrzuciłem magnetyczny drops), obłożyłem z zewnątrz lodem i tak to się miało kręcić całą dobę.
Kolejnego dna po ostatnim wykładzie przyszedłem zobaczyć co wyszło. A wyszło mianowicie to, że zastałem w kolbce żółtawą mieszaninę poreakcyjną. Należało ją teraz rozdzielić. Najpierw ekstrahowałem ją chlorkiem metylenu aby oddzielić węglan sodu i częściowo zhydrolizowany hydrazyd, otrzymując brązowy roztwór:
Potem oczywiście nałożyłem na kolumnę i rozdzieliłem chromatograficznie. Wcześniejsze próby na płytce pokazały że w ekstrakcie miałem głównie pożądany produkt i ślady izomeru 6, możliwe do rozdzielenia. Kwestię rozdziału na kolumnie preparatywnej, jej wykonywanie i problemy z tym związane, już tu omawiałem, więc nie będę się u szczegółowo powtarzał. Początkowo użyłem mieszanki CH2Cl2:metanol 100:1 która na płytce dawała dobre rezultaty. Niestety na kolumnie nie specjalnie.
Związek główny strasznie ogonował - za czołem zawierającym główną porcję ciągnął się "ogon" zawierający produkt, co oznaczało że do całkowitego wymycia potrzebne jest przelanie przez kolumnę dużej ilości eluentu. Zdaje się że zużyłem w ten sposób ponad pół butelki chlorku metylenu zbierając 12 frakcji aż prowadząca uznała, że lepiej użyć mieszanki z większa ilością metanolu i dopiero wówczas związek wymył się całkiem.
Kolejnego dnia miałem zająć się przede wszystkim odparowaniem czystych frakcji na wyparce. Jest to przyrząd w którym roztwór umieszczony zostaje w kulistej kolbie zanurzonej w misie z ciepłą wodą i podłączony do chłodnicy pod obniżonym ciśnieniem. Kombinacja niskiego ciśnienia, podgrzewania i rozprowadzania cieczy na ściankach powoduje szybkie odparowanie rozpuszczalnika.
Tak więc nalewałem do kolby kolejne frakcje, i odparowywałem. Pierwsza, drugą, trzecią, czwartą, piątą... a gdy byłem przy dziesiątej zdarzyła się katastrofa.
Kolbka podłączona do wyparki trzyma się obracającego szlifu trochę za sprawą tarcia a trochę za sprawą przyssania. Dla pewności można założyć plastikowy klips. Gdy odparowałem już wszystkie wcześniejsze frakcje, odszedłem na chwilę a przez ten czas z tej samej pompy ssącej skorzystał ktoś inny aby coś sobie przesączyć. I wyłączył pompę. Gdy powróciłem nie zwróciłem na to uwagi - wlałem do kolbki jedenastą frakcję, nasunąłem ją na szlif, zanurzyłem w misie i włączyłem obrót. Kolbka obróciła się kilka razy i wpadła do misy...
Oczywiście nie do końca odparowany roztwór wylał się do środka i będąc cięższym od wody osiadł na dnie. Łatwo sobie wyobrazić moją reakcję. No ale cóż, nie było na co się dalej złościć, trzeba było ratować co się da. Wybrałem wodę z misy po czym odciągnąłem roztwór z dna pipetką. Zanieczyszczony różnymi osadami z dna i wodą roztwór wlałem do kolby i zasypałem środkiem suszącym. I tak skończył się dzień kolejny.
Na następnej pracowni odparowałem ocaloną frakcję produktu, po czym nałożyłem wysuszoną i przesączoną mieszaninę powypadkową, po czym... nałożyłem na kolumnę i rozdzielałem.
Tym razem poszło mi to szybciej za sprawą lepiej dobranego układu, ale też zeszło na to trochę czasu. Na koniec porównałem obie części ze wzorcem produktu i odparowałem wspólnie, w jednej kolbie, otrzymując 1,5 grama związku. Po odparowaniu początkowo utworzył olejek, który ładnie wykrystalizował:
Porządnie mnie wymęczył ten etap.
niedziela, 17 listopada 2013
Ostatnio w laboratorium (35.)
Ostatnio w laboratorium badałem temperaturę topnienie otrzymanego związku. Jeszcze tu o tym nie pisałem, ale na pracowni zajmuję się syntezą, może jak pokonam różne zaległości do uda się dodać jakiś bardziej aktualny wpis na temat tej pracy. Na razie jednak migawka.
Badanie temperatury topnienia jest stosunkowo szybką i tanią metodą potwierdzenia czystości związku, jeśli oczywiście mamy z czym ją porównać. Im szerszy zakres topnienia tym bardziej zanieczyszczony związek. O jednym ze sposobów pomiaru już pisałem w jednym ze starych wpisów, wtedy obserwowałem zawartość kapilarki w ogrzewanej komorze, teraz natomiast obserwowałem kryształki na ogrzewanym szkiełku pod mikroskopem.
Małą próbkę oczyszczonego ligandu umieściłem między szkiełkami nakrywkowymi i położyłem na podgrzewanym stoliku mikroskopu. Jednym okiem patrzyłem na kryształki a drugim zerkałem na wskazania termopary czekając na moment aż zaczną się topić:
W tym akurat przypadku czekałem długo bo topiły się dopiero w 270 stopniach. Jest to związek słabo rozpuszczalny i nie wiem czy będzie się nadawał do syntez jakie mam badać.
Badanie temperatury topnienia jest stosunkowo szybką i tanią metodą potwierdzenia czystości związku, jeśli oczywiście mamy z czym ją porównać. Im szerszy zakres topnienia tym bardziej zanieczyszczony związek. O jednym ze sposobów pomiaru już pisałem w jednym ze starych wpisów, wtedy obserwowałem zawartość kapilarki w ogrzewanej komorze, teraz natomiast obserwowałem kryształki na ogrzewanym szkiełku pod mikroskopem.
Małą próbkę oczyszczonego ligandu umieściłem między szkiełkami nakrywkowymi i położyłem na podgrzewanym stoliku mikroskopu. Jednym okiem patrzyłem na kryształki a drugim zerkałem na wskazania termopary czekając na moment aż zaczną się topić:
W tym akurat przypadku czekałem długo bo topiły się dopiero w 270 stopniach. Jest to związek słabo rozpuszczalny i nie wiem czy będzie się nadawał do syntez jakie mam badać.
niedziela, 10 listopada 2013
Skaczące kryształy
Gdy usłyszałem o skaczących kryształach, byłem bardzo zaskoczony ale i zaciekawiony. Kryształy pewnych substancji w odpowiednich warunkach deformują się na tyle gwałtownie, że są w stanie poskoczyć, niejednokrotnie na stosunkowo dużą odległość.
Stan krystaliczny charakteryzuje się regularnym, sieciowym ułożeniem cząstek i niejednorodnością właściwości fizycznych - na przykład wzdłuż pewnego wymiaru kryształ przewodzi prąd lepiej niż w innym, albo ogrzany wydłuża się w pewnym kierunku a w innym kurczy. Zależnie od stopnia powiązania budujących go cząstek, możemy mieć do czynienia z kryształem jonowym, złożonym z jonów soli połączonych w trwałą siatkę; z kryształem kowalencyjnym gdzie podobne do siebie atomy łączą się wiązaniami, bądź z kryształem molekularnym gdzie osobne cząsteczki związku nie są ze sobą trwale połączone, a jedynie upakowały się w przestrzeni na tyle ciasno, że tworzą ciało stałe.
Kwestia oddziaływań mechanicznych na właściwości kryształów była już dosyć dokładnie zbadana. Wiadomo że niektóre są na tyle plastyczne, że potrafią deformować się pod wpływem stale działających sił - przykładem sól kamienna która pod wpływem dużego ciśnienia nabiera skłonności do płynięcia. Inne kryształy reagują w jeszcze ciekawszy sposób - piezoelektryki pod wpływem ściskania elektryzują się z jednym ładunkiem na jednym końcu i drugim na przeciwnym. Różnice wytworzonych w ten sposób napięć potrafią być bardzo duże; kostka kryształu górskiego ściśnięta siłą 500 kN wytwarza różnicę napięć 12 tysięcy V, czego praktycznym wykorzystaniem z jakim każdy się spotkał, są zapalniczki piezoelektryczne - nacisk na przycisk deformuje grupę kryształów a różnica napięć generuje iskrę.
Piezoelektryki to substancje których komórki krystaliczne (najmniejsze stałe elementy sieci) nie mają środka symetrii a składają się z cząstek o różnym ładunku. Powoduje to że środki układu ładunków dodatnich i ujemnych nie pokrywają się ze sobą tworząc niewielki dipol. Ściskanie kryształu deformuje go, ściska komórki krystaliczne i przez zmianę ich kształtu rozsuwa środki układu ładunków - każda komórka staje się więc dipolem elektrycznym o wielkości zależnej od siły ucisku.
Sumą dipolów poszczególnych komórek jest naelektryzowanie się dwóch końców całego kryształu. Obserwuje się też efekt odwrotny - rozciąganie się kryształu pod wpływem przyłożonego ładunku. Wykorzystuje się to w zegarkach kwarcowych - piezoelektryczny kwarc pod wpływem napięcia z baterii nieco rozszerza się a potem kurczy, wydzielając mały impuls elektryczny; częstość pierwotna drgań daje 32768 impulsów na sekundę. Elektroniczne podzielniki zmniejszają ilość impulsów o połowę i po piętnastu takich podziałach pozostaje nam stały sygnał jeden impuls na sekundę
Wszystkie te efekty mechaniczne następują stopniowo, zmieniając się płynnie zależnie od przyłożonych sił. Dlatego zaskoczeniem było odkrycie silnych deformacji mechanicznych, które następują dosłownie skokowo.
Pierwszymi zaobserwowanymi skaczącymi kryształami były kryształy bromku oksytropium - leku rozkurczowego, od dawna stosowanego w medycynie. W zasadzie ciekawe że przez długi czas ta właściwość umykała badaczom, choć zapewne mogli ją obserwować podczas często stosowanego do identyfikacji testu pomiaru temperatury topnienia, efekt następuje bowiem podczas ogrzewania - niewielkie kryształki związku nagle podskakują na odległość do kilku centymetrów. Zjawisko zarejestrowano na filmie:
Kryształy przeskakują w całości lub po pęknięciu. Jaki jest mechanizm zjawiska?
Bromek oksytropium składa się z dwóch części: tricyklicznego kationu epoksyazanonyliowego połączonego przez elastyczne wiązanie estrowe z częścią aromatyczną, zaś aniony bromkowe zobojętniają cząsteczkę; podejrzewam że dodatkową stabilizację układu zapewnia nie zaznaczone wiązanie wodorowe.
Tylko wiązanie estrowe nie jest sztywne i możliwy jest obrót jednej części cząsteczki względem drugiej, co jednak nie następuje w niskich temperaturach. W miarę wzrostu temperatury wzrasta energia drgań cząsteczki aż możliwe staje się przełamanie bariery rotacji i uzyskanie odmiennego kształtu. Powoduje to nagromadzenie się naprężeń uwalnianych jako jedno silne drgnięcie w chwili odblokowania rotacji większości cząsteczek. Kryształ wykonuje skok.[1] Zjawisko nazwano thremosalient effect co można by jak sądzę przetłumaczyć jako "efekt termosprężnujący" ("termoskokowy" źle by brzmiał, choć takie byłoby tłumaczenie dosłowne, od łacińskiego źródłosłowu saliens - skakanie, podskakiwanie).
Po tym odkryciu znaleziono inne, działające na innej zasadzie, ciekawa jest na przykład praca w której odkryto, że kryształy pewnych skomplikowanych kompleksów kompleksów metali przejściowych z perfluorowanym acetyloacetonem i ligandem będącym N-tlenkiem nitronylu, po utworzeniu wykazują skokowe ruchy polegające na podskokach i fragmentacji, trwające samoczynnie przez kilka tygodni. Źródłem okazała się reakcja eliminacji tlenu, powodująca zmiany upakowania cząstek kompleksu a co za tym idzie także deformacje kształtu kryształu.[2] Stosunkowo prostym związkiem którego kryształy ulegają podskakiwaniu jest 1,2,4,5-tetrabromobenzen.
Najciekawszy jest jednak efekt odkryty zupełnie niedawno - podskoki lub wręcz wybuchowa fragmentacja kryształy pod wpływem światła ultrafioletowego. Igiełkowate kryształki o wielkości do 1 mm odsakiwały nawet na kilkanaście centymetrów, a więc na odległość tysiące razy większą od własnej wielkości. Przy pomocy szybkiej kamery i ten efekt dało się utrwalić:
Są to kryształy stosunkowo prostego i jak sądzę łatwego do otrzymania kompleksu kobaltu [Co(NH3)5(NO2)]Cl(NO3) , zaś mechanizm powstawania tak silnych naprężeń, opiera się na jeszcze innej zasadzie. Jednym z ligandów wokół centralnego atomu kobaltu jest ligand nitrytowy NO2, który łączy się z kobaltem za pomocą wiązania koordynacyjnego poprzez azot. Ligand ten mógłby jednak równie dobrze połączyć się poprzez któryś z tlenów, tworząc nieco inny kompleks, i jak się wydaje, podczas naświetlana ultrafioletem taka przemiana właśnie następuje.
Ligand obraca się i przyłącza od innej strony co zmienia upakowanie cząstek, a ponieważ obracają się praktycznie wszystkie w krysztale, bez wytwarzania nowej fazy krystalicznej, dochodzi do nagromadzenia się naprężeń mechanicznych. Znane są dwie formy krystaliczne tego kompleksu - jedna, znana już dotychczas, o pokroju wykształconym przez dodatek inhibitora powodującego zmianę kształtu zarodka. Takie kryształy po oświetleniu ultrafioletem wyginały się, z wypukłością skierowaną w stronę źródła światła, a po kilku godzinach powracały do stanu pierwotnego.
Druga forma to kryształy otrzymane bez dodatków, mniej plastyczne, w których naprężenia nie mogły stopniowo uwalniać się w ciągłym ruchu. Mogło to nastąpić dopiero w wyskoku, do którego dochodziło na kilka sposobów - przez odłamanie końcówki, odłamanie naroży, przełamanie na pół lub podskok całego kryształu bez rozpadu
Czasem kryształ roztrzaskiwał się na kilka kawałków. Zjawisko nazwano "photosalient effect" co tłumaczyłbym jako "efekt fotosprężynujący".
Autorzy artykułu na temat odkrycia przypuszczają, że może przydać się w maszynach molekularnych lub, po opanowaniu, w materiałach w rodzaju sztucznych mięśni.[3] Osobiście obstawiałbym jednak że w zestawieniu z kryształami piezoelektrycznymi mógłby służyć go generowania pojedynczych silnych impulsów, na przykład w pewnych typach czujników.
--------
 [1] Skoko Ž, Zamir S, Naumov P, & Bernstein J (2010). The thermosalient phenomenon. "Jumping crystals" and crystal chemistry of the anticholinergic agent oxitropium bromide. Journal of the American Chemical Society, 132 (40), 14191-202 PMID: 20860383
[1] Skoko Ž, Zamir S, Naumov P, & Bernstein J (2010). The thermosalient phenomenon. "Jumping crystals" and crystal chemistry of the anticholinergic agent oxitropium bromide. Journal of the American Chemical Society, 132 (40), 14191-202 PMID: 20860383
[2] Ovcharenko VI, Fokin SV, Fursova EY, Kuznetsova OV, Tretyakov EV, Romanenko GV, & Bogomyakov AS (2011). "Jumping crystals": oxygen-evolving metal-nitroxide complexes. Inorganic chemistry, 50 (10), 4307-12 PMID: 21491890
[3] Prof. Panče Naumov, Dr. Subash Chandra Sahoo, Dr. Boris A. Zakharov, Prof. Elena V. Boldyreva (2013). Dynamic Single Crystals: Kinematic Analysis of Photoinduced Crystal Jumping (The Photosalient Effect) Angewandte Chemie International Edition DOI: 10.1002/anie.201303757
[To swoją drogą dosyć dziwna praca. We wstępie autorzy odnoszą się do tego iż dotychczas samoczynne ruchy obserwowano w przyrodzie ożywionej, a więc u zwierząt i u roślin, zaś efekt fotosprężynujący jest ciekawym przykładem ruchów w przyrodzie nieożywionej. Ten fragment został opatrzony aż ośmioma przypisami do prac i książek na temat ruchów w świecie zwierzęcym i przypadkowych prac na temat ruchów roślin. Nie wiem na ile zgadza się to z przyjętymi zwyczajami, ale wygląda mi na sposób zwiększenia objętości bibliografii, aby - kto wie? - całość lepiej wyglądała]
Stan krystaliczny charakteryzuje się regularnym, sieciowym ułożeniem cząstek i niejednorodnością właściwości fizycznych - na przykład wzdłuż pewnego wymiaru kryształ przewodzi prąd lepiej niż w innym, albo ogrzany wydłuża się w pewnym kierunku a w innym kurczy. Zależnie od stopnia powiązania budujących go cząstek, możemy mieć do czynienia z kryształem jonowym, złożonym z jonów soli połączonych w trwałą siatkę; z kryształem kowalencyjnym gdzie podobne do siebie atomy łączą się wiązaniami, bądź z kryształem molekularnym gdzie osobne cząsteczki związku nie są ze sobą trwale połączone, a jedynie upakowały się w przestrzeni na tyle ciasno, że tworzą ciało stałe.
Kwestia oddziaływań mechanicznych na właściwości kryształów była już dosyć dokładnie zbadana. Wiadomo że niektóre są na tyle plastyczne, że potrafią deformować się pod wpływem stale działających sił - przykładem sól kamienna która pod wpływem dużego ciśnienia nabiera skłonności do płynięcia. Inne kryształy reagują w jeszcze ciekawszy sposób - piezoelektryki pod wpływem ściskania elektryzują się z jednym ładunkiem na jednym końcu i drugim na przeciwnym. Różnice wytworzonych w ten sposób napięć potrafią być bardzo duże; kostka kryształu górskiego ściśnięta siłą 500 kN wytwarza różnicę napięć 12 tysięcy V, czego praktycznym wykorzystaniem z jakim każdy się spotkał, są zapalniczki piezoelektryczne - nacisk na przycisk deformuje grupę kryształów a różnica napięć generuje iskrę.
Piezoelektryki to substancje których komórki krystaliczne (najmniejsze stałe elementy sieci) nie mają środka symetrii a składają się z cząstek o różnym ładunku. Powoduje to że środki układu ładunków dodatnich i ujemnych nie pokrywają się ze sobą tworząc niewielki dipol. Ściskanie kryształu deformuje go, ściska komórki krystaliczne i przez zmianę ich kształtu rozsuwa środki układu ładunków - każda komórka staje się więc dipolem elektrycznym o wielkości zależnej od siły ucisku.
Sumą dipolów poszczególnych komórek jest naelektryzowanie się dwóch końców całego kryształu. Obserwuje się też efekt odwrotny - rozciąganie się kryształu pod wpływem przyłożonego ładunku. Wykorzystuje się to w zegarkach kwarcowych - piezoelektryczny kwarc pod wpływem napięcia z baterii nieco rozszerza się a potem kurczy, wydzielając mały impuls elektryczny; częstość pierwotna drgań daje 32768 impulsów na sekundę. Elektroniczne podzielniki zmniejszają ilość impulsów o połowę i po piętnastu takich podziałach pozostaje nam stały sygnał jeden impuls na sekundę
Wszystkie te efekty mechaniczne następują stopniowo, zmieniając się płynnie zależnie od przyłożonych sił. Dlatego zaskoczeniem było odkrycie silnych deformacji mechanicznych, które następują dosłownie skokowo.
Pierwszymi zaobserwowanymi skaczącymi kryształami były kryształy bromku oksytropium - leku rozkurczowego, od dawna stosowanego w medycynie. W zasadzie ciekawe że przez długi czas ta właściwość umykała badaczom, choć zapewne mogli ją obserwować podczas często stosowanego do identyfikacji testu pomiaru temperatury topnienia, efekt następuje bowiem podczas ogrzewania - niewielkie kryształki związku nagle podskakują na odległość do kilku centymetrów. Zjawisko zarejestrowano na filmie:
Kryształy przeskakują w całości lub po pęknięciu. Jaki jest mechanizm zjawiska?
Bromek oksytropium składa się z dwóch części: tricyklicznego kationu epoksyazanonyliowego połączonego przez elastyczne wiązanie estrowe z częścią aromatyczną, zaś aniony bromkowe zobojętniają cząsteczkę; podejrzewam że dodatkową stabilizację układu zapewnia nie zaznaczone wiązanie wodorowe.
Tylko wiązanie estrowe nie jest sztywne i możliwy jest obrót jednej części cząsteczki względem drugiej, co jednak nie następuje w niskich temperaturach. W miarę wzrostu temperatury wzrasta energia drgań cząsteczki aż możliwe staje się przełamanie bariery rotacji i uzyskanie odmiennego kształtu. Powoduje to nagromadzenie się naprężeń uwalnianych jako jedno silne drgnięcie w chwili odblokowania rotacji większości cząsteczek. Kryształ wykonuje skok.[1] Zjawisko nazwano thremosalient effect co można by jak sądzę przetłumaczyć jako "efekt termosprężnujący" ("termoskokowy" źle by brzmiał, choć takie byłoby tłumaczenie dosłowne, od łacińskiego źródłosłowu saliens - skakanie, podskakiwanie).
Po tym odkryciu znaleziono inne, działające na innej zasadzie, ciekawa jest na przykład praca w której odkryto, że kryształy pewnych skomplikowanych kompleksów kompleksów metali przejściowych z perfluorowanym acetyloacetonem i ligandem będącym N-tlenkiem nitronylu, po utworzeniu wykazują skokowe ruchy polegające na podskokach i fragmentacji, trwające samoczynnie przez kilka tygodni. Źródłem okazała się reakcja eliminacji tlenu, powodująca zmiany upakowania cząstek kompleksu a co za tym idzie także deformacje kształtu kryształu.[2] Stosunkowo prostym związkiem którego kryształy ulegają podskakiwaniu jest 1,2,4,5-tetrabromobenzen.
Najciekawszy jest jednak efekt odkryty zupełnie niedawno - podskoki lub wręcz wybuchowa fragmentacja kryształy pod wpływem światła ultrafioletowego. Igiełkowate kryształki o wielkości do 1 mm odsakiwały nawet na kilkanaście centymetrów, a więc na odległość tysiące razy większą od własnej wielkości. Przy pomocy szybkiej kamery i ten efekt dało się utrwalić:
Są to kryształy stosunkowo prostego i jak sądzę łatwego do otrzymania kompleksu kobaltu [Co(NH3)5(NO2)]Cl(NO3) , zaś mechanizm powstawania tak silnych naprężeń, opiera się na jeszcze innej zasadzie. Jednym z ligandów wokół centralnego atomu kobaltu jest ligand nitrytowy NO2, który łączy się z kobaltem za pomocą wiązania koordynacyjnego poprzez azot. Ligand ten mógłby jednak równie dobrze połączyć się poprzez któryś z tlenów, tworząc nieco inny kompleks, i jak się wydaje, podczas naświetlana ultrafioletem taka przemiana właśnie następuje.
Ligand obraca się i przyłącza od innej strony co zmienia upakowanie cząstek, a ponieważ obracają się praktycznie wszystkie w krysztale, bez wytwarzania nowej fazy krystalicznej, dochodzi do nagromadzenia się naprężeń mechanicznych. Znane są dwie formy krystaliczne tego kompleksu - jedna, znana już dotychczas, o pokroju wykształconym przez dodatek inhibitora powodującego zmianę kształtu zarodka. Takie kryształy po oświetleniu ultrafioletem wyginały się, z wypukłością skierowaną w stronę źródła światła, a po kilku godzinach powracały do stanu pierwotnego.
Druga forma to kryształy otrzymane bez dodatków, mniej plastyczne, w których naprężenia nie mogły stopniowo uwalniać się w ciągłym ruchu. Mogło to nastąpić dopiero w wyskoku, do którego dochodziło na kilka sposobów - przez odłamanie końcówki, odłamanie naroży, przełamanie na pół lub podskok całego kryształu bez rozpadu
Czasem kryształ roztrzaskiwał się na kilka kawałków. Zjawisko nazwano "photosalient effect" co tłumaczyłbym jako "efekt fotosprężynujący".
Autorzy artykułu na temat odkrycia przypuszczają, że może przydać się w maszynach molekularnych lub, po opanowaniu, w materiałach w rodzaju sztucznych mięśni.[3] Osobiście obstawiałbym jednak że w zestawieniu z kryształami piezoelektrycznymi mógłby służyć go generowania pojedynczych silnych impulsów, na przykład w pewnych typach czujników.
--------
[2] Ovcharenko VI, Fokin SV, Fursova EY, Kuznetsova OV, Tretyakov EV, Romanenko GV, & Bogomyakov AS (2011). "Jumping crystals": oxygen-evolving metal-nitroxide complexes. Inorganic chemistry, 50 (10), 4307-12 PMID: 21491890
[3] Prof. Panče Naumov, Dr. Subash Chandra Sahoo, Dr. Boris A. Zakharov, Prof. Elena V. Boldyreva (2013). Dynamic Single Crystals: Kinematic Analysis of Photoinduced Crystal Jumping (The Photosalient Effect) Angewandte Chemie International Edition DOI: 10.1002/anie.201303757
[To swoją drogą dosyć dziwna praca. We wstępie autorzy odnoszą się do tego iż dotychczas samoczynne ruchy obserwowano w przyrodzie ożywionej, a więc u zwierząt i u roślin, zaś efekt fotosprężynujący jest ciekawym przykładem ruchów w przyrodzie nieożywionej. Ten fragment został opatrzony aż ośmioma przypisami do prac i książek na temat ruchów w świecie zwierzęcym i przypadkowych prac na temat ruchów roślin. Nie wiem na ile zgadza się to z przyjętymi zwyczajami, ale wygląda mi na sposób zwiększenia objętości bibliografii, aby - kto wie? - całość lepiej wyglądała]
niedziela, 3 listopada 2013
Nietypowe organiczne
Znamy już kilka milionów związków organicznych a wciąż syntezowane są nowe (na pracowni otrzymałem jeden), toteż przebierając w tym ogromie, można wybrać sobie kilka strukturalnych osobliwości.
Domek
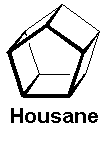
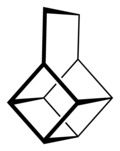
Związek jak z dziecięcego obrazka - housan o kształcie domku:
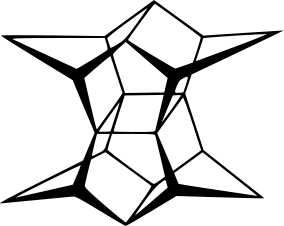
Cząsteczka ze względu na naprężenia występuje w konformacji koperty - z trójkątnym daszkiem odchylonym od płaszczyzny kwadratowej podstawy, ze względu na reaktywność atomów wodoru na zgięciu i skłonność do zamiany w penten, ma ciekawe zastosowania w syntezie organicznej. Spotykam się jednak z innym związkiem, też nazywanym housanem (zresztą nazwy zwyczajowe często są nieoficjalne) wyglądający jak dwa pięciokąty połączone palikami:
Nazwa jednak chyba się szerzej nie przyjęła, więc oficjalnie jest to [5]-pryzman. Jego modyfikacja z dodatkowym węglem, tworzącym "iglicę" nazywana bywa churchanem przez skojarzenie z kościołem:
Szczególnym przypadkiem domkowatego związku jest Pagodan, który skojarzył się twórcom z kształtem chińskiej pagody (albo dwóch jedna na drugiej)
Kuban i inne figury geometryczne
Wśród węglowodorów o ciekawym kształcie, szczególną grupę stanowią te których szkielet stanowi krawędzie wielościanów foremnych, nazywane alkanami platońskimi. Najmniejszą taką molekułą jest Tetraedran, mający kształt czworościanu foremnego
W normalnym przypadku wiązania między atomami węgla tworzą szerszy kąt, bo 109 stopni, tutaj są z powodu geometrii bardzo ściśnięte, przez co naprężona cząsteczka w normalnych warunkach nie powstaje. Jak dotychczas otrzymano tylko pochodne z podstawnikami tert-butylowymi na każdym węglu. Takie pochodne są przestrzennie bardzo zatłoczone i stabilizowane przyciąganiem między grupami. Inne pochodne zawierają podstawniki silanowe, ale wersji niezatłoczonej, czyli czystego wielościanu jeszcze nie otrzymano. Teoretycznie powinien był związkiem stosunkowo trwałym przy nieobecności utleniaczy.
Znany jest też krzemowy analog. Podobną strukturę ma biały fosfor i żółty arsen.
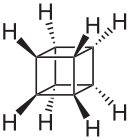
Większą bryłą foremną jest sześcian, a jej węglowodorowy odpowiednik to Kuban - węglowodór o kształcie kostki do gry, z kątami prostymi między wiązaniami.:
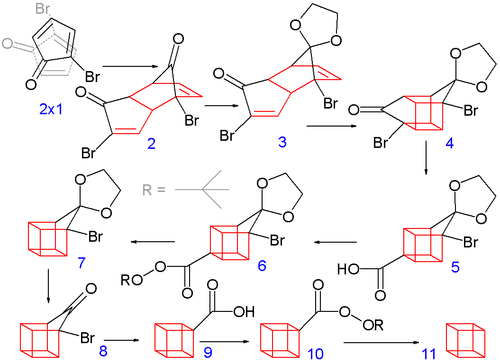
Ta bryła też ma bardzo napięte wiązania, stąd przez długi czas sądzono, że jego synteza będzie niemożliwa. Dokonał tego w 1964 roku Philip Eaton w bardzo sprytny sposób, szyjąc kostkowaty szkielet niczym dziewiarka wymyślną rękawiczkę. A dokonał tego w 11 krokach, które warto chyba pokrótce opisać:
W pierwszym etapie otrzymał bromopochodną cyklopentadienonu. Jest to związek ulegający spontanicznie i dosyć łatwo reakcji addycji Dielsa-Adlera w której cząsteczka posiadająca dwa wiązania podwójne, tworzy sześciokątny pierścień z cząsteczką z jednym takim wiązaniem; jest to addycja typu 4+2 bo wiązania są tworzone przez przesunięcie czterech elektronów jednej i dwóch drugiej czasteczki.
Utworzona w ten sposób cząsteczka zawiera dwa wiązania podwójne. Po naświetleniu światłem odpowiedniej długości następuje kolejna addycja, tym razem 2+2 gdy wiązania podwójne łączą się w czworokącik a cała cząsteczka zagina się w związek nr. 4. Ten etap jest przestrzennie trudniejszy do wyobrażenia, ale to dzięki niemu powstaje kilka pierwszych kątów prostych. Jedna grupa ketonowa zostaje zabezpieczona przez zamienienie w acetal.
Pozostały nam już tylko dwa wiązania do zamknięcia klatki, każde trzeba zawiązać osobno i jeszcze odszczepić niepotrzebne podstawniki. Jedno zostaje otrzymane za pomocą przegrupowania Faworskiego, gdzie w roztworze wodorotlenku atom bromu zostaje usunięty z pobliża grupy ketonowej, a ta zamieniona w karboksylową, otrzymując związek nr. 5. Ponieważ grupa karboksylowa, właściwa kwasom organicznym, sterczy teraz niepotrzebnie z jednego z naroży, należy ją usunąć - najpierw tworzymy ester tertbutylowy, potem utleniamy do nadestru z grupą nadtlenkową, a na koniec usuwamy całe ugrupowanie przez ogrzanie, w wyniku którego dekarboksyluje do dwutlenku węgla.
Zostaje jeszcze jedno wiązanie do utworzenia, tam gdzie znajduje się druga grupa ketonowa, przez dotychczasowe etapy zabezpieczona przez zamianę w acetal. Usuwamy go przez hydrolizę i powtarzamy poprzednie etapy - przegrupowanie Faworskiego, zamiana w ester, utlenienie do nadestru i dekarboksylacja.
Na koniec zostaje nam czysty, nie podstawiony kuban.
Jest to związek stosunkowo trwały z powodu braku łatwych sposobów rozkładu, dlatego otrzymano liczne pochodne. Interesującą jest ośmionitrokuban, stanowiący materiał wybuchowy o największej znanej prędkości detonacji. Ponieważ jednak otrzymuje się go trudno i jest wagowo cenniejszy od złota, na razie nie znalazł zastosowania. Inną ciekawą pochodną jest Basketan - kuban z dodatkową poprzeczką, dającą kształt koszyka:
Ponieważ węgiel nie tworzy pięciu wiązań, następnym węglowodorem o kształcie wielościanu foremnego jest dopiero dodekaedran, a więc cząsteczka będąca szkieletem dwunastościanu z każdą ścianą pięciokątną:
Po raz pierwszy został zsyntezowany w 1982 roku w skomplikowanej syntezie obejmującej 29 kroków, których jednak nie będę tu opisywał, żeby nie zanudzać. Potem odkryto łatwiejszą drogę poprzez izomeryzację pagodanu, który już opisywałem. Jest to związek dosyć trwały, mało napięty, zbliżona do kulistej budowa powoduje, że niekiedy klasyfikuje się go do grupy fulleranów, czyli uwodornionych fullerenów.
Istnieją też liczne węglowodory tworzące inne bryły, na przykład pryzman, o kształcie trójkątnego pryzmatu:
Stanowi strukturalny izomer benzenu, mając wzór C6H6, cząsteczka jest tak silnie naprężona, że rozkłada się wybuchowo z wydzieleniem wodoru. Możliwe są dalsze pryzmany o innych wielokątnych podstawach - [4] pryzman to kuban, zdaje się że istnieje [8]-pryzman ale obliczenia wskazują na szansę istnienia większych, przypominających kształtem odcinki rurki.
Inne podobne do brył związki to oktaedran C12H12 będący szkieletem ośmiościanu z bokami cztero i pięciokątnymi, nonaedran C14H14, dekaedran C16H16 i większe[1]
Cząsteczka Iron maiden
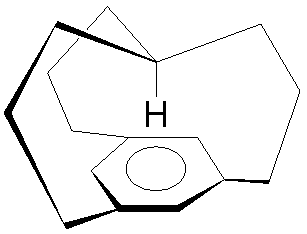
Nazwa cząsteczki nie pochodzi od znanego zespołu muzycznego, aczkolwiek inspiracji nie sposób wykluczyć. Jest to pewien typ cyklofanów, a więc związków zawierających płaski pierścień aromatyczny i poprzeczkę łączącą jego atomy na ukos. W tym konkretnym przypadku trzy poprzeczki tworzą nad pierścieniem "klosz" zakończony zwornikowym węglem, z którego zwisa atom wodoru wycelowany w pierścień niczym kolec:
Stąd też zapewne skojarzenie ze średniowiecznym narzędziem tortur - skrzynią z kolcami na zamykanym wieku, raniącymi zamkniętego w jej osobnika (ale nie zabijającymi, bo wtedy nie było by tortury). Związek tego typu charakteryzuje się ciekawym sygnałem podczas badania przesunięć sygnału protonów za pomocą H-NMR - w technice tej bada się reakcję spinów jąder atomów wodoru umieszczonych w silnym polu magnetycznym, na fale radiowe. Czysty wodór dawałby sygnał przy stałej częstotliwości, wodór w cząsteczkach organicznych reaguje na różne częstotliwości zależnie od tego do czego jest doczepiony. Sygnały reakcji przedstawia się zwykle w skali przesunięć względem jakiegoś wzorca, dla którego przyjmuje się wartość 0, zwykle jest to tetrametylosilan, który daje sygnał poniżej sygnałów większości grup związków organicznych, sygnały pozostałych sięgają więc od 0 do 12 ppm.Wyjątkiem jest wodór tworzący "kolec" Żelaznej Dziewicy - jego przesunięcie sięga daleko za skalę do -4 ppm.
Bullwalen czyli chaos w stanie czystym
Bardzo prosta cząsteczka o wzorze C10H10, z trzema wiązaniami podwójnymi.
Elektrony w związkach organicznych chętnie wędrują, zmieniając kształt czasteczki i liczbę wiązań. W tej cząsteczce mają one wyjątkową swobodę - oprócz możliwości przeskakiwania na miejsce obok, mogą tworzyć nowe wiązania za sprawą przegrupowanie Cope'a. A w każdej z nowych struktur, elektrony mogą przeskakiwać w miejsce obok. Przez to liczba wszystkich możliwych struktur mezomerycznych wynosi dla tej małej cząsteczki aż 1,2 mln! W temperaturze pokojowej i wyższych wszystkie przeskoki następują nieustannie, zatem roztwór bullwalenu stanowi swoisty molekularny chaos - każda cząsteczka w innym stanie.
Nazwa pochodzi od pseudonimu chemika który przewidywał istnienie takiego związku Williama Doeringa, nazywanego Bykiem (Bull)
W zasadzie omówiłem tu praktycznie same węglowodory, związki z dodatkowymi innymi atomami omówię kiedy indziej.
-----
[1] Syntezy poliedrów
Strona miłośnika budowania struktur fullerenów z koralików i słomek: http://thebeadedmolecules.blogspot.com/
Domek
Związek jak z dziecięcego obrazka - housan o kształcie domku:
Cząsteczka ze względu na naprężenia występuje w konformacji koperty - z trójkątnym daszkiem odchylonym od płaszczyzny kwadratowej podstawy, ze względu na reaktywność atomów wodoru na zgięciu i skłonność do zamiany w penten, ma ciekawe zastosowania w syntezie organicznej. Spotykam się jednak z innym związkiem, też nazywanym housanem (zresztą nazwy zwyczajowe często są nieoficjalne) wyglądający jak dwa pięciokąty połączone palikami:
Nazwa jednak chyba się szerzej nie przyjęła, więc oficjalnie jest to [5]-pryzman. Jego modyfikacja z dodatkowym węglem, tworzącym "iglicę" nazywana bywa churchanem przez skojarzenie z kościołem:
Szczególnym przypadkiem domkowatego związku jest Pagodan, który skojarzył się twórcom z kształtem chińskiej pagody (albo dwóch jedna na drugiej)
Kuban i inne figury geometryczne
Wśród węglowodorów o ciekawym kształcie, szczególną grupę stanowią te których szkielet stanowi krawędzie wielościanów foremnych, nazywane alkanami platońskimi. Najmniejszą taką molekułą jest Tetraedran, mający kształt czworościanu foremnego
W normalnym przypadku wiązania między atomami węgla tworzą szerszy kąt, bo 109 stopni, tutaj są z powodu geometrii bardzo ściśnięte, przez co naprężona cząsteczka w normalnych warunkach nie powstaje. Jak dotychczas otrzymano tylko pochodne z podstawnikami tert-butylowymi na każdym węglu. Takie pochodne są przestrzennie bardzo zatłoczone i stabilizowane przyciąganiem między grupami. Inne pochodne zawierają podstawniki silanowe, ale wersji niezatłoczonej, czyli czystego wielościanu jeszcze nie otrzymano. Teoretycznie powinien był związkiem stosunkowo trwałym przy nieobecności utleniaczy.
Znany jest też krzemowy analog. Podobną strukturę ma biały fosfor i żółty arsen.
Większą bryłą foremną jest sześcian, a jej węglowodorowy odpowiednik to Kuban - węglowodór o kształcie kostki do gry, z kątami prostymi między wiązaniami.:
Ta bryła też ma bardzo napięte wiązania, stąd przez długi czas sądzono, że jego synteza będzie niemożliwa. Dokonał tego w 1964 roku Philip Eaton w bardzo sprytny sposób, szyjąc kostkowaty szkielet niczym dziewiarka wymyślną rękawiczkę. A dokonał tego w 11 krokach, które warto chyba pokrótce opisać:
Utworzona w ten sposób cząsteczka zawiera dwa wiązania podwójne. Po naświetleniu światłem odpowiedniej długości następuje kolejna addycja, tym razem 2+2 gdy wiązania podwójne łączą się w czworokącik a cała cząsteczka zagina się w związek nr. 4. Ten etap jest przestrzennie trudniejszy do wyobrażenia, ale to dzięki niemu powstaje kilka pierwszych kątów prostych. Jedna grupa ketonowa zostaje zabezpieczona przez zamienienie w acetal.
Pozostały nam już tylko dwa wiązania do zamknięcia klatki, każde trzeba zawiązać osobno i jeszcze odszczepić niepotrzebne podstawniki. Jedno zostaje otrzymane za pomocą przegrupowania Faworskiego, gdzie w roztworze wodorotlenku atom bromu zostaje usunięty z pobliża grupy ketonowej, a ta zamieniona w karboksylową, otrzymując związek nr. 5. Ponieważ grupa karboksylowa, właściwa kwasom organicznym, sterczy teraz niepotrzebnie z jednego z naroży, należy ją usunąć - najpierw tworzymy ester tertbutylowy, potem utleniamy do nadestru z grupą nadtlenkową, a na koniec usuwamy całe ugrupowanie przez ogrzanie, w wyniku którego dekarboksyluje do dwutlenku węgla.
Zostaje jeszcze jedno wiązanie do utworzenia, tam gdzie znajduje się druga grupa ketonowa, przez dotychczasowe etapy zabezpieczona przez zamianę w acetal. Usuwamy go przez hydrolizę i powtarzamy poprzednie etapy - przegrupowanie Faworskiego, zamiana w ester, utlenienie do nadestru i dekarboksylacja.
Na koniec zostaje nam czysty, nie podstawiony kuban.
Jest to związek stosunkowo trwały z powodu braku łatwych sposobów rozkładu, dlatego otrzymano liczne pochodne. Interesującą jest ośmionitrokuban, stanowiący materiał wybuchowy o największej znanej prędkości detonacji. Ponieważ jednak otrzymuje się go trudno i jest wagowo cenniejszy od złota, na razie nie znalazł zastosowania. Inną ciekawą pochodną jest Basketan - kuban z dodatkową poprzeczką, dającą kształt koszyka:
Ponieważ węgiel nie tworzy pięciu wiązań, następnym węglowodorem o kształcie wielościanu foremnego jest dopiero dodekaedran, a więc cząsteczka będąca szkieletem dwunastościanu z każdą ścianą pięciokątną:
Po raz pierwszy został zsyntezowany w 1982 roku w skomplikowanej syntezie obejmującej 29 kroków, których jednak nie będę tu opisywał, żeby nie zanudzać. Potem odkryto łatwiejszą drogę poprzez izomeryzację pagodanu, który już opisywałem. Jest to związek dosyć trwały, mało napięty, zbliżona do kulistej budowa powoduje, że niekiedy klasyfikuje się go do grupy fulleranów, czyli uwodornionych fullerenów.
Istnieją też liczne węglowodory tworzące inne bryły, na przykład pryzman, o kształcie trójkątnego pryzmatu:
Stanowi strukturalny izomer benzenu, mając wzór C6H6, cząsteczka jest tak silnie naprężona, że rozkłada się wybuchowo z wydzieleniem wodoru. Możliwe są dalsze pryzmany o innych wielokątnych podstawach - [4] pryzman to kuban, zdaje się że istnieje [8]-pryzman ale obliczenia wskazują na szansę istnienia większych, przypominających kształtem odcinki rurki.
Inne podobne do brył związki to oktaedran C12H12 będący szkieletem ośmiościanu z bokami cztero i pięciokątnymi, nonaedran C14H14, dekaedran C16H16 i większe[1]
Cząsteczka Iron maiden
Nazwa cząsteczki nie pochodzi od znanego zespołu muzycznego, aczkolwiek inspiracji nie sposób wykluczyć. Jest to pewien typ cyklofanów, a więc związków zawierających płaski pierścień aromatyczny i poprzeczkę łączącą jego atomy na ukos. W tym konkretnym przypadku trzy poprzeczki tworzą nad pierścieniem "klosz" zakończony zwornikowym węglem, z którego zwisa atom wodoru wycelowany w pierścień niczym kolec:
Stąd też zapewne skojarzenie ze średniowiecznym narzędziem tortur - skrzynią z kolcami na zamykanym wieku, raniącymi zamkniętego w jej osobnika (ale nie zabijającymi, bo wtedy nie było by tortury). Związek tego typu charakteryzuje się ciekawym sygnałem podczas badania przesunięć sygnału protonów za pomocą H-NMR - w technice tej bada się reakcję spinów jąder atomów wodoru umieszczonych w silnym polu magnetycznym, na fale radiowe. Czysty wodór dawałby sygnał przy stałej częstotliwości, wodór w cząsteczkach organicznych reaguje na różne częstotliwości zależnie od tego do czego jest doczepiony. Sygnały reakcji przedstawia się zwykle w skali przesunięć względem jakiegoś wzorca, dla którego przyjmuje się wartość 0, zwykle jest to tetrametylosilan, który daje sygnał poniżej sygnałów większości grup związków organicznych, sygnały pozostałych sięgają więc od 0 do 12 ppm.Wyjątkiem jest wodór tworzący "kolec" Żelaznej Dziewicy - jego przesunięcie sięga daleko za skalę do -4 ppm.
Bullwalen czyli chaos w stanie czystym
Bardzo prosta cząsteczka o wzorze C10H10, z trzema wiązaniami podwójnymi.
Elektrony w związkach organicznych chętnie wędrują, zmieniając kształt czasteczki i liczbę wiązań. W tej cząsteczce mają one wyjątkową swobodę - oprócz możliwości przeskakiwania na miejsce obok, mogą tworzyć nowe wiązania za sprawą przegrupowanie Cope'a. A w każdej z nowych struktur, elektrony mogą przeskakiwać w miejsce obok. Przez to liczba wszystkich możliwych struktur mezomerycznych wynosi dla tej małej cząsteczki aż 1,2 mln! W temperaturze pokojowej i wyższych wszystkie przeskoki następują nieustannie, zatem roztwór bullwalenu stanowi swoisty molekularny chaos - każda cząsteczka w innym stanie.
Nazwa pochodzi od pseudonimu chemika który przewidywał istnienie takiego związku Williama Doeringa, nazywanego Bykiem (Bull)
W zasadzie omówiłem tu praktycznie same węglowodory, związki z dodatkowymi innymi atomami omówię kiedy indziej.
-----
[1] Syntezy poliedrów
Strona miłośnika budowania struktur fullerenów z koralików i słomek: http://thebeadedmolecules.blogspot.com/
Subskrybuj:
Komentarze (Atom)