Po różnych zawirowaniach życiowych wreszcie się udało - dostałem się na studia doktoranckie na WCh UW. W związku z czym pozdrawiam czytelników z tej uczelni.
Po tym jak w zeszłym roku nie udało mi się dostać na doktoranckie na IChO PAN musiałem czegoś sobie poszukać. Na krótko, dzięki upierdliwemu obdzwanianiu czy aby nie mają możliwości przyjęcia na staż, zostałem tam przyjęty na wakat za zastępstwo pracownicy która miała wypadek, ale to skończyło się i w lutym zostałem bez dobrych perspektyw na przyszłość. Potem kilka miesięcy szukałem pracy (temat zderzenia nadziei absolwenta z oczekiwaniami pracodawców jest zresztą godny osobnego wpisu) aż w wakacje udało mi się znaleźć etat w małej fabryczce chemicznej, gdzie jednakowoż wykonywałem głównie prace fizyczne. Gdy pod koniec września ponownie nie udało się dostać do PAN-u, studia na Uniwersytecie Warszawskim pozostawały w zasadzie jedyną możliwością aby móc kontynuować pracę naukową i nie stracić kontaktu z dziedziną.
Doktorat wykonywać będę w grupie profesora Czarnockiego zajmującej się chemią związków naturalnych i syntezą stereokontrolowaną, znam już prawdopodobny temat badań, dość ciekawy, trochę podobny do tematu pracy magisterskiej. Mam nadzieję że będę mógł wrzucać tutaj relacje z prowadzonych badań.
informacje
czwartek, 15 października 2015
środa, 14 października 2015
Tajemnice czerni czyli bardzo długie nazwy
Będąc ostatnio w sklepie przeglądałem różne płyny i proszki do płukania tkanin, szukając czegoś do usuwania zafarbowania, bowiem po nieopatrznym wrzuceniu wraz z bielizną czarnych skarpet, okazało się, że wszystkie rzeczy zabarwiły się na kolor szaro-niebieski. Oczywiście zaglądałem na składy bo nie chodziło mi po prostu o wybielacz. Niestety składy środków czyszczących są zwykle nadmiernie ogólnikowe. Nawet mi, jako chemikowi, skład "10% anionowe środki powierzchniowo czynne, 10% kationowe środki czynne, 10% niejonowe środki czynne" nic właściwie nie mówi. Dlatego też w pewnym zdumieniem odczytałem skład środka mającego przywracać czarny kolor, gdzie nie tylko podano główne składniki, ale w dodatku podano ich pełne nazwy chemiczne. A były to nazwy tak długie i skomplikowane, że ledwie się zmieściły. Osobę nie zorientowaną takie nazwy mogą przerazić. Zaś chemika zaciekawić.
Nazwy te to:
* 4-amino-6-[5-(5-chloro-2,6-difluoropirymidyno-4-ylamino)-2-sulfonianofenyloazo]-5-hydroky-3-{4-[2-(sulfonianooksy)etylosulfonylo]fenyloazo} naftaleno-2,7-disulfonian litu-sodu-wodoru
* 7-(4,6-dichloro-1,3,5-triazyn-2-yloamino-4-hydroksy-3-{4-[2(sulfonianoksy)etylsulfonylo] fenyloazo} naftaleno-2-sulfonian disodu;
* kwas 5-naftaleno-disulfonowy,2-[2-8[[4-chloro-6[[4-[[2-(sulfooksy)etylo]sulfonylo]fenylo]amino-1,3,5-triazin-2-yl]amino]-1-hydroksy-3,6-disulfo-2-naftalenylo]diazenylo]-, sól sodowa(1:5)
Zaś aby je prawidłowo odczytać należy dowiedzieć się coś niecoś na temat tego jak właściwie tworzone są nazwy związków chemicznych.
Nazewnictwo związków organicznych podporządkowane jest zasadzie opisania związków tak, aby możliwe było dysponując samą nazwą rozrysować strukturę cząsteczki. Najczęściej używany sposób traktuje strukturę cząsteczki hierarhicznie, to jest wyróżnia pewien rdzeń do którego przyczepione są podstawniki, do tych mogą być dołączone inne poboczne podstawniki zależnie od stopnia rozgałęzienia. Nazwa wymienia więc kolejno podstawniki podczepione do rdzenia, najczęściej w kolejności alfabetycznej aby na końcu przejść do nazwy rdzenia i zakończyć końcówką specyficzną dla grupy funkcyjnej. Podstawnikom przypisywane są liczbowe określenia miejsca w którym są dołączone do rdzenia, liczone począwszy od grupy funkcyjnej rdzenia. Najbardziej optymalna zasada jest taka, aby zaczynać liczenie podstawników od takiego miejsca, aby przypisane im liczby były jak najmniejsze.
Nazwy podstawników są zwykle tworzone od nazw związków z jakich można by je otrzymać. Podstawnik -CH3, będący metanem bez jednego wodoru, to metyl, podstawnik -CH2-CH3 będący etanem bez jednego wodoru to etyl. Czasem nazwy podstawników pochodzą od innej niż zwykle używana nazwy związku wyjściowego, podstawnik będący benzenem bez jednego wodoru to nie benzenyl tylko fenyl. Pewne grupy mają swoje stałe nazwy, przykładowo złożona z pięciu węgli grupa którą można by nazwać dimetyloprolylową, jest nazywana tert-amylową, zaś grupa utworzona z etenu to grupa winylowa.
Zacznijmy więc od najprostszych przypadków:
Rdzeniem cząsteczki jest dwuwęglowy łańcuch etanu. Do niego podłączone są dwa podstawniki - chlorowy i hydroksylowy. Ten drugi można uznać za grupę funkcyjną zaś sam związek za pochodną alkoholu etylowego. Licząc od węgla przy którym jest grupa -OH, chlor jest połączony z drugim, stąd też nazwa 2-chloroetanol. Następny przykład:
Tutaj sytuację możemy potraktować dwojako - albo uznamy, że to nadal pochodna etanolu, tylko że z dodaną grupą metylową -CH3, albo uznamy że to pochodna propanolu. W tym pierwszym przypadku zaczniemy nazwę od podstawnika zaczynającego się na literę wcześniejszą w alfabecie, będzie to 2-chloro-2-metyloetanol. Zwykle jednak w takich sytuacjach preferuje się przedłużenie rdzenia czyli potraktowanie metylu jako dalszej części łańcucha. Związek będzie wtedy pochodną propanolu i nazywać się będzie 2-chloropropanol.
Oba sposoby opisu są w zasadzie równoważne bo z obu można wywnioskować poprawną strukturę, preferowany jest jednak ten drugi, bowiem skutkuje prostszą nazwą. Różnice w sposobie opisu powodują, że często związek na wiele synonimów nazwy.
Tutaj znów sytuację można różnie opisywać. Możemy na przykład uznać, że jest to pochodna etanu, z chlorem przy jednym węglu, dwoma metylami przy drugim i grupą fenylową przy tymże. Wtedy nazwa będzie brzmiała 1-chloro-2,2-dimetylo-2-fenyloetan. Możemy uznać jedną z grup metylowych za przedłużenie łańcucha, tak że będzie to pochodna propanu o nazwie 1-chloro-2-metylo-2-fenylopropan. Ale możemy też uznać, że dwie grupy metylowe i łączący je węgiel to główny rdzeń, wtedy związek będzie się nazywał 2-chlorometylo-2-fenylopropan. Ja preferowałbym tą drugą ale w internecie związek częściej występuje pod tą ostatnią.
Kolejny przypadek zawiera podstawniki połączone przez różne miejsca:
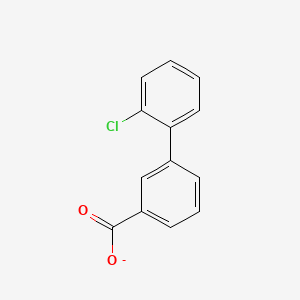
Tą cząsteczkę można opisać na dwa sposoby - albo jako pochodną chlorobenzenu albo jako pochodną kwasu benzoesowego. W tym pierwszym przypadku grupa złożona z kwasu benzoesowego będzie grupą 3-karboksyfenolową albowiem dla tego podstawnika grupą funkcyjną od której liczone są miejsca jest grupa karboksylowa. Podstawnik jest podłączony przez węgiel od którego grupa ta jest przy trzecim stąd nazwa całego podstawnika 3-karboksyfenylowy. Licząc w rdzeniu od chloru, grupa ta znajduje się na drugim miejscu, stąd aby nie pomieszać cyferek, trzeba dodać nawias w którym mieścić się będzie nazwa całej grupy, stąd zapis: 2-(3-karboksyfenlo)-chlorobenzen.
Możemy też potraktować cząsteczkę jak pochodną kwasu benzoesowego, wówczas nazwa będzie brzmiała kwas 3-(2-chlorofenylo)-benzoesowy. Ta druga wersja jest częściej używana.
A teraz podstawnik z podstawnikiem z podstawnikiem:
I trzy możliwości - albo to pochodna chlorobenzenu, albo fenolu albo kwasu benzoesowego. Dla pierwszej wersji nazwa brzmi: 2-{4-[2-(2-karboksylofenylo)fenoksylo]}-metylenochlorobenzen bo jest to chlorobenzen do którego w miejscu 2 podłączono przez mostek metylenowy -CH2- fenol, łączony przez pozycję 4 wobec grupy hydroksylowej i sam mający przy pozycji 2 grupę karboksyfenylową, połączoną przez węgiel w pozycji 2. I tu widać ten hierarchiczny opis.
Dla drugiej opcji będzie to 4-(2-chlorofenylometyleno)-2-(2-karboksyfenylo)-fenol. Dla trzeciej kwas 2-{2-[4-(2-chlorofenylometyleno)-fenoksy]}-benzoesowy. Ta druga wersja jest preferowana bo jest w niej mniej nawiasów.
Skoro już przeszliśmy ten krótki kurs nazewnictwa, zajmijmy się tymi długaśnymi nazwami z doczerniacza.
4-amino-6
Pierwszy związek jest bardzo długi:
Wiemy, że rdzeń ten zwiera już dwie grupy sulfonowe, a co z resztą? Resztą są cztery podstawniki, w tym dwa bardzo rozbudowane, pierwszy to fragment "4-amino" i jest to grupa aminowa -NH2 podłączona przy pozycji 4 a drugi zaczyna się od "6-[5-(5-chloro-" trzeci to "5-hydroksy" i jest grupą hydroksylową -OH podczepioną przy pozycji 5, czwarty zaczyna się od "3-{4-[2(sulfonianooksy". Nazwę można więc rozbić na części oznaczając je kolorami:
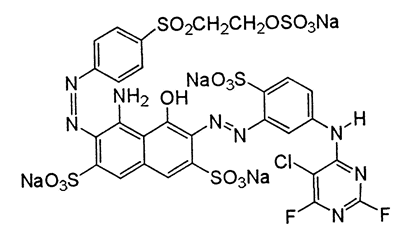
4-amino-6-[5-(5-chloro-2,6-difluoropirymidyno-4-ylamino)-2-sulfonianofenyloazo]-5-hydroksy-3-{4-[2-(sulfonianooksy)etylosulfonylo]fenyloazo} naftaleno-2,7-disulfonian litu-sodu-wodoru
To nadal jest zawiłe ale już widzimy jak to opanować. Teraz rozbierzmy na części podstawniki:
* 6-[5-(5-chloro-2,6-difluoropirymidyno-4-ylamino)-2-sulfonianofenyloazo] - tutaj mamy trzy wyraźne części. Grupa zaczyna się od pirymidyny zawierającej dwa podstawniki fluorowe w pozycjach 2 i 6 wobec azotu od którego zaczynamy liczyć i chlorowy w pozycji 5, i jest połączona przez węgiel 4 z mostkową aminą:
Poprzez tą aminę połączona jest z węglem 5 grupy 2-sulfonianofenyloazowej:
Która poprzez grupę azową połączona jest z rdzeniem naftalenowym w pozycji 6
Drugi podstawnik:
* 3-{4-[2-(sulfonianooksy)etylosulfonylo]fenyloazo} - zaczyna się od grupy sulfonianooksylowej, czyli reszty kwasu siarkowego połączonej przez tlen -OHSO3 z grupą etylową do drugiego węgla. Grupa ta przez pierwszy węgiel etylu jest połączona z sulfonylem poprzez który w pozycji 4 łączy się z grupą fenyloazową:
a przez ugrupowanie azowe z miejscem 3 rdzenia naftalenowego.
Po złożeniu tego do kupy otrzymujemy taki oto związek, tu w wersji soli sodowej:
Czym jest ten skomplikowany związek? Rozpuszczalną formą barwnika azowego. Grupy azowe -N=N- to silne chromofory a więc zapewniają cząsteczce kolor, podstawione wzmacniającymi efekt grupami aromatycznymi z wyciągającymi elektrony podstawnikami halogenowymi dają w efekcie silne zabarwienie. Ten konkretny związek znany jest też pod nazwą handlową Reactive Blue 225 i farbuje na kolor ciemnoniebieski
7-[4-(6-dichloro
Następny związek w składzie to także bardzo rozgałęziona sól sulfoniowa będąca pochodną naftalenu. Zaznaczmy poszczególne części:
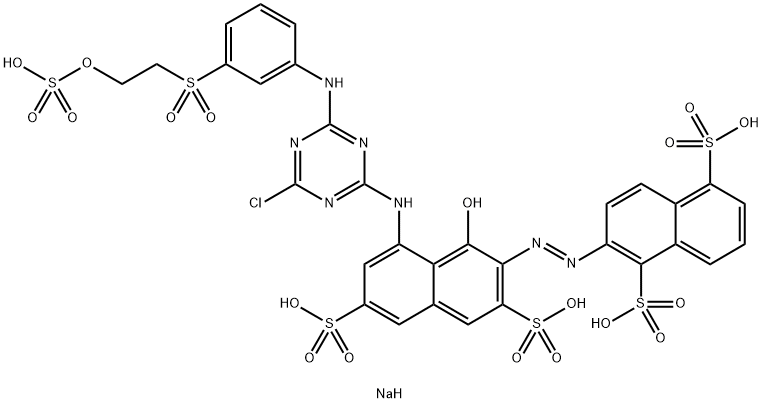
7-(4,6-dichloro-1,3,5-triazyn-2-yloamino-4-hydroksy-3-{4-[2(sulfonianoksy)etylsulfonylo] fenyloazo} naftaleno-2-sulfonian disodu;
Rdzeniem jest naftalen, który w pozycji 4 ma dołączoną grupę hydroksylową a w pozycji 2 sulfonylową. Dwa pozostałe podstawniki są rozbudowane.
Pierwszy to pierścień 1,3,5-triazyny, związku aromatycznego w którym w sześciokątnym pierścieniu co drugi atom stanowi azot. Pierścień w dwóch miejscach podstawiony jest chlorem i poprzez węgiel w pozycji 2 połączony z aminą, a ta z naftalenem w pozycji 7. Drugi jest taki sam jak w poprzednim związku - grupa sulfoksylowa połączona przez tlen z etanem, ten z ugrupowaniem sulfonowym, to z benzenem a ten z grupą azową łączącą go z naftalenem.
Ostateczny wzór przedstawia się zatem następująco:
Związek ma też oznaczenie handlowe Orange HF SNK lub Reactive Orange FD 19969 FW, jest to zatem kolejny barwnik azowy, tym razem zapewne ciemno-pomarańczowy. Znajduje się na listach substancji niebezpiecznych w dziale substancji wywołujących podrażnienia skóry[2] [3]
kwas 5-naftaleno-disulfonowy
Ten związek będzie można już łatwiej rozszyfrować bo pewne jego elementy są podobne do poprzednich.
Zaznaczając poszczególne części, jest to: kwas 2-[2-[8-[[4-chloro-6[[4-[[2-(sulfooksy)etylo]sulfonylo]fenylo]amino-1,3,5-triazin-2-yl]amino]-1-hydroksy-3,6-disulfo-2-naftalenylo]diazenylo]-5-naftaleno-disulfonowy sól sodowa(1:5)
Cząsteczka wygląda zatem następująco:
Nazwa handlowa Reactive Red 195A [4]
I po co to wszystko?
Cóż. Czarne tkaniny szarzeją z powodu spierania lub ścierania ciemnych barwników. Dlatego omawiany doczerniacz po prostu farbuje tkaninę. Są to barwniki reaktywne, to jest wchodzące w reakcję z materiałem włókna i tworzące trwałe połączenia; reakcji ulegają włókna naturalne, dlatego preparat nie nadaje się do tkanin z włókiem całkowicie sztucznych.
Zauważmy, że żaden z wymienionych barwników nie jest czarny. Tak na prawdę nie ma czarnych barwników, czerń oznacza, że dany przedmiot pochłonął na tyle dużo światła, iż nie jesteśmy w stanie określić jego koloru, jednak rozcieńczając czarne tusze możemy się przekonać, że zwykle są one po prostu mieszanką bardzo ciemnych brązów i błękitów (zaś brąz to bardzo ciemny odcień pomarańczy). Czarne tulipany są w rzeczywistości fioletowe, tylko dość intensywnie. Czerń można osiągnąć zatem albo używając jakiegoś barwnika w tak dużym stężeniu, że będzie pochłaniał większość światła, albo mieszankę barwników, z których każdy pochłania jakąś część spektrum.
W tym przypadku zmieszanie barwników intensywnie niebieskiego, pomarańczowego i żółtego, daje czerń. Być może gdybyśmy włożyli do prania białą tkaninę, to okazałaby się ostatecznie raczej szara, ale dla tkanin czarnych które tylko nieco spłowiały i wytarły się wystarczy przyciemnienie jasnych miejsc aby wyglądały na zdecydowanie czarniejsze.
----------
* http://www.auchandirect.pl/sklep/artykuly/1171_1240_1630/99701801/Dla-Domu/Pralnia/Odplamiacze/Renowator-koloru-czarnego-Dylon-2-szt.-1-szt
[2] http://www.pis.gov.pl/userfiles/file/departament%20Higieny%20%C5%9Arodowiska%20JUPIK/chemia%20prawo/elincsk-wykaz%20substancji.pdf pozycja 404-600-07
[3] http://www.chemindustry.com/chemicals/41146.html
[4] http://ofmpub.epa.gov/sor_internet/registry/substreg/searchandretrieve/advancedsearch/externalSearch.do?p_type=CASNO&p_value=77365-64-1
Nazwy te to:
* 4-amino-6-[5-(5-chloro-2,6-difluoropirymidyno-4-ylamino)-2-sulfonianofenyloazo]-5-hydroky-3-{4-[2-(sulfonianooksy)etylosulfonylo]fenyloazo} naftaleno-2,7-disulfonian litu-sodu-wodoru
* 7-(4,6-dichloro-1,3,5-triazyn-2-yloamino-4-hydroksy-3-{4-[2(sulfonianoksy)etylsulfonylo] fenyloazo} naftaleno-2-sulfonian disodu;
* kwas 5-naftaleno-disulfonowy,2-[2-8[[4-chloro-6[[4-[[2-(sulfooksy)etylo]sulfonylo]fenylo]amino-1,3,5-triazin-2-yl]amino]-1-hydroksy-3,6-disulfo-2-naftalenylo]diazenylo]-, sól sodowa(1:5)
Zaś aby je prawidłowo odczytać należy dowiedzieć się coś niecoś na temat tego jak właściwie tworzone są nazwy związków chemicznych.
Nazewnictwo związków organicznych podporządkowane jest zasadzie opisania związków tak, aby możliwe było dysponując samą nazwą rozrysować strukturę cząsteczki. Najczęściej używany sposób traktuje strukturę cząsteczki hierarhicznie, to jest wyróżnia pewien rdzeń do którego przyczepione są podstawniki, do tych mogą być dołączone inne poboczne podstawniki zależnie od stopnia rozgałęzienia. Nazwa wymienia więc kolejno podstawniki podczepione do rdzenia, najczęściej w kolejności alfabetycznej aby na końcu przejść do nazwy rdzenia i zakończyć końcówką specyficzną dla grupy funkcyjnej. Podstawnikom przypisywane są liczbowe określenia miejsca w którym są dołączone do rdzenia, liczone począwszy od grupy funkcyjnej rdzenia. Najbardziej optymalna zasada jest taka, aby zaczynać liczenie podstawników od takiego miejsca, aby przypisane im liczby były jak najmniejsze.
Nazwy podstawników są zwykle tworzone od nazw związków z jakich można by je otrzymać. Podstawnik -CH3, będący metanem bez jednego wodoru, to metyl, podstawnik -CH2-CH3 będący etanem bez jednego wodoru to etyl. Czasem nazwy podstawników pochodzą od innej niż zwykle używana nazwy związku wyjściowego, podstawnik będący benzenem bez jednego wodoru to nie benzenyl tylko fenyl. Pewne grupy mają swoje stałe nazwy, przykładowo złożona z pięciu węgli grupa którą można by nazwać dimetyloprolylową, jest nazywana tert-amylową, zaś grupa utworzona z etenu to grupa winylowa.
Zacznijmy więc od najprostszych przypadków:
Rdzeniem cząsteczki jest dwuwęglowy łańcuch etanu. Do niego podłączone są dwa podstawniki - chlorowy i hydroksylowy. Ten drugi można uznać za grupę funkcyjną zaś sam związek za pochodną alkoholu etylowego. Licząc od węgla przy którym jest grupa -OH, chlor jest połączony z drugim, stąd też nazwa 2-chloroetanol. Następny przykład:
Tutaj sytuację możemy potraktować dwojako - albo uznamy, że to nadal pochodna etanolu, tylko że z dodaną grupą metylową -CH3, albo uznamy że to pochodna propanolu. W tym pierwszym przypadku zaczniemy nazwę od podstawnika zaczynającego się na literę wcześniejszą w alfabecie, będzie to 2-chloro-2-metyloetanol. Zwykle jednak w takich sytuacjach preferuje się przedłużenie rdzenia czyli potraktowanie metylu jako dalszej części łańcucha. Związek będzie wtedy pochodną propanolu i nazywać się będzie 2-chloropropanol.
Oba sposoby opisu są w zasadzie równoważne bo z obu można wywnioskować poprawną strukturę, preferowany jest jednak ten drugi, bowiem skutkuje prostszą nazwą. Różnice w sposobie opisu powodują, że często związek na wiele synonimów nazwy.
Tutaj znów sytuację można różnie opisywać. Możemy na przykład uznać, że jest to pochodna etanu, z chlorem przy jednym węglu, dwoma metylami przy drugim i grupą fenylową przy tymże. Wtedy nazwa będzie brzmiała 1-chloro-2,2-dimetylo-2-fenyloetan. Możemy uznać jedną z grup metylowych za przedłużenie łańcucha, tak że będzie to pochodna propanu o nazwie 1-chloro-2-metylo-2-fenylopropan. Ale możemy też uznać, że dwie grupy metylowe i łączący je węgiel to główny rdzeń, wtedy związek będzie się nazywał 2-chlorometylo-2-fenylopropan. Ja preferowałbym tą drugą ale w internecie związek częściej występuje pod tą ostatnią.
Kolejny przypadek zawiera podstawniki połączone przez różne miejsca:
Tą cząsteczkę można opisać na dwa sposoby - albo jako pochodną chlorobenzenu albo jako pochodną kwasu benzoesowego. W tym pierwszym przypadku grupa złożona z kwasu benzoesowego będzie grupą 3-karboksyfenolową albowiem dla tego podstawnika grupą funkcyjną od której liczone są miejsca jest grupa karboksylowa. Podstawnik jest podłączony przez węgiel od którego grupa ta jest przy trzecim stąd nazwa całego podstawnika 3-karboksyfenylowy. Licząc w rdzeniu od chloru, grupa ta znajduje się na drugim miejscu, stąd aby nie pomieszać cyferek, trzeba dodać nawias w którym mieścić się będzie nazwa całej grupy, stąd zapis: 2-(3-karboksyfenlo)-chlorobenzen.
Możemy też potraktować cząsteczkę jak pochodną kwasu benzoesowego, wówczas nazwa będzie brzmiała kwas 3-(2-chlorofenylo)-benzoesowy. Ta druga wersja jest częściej używana.
A teraz podstawnik z podstawnikiem z podstawnikiem:
I trzy możliwości - albo to pochodna chlorobenzenu, albo fenolu albo kwasu benzoesowego. Dla pierwszej wersji nazwa brzmi: 2-{4-[2-(2-karboksylofenylo)fenoksylo]}-metylenochlorobenzen bo jest to chlorobenzen do którego w miejscu 2 podłączono przez mostek metylenowy -CH2- fenol, łączony przez pozycję 4 wobec grupy hydroksylowej i sam mający przy pozycji 2 grupę karboksyfenylową, połączoną przez węgiel w pozycji 2. I tu widać ten hierarchiczny opis.
Dla drugiej opcji będzie to 4-(2-chlorofenylometyleno)-2-(2-karboksyfenylo)-fenol. Dla trzeciej kwas 2-{2-[4-(2-chlorofenylometyleno)-fenoksy]}-benzoesowy. Ta druga wersja jest preferowana bo jest w niej mniej nawiasów.
Skoro już przeszliśmy ten krótki kurs nazewnictwa, zajmijmy się tymi długaśnymi nazwami z doczerniacza.
4-amino-6
Pierwszy związek jest bardzo długi:
4-amino-6-[5-(5-chloro-2,6-difluoropirymidyno-4-ylamino)-2-sulfonianofenyloazo]-5-hydroksy-3-{4-[2-(sulfonianooksy)etylosulfonylo]fenyloazo} naftaleno-2,7-disulfonian litu-sodu-wodorujednak już z pobieżnego przejrzenia wychwycić można czym jest tutaj rdzeń do którego podczepiono podstawniki - to sama końcówka nazwy "naftaleno-2,7-disulfonian litu-sodu-wodoru". Mamy tu więc do czynienia z rozbudowaną solą sulfonową, zobojętnioną częściowo sodem a częściowo litem, z dwiema grupami sulfonowymi pochodzącymi od kwasu siarkowego w pozycjach 2 i 7. Naftalen to związek złożony z dwóch pierścieni aromatycznych połączonych bokiem i może mieć maksymalnie do ośmiu podstawników liczonych w tej kolejności:
Wiemy, że rdzeń ten zwiera już dwie grupy sulfonowe, a co z resztą? Resztą są cztery podstawniki, w tym dwa bardzo rozbudowane, pierwszy to fragment "4-amino" i jest to grupa aminowa -NH2 podłączona przy pozycji 4 a drugi zaczyna się od "6-[5-(5-chloro-" trzeci to "5-hydroksy" i jest grupą hydroksylową -OH podczepioną przy pozycji 5, czwarty zaczyna się od "3-{4-[2(sulfonianooksy". Nazwę można więc rozbić na części oznaczając je kolorami:
4-amino-6-[5-(5-chloro-2,6-difluoropirymidyno-4-ylamino)-2-sulfonianofenyloazo]-5-hydroksy-3-{4-[2-(sulfonianooksy)etylosulfonylo]fenyloazo} naftaleno-2,7-disulfonian litu-sodu-wodoru
To nadal jest zawiłe ale już widzimy jak to opanować. Teraz rozbierzmy na części podstawniki:
* 6-[5-(5-chloro-2,6-difluoropirymidyno-4-ylamino)-2-sulfonianofenyloazo] - tutaj mamy trzy wyraźne części. Grupa zaczyna się od pirymidyny zawierającej dwa podstawniki fluorowe w pozycjach 2 i 6 wobec azotu od którego zaczynamy liczyć i chlorowy w pozycji 5, i jest połączona przez węgiel 4 z mostkową aminą:
Poprzez tą aminę połączona jest z węglem 5 grupy 2-sulfonianofenyloazowej:
Która poprzez grupę azową połączona jest z rdzeniem naftalenowym w pozycji 6
Drugi podstawnik:
* 3-{4-[2-(sulfonianooksy)etylosulfonylo]fenyloazo} - zaczyna się od grupy sulfonianooksylowej, czyli reszty kwasu siarkowego połączonej przez tlen -OHSO3 z grupą etylową do drugiego węgla. Grupa ta przez pierwszy węgiel etylu jest połączona z sulfonylem poprzez który w pozycji 4 łączy się z grupą fenyloazową:
a przez ugrupowanie azowe z miejscem 3 rdzenia naftalenowego.
Po złożeniu tego do kupy otrzymujemy taki oto związek, tu w wersji soli sodowej:
Czym jest ten skomplikowany związek? Rozpuszczalną formą barwnika azowego. Grupy azowe -N=N- to silne chromofory a więc zapewniają cząsteczce kolor, podstawione wzmacniającymi efekt grupami aromatycznymi z wyciągającymi elektrony podstawnikami halogenowymi dają w efekcie silne zabarwienie. Ten konkretny związek znany jest też pod nazwą handlową Reactive Blue 225 i farbuje na kolor ciemnoniebieski
7-[4-(6-dichloro
Następny związek w składzie to także bardzo rozgałęziona sól sulfoniowa będąca pochodną naftalenu. Zaznaczmy poszczególne części:
7-(4,6-dichloro-1,3,5-triazyn-2-yloamino-4-hydroksy-3-{4-[2(sulfonianoksy)etylsulfonylo] fenyloazo} naftaleno-2-sulfonian disodu;
Rdzeniem jest naftalen, który w pozycji 4 ma dołączoną grupę hydroksylową a w pozycji 2 sulfonylową. Dwa pozostałe podstawniki są rozbudowane.
Pierwszy to pierścień 1,3,5-triazyny, związku aromatycznego w którym w sześciokątnym pierścieniu co drugi atom stanowi azot. Pierścień w dwóch miejscach podstawiony jest chlorem i poprzez węgiel w pozycji 2 połączony z aminą, a ta z naftalenem w pozycji 7. Drugi jest taki sam jak w poprzednim związku - grupa sulfoksylowa połączona przez tlen z etanem, ten z ugrupowaniem sulfonowym, to z benzenem a ten z grupą azową łączącą go z naftalenem.
Ostateczny wzór przedstawia się zatem następująco:
Związek ma też oznaczenie handlowe Orange HF SNK lub Reactive Orange FD 19969 FW, jest to zatem kolejny barwnik azowy, tym razem zapewne ciemno-pomarańczowy. Znajduje się na listach substancji niebezpiecznych w dziale substancji wywołujących podrażnienia skóry[2] [3]
kwas 5-naftaleno-disulfonowy
Ten związek będzie można już łatwiej rozszyfrować bo pewne jego elementy są podobne do poprzednich.
Zaznaczając poszczególne części, jest to: kwas 2-[2-[8-[[4-chloro-6[[4-[[2-(sulfooksy)etylo]sulfonylo]fenylo]amino-1,3,5-triazin-2-yl]amino]-1-hydroksy-3,6-disulfo-2-naftalenylo]diazenylo]-5-naftaleno-disulfonowy sól sodowa(1:5)
Cząsteczka wygląda zatem następująco:
Nazwa handlowa Reactive Red 195A [4]
I po co to wszystko?
Cóż. Czarne tkaniny szarzeją z powodu spierania lub ścierania ciemnych barwników. Dlatego omawiany doczerniacz po prostu farbuje tkaninę. Są to barwniki reaktywne, to jest wchodzące w reakcję z materiałem włókna i tworzące trwałe połączenia; reakcji ulegają włókna naturalne, dlatego preparat nie nadaje się do tkanin z włókiem całkowicie sztucznych.
Zauważmy, że żaden z wymienionych barwników nie jest czarny. Tak na prawdę nie ma czarnych barwników, czerń oznacza, że dany przedmiot pochłonął na tyle dużo światła, iż nie jesteśmy w stanie określić jego koloru, jednak rozcieńczając czarne tusze możemy się przekonać, że zwykle są one po prostu mieszanką bardzo ciemnych brązów i błękitów (zaś brąz to bardzo ciemny odcień pomarańczy). Czarne tulipany są w rzeczywistości fioletowe, tylko dość intensywnie. Czerń można osiągnąć zatem albo używając jakiegoś barwnika w tak dużym stężeniu, że będzie pochłaniał większość światła, albo mieszankę barwników, z których każdy pochłania jakąś część spektrum.
W tym przypadku zmieszanie barwników intensywnie niebieskiego, pomarańczowego i żółtego, daje czerń. Być może gdybyśmy włożyli do prania białą tkaninę, to okazałaby się ostatecznie raczej szara, ale dla tkanin czarnych które tylko nieco spłowiały i wytarły się wystarczy przyciemnienie jasnych miejsc aby wyglądały na zdecydowanie czarniejsze.
----------
* http://www.auchandirect.pl/sklep/artykuly/1171_1240_1630/99701801/Dla-Domu/Pralnia/Odplamiacze/Renowator-koloru-czarnego-Dylon-2-szt.-1-szt
[2] http://www.pis.gov.pl/userfiles/file/departament%20Higieny%20%C5%9Arodowiska%20JUPIK/chemia%20prawo/elincsk-wykaz%20substancji.pdf pozycja 404-600-07
[3] http://www.chemindustry.com/chemicals/41146.html
[4] http://ofmpub.epa.gov/sor_internet/registry/substreg/searchandretrieve/advancedsearch/externalSearch.do?p_type=CASNO&p_value=77365-64-1
wtorek, 6 października 2015
Chemiczne wieści (2.)
Wysokociśnieniowy osm.
Zachowanie się materiałów pod ekstremalnie wysokim ciśnieniem to dość ciekawa sprawa Ciała stałe zasadniczo uznaje się za nieściśliwe, jednak w rzeczywistości mają pewną niewielką ściśliwość, zaś poddanie ich wysokiemu ciśnieniu powoduje zbliżenie budujących je atomów, czasem powodując przemianę do nowej formy uporządkowania lub ujawnienie się nietypowych cech.
Zespół naukowców pod kierunkiem niemieckiego uniwersytetu Bayreuth dokonał ostatnio dość szczególnego odkrycia. Przy pomocy nowej komory ciśnieniowej udało się im wytworzyć najwyższe dotąd otrzymane ciśnienie statyczne - nacisk 770 GPa, czyli ciśnienie dwa razy większe niż w jądrze Ziemi. Ciśnieniu temu poddano natomiast najbardziej gęsty metal - osm - znany też z bardzo niskiej ściśliwości.
Jeśli prawie najmniej ściśliwy materiał poddano najwyższemu ciśnieniu, to chyba powinno z tego coś wyniknąć? Wbrew oczekiwaniom osm nie przyjął żadnej nowej struktury krystalicznej, jedynie atomy nieco się do siebie przybliżyły, zachowując ten sam układ co w warunkach normalnych. Zaskoczeniem okazało się natomiast coś innego - pomiędzy atomami oprócz znanych już wiązań metalicznych, utworzonych przez elektrony walencyjne, zaczęły się także pojawiać oddziaływania utworzone przez elektrony wewnętrznych powłok elektronowych, które nigdy nie biorą udziału w tworzeniu wiązań. [1]
Wcześniej znane były wyliczenia teoretyczne sugerujące możliwość tworzenia wiązań między wewnętrznymi elektronami przy dużych ciśnieniach, ale teraz taka możliwość znalazła jakieś potwierdzenie w badaniach rentgenowskich rzeczywistego materiału.
Najtrudniej topliwy materiał
Tantal, metal przejściowy podobny do cyrkonu, jest znany z wysokotopliwego węgliku, który staje się płynny dopiero w temperaturze 3880*C, podobną temperaturę topnienia ma węglik hafnu. Połączenie tych substancji daje materiał o jeszcze większej odporności na temperaturę, dla składu Ta4HfC5 topiący się dopiero przy 3990 stopniach Celsiusza. Ale fizykochemicy nie poprzestają. Nowe wyliczenia jakie właśnie opublikowano sugerują możliwość stworzenia jeszcze trwalszego materiału. Wedle symulacji mieszany węglik-azotek hafnu o optymalnym składzie HfN0,38C0,51, osiągnąć może temperaturę topnienia nawet do 4400*C.[2]
Pozostaje teraz tylko poczekać na próby uzyskania nowego materiału.
Bateria z grzybów
W poprzednim odcinku wieści mówiłem już o otrzymywaniu kwantowych kropek ze zmiksowanej kapusty, dlatego baterie do telefonów ze zwęglonych grzybów nie będą chyba aż tak zaskakujące.
Jednym z głównych komponentów baterii litowych jest grafitowa anoda, zwykle wytwarzana z syntetycznego grafitu porowatego. Jego wytworzenie w ilościach przemysłowych jest jednak nieco skomplikowane i niezbyt ekologiczne, stąd liczne próby stworzenia dobrej alternatywy. Jedną z tych prób opisuje praca badaczy z University of California.
Wzięli oni cienki plaster wycięty z owocnika grzyba, akurat w tym przypadku była to pieczarka, po czym poddali go zwęgleniu w hydroreaktorze w wysokiej temperaturze. Otrzymany zwęglony plaster dodatkowo wyżarzono uzyskując porowaty materiał złożony ze splecionych węglowych włókien zachowujących strukturę strzępek grzyba i przewodzący prąd, będący dobrym zamiennikiem grafitu. Anoda wytworzona ze zwęglonego grzyba nie potrzebuje dodatkowych lepiszczy, dobrze przyjmuje płynny elektrolit i dobrze oddziałuje z jonami. Bardzo możliwe że ze względu na strukturę będzie wytrzymywała więcej cykli ładowania.[3]
Woda orto, woda para
Jądro atomu wodoru to proton, który jako samotna cząstka posiada szczególną właściwość jaką jest spin. W dużym uproszczeniu można przedstawić to jako wektor momentu pędu protonu, mogącego obracać się bądź w jedną lub w drugą stronę - opis kwantowy tego zjawiska jest dużo bardziej skomplikowany. Ponieważ proton jest cząstką naładowaną, jego spin powoduje powstanie małego jądrowego pola magnetycznego. W sytuacji gdy mamy cząsteczkę wodoru składającą się z dwóch atomów te jądrowe pola magnetyczne oddziałują ze sobą i możliwe stają się dwie sytuacje którym odpowiadają różne energie - wodór orto ma spiny skierowane w tą samą stronę, wodór para w przeciwną. Ta druga sytuacja jest minimalnie korzystniejsza energetycznie jednak różnica energii jest na tyle mała że w warunkach normalnych wodór posiada mieszankę cząsteczek z tych dwóch stanów z przewagą ortowodoru.
To zresztą ciekawa sytuacja - pod wpływem temperatury trwalszy parawodór przechodzi w ortowodór, natomiast przemiana w drugą stronę jest powolna bowiem utrudnia ją zabronione przejście kwantowe. W efekcie w wodorze gazowym przeważa mniej trwała energetycznie odmiana, co ma też przełożenie na skład wodoru ciekłego. W niskich temperaturach powolna przemiana ortowodoru w trwalszy parawodór ma istotne znaczenie dla przechowywania, bowiem przemiana ta przebiega z wydzielaniem ciepła. Aby więc ułatwić przechowywanie ciekłego wodoru, katalizuje się tą przemianę przy pomocy odpowiedniego dielektryka otrzymując przewagę trwalszej formy.
Wróćmy jednak do naszego newsa.
W cząsteczce wody dwa wodory znajdują się na tyle blisko siebie, że także i u nich powinna być możliwa izomeria spinowa, jednak dotychczas nie udało się tego wykryć. Cząsteczki wody oddziaływały ze sobą powodując ciągłą zmianę spinów, toteż trudno było uchwycić sygnał od populacji poszczególnych izomerów. Jak się jednak okazało, możliwe jest odizolowanie od siebie cząsteczek. Zespół badaczy z University of Suthampton otrzymał pochodną fullerenu C60 z pojedynczymi cząsteczkami wody wewnątrz węglowej kul. Tego typu połączenie stanowi kolejny przykład związków cząsteczek "połączonych acz nie związanych" jak omawiane tu kiedyś katenany.
Cząstki C60@H2O były wystarczająco odizolowane aby w niskich temperaturach możliwe było wykrycie czystych sygnałów izomerów spinowych wody i przemian jednego w drugi.
[4]
Paliwo z powietrza
Temat przeróbki dwutlenku węgla na paliwo jest aktualnie bardzo gorący, stąd też w ostatnich miesiącach ukazało się wiele doniesień dotyczących nowych sposobów takiej syntezy.
Wedle doniesień z początku sierpnia zespół z Argonne National Laboratory stworzył nowy katalizator do reakcji zamiany dwutlenku węgla i wody w metanol. Znane dotychczas katalizatory oparte o tlenki cynku i glinu zostały zmodyfikowane poprzez precyzyjne umieszczenie na powierzchni tlenku cynku klastrów czterech atomów miedzi, stanowiących centrum katalityczne do którego przyłącza się cząsteczka CO2. Materiał pozwala na przeprowadzanie reakcji w warunkach niższego ciśnienia i temperatury, co poprawia opłacalność całego procesu produkcyjnego. [5]
A co robić z metanolem? Można go użyć jako paliwa, ale można też poddać innym procesom. Pod koniec września pojawiła się praca zespołu z ETH w Zurychu na temat nowego katalizatora umożliwiający ekonomiczny proces konwersji metanol-olefina (MTO). Metanol lub eter dimetylowy pod odpowiednim ciśnieniem może ulegać przemianie na powierzchni tlenku cynku, z wytworzeniem etenu. [6]
Mniej toksyczne wydobycie złota
Jednym ze sposobów na uzyskanie złota ze złóż w których występuje w postaci rozproszonej, jest metoda rtęciowa, w której wykorzystuje się zdolność rtęci do rozpuszczania złota i tworzenie amalgamatu, od którego może być oddzielona przez destylację. Dziś już w zasadzie się od niej odchodzi z powodu wysokiej szkodliwości, mimo to wciąż używają jej małe kopalnie w biedniejszych rejonach świata, co jest źródłem zanieczyszczeń. Szacuje się że nawet 40% rocznych emisji rtęci do środowiska pochodzi z małych kopalni Indonezji i środkowej Afryki.
Oczywiście można próbować różnych zakazów, ale trudno jest je egzekwować, tym bardziej że praca w kopalniach stanowi często jedyne źródło utrzymania najbiedniejszych. Jest też jednak ich przekleństwem - pracownicy mieszający skałę z rtęcią, wyciskający amalgamat (nawet ręcznie) a zwłaszcza pracujący przy wypalaniu amalgamatu dla usunięcia rtęci po kilku latach zaczynają chorować. Skażenie wraz z zanieczyszczonym złotem przenosi się do miast gdzie na opary rtęci narażone są rodziny złotników przetapiających surowe złoto.
Jednym z ciekawych sposobów aby sprawić, że proces stanie się mniej groźny dla tych, którzy nie chcą z niego zrezygnować, jest dostarczenie wytwórcom tanich aparatów do bezpieczniejszej destylacji.
Geochemik Marcello Veiga z kanadyjskiego Uniwersytetu Inżynierii i Górnictwa opracował przyrząd podobny do blaszanej retorty, takiej jak używane przez dawnych alchemików. Zbiornik w którym wyżarzany jest amalgamat kończy się długą opadającą rurą, której wąski koniec kończy się w zbiorniku z zimną wodą. Opary rtęci zamiast trafiać do atmosfery są skraplane a krople metalu zbierane na dnie zbiornika, dzięki czemu może być użyty ponownie. W efekcie emisje rtęci spadają o 90%, mniej jej trafia do środowiska a pracownicy są mniej narażeni na toksyczne opary[7]
---------
[1] The most incompressible metal osmium at static pressures above 750 GPa;L. Dubrovinsky, N. Dubrovinskaia, E. Bykova, M. Bykov, V. Prakapenka, C. Prescher, K. Glazyrin, H.-P. Liermann, M. Hanfland, M. Ekholm, Q. Feng, L. V. Pourovskii, M. I. Katsnelson, J. M. Wills, and I. A. Abrikosov; Nature (2015); DOI: 10.1038/nature14681
[2] Prediction of the material with highest known melting point fromab initiomolecular dynamics calculations. Qi-Jun Hong, Axel van de Walle. Physical Review B, 2015; 92 (2) DOI: 10.1103/PhysRevB.92.020104
[3] Bio-Derived, Binderless, Hierarchically Porous Carbon Anodes for Li-ion Batteries. Brennan Campbell, Robert Ionescu, Zachary Favors, Cengiz S. Ozkan, Mihrimah Ozkan. Scientific Reports, 2015; 5: 14575 DOI: 10.1038/srep14575
[4] Electrical detection of ortho–para conversion in fullerene-encapsulated water. Benno Meier, Salvatore Mamone, Maria Concistrè, Javier Alonso-Valdesueiro, Andrea Krachmalnicoff, Richard J. Whitby, Malcolm H. Levitt. Nature Communications, 2015; 6: 8112 DOI: 10.1038/ncomms9112
[5] Carbon Dioxide Conversion to Methanol over Size-Selected Cu4Clusters at Low Pressures. Cong Liu, Bing Yang, Eric Tyo, Soenke Seifert, Janae DeBartolo, Bernd von Issendorff, Peter Zapol, Stefan Vajda, Larry A. Curtiss. Journal of the American Chemical Society, 2015; 137 (27): 8676 DOI: 10.1021/jacs.5b03668
[6] Cooperativity between Al Sites Promotes Hydrogen Transfer and Carbon–Carbon Bond Formation upon Dimethyl Ether Activation on Alumina, Aleix Comas-Vives, Maxence Valla, Christophe Copéret, Philippe Sautet.. ACS Central Science , 2015 r.; 150807151553006 DOI: 10,1021 / acscentsci.5b00226
[7] http://www.rsc.org/chemistryworld/2015/08/chemistry-saves-thousands-gold-miners-mercury-poisoning
Zachowanie się materiałów pod ekstremalnie wysokim ciśnieniem to dość ciekawa sprawa Ciała stałe zasadniczo uznaje się za nieściśliwe, jednak w rzeczywistości mają pewną niewielką ściśliwość, zaś poddanie ich wysokiemu ciśnieniu powoduje zbliżenie budujących je atomów, czasem powodując przemianę do nowej formy uporządkowania lub ujawnienie się nietypowych cech.
Zespół naukowców pod kierunkiem niemieckiego uniwersytetu Bayreuth dokonał ostatnio dość szczególnego odkrycia. Przy pomocy nowej komory ciśnieniowej udało się im wytworzyć najwyższe dotąd otrzymane ciśnienie statyczne - nacisk 770 GPa, czyli ciśnienie dwa razy większe niż w jądrze Ziemi. Ciśnieniu temu poddano natomiast najbardziej gęsty metal - osm - znany też z bardzo niskiej ściśliwości.
Jeśli prawie najmniej ściśliwy materiał poddano najwyższemu ciśnieniu, to chyba powinno z tego coś wyniknąć? Wbrew oczekiwaniom osm nie przyjął żadnej nowej struktury krystalicznej, jedynie atomy nieco się do siebie przybliżyły, zachowując ten sam układ co w warunkach normalnych. Zaskoczeniem okazało się natomiast coś innego - pomiędzy atomami oprócz znanych już wiązań metalicznych, utworzonych przez elektrony walencyjne, zaczęły się także pojawiać oddziaływania utworzone przez elektrony wewnętrznych powłok elektronowych, które nigdy nie biorą udziału w tworzeniu wiązań. [1]
Wcześniej znane były wyliczenia teoretyczne sugerujące możliwość tworzenia wiązań między wewnętrznymi elektronami przy dużych ciśnieniach, ale teraz taka możliwość znalazła jakieś potwierdzenie w badaniach rentgenowskich rzeczywistego materiału.
Najtrudniej topliwy materiał
Tantal, metal przejściowy podobny do cyrkonu, jest znany z wysokotopliwego węgliku, który staje się płynny dopiero w temperaturze 3880*C, podobną temperaturę topnienia ma węglik hafnu. Połączenie tych substancji daje materiał o jeszcze większej odporności na temperaturę, dla składu Ta4HfC5 topiący się dopiero przy 3990 stopniach Celsiusza. Ale fizykochemicy nie poprzestają. Nowe wyliczenia jakie właśnie opublikowano sugerują możliwość stworzenia jeszcze trwalszego materiału. Wedle symulacji mieszany węglik-azotek hafnu o optymalnym składzie HfN0,38C0,51, osiągnąć może temperaturę topnienia nawet do 4400*C.[2]
Pozostaje teraz tylko poczekać na próby uzyskania nowego materiału.
Bateria z grzybów
W poprzednim odcinku wieści mówiłem już o otrzymywaniu kwantowych kropek ze zmiksowanej kapusty, dlatego baterie do telefonów ze zwęglonych grzybów nie będą chyba aż tak zaskakujące.
 |
| Wszystko co trzeba o metodzie. Udostępnione przez University of California |
Jednym z głównych komponentów baterii litowych jest grafitowa anoda, zwykle wytwarzana z syntetycznego grafitu porowatego. Jego wytworzenie w ilościach przemysłowych jest jednak nieco skomplikowane i niezbyt ekologiczne, stąd liczne próby stworzenia dobrej alternatywy. Jedną z tych prób opisuje praca badaczy z University of California.
Wzięli oni cienki plaster wycięty z owocnika grzyba, akurat w tym przypadku była to pieczarka, po czym poddali go zwęgleniu w hydroreaktorze w wysokiej temperaturze. Otrzymany zwęglony plaster dodatkowo wyżarzono uzyskując porowaty materiał złożony ze splecionych węglowych włókien zachowujących strukturę strzępek grzyba i przewodzący prąd, będący dobrym zamiennikiem grafitu. Anoda wytworzona ze zwęglonego grzyba nie potrzebuje dodatkowych lepiszczy, dobrze przyjmuje płynny elektrolit i dobrze oddziałuje z jonami. Bardzo możliwe że ze względu na strukturę będzie wytrzymywała więcej cykli ładowania.[3]
Woda orto, woda para
Jądro atomu wodoru to proton, który jako samotna cząstka posiada szczególną właściwość jaką jest spin. W dużym uproszczeniu można przedstawić to jako wektor momentu pędu protonu, mogącego obracać się bądź w jedną lub w drugą stronę - opis kwantowy tego zjawiska jest dużo bardziej skomplikowany. Ponieważ proton jest cząstką naładowaną, jego spin powoduje powstanie małego jądrowego pola magnetycznego. W sytuacji gdy mamy cząsteczkę wodoru składającą się z dwóch atomów te jądrowe pola magnetyczne oddziałują ze sobą i możliwe stają się dwie sytuacje którym odpowiadają różne energie - wodór orto ma spiny skierowane w tą samą stronę, wodór para w przeciwną. Ta druga sytuacja jest minimalnie korzystniejsza energetycznie jednak różnica energii jest na tyle mała że w warunkach normalnych wodór posiada mieszankę cząsteczek z tych dwóch stanów z przewagą ortowodoru.
To zresztą ciekawa sytuacja - pod wpływem temperatury trwalszy parawodór przechodzi w ortowodór, natomiast przemiana w drugą stronę jest powolna bowiem utrudnia ją zabronione przejście kwantowe. W efekcie w wodorze gazowym przeważa mniej trwała energetycznie odmiana, co ma też przełożenie na skład wodoru ciekłego. W niskich temperaturach powolna przemiana ortowodoru w trwalszy parawodór ma istotne znaczenie dla przechowywania, bowiem przemiana ta przebiega z wydzielaniem ciepła. Aby więc ułatwić przechowywanie ciekłego wodoru, katalizuje się tą przemianę przy pomocy odpowiedniego dielektryka otrzymując przewagę trwalszej formy.
Wróćmy jednak do naszego newsa.
W cząsteczce wody dwa wodory znajdują się na tyle blisko siebie, że także i u nich powinna być możliwa izomeria spinowa, jednak dotychczas nie udało się tego wykryć. Cząsteczki wody oddziaływały ze sobą powodując ciągłą zmianę spinów, toteż trudno było uchwycić sygnał od populacji poszczególnych izomerów. Jak się jednak okazało, możliwe jest odizolowanie od siebie cząsteczek. Zespół badaczy z University of Suthampton otrzymał pochodną fullerenu C60 z pojedynczymi cząsteczkami wody wewnątrz węglowej kul. Tego typu połączenie stanowi kolejny przykład związków cząsteczek "połączonych acz nie związanych" jak omawiane tu kiedyś katenany.
Cząstki C60@H2O były wystarczająco odizolowane aby w niskich temperaturach możliwe było wykrycie czystych sygnałów izomerów spinowych wody i przemian jednego w drugi.
[4]
Paliwo z powietrza
Temat przeróbki dwutlenku węgla na paliwo jest aktualnie bardzo gorący, stąd też w ostatnich miesiącach ukazało się wiele doniesień dotyczących nowych sposobów takiej syntezy.
Wedle doniesień z początku sierpnia zespół z Argonne National Laboratory stworzył nowy katalizator do reakcji zamiany dwutlenku węgla i wody w metanol. Znane dotychczas katalizatory oparte o tlenki cynku i glinu zostały zmodyfikowane poprzez precyzyjne umieszczenie na powierzchni tlenku cynku klastrów czterech atomów miedzi, stanowiących centrum katalityczne do którego przyłącza się cząsteczka CO2. Materiał pozwala na przeprowadzanie reakcji w warunkach niższego ciśnienia i temperatury, co poprawia opłacalność całego procesu produkcyjnego. [5]
A co robić z metanolem? Można go użyć jako paliwa, ale można też poddać innym procesom. Pod koniec września pojawiła się praca zespołu z ETH w Zurychu na temat nowego katalizatora umożliwiający ekonomiczny proces konwersji metanol-olefina (MTO). Metanol lub eter dimetylowy pod odpowiednim ciśnieniem może ulegać przemianie na powierzchni tlenku cynku, z wytworzeniem etenu. [6]
Mniej toksyczne wydobycie złota
Jednym ze sposobów na uzyskanie złota ze złóż w których występuje w postaci rozproszonej, jest metoda rtęciowa, w której wykorzystuje się zdolność rtęci do rozpuszczania złota i tworzenie amalgamatu, od którego może być oddzielona przez destylację. Dziś już w zasadzie się od niej odchodzi z powodu wysokiej szkodliwości, mimo to wciąż używają jej małe kopalnie w biedniejszych rejonach świata, co jest źródłem zanieczyszczeń. Szacuje się że nawet 40% rocznych emisji rtęci do środowiska pochodzi z małych kopalni Indonezji i środkowej Afryki.
Oczywiście można próbować różnych zakazów, ale trudno jest je egzekwować, tym bardziej że praca w kopalniach stanowi często jedyne źródło utrzymania najbiedniejszych. Jest też jednak ich przekleństwem - pracownicy mieszający skałę z rtęcią, wyciskający amalgamat (nawet ręcznie) a zwłaszcza pracujący przy wypalaniu amalgamatu dla usunięcia rtęci po kilku latach zaczynają chorować. Skażenie wraz z zanieczyszczonym złotem przenosi się do miast gdzie na opary rtęci narażone są rodziny złotników przetapiających surowe złoto.
Jednym z ciekawych sposobów aby sprawić, że proces stanie się mniej groźny dla tych, którzy nie chcą z niego zrezygnować, jest dostarczenie wytwórcom tanich aparatów do bezpieczniejszej destylacji.
Geochemik Marcello Veiga z kanadyjskiego Uniwersytetu Inżynierii i Górnictwa opracował przyrząd podobny do blaszanej retorty, takiej jak używane przez dawnych alchemików. Zbiornik w którym wyżarzany jest amalgamat kończy się długą opadającą rurą, której wąski koniec kończy się w zbiorniku z zimną wodą. Opary rtęci zamiast trafiać do atmosfery są skraplane a krople metalu zbierane na dnie zbiornika, dzięki czemu może być użyty ponownie. W efekcie emisje rtęci spadają o 90%, mniej jej trafia do środowiska a pracownicy są mniej narażeni na toksyczne opary[7]
---------
[1] The most incompressible metal osmium at static pressures above 750 GPa;L. Dubrovinsky, N. Dubrovinskaia, E. Bykova, M. Bykov, V. Prakapenka, C. Prescher, K. Glazyrin, H.-P. Liermann, M. Hanfland, M. Ekholm, Q. Feng, L. V. Pourovskii, M. I. Katsnelson, J. M. Wills, and I. A. Abrikosov; Nature (2015); DOI: 10.1038/nature14681
[2] Prediction of the material with highest known melting point fromab initiomolecular dynamics calculations. Qi-Jun Hong, Axel van de Walle. Physical Review B, 2015; 92 (2) DOI: 10.1103/PhysRevB.92.020104
[3] Bio-Derived, Binderless, Hierarchically Porous Carbon Anodes for Li-ion Batteries. Brennan Campbell, Robert Ionescu, Zachary Favors, Cengiz S. Ozkan, Mihrimah Ozkan. Scientific Reports, 2015; 5: 14575 DOI: 10.1038/srep14575
[4] Electrical detection of ortho–para conversion in fullerene-encapsulated water. Benno Meier, Salvatore Mamone, Maria Concistrè, Javier Alonso-Valdesueiro, Andrea Krachmalnicoff, Richard J. Whitby, Malcolm H. Levitt. Nature Communications, 2015; 6: 8112 DOI: 10.1038/ncomms9112
[5] Carbon Dioxide Conversion to Methanol over Size-Selected Cu4Clusters at Low Pressures. Cong Liu, Bing Yang, Eric Tyo, Soenke Seifert, Janae DeBartolo, Bernd von Issendorff, Peter Zapol, Stefan Vajda, Larry A. Curtiss. Journal of the American Chemical Society, 2015; 137 (27): 8676 DOI: 10.1021/jacs.5b03668
[6] Cooperativity between Al Sites Promotes Hydrogen Transfer and Carbon–Carbon Bond Formation upon Dimethyl Ether Activation on Alumina, Aleix Comas-Vives, Maxence Valla, Christophe Copéret, Philippe Sautet.. ACS Central Science , 2015 r.; 150807151553006 DOI: 10,1021 / acscentsci.5b00226
[7] http://www.rsc.org/chemistryworld/2015/08/chemistry-saves-thousands-gold-miners-mercury-poisoning
sobota, 3 października 2015
Kiedyś w laboratorium (47.)
Kiedyś na zajęciach z analityki robiliśmy doświadczenie z elektroforezą aminokwasów.
Aminokwasy zgodnie z nazwą są związkami, które zależnie od warunków mogą być kwasami lub zasadami - posiadają grupę karboksylową mogącą odszczepiać proton, która zwykle decyduje o właściwościach kwaśnych, oraz grupę aminową która mogłaby przyjąć proton w odpowiednio zakwaszonym środowisku. W szczególnych warunkach zjonizowane są obie grupy i punkt ten nazywany izoelektrycznym.
Ponieważ w aminokwasach o różnej budowie stała protonowania grupy aminowej i stała deprotonacji grupy karboksylowej przybierają różne wartości, toteż w roztworach o tym samym odczynie różne aminokwasy będą przyjmowały bądź formę anionu bądź kationu. A gdy do roztworu przyłożymy napięcie elektryczne, każdy pomknie w inną stronę.
Przyciąganie jonów do elektrody o przeciwnym znaku powoduje ich migrację, której prędkość zależy od wielkości i stopnia naładowania cząsteczki. Wskutek tego możliwy staje się rozdział naładowanych cząstek w polu elektrycznym na podobnej zasadzie jak to się ma przy chromatografii. Techniki tej używa się do rozdziału białek, peptydów i fragmentów DNA na przykład podczas badań genetycznych, co kiedyś już opisywałem.
W tym przypadku jednak poprzestaliśmy na sytuacji dużo prostszej - na kilka pasków bibuły nasączonej przewodzącym buforem nałożyliśmy próbki kilku aminokwasów i przez pewien czas podłączyliśmy paski do elektrod. Te aminokwasy które w odczynie buforu były anionami pomknęły w stronę elektrody dodatniej zaś te będące kationami w stronę elektrody ujemnej. Plamy aminokwasów ujawnialiśmy ninhydryną:
Jak dogrzebię się do starego zeszytu to dopiszę jeszcze który pasek odpowiadał któremu z aminokwasów.
Aminokwasy zgodnie z nazwą są związkami, które zależnie od warunków mogą być kwasami lub zasadami - posiadają grupę karboksylową mogącą odszczepiać proton, która zwykle decyduje o właściwościach kwaśnych, oraz grupę aminową która mogłaby przyjąć proton w odpowiednio zakwaszonym środowisku. W szczególnych warunkach zjonizowane są obie grupy i punkt ten nazywany izoelektrycznym.
Ponieważ w aminokwasach o różnej budowie stała protonowania grupy aminowej i stała deprotonacji grupy karboksylowej przybierają różne wartości, toteż w roztworach o tym samym odczynie różne aminokwasy będą przyjmowały bądź formę anionu bądź kationu. A gdy do roztworu przyłożymy napięcie elektryczne, każdy pomknie w inną stronę.
Przyciąganie jonów do elektrody o przeciwnym znaku powoduje ich migrację, której prędkość zależy od wielkości i stopnia naładowania cząsteczki. Wskutek tego możliwy staje się rozdział naładowanych cząstek w polu elektrycznym na podobnej zasadzie jak to się ma przy chromatografii. Techniki tej używa się do rozdziału białek, peptydów i fragmentów DNA na przykład podczas badań genetycznych, co kiedyś już opisywałem.
W tym przypadku jednak poprzestaliśmy na sytuacji dużo prostszej - na kilka pasków bibuły nasączonej przewodzącym buforem nałożyliśmy próbki kilku aminokwasów i przez pewien czas podłączyliśmy paski do elektrod. Te aminokwasy które w odczynie buforu były anionami pomknęły w stronę elektrody dodatniej zaś te będące kationami w stronę elektrody ujemnej. Plamy aminokwasów ujawnialiśmy ninhydryną:
Jak dogrzebię się do starego zeszytu to dopiszę jeszcze który pasek odpowiadał któremu z aminokwasów.
Subskrybuj:
Komentarze (Atom)