O superkleju już tu kiedyś pisałem w artykule na temat ujawniania odbitek linii papilarnych, teraz na krótko powrócę do tej substancji aby opowiedzieć o nietypowej reakcji.
Z pewnością wielu bądź widziało bądź choćby słyszało o tym filmie:
Wata polana superklejem zapala się? Czy to możliwe?
Superkleje opierają swe działanie na samorzutnej polimeryzacji cyjanoakrylanu metylu bądź etylu.
Jest to ester o specyficznej budowie - przy węglu alfa (pierwszy przy grupie karboksylowej) znajduje się grupa nitrylowa i jest on połączony z następnym węglem wiązaniem podwójnym. Zarówno grupa karboksylowa jak i nitrylowa mają skłonność do wyciągania elektronów, toteż wiązanie podwójne zostaje bardzo w nie zubożone. Przekłada się to na zwiększenie kwasowości protonów przy końcowym węglu. W tym przypadku skłonność do oddawania tych protonów jest na tyle duża, iż wystarcza bardzo słaba zasada by je oderwać. Gdy to następuje, zapoczątkowana zostaje reakcja łańcuchowa:
Nukleofilowa zasada odrywa protony na końcu, wiązanie podwójne pęka a na zwornikowym węglu w cząsteczce pojawia się silny ładunek ujemny. Taka cząsteczka sama staje się zasadą i atakuje drugą cząsteczkę. Po utworzeniu wiązania w drugiej cząsteczce pęka wiązanie podwójne, powstaje ładunek ujemny i następuje atak na trzecią cząsteczkę... I tak dalej aż utworzy się nam stała masa splątanych długich łańcuchów.
Zasadą zapoczątkowującą reakcję jest zwykle woda ze śladów wilgoci, bądź substancje klejonych powierzchni. Co jednak zachodzi po nasączeniu klejem bawełny?
Bawełna to celuloza, będąca długimi łańcuchami połączonych cząsteczek glukozy, te zaś posiadają grupy hydroksylowe, w łańcuchu cztery wolne. Własności nukleofilowe tych grup w celulozie są wprawdzie słabe, ale wystarczą do inicjowania reakcji. Duża powierzchnia włókien w kłębku w połączeniu z dużą ilością kleju powoduje zapoczątkowanie polimeryzacji o razu dużej masy akrylanów. W miarę powstawania kolejnych łańcuchów reakcja przyspiesza. Ponieważ jest samorzutna, w jej przebiegu wydziela się energia toteż zaklejony kłębek rozgrzewa się.
Czy jednak aż tak bardzo by zapłonąć? Karty charakterystyki klejów zwykle ostrzegają przed egzotermiczną reakcją z bawełną, czasem wspominając o możliwości zapłonu. Nie tak dawno SciFun wykonał własne pomiary, i maksymalna temperatura w dobrze odizolowanym kłębku wyniosła 115 stopni C, w otwartym ponad 80 stopni. To jednak za mało aby doszło do samozapłonu celulozy, bo na to potrzeba 400 stopni, zatem jego zdaniem kłębek został przez autora podpalony.
Moim zdaniem mogło jednak zajść coś trochę innego - kłębek był przecież cały oblany klejem. Wprawdzie temperatura samozapłonu cyjanoakrylanu to prawie 480 stopni[1], ale już temperatura zapłonu opar kleju to 85 stopni. Jest to temperatura w której opary zmieszane z powietrzem zapalają się po zainicjowaniu. A ponieważ opary te w postaci białego dymu pojawiły się nieco wcześniej, przebieg był zapewne taki - kłębek rozgrzał się do takiej temperatury, że wydzielił intensywne opary, było to temperatura w której opary zapalały się w zetknięciu z ogniem. Wystarczyło zapalić zapałkę w pobliżu kłębka a zapalał się nawet bez przykładania ognia, po prostu od zapłonu unoszących się par. Zastanawia mnie czy w takich warunkach wystarczająca mogłaby być iska elektryczności statycznej.
Podobna egzotermiczna reakcja następuje też z wełną i materiałami skórzanymi. Szansę na samozapłon miałaby w sprzyjających warunkach nitroceluloza dla której graniczna temperatura to 160-170 C, a także tłusta surowa bawełna dla której podaje się wartość 120 stopni. Znalazłem też informacje, że silnie rozgrzać może się spoina gdy próbuje się skleić tym plexiglas, co nie jest chyba tak zaskakujące zażywszy że pleksi to polimer akrylowy i powinien zawierać jeszcze ślady polimeryzatorów. Nie wywołuje to zapalenia ale materiał może się nadtopić. Już większe niebezpieczeństwo sprawia schnący pokost - nie raz zdarzało się że szmaty zabrudzone pokostem lub farbami olejnymi zapalały się od szybkiej reakcji utlenienia.
Myślę że warto tu dodać jeszcze jeden ciekawy przykład. Majsterkowicze czasem używają superkleju do uzupełnienia ubytków w przedmiotach, Mieszają wówczas klej z proszkiem do pieczenia czyli wodorowęglanem sodu. Mieszanka rozgrzewa się i puchnie, szybko jednak twardniejąc w lekką ale mocną masę. Jak łatwo się domyśleć, soda jest dobrą zasadą odrywającą protony i wywołującą szybką reakcję polimeryzacji. Równocześnie następuje częściowy jej rozkład, głównie chyba z powodu połączenia z oderwanymi protonami, może też od ciepła. Ponieważ masa szybko twardnieje zamiast pianki tworzy się lekka masa zwierająca mieszankę kleju, stałej, nieprzereagowanej sody i drobnych bąbelków dwutlenku węgla, która dobrze wypełnia ubytek przylegając do porowatych powierzchni.
Zatem prawdopodobnie klej wylany na bawełniany materiał nie wywoła zapłonu, mimo wszystko jednak rozgrzeje się wystarczająco mocno aby poparzyć. Powstające wówczas białe opary są szkodliwe dla płuc.
------
* Opis chemii i nietypowych zastosowań kleju
[1] http://apps.echa.europa.eu/registered/data/dossiers/DISS-9e9bc392-29b8-523e-e044-00144f67d031/AGGR-5815fa25-4c2c-4942-a8ff-6477f4252fb0_DISS-9e9bc392-29b8-523e-e044-00144f67d031.html
informacje
piątek, 21 lutego 2014
wtorek, 18 lutego 2014
Rodział jonów niklu i kobaltu - chromatografia jonowymienna
Przegrzebując fotograficzne archiwa dotarłem do pierwszego roku studiów, na którym mieliśmy zajęcia z chemii nieorganicznej, i tam znalazłem kilka zdjęć dokumentujących pewne stare ćwiczenie, które chyba warto tu omówić.
Kobalt i Nikiel są pierwiastkami należącymi do raczej dziś już historycznej triady żelazowców. Wszystkie trzy wraz z żelazem charakteryzują się bardzo podobnymi właściwościami chemicznymi, podobieństwo w okresie jest większe niż w grupie. To metale, ferromagnetyki, chętnie występujące na +2 i +3 stopniu utlenienia. Właściwości ich soli są na tyle podobne, że rozdział metodami fizycznymi i chemicznymi jest trudny - o ile można to jeszcze przeprowadzić dla żelaza, to już kobalt i nikiel reagują tak samo.
Na samym początku przygotowaliśmy roztwory chlorku kobaltu II i chlorku niklu II, o różnych kolorach:
i zmieszaliśmy je ze sobą. Otrzymana mieszanka miała kolor brunatny. I co też tu teraz zrobić? A no napełnić kolumnę kationitem.
Substancje jonowymienne to bądź minerały i materiały ceramiczne bądź tworzywa sztuczne zawierające przyłączone do powierzchni grupy kwasowe lub zasadowe. W pewnym stopniu można je uznać za nierozpuszczalne kwasy i zasady. Przykładem może być choćby żel krzemionkowy, zawierający na powierzchni reszty kwasu krzemowego, albo polimer styrenowy z resztami kwasu siarkowego. Te "stałe kwasy" w odróżnieniu od takich nierozpuszczalnych substancji jak wolne kwasy tłuszczone, mają jednak specyficzną właściwość - chętnie dysocjują, zwłaszcza gdy mogą wymienić jony wodoru na jakieś inne kationy. Taki kationit zachowuje się w roztworach soli jak kwas siarkowy w proszku - zakwasza roztwór i tworzy sole, przy czym są to oczywiście sole przytwierdzone o podłoża polimerowego. Kation przyłącza się do podłoża i uwalnia jon wodorowy, który sam uwalnia się trudno.
Jest to cenna właściwość i korzysta się z niej wówczas, gdy potrzebne jest zakwaszenie ale nie potrzebne wprowadzanie nowych jonów pochodzących od reszt rozpuszczalnego kwasu. Bywa używany w modyfikacji klasycznej reakcji estryfikacji kwasu z alkoholem. Najczęstsze zastosowanie, z jakim co niektórzy mogą się spotkać w życiu codziennym, to zmiękczanie wody - po dodaniu kationitu z przyłączonym sodem, jony wapniowe i magnezowe przyłączają się do niego.
Szczególnym przypadkiem jest otrzymywanie wody dejonizowanej - wówczas woda przepuszczana jest przez bęben z wypełnieniem kationitu, który wyłapuje kationy, a potem przez bęben wypełniony anionitem, który pochłania aniony. Uwolnione kationy wodorowe i aniony hydroksylowe zobojętniają się i powstaje nam czysta, pozbawiona soli woda, jest to szybsze i bardziej energooszczędne od wielokrotnej destylacji.
Zużyty jonit można zregenerować - ten kwasowy przemywając roztworem mocnego kwasu, ten sodowy przemywając stężonym roztworem soli (tak właśnie zmywarki do naczyń regenerują kationit zmiękczający i do tego potrzebna jest sól do zmywarek).
Jak jednak ma się to do rozdziału jonów?
Do podłoża przyłączać mogą się różne jony, przy czym siła tego wiązania zależy od właściwości jonu. Powinowactwo kationu metalu do grupy sulfonowej w dużym stopniu zależy od ładunku, toteż kationy dwudodatnie jak Ca2+ będą przyłączane chętniej niż jednododatnie jak Na+ . W przypadku jonów o tym samym ładunku znaczenie ma też siła tego ładunku zależna od liczby atomowej i wielkości jonu, co wpływa na zagęszczenie ładunku. Jon silniej wiążący się z podłożem, będzie wypierał jon słabiej związany. Wypieranie następuje też gdy jon słabszy występuje w dużym stężeniu.
Jak to wszystko ma się do rozdziału pierwiastków?
Nasze pierwiastki, kobalt i nikiel, leżą obok siebie w układzie okresowym, ich atomy mają podobną wielkość, jednak między kationami występuje niewielka różnica - kation niklu jest większy. Wobec tego ładunek na zewnątrz kationu jest mniej zagęszczony a sam kation jest słabiej wiązany do kationitu. Różnica jest niewielka, ale wystarczająca. Gdy nałożymy mieszankę obu pierwiastków na kolumnę kwaśnego żelu i będziemy przemywali ją kwaśnym roztworem, wymywającym kationy przez wypieranie, słabiej związany nikiel będzie po pierwsze bardziej wymywany przez eluent a po drugie nieco bardziej wypierany przez silniej wiążący kobalt. Ta niewielka różnica doprowadzi do tego, że kation niklu oddzieli się od kobaltu i będzie szybciej przepływał przez wypełnienie. Dzięki temu dokona się rozdział.
Tak więc na początek napełniłem szklaną kolumnę sypkim wypełnieniem, i przepłukałem wodą destylowaną, następnie przepłukałem kolumnę zasadowym buforem cytrynianowym mającym za zadanie zdeprotonować powierzchnię i usunąć wszystkie kationy. Przemywałem kolumnę tak długo aż odczyn wycieku stał się obojętny. Teraz przepłukałem ją ponownie ale roztworem kwasu, był to chyba rozcieńczony kwas solny, aby sprotonowac wszystkie grupy. Całość należało teraz przemywać wodą tak długo, aż wyciek będzie obojętny. Żel podczas tych manipulacji to puchł to kurczył się. Taka kolumna była już gotowa do użytku:
Na szczyt kolumny nalałem mieszankę soli, które zostały silnie zaabsorbowane, tworząc brunatną warstewkę:
Pochłonięte kationy dosyć dobrze związały się z podłożem, dlatego kolumnę przemyłem jeszcze wodą, aby odmyć aniony, po czym zacząłem przepłukiwać ją kwaśnym roztworem. Kationy ruszyły w dół i zaczeły rozdzielać się na szybsze zielone i wolniejsze różowe pasmo.
Teraz należało obserwować kolor wycieku i podstawić w odpowiedniej chwili odbieralniki, najpierw na frakcję zieloną:
a potem na różową:
I tak dwa bardzo podobne pierwiastki zostały oddzielone.
W praktyce używa się tej techniki do rozdziału lantanowców - bardzo cennych pierwiastków mających zastosowanie w technice i elektronice (na przykład neodym), o praktycznie identycznych właściwościach fizycznych, występujących na raz w tym samym minerale. Można też w ten sposób rozdzielać związki organiczne, na przykład aminy w formie kationów amoniowych.
Kobalt i Nikiel są pierwiastkami należącymi do raczej dziś już historycznej triady żelazowców. Wszystkie trzy wraz z żelazem charakteryzują się bardzo podobnymi właściwościami chemicznymi, podobieństwo w okresie jest większe niż w grupie. To metale, ferromagnetyki, chętnie występujące na +2 i +3 stopniu utlenienia. Właściwości ich soli są na tyle podobne, że rozdział metodami fizycznymi i chemicznymi jest trudny - o ile można to jeszcze przeprowadzić dla żelaza, to już kobalt i nikiel reagują tak samo.
Na samym początku przygotowaliśmy roztwory chlorku kobaltu II i chlorku niklu II, o różnych kolorach:
i zmieszaliśmy je ze sobą. Otrzymana mieszanka miała kolor brunatny. I co też tu teraz zrobić? A no napełnić kolumnę kationitem.
Substancje jonowymienne to bądź minerały i materiały ceramiczne bądź tworzywa sztuczne zawierające przyłączone do powierzchni grupy kwasowe lub zasadowe. W pewnym stopniu można je uznać za nierozpuszczalne kwasy i zasady. Przykładem może być choćby żel krzemionkowy, zawierający na powierzchni reszty kwasu krzemowego, albo polimer styrenowy z resztami kwasu siarkowego. Te "stałe kwasy" w odróżnieniu od takich nierozpuszczalnych substancji jak wolne kwasy tłuszczone, mają jednak specyficzną właściwość - chętnie dysocjują, zwłaszcza gdy mogą wymienić jony wodoru na jakieś inne kationy. Taki kationit zachowuje się w roztworach soli jak kwas siarkowy w proszku - zakwasza roztwór i tworzy sole, przy czym są to oczywiście sole przytwierdzone o podłoża polimerowego. Kation przyłącza się do podłoża i uwalnia jon wodorowy, który sam uwalnia się trudno.
Jest to cenna właściwość i korzysta się z niej wówczas, gdy potrzebne jest zakwaszenie ale nie potrzebne wprowadzanie nowych jonów pochodzących od reszt rozpuszczalnego kwasu. Bywa używany w modyfikacji klasycznej reakcji estryfikacji kwasu z alkoholem. Najczęstsze zastosowanie, z jakim co niektórzy mogą się spotkać w życiu codziennym, to zmiękczanie wody - po dodaniu kationitu z przyłączonym sodem, jony wapniowe i magnezowe przyłączają się do niego.
Szczególnym przypadkiem jest otrzymywanie wody dejonizowanej - wówczas woda przepuszczana jest przez bęben z wypełnieniem kationitu, który wyłapuje kationy, a potem przez bęben wypełniony anionitem, który pochłania aniony. Uwolnione kationy wodorowe i aniony hydroksylowe zobojętniają się i powstaje nam czysta, pozbawiona soli woda, jest to szybsze i bardziej energooszczędne od wielokrotnej destylacji.
Zużyty jonit można zregenerować - ten kwasowy przemywając roztworem mocnego kwasu, ten sodowy przemywając stężonym roztworem soli (tak właśnie zmywarki do naczyń regenerują kationit zmiękczający i do tego potrzebna jest sól do zmywarek).
Jak jednak ma się to do rozdziału jonów?
Do podłoża przyłączać mogą się różne jony, przy czym siła tego wiązania zależy od właściwości jonu. Powinowactwo kationu metalu do grupy sulfonowej w dużym stopniu zależy od ładunku, toteż kationy dwudodatnie jak Ca2+ będą przyłączane chętniej niż jednododatnie jak Na+ . W przypadku jonów o tym samym ładunku znaczenie ma też siła tego ładunku zależna od liczby atomowej i wielkości jonu, co wpływa na zagęszczenie ładunku. Jon silniej wiążący się z podłożem, będzie wypierał jon słabiej związany. Wypieranie następuje też gdy jon słabszy występuje w dużym stężeniu.
Jak to wszystko ma się do rozdziału pierwiastków?
Nasze pierwiastki, kobalt i nikiel, leżą obok siebie w układzie okresowym, ich atomy mają podobną wielkość, jednak między kationami występuje niewielka różnica - kation niklu jest większy. Wobec tego ładunek na zewnątrz kationu jest mniej zagęszczony a sam kation jest słabiej wiązany do kationitu. Różnica jest niewielka, ale wystarczająca. Gdy nałożymy mieszankę obu pierwiastków na kolumnę kwaśnego żelu i będziemy przemywali ją kwaśnym roztworem, wymywającym kationy przez wypieranie, słabiej związany nikiel będzie po pierwsze bardziej wymywany przez eluent a po drugie nieco bardziej wypierany przez silniej wiążący kobalt. Ta niewielka różnica doprowadzi do tego, że kation niklu oddzieli się od kobaltu i będzie szybciej przepływał przez wypełnienie. Dzięki temu dokona się rozdział.
Tak więc na początek napełniłem szklaną kolumnę sypkim wypełnieniem, i przepłukałem wodą destylowaną, następnie przepłukałem kolumnę zasadowym buforem cytrynianowym mającym za zadanie zdeprotonować powierzchnię i usunąć wszystkie kationy. Przemywałem kolumnę tak długo aż odczyn wycieku stał się obojętny. Teraz przepłukałem ją ponownie ale roztworem kwasu, był to chyba rozcieńczony kwas solny, aby sprotonowac wszystkie grupy. Całość należało teraz przemywać wodą tak długo, aż wyciek będzie obojętny. Żel podczas tych manipulacji to puchł to kurczył się. Taka kolumna była już gotowa do użytku:
Na szczyt kolumny nalałem mieszankę soli, które zostały silnie zaabsorbowane, tworząc brunatną warstewkę:
Pochłonięte kationy dosyć dobrze związały się z podłożem, dlatego kolumnę przemyłem jeszcze wodą, aby odmyć aniony, po czym zacząłem przepłukiwać ją kwaśnym roztworem. Kationy ruszyły w dół i zaczeły rozdzielać się na szybsze zielone i wolniejsze różowe pasmo.
Teraz należało obserwować kolor wycieku i podstawić w odpowiedniej chwili odbieralniki, najpierw na frakcję zieloną:
a potem na różową:
I tak dwa bardzo podobne pierwiastki zostały oddzielone.
W praktyce używa się tej techniki do rozdziału lantanowców - bardzo cennych pierwiastków mających zastosowanie w technice i elektronice (na przykład neodym), o praktycznie identycznych właściwościach fizycznych, występujących na raz w tym samym minerale. Można też w ten sposób rozdzielać związki organiczne, na przykład aminy w formie kationów amoniowych.
czwartek, 13 lutego 2014
Pomiar skręcalności optycznej
Jednym z prostych pomiarów fizykochemicznych, które być może były omawiane w szkołach, jest pomiar skręcalności optycznej substancji. Podobny wykonuję też i ja na pracowni, ale sprzętem nieco dokładniejszym. Tylko po co to wszystko?
U początków wielkiej naukowej debaty o prawdziwej naturze światła zwrócono uwagę na zjawisko polaryzacji. Przezroczyste kryształy szpatu islandzkiego podwajały obraz jaki przez nie obserwowano, a wpuszczony w nie promień światła rozdzielał się na dwa - normalny, biegnący zgodnie z wartością załamania, i nadzwyczajny o silniejszym załamaniu.
Jeszcze zaś dziwaczniej zachowywały się dwa takie kryształy położone na sobie - w pewnej wzajemnej orientacji pozostawały przezroczyste, po obróceniu o 90 stopni wygaszały obraz. Zjawisko to nazwano polaryzacją i niespecjalnie się nim potem przejmowano, gdy tymczasem trwał spór między fizykami - czy światło to promień czy może wiązka przenikliwych cząstek? Istniało wiele zjawisk które udawało się łatwo wytłumaczyć modelem cząstkowym i on w zasadzie był powszechnie przyjmowany aż do 1801, gdy Thomas Young zaproponował doświadczenie z dwoma szczelinami.
Weźmy źródło światła i ujednolićmy je przepuszczając przez mały otwór. Teraz przepuśćmy nasze spójne światło przez dwa małe otworki, wielkości nakłuć końcem igły, położone blisko siebie. Zgodnie z teorią cząstkowa, powinniśmy zobaczyć dwie jasne plamki. Zamiast tego obserwowano jasną plamę pośrodku i rząd rozchodzących się po bokach mniejszych, kolorowych plamek oddzielonych plamami cienia. W sposób cząstkowy wyjaśnić się tego nie dało. Chyba że światło jest jednak falą:
Dwie szczeliny tworzą dwa źródła rozchodzących się fal, które nakładają się na siebie raz wzmacniając raz wygaszając. Young zainspirował się tu obserwacją fal na powierzchni wody, przy czym z występowania tego zjawiska wynikało, że jeśli już światło faluje, to poprzecznie do kierunku ruchu.
Późniejsza teoria powiązała światło z zaburzeniami w rozprzestrzeniającym się polu elektrycznym i magnetycznym. Pole magnetyczne które zmienia natężenie i kierunek powoduje wygenerowane pola elektrycznego, ale także o zmiennym kierunku. Zmienne pole elektryczne z kolei generuje zmienne pole magnetyczne. Te dwa wzajemnie się indukujące pola łączą się ze sobą tworząc promieniowanie elektro-magnetyczne. Wektor pola magnetycznego jest prostopadły do wektora pola elektrycznego a obydwa do kierunku rozchodzenia się promieni.:
Późniejsza teoria kwantowa zmodyfikowała ten model, wprowadzając podwójną falowo-cząstkowa naturę światła.
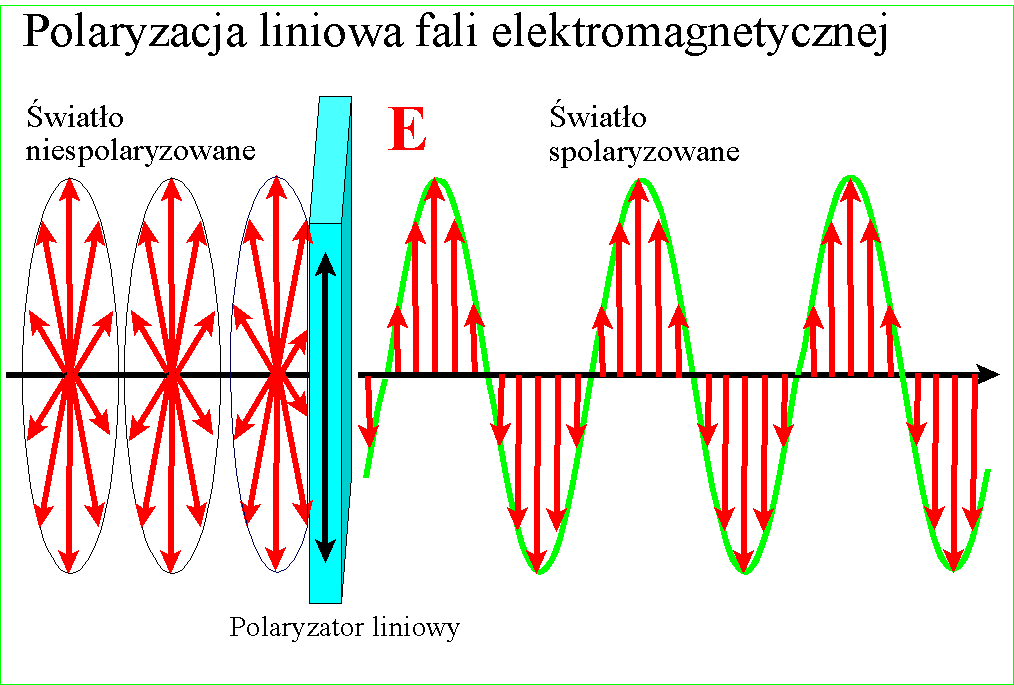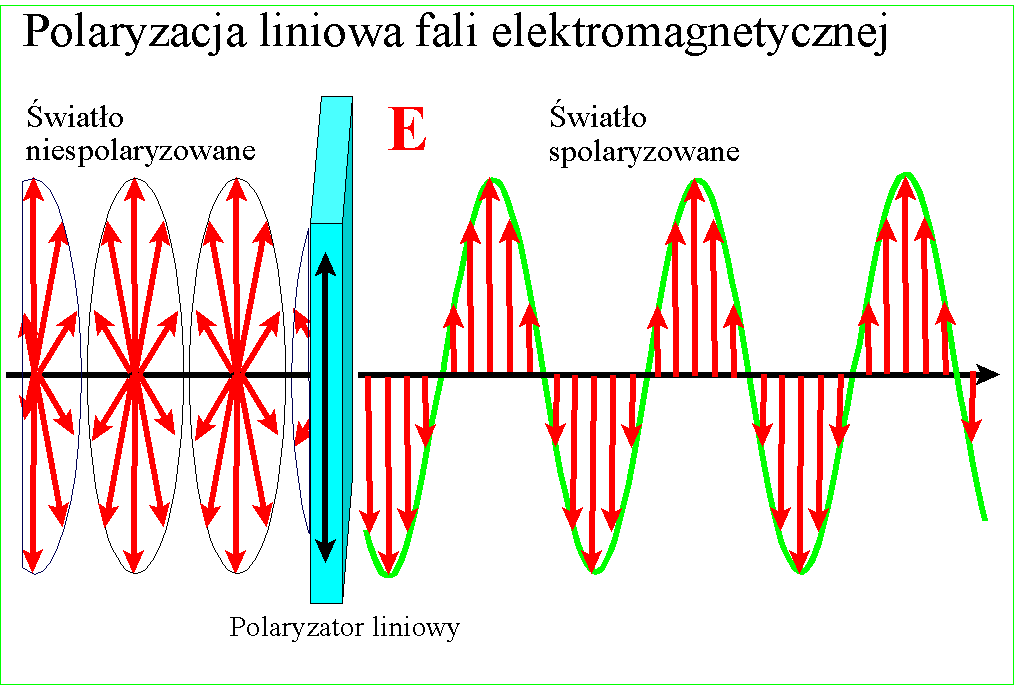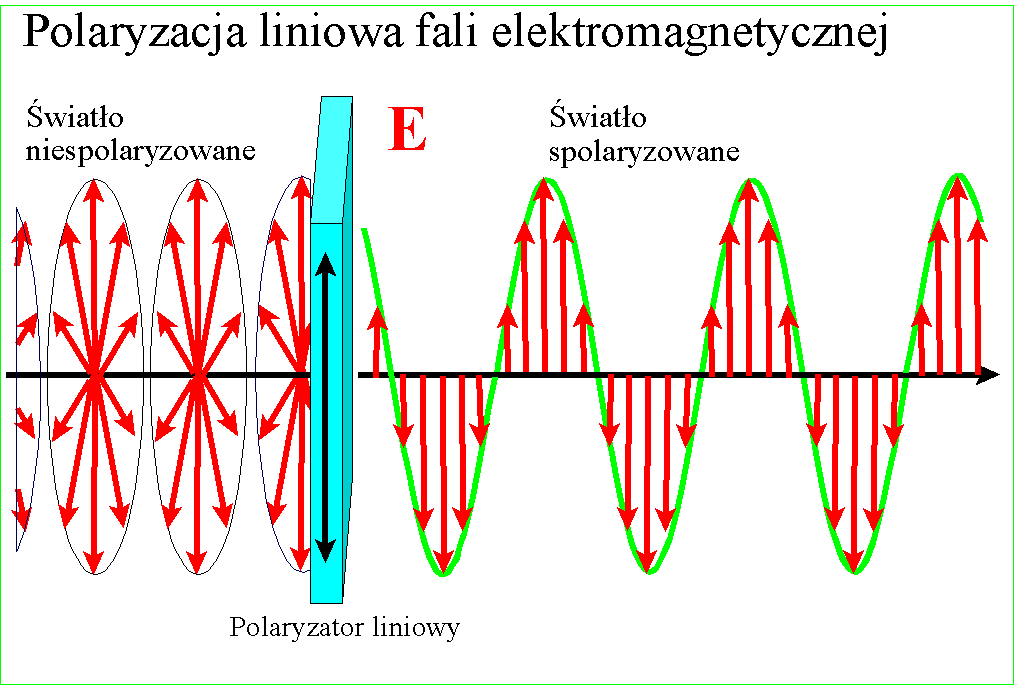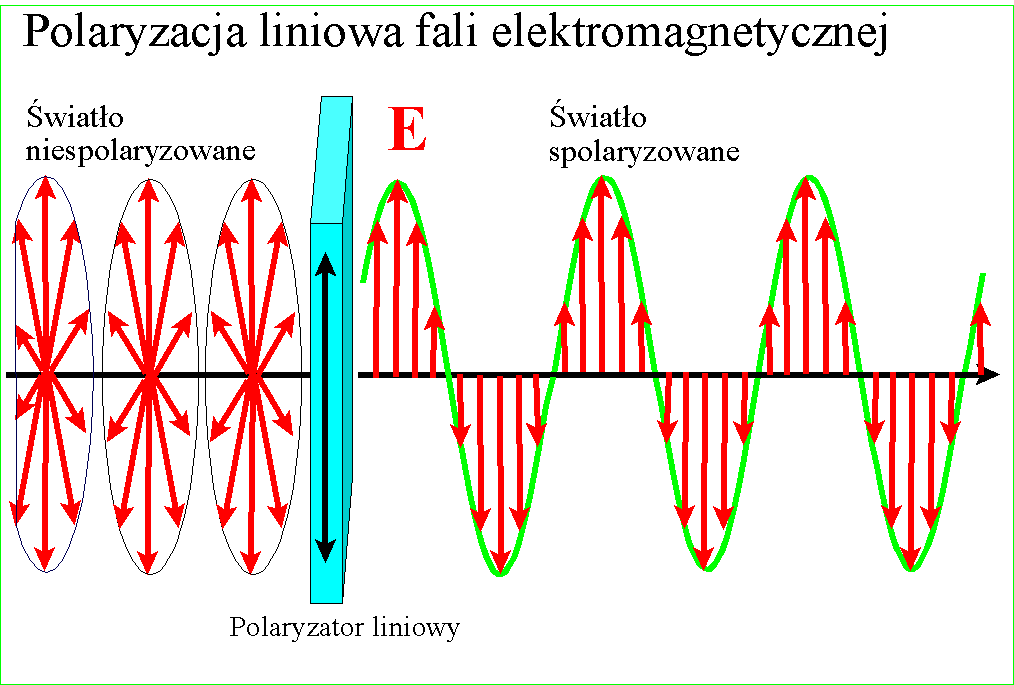
W każdym razie gdy Young udowodnił falową naturę światła, znane wcześniej zjawisko polaryzacji stało się zrozumiałe - po postu wektory pól zajmują w przestrzeni jakieś płaszczyzny względem kierunku rozchodzenia, ale w świetle zwykłym są one przemieszane. Gdy światło zostanie spolaryzowane, kierunki te porządkują się :
i wszystkie wektory spolaryzowanego światła leżą w jednej płaszczyźnie. Wyjaśnienie dwójłomności szpatu islandzkiego, powodującej podwojenie obrazu jest w tym kontekście ciekawe - prędkość światła w takim krysztale zależy od kierunku polaryzacji pól składowych. Różnica prędkości światła między kryształem a powietrzem jest przyczyną załamania światła, zatem zależnie od polaryzacji światło będzie się załamywało pod różnym kątem
Gdy wpuścimy do kryształu promień, zostanie on rozdzielony na dwa o połowę słabsze - jeden, normalny, będzie miał jedną polaryzację, a drugi, nadzwyczajny, polaryzację obróconą pod kątem prostym do polaryzacji tamtego. Każdy z promieni ma nieco inny kąt załamania dlatego oddzielają się od siebie:
Niedługo potem Malus odkrył że światło częściowo polaryzuje się przy odbiciu, zaś William Nicol wpadł na pomysł, jak za pomocą dwójłomnego kryształu uzyskać pojedynczą wiązkę spolaryzowanego światła. Wziął on rombowy kryształ szpatu islandzkiego i przeciął na ukos, otrzymując dwa pryzmaty. Połączył je ze sobą cienką warstwą przezroczystego kleju. Wiadomo było wówczas, że promień biegnący wewnątrz przezroczystego materiału może zostać całkowicie odbity, jeśli padnie na jego ścianę pod odpowiednim kątem - z tego prawa korzystają światłowody - połączenie tego z dwójłomnością pozwoliło na oddzielenie powstających dwóch promieni.
Cięcie między dwoma pryzmatami zostało poprowadzone pod takim kątem, że niewiele brakuje aby promień biegnący przez kryształ odbił się całkowicie. Wpuszczamy w kryształ promień zwykłego światła - promień rozdziela się na dwa załamane pod różnym kątem. Mniej załamany normalny biegnie dalej, silniej załamany promień nadzwyczajny odbija się całkowicie i wypada bokiem. Przechodząca wiązka zostaje spolaryzowana.
Dzięki temu urządzeniu można było badać właściwości światła spolaryzowanego, na przykład zabarwianie się minerałów i tworzyw sztucznych wykazujących choć niewielką dwójłomność.
Tym jednak co najbardziej mnie interesuje, jest odkrycie, że po przejściu przez pewne substancje, polaryzacja światła może się zmienić. Aby wygasić całkowicie liniowo spolaryzowane światło, należy umieścić na jego drodze filtr bądź drugi układ pryzmatów, ale obrócony o 90 stopni. Jednak jeśli między nie wsuniemy próbkę jakiejś substancji, jak na przykład roztwór cukru, okaże się że światło już nie jest całkowicie pochłaniane, i aby znów uzyskać ten efekt trzeba obrócić układ o jeszcze pewien kąt.
Zdolność do zmiany płaszczyzny polaryzacji światła to skręcalność optyczna, a substancje które tak robią nazywany czynnymi optycznie. Czynność ta jest związana z budową cząsteczki o asymetrii polaryzacji a co za tym idzie, asymetrią budowy. W związkach organicznych możliwa jest sytuacja, że cząsteczka może posiadać dwie formy przestrzenne, podobne do siebie jak lustrzane odbicia. Są to cząsteczki chiralne. Szersze wytłumaczenie jak to zachodzi i jakie ma znaczenie, już omawiałem w pewnym artykule.
Gdy światło spolaryzowane przejdzie przez roztwór substancji czynnej optycznie, płaszczyzna w której sytuują się wektory fali elektromagnetycznej, przekręci się o pewien kąt. Ilościowa zdolność do skręcania płaszczyzny to skręcalność, zależna od grubości roztworu, rozpuszczalnika, długości fali świetlnej i stężenia.
Własności te znalazły bardzo szerokie zastosowanie do szybkiego mierzenia zawartości cukru w sokach roślinnych. I takie też ćwiczenie wykonywałem kiedyś na pracowni jeszcze w technikum.
Wzięliśmy jabłko, z którego odważyliśmy określoną ilość miąższu, a ten po rozgnieceniu zalaliśmy odmierzoną ilością wody i zagotowaliśmy:
Po odsączeniu wyciągu wlaliśmy go do polarymetru widocznym na pierwszej fotografii - to bardzo proste urządzenie. Lampa sodowa daje intensywne światło o określonej długości fali, wpadające do urządzenia przez wstępny filtr polaryzacyjny. Następnie przechodzi przez szklaną rurkę w tubie przyrządu gdzie wlany został nasz sok. Na jego drodze staje następnie prostokąt drugiego filtru polaryzacyjnego, o polaryzacji takiej samej jak pierwszy. Gdy w urządzeniu była nieaktywna woda, w okularze widać było jednolity krążek światła:
Jednak zawierający czynne optycznie cukry sok jabłkowy skręcał płaszczyznę światła spolaryzowanego przez pierwszy filtr. Takie światło było więc częściowo zatrzymywane przez drugi filtr i na tle jasnego krążka pojawiał się ciemniejszy prostokąt:
Teraz należało przekręcić małą tarczę przy okularze tak, aby obrócić drugi filtr zgodnie z polaryzacją o pewien kąt. Ten kąt to właśnie skręcalność roztworu. Z boku obiektywu przez małą lupę można było obserwować skalę podającą z jednej strony kąt skręcenia a z drugiej stężenie cukru w roztworze.
Podobne pomiary wykonuję czasem na pracowni. Zasadniczy temat pracy magisterskiej polega na wytworzeniu ligandów do asymetrycznej reakcji Henry'ego. W takiej reakcji powinienem otrzymać mieszaninę chiralnych beta nitroalkoholi z przewagą jednej, pożądanej formy
Ale jak poznać z jak dużą przewagą? Każda forma skręca płaszczyznę polaryzacji światła o taką samą wartość ale w przeciwne strony. Mieszanina 1:1 jest wobec tego nie czynna, zaś każda przewaga którejś z form objawia się jakąś skręcalnością wypadkową. Mając porównanie z danymi literaturowymi, gdzie obie formy oddzielono i ustalono konfigurację, i gdzie podana została skręcalność mieszaniny o ustalonym stosunku, mogę przez własny pomiar w identycznych warunkach określić skład swojej otrzymanej mieszaniny wyrażony w jednostce nadmiaru enancjomerycznego - czyli procentowej nadwyżki jednej z form nad drugą.
Jak na razie najlepszy wynik jednej reakcji to nadmiar 88% ee, ale czekam na więcej.
ps. to mój 150 opublikowany wpis.
U początków wielkiej naukowej debaty o prawdziwej naturze światła zwrócono uwagę na zjawisko polaryzacji. Przezroczyste kryształy szpatu islandzkiego podwajały obraz jaki przez nie obserwowano, a wpuszczony w nie promień światła rozdzielał się na dwa - normalny, biegnący zgodnie z wartością załamania, i nadzwyczajny o silniejszym załamaniu.
Jeszcze zaś dziwaczniej zachowywały się dwa takie kryształy położone na sobie - w pewnej wzajemnej orientacji pozostawały przezroczyste, po obróceniu o 90 stopni wygaszały obraz. Zjawisko to nazwano polaryzacją i niespecjalnie się nim potem przejmowano, gdy tymczasem trwał spór między fizykami - czy światło to promień czy może wiązka przenikliwych cząstek? Istniało wiele zjawisk które udawało się łatwo wytłumaczyć modelem cząstkowym i on w zasadzie był powszechnie przyjmowany aż do 1801, gdy Thomas Young zaproponował doświadczenie z dwoma szczelinami.
Weźmy źródło światła i ujednolićmy je przepuszczając przez mały otwór. Teraz przepuśćmy nasze spójne światło przez dwa małe otworki, wielkości nakłuć końcem igły, położone blisko siebie. Zgodnie z teorią cząstkowa, powinniśmy zobaczyć dwie jasne plamki. Zamiast tego obserwowano jasną plamę pośrodku i rząd rozchodzących się po bokach mniejszych, kolorowych plamek oddzielonych plamami cienia. W sposób cząstkowy wyjaśnić się tego nie dało. Chyba że światło jest jednak falą:
Dwie szczeliny tworzą dwa źródła rozchodzących się fal, które nakładają się na siebie raz wzmacniając raz wygaszając. Young zainspirował się tu obserwacją fal na powierzchni wody, przy czym z występowania tego zjawiska wynikało, że jeśli już światło faluje, to poprzecznie do kierunku ruchu.
Późniejsza teoria powiązała światło z zaburzeniami w rozprzestrzeniającym się polu elektrycznym i magnetycznym. Pole magnetyczne które zmienia natężenie i kierunek powoduje wygenerowane pola elektrycznego, ale także o zmiennym kierunku. Zmienne pole elektryczne z kolei generuje zmienne pole magnetyczne. Te dwa wzajemnie się indukujące pola łączą się ze sobą tworząc promieniowanie elektro-magnetyczne. Wektor pola magnetycznego jest prostopadły do wektora pola elektrycznego a obydwa do kierunku rozchodzenia się promieni.:
Późniejsza teoria kwantowa zmodyfikowała ten model, wprowadzając podwójną falowo-cząstkowa naturę światła.
W każdym razie gdy Young udowodnił falową naturę światła, znane wcześniej zjawisko polaryzacji stało się zrozumiałe - po postu wektory pól zajmują w przestrzeni jakieś płaszczyzny względem kierunku rozchodzenia, ale w świetle zwykłym są one przemieszane. Gdy światło zostanie spolaryzowane, kierunki te porządkują się :
i wszystkie wektory spolaryzowanego światła leżą w jednej płaszczyźnie. Wyjaśnienie dwójłomności szpatu islandzkiego, powodującej podwojenie obrazu jest w tym kontekście ciekawe - prędkość światła w takim krysztale zależy od kierunku polaryzacji pól składowych. Różnica prędkości światła między kryształem a powietrzem jest przyczyną załamania światła, zatem zależnie od polaryzacji światło będzie się załamywało pod różnym kątem
Gdy wpuścimy do kryształu promień, zostanie on rozdzielony na dwa o połowę słabsze - jeden, normalny, będzie miał jedną polaryzację, a drugi, nadzwyczajny, polaryzację obróconą pod kątem prostym do polaryzacji tamtego. Każdy z promieni ma nieco inny kąt załamania dlatego oddzielają się od siebie:
Niedługo potem Malus odkrył że światło częściowo polaryzuje się przy odbiciu, zaś William Nicol wpadł na pomysł, jak za pomocą dwójłomnego kryształu uzyskać pojedynczą wiązkę spolaryzowanego światła. Wziął on rombowy kryształ szpatu islandzkiego i przeciął na ukos, otrzymując dwa pryzmaty. Połączył je ze sobą cienką warstwą przezroczystego kleju. Wiadomo było wówczas, że promień biegnący wewnątrz przezroczystego materiału może zostać całkowicie odbity, jeśli padnie na jego ścianę pod odpowiednim kątem - z tego prawa korzystają światłowody - połączenie tego z dwójłomnością pozwoliło na oddzielenie powstających dwóch promieni.
Cięcie między dwoma pryzmatami zostało poprowadzone pod takim kątem, że niewiele brakuje aby promień biegnący przez kryształ odbił się całkowicie. Wpuszczamy w kryształ promień zwykłego światła - promień rozdziela się na dwa załamane pod różnym kątem. Mniej załamany normalny biegnie dalej, silniej załamany promień nadzwyczajny odbija się całkowicie i wypada bokiem. Przechodząca wiązka zostaje spolaryzowana.
Dzięki temu urządzeniu można było badać właściwości światła spolaryzowanego, na przykład zabarwianie się minerałów i tworzyw sztucznych wykazujących choć niewielką dwójłomność.
Tym jednak co najbardziej mnie interesuje, jest odkrycie, że po przejściu przez pewne substancje, polaryzacja światła może się zmienić. Aby wygasić całkowicie liniowo spolaryzowane światło, należy umieścić na jego drodze filtr bądź drugi układ pryzmatów, ale obrócony o 90 stopni. Jednak jeśli między nie wsuniemy próbkę jakiejś substancji, jak na przykład roztwór cukru, okaże się że światło już nie jest całkowicie pochłaniane, i aby znów uzyskać ten efekt trzeba obrócić układ o jeszcze pewien kąt.
Zdolność do zmiany płaszczyzny polaryzacji światła to skręcalność optyczna, a substancje które tak robią nazywany czynnymi optycznie. Czynność ta jest związana z budową cząsteczki o asymetrii polaryzacji a co za tym idzie, asymetrią budowy. W związkach organicznych możliwa jest sytuacja, że cząsteczka może posiadać dwie formy przestrzenne, podobne do siebie jak lustrzane odbicia. Są to cząsteczki chiralne. Szersze wytłumaczenie jak to zachodzi i jakie ma znaczenie, już omawiałem w pewnym artykule.
Gdy światło spolaryzowane przejdzie przez roztwór substancji czynnej optycznie, płaszczyzna w której sytuują się wektory fali elektromagnetycznej, przekręci się o pewien kąt. Ilościowa zdolność do skręcania płaszczyzny to skręcalność, zależna od grubości roztworu, rozpuszczalnika, długości fali świetlnej i stężenia.
Własności te znalazły bardzo szerokie zastosowanie do szybkiego mierzenia zawartości cukru w sokach roślinnych. I takie też ćwiczenie wykonywałem kiedyś na pracowni jeszcze w technikum.
Wzięliśmy jabłko, z którego odważyliśmy określoną ilość miąższu, a ten po rozgnieceniu zalaliśmy odmierzoną ilością wody i zagotowaliśmy:
Po odsączeniu wyciągu wlaliśmy go do polarymetru widocznym na pierwszej fotografii - to bardzo proste urządzenie. Lampa sodowa daje intensywne światło o określonej długości fali, wpadające do urządzenia przez wstępny filtr polaryzacyjny. Następnie przechodzi przez szklaną rurkę w tubie przyrządu gdzie wlany został nasz sok. Na jego drodze staje następnie prostokąt drugiego filtru polaryzacyjnego, o polaryzacji takiej samej jak pierwszy. Gdy w urządzeniu była nieaktywna woda, w okularze widać było jednolity krążek światła:
Jednak zawierający czynne optycznie cukry sok jabłkowy skręcał płaszczyznę światła spolaryzowanego przez pierwszy filtr. Takie światło było więc częściowo zatrzymywane przez drugi filtr i na tle jasnego krążka pojawiał się ciemniejszy prostokąt:
Teraz należało przekręcić małą tarczę przy okularze tak, aby obrócić drugi filtr zgodnie z polaryzacją o pewien kąt. Ten kąt to właśnie skręcalność roztworu. Z boku obiektywu przez małą lupę można było obserwować skalę podającą z jednej strony kąt skręcenia a z drugiej stężenie cukru w roztworze.
Podobne pomiary wykonuję czasem na pracowni. Zasadniczy temat pracy magisterskiej polega na wytworzeniu ligandów do asymetrycznej reakcji Henry'ego. W takiej reakcji powinienem otrzymać mieszaninę chiralnych beta nitroalkoholi z przewagą jednej, pożądanej formy
Ale jak poznać z jak dużą przewagą? Każda forma skręca płaszczyznę polaryzacji światła o taką samą wartość ale w przeciwne strony. Mieszanina 1:1 jest wobec tego nie czynna, zaś każda przewaga którejś z form objawia się jakąś skręcalnością wypadkową. Mając porównanie z danymi literaturowymi, gdzie obie formy oddzielono i ustalono konfigurację, i gdzie podana została skręcalność mieszaniny o ustalonym stosunku, mogę przez własny pomiar w identycznych warunkach określić skład swojej otrzymanej mieszaniny wyrażony w jednostce nadmiaru enancjomerycznego - czyli procentowej nadwyżki jednej z form nad drugą.
Jak na razie najlepszy wynik jednej reakcji to nadmiar 88% ee, ale czekam na więcej.
ps. to mój 150 opublikowany wpis.
Subskrybuj:
Komentarze (Atom)