Kiedyś już omawiałem na blogu jeden z rodzajów izomerii - izomery orto, meta i para. Czas więc opowiedzieć coś o innym, równie często spotykanym - izomerii Trans-Cis, opartej o różne ustawienie podstawników wokół wiązania podwójnego.
Podwójne wiązanie między atomami powstaje wskutek dodania jednego wiązania typu sigma i jednego typu pi. Następuje to po hydrydyzacji orbitali elektronowych, to jest swoistego wymieszania tworzącego orbitale o wyrównanej energii. Wiązanie sigma tworzą orbitale nakładające się na wprost, zaś wiązanie pi jest tworzone przez boczne nałożenie orbitali w kształcie klepsydry po obu stromach wiązania sigma:
W efekcie wiązanie to jest sztywne i płaskie, a grupy na końcach nie zmieniają ustawienia w zwyczajnych warunkach (wysoka temperatura lub naświetlenie mogą wywołać izomeryzację). W związku z tym faktem, gdy na czterech końcach wokół wiązania obecne są różne podstawniki, możliwe stają się różne izomery.
W najprostszym przypadku na dwóch końcach pojawiają się dalsze organiczne części cząsteczki, zaś dwa pozostałe zajmują wodory. Przyjęto więc zasadę nazewnictwa, wedle której izomerami cis są cząsteczki, w których grupy organiczne znajdują się po tej samej stronie, a izomerami trans cząsteczki, w których grupy ustawione są po przeciwnych stronach:
Czasem też korzysta się z tego układu gdy przy wiązaniu pojawiają się inne podstawniki, ale takie same, na przykład dwa podstawniki chlorowe.
Z przedrostkami określającymi izomerię wiązań podwójnych możemy spotkać się w nazwach pospolitych. Słynne w ostatnich latach tłuszcze trans, to tłuszcze zawierające wyłącznie-trans nienasycone kwasy tłuszczowe. Układ taki nadaje im generalnie liniowy kształt co ma wpływ na właściwości fizyczne - tłuszcze trans mają wyższą temperaturę topnienia z powodu ściślejszego przylegania prostych cząsteczek co zwiększa oddziaływania między nimi.
Tłuszcze zawierające przynajmniej jedno wiązanie cis są bardziej wygięte, co utrudnia ścisłe upakowanie. Przykładowo kwas oleinowy, będący głównym kwasem tłuszczowym oliwki z oliwek, posiada tylko jedno wiązanie podwójne na 9 węglu (omega-9) i ma ono układ cis, przez co cząsteczka nabiera wygiętego kształtu a sam związek ma temperaturę topnienia 13°C. Jego izomer trans to kwas elaidynowy o temperaturze topnienia 45°C. Oznacza to, że ten pierwszy pozostaje płynny w temperaturze pokojowej, zaś ten drugi pozostaje stały nawet w temperaturze ludzkiego ciała.
Związkiem o dużej ilości wiązań podwójnych w układzie trans jest karoten, pomarańczowy barwnik marchwi. Z kolei przykładem związku z dużą ilością samych tylko wiązań cis jest bardzo rzadki kwas dokozoheksaenowy (DHA), w którym sześć kolejnych takich wiązań skręca jego cząsteczkę w kółeczko:
W ostatnich dekadach zwraca się uwagę na dostarczanie wraz z dietą odpowiedniej ilości tłuszczy z kwasami cis, które pełnią w organizmie różne funkcje biologiczne.
Ten typ izomerii występuje też w związkach pierścieniowych z wiązaniami pojedynczymi. W takim przypadku cały pierścień pełni rolę drugiego wiązania, powstrzymując rotację sąsiadujących grup. Izomerem cis jest związek, gdy podstawniki na sąsiednich węglach są położone po tej samej stronie pierścienia, a trans gdy po przeciwnych:
Związki różniące się geometrią wokół wiązania podwójnego mogą posiadać różne właściwości nie tylko fizyczne ale i chemiczne. W układzie Cis grupy po obu stronach mogą silniej ze sobą oddziaływać. Przykładem mogą być najprostsze nienasycone kwasy dikarboksylowe - fumarowy i maleinowy. Ten pierwszy zawiera dwie grupy karboksylowe w układzie trans, a więc po przeciwnych stronach. Dzięki temu w kryształach dość chętnie tworzą wiązania wodorowe między cząsteczkami, sam związek ma więc stosunkowo dużą temperaturę topnienia (287 °C ) i jest słabo rozpuszczalny w wodzie.
Natomiast kwas maleinowy posiada dwie grupy karboksylowe w układzie cis, po tej samej stronie, które w tym bliskim położeniu tworzą wewnątrzcząsteczkowe wiązanie wodorowe, kosztem tych pomiędzy cząsteczkami. Słabsze oddziaływania między cząsteczkami w krysztale zwiększają rozpuszczalność w wodzie oraz obniżają temperaturę topnienia niemal dwa razy. (135 °C ) W dodatku utworzenie wewnętrznego wiązania wodorowego do jednej z grup karboksylowym powoduje, że niezwiązany wodór z tej drugiej łatwiej ulega odszczepieniu, przez co kwas maleinowy jest w roztworach silniejszym kwasem niż fumarowy (pKa = 1,9 wobec 3,0). W niektórych przypadkach izomery geometryczne mogą różnić się kolorem.
Izomeria geometryczna może też mieć znaczenie dla stabilności związku. Stosunkowo duże grupy organiczne przeszkadzają sobie w przestrzeni a nawet odpychają się, dlatego ułożenie ich po tej samej stronie, w zbliżeniu, jest bardziej niekorzystne energetycznie. Objawia się to wyższą wartością ciepła spalania dla izomerów cis o dużych grupach niż dla izomerów trans. W warunkach osłabiających lub przejściowo likwidujących wiązanie podwójne obserwuje się izomeryzację i częściej wówczas ustala się równowaga z przewagą układu trans, jako mniej naprężonego.
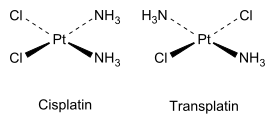
Podobny typ izomerii występuje też w związkach nieorganicznych - jeśli w kompleksie metalu z różnymi ligandami tworzona jest płaska, kwadratowa struktura, zaś kompleks tworzą dwa rodzaje ligandów, możliwe stają się dwa izomery - kompleksy cis, gdy dwa takie same ligandy znajdują się obok siebie, i kompleksy trans, gdy są położone w przeciwnych narożach kwadratu:
W powyższym przypadku kompleks nazywany cisplatyną jest znanym lekiem przeciwnowotworowym.
E/Z
Ale przypadek gdy przy wiązaniu podwójnym dwa podstawniki to wodory a kolejne dwa to grupy organiczne, jest za prosty. Jeśli w takim miejscu pojawią się cztery różne podstawniki, wówczas stosuje się nazewnictwo w systemie E/Z. Oznaczenia pochodzą od niemieckich słów "zusammen" czyli "razem" oraz "entgegen" czyli "naprzeciwko".
Zasada nazewnictwa opiera się o ważność podstawników, główną braną pod uwagę regułą jest ciężar atomowy, kolejną stopień rozbudowania czy obecność wiązań wielokrotnych. Jeśli dwie kolejno najważniejsze grupy są położone po tej samej stronie, to układ oznacza się jako Z, zaś gdy są po przeciwnych stronach, to jako E.
Warto zauważyć, że w zasadzie jest to system bardziej ogólny, w ramach którego izomeria trans/cis stanowi szczególny przypadek.
Izomeryzacja
Proces w wyniku którego następuje obrót grup i zamiana jednego izomeru w drugi, to izomeryzacja. Ze względu na sztywność wiązania podwójnego, proces musi przebiegać poprzez stan pośredni, w którym jest ono osłabione lub nie istnieje. Jedną odmian jest fotoizomeryzacja, gdzie obrót staje się możliwy dzięki energii z pochłoniętego światła. Wiązanie podwójne pochłania kwant światła i przechodzi w stan wzbudzony, w którym nie jest już tak sztywne i staje się podatne na ruchy skręcające. Może więc nastąpić obrót i zamiana w inny izomer.
W przypadku wielu związków organicznych, zakres energii pochłanianego światła lokuje je w obrębie ultrafioletu, czasem też bliżej fioletu z zakresu widzialnego, co nadaje wielu związkom nieco żółtawy kolor. Wiele związków używanych jako filtry UV w kremach do opalania to cząsteczki z wiązaniem podwójnym, które bardzo łatwo izomeryzują w obie strony. Dość chętnie używane są na przykład pochodne kwasu cynamonowego, w formie naturalnej w układzie trans :
Inny przykład to enzokamen, oznaczany jako 4-MBC, będący specyficzną pochodną kamfory:
Fotoizomeryzacja ma znaczenie dla procesu widzenia. W fotoreceptorach oka zawarty jest kompleks białka opsyny z retinalem, czyli aktywną formą witaminy A, która jest cząsteczką z trzema wiązaniami podwójnymi. W formie aktywnej w foceptorze retinal występuje w geometrii 11-cis, a więc wygiętej. Pod wpływem kwantu światła następuje izomeryzacja, przez co cząsteczka się prostuje. Do obu końców cząsteczki przyczepione są fragmenty białkowej opsyny, która po zmianie kształtu retinalu, pociągnięta mechanicznie dwoma końcami musi zmienić kształt. Generuje to kaskadę dalszych reakcji prowadzących w końcu do wytworzenia impulsu nerwowego.
Izomeryzacja może też zajść pod wpływem wysokiej temperatury i reakcji chemicznych. Przykładowo podczas uwodornienia tłuszczów nienasyconych przy produkcji margaryny, reakcja przyłączenia jednego atomu wodoru do jednego z wiązań podwójnych kwasu tłuszczowego, zamienia go w formę karboanionu. Jest to struktura niepłaska z wiązaniem pojedynczym, w której może nastąpić obrót cząsteczki. Jeśli drugi atom wodoru się nie przyłączy, aż ten dodany z powrotem ulegnie odszczepieniu, cząsteczka powróci do stanu nienasyconego ale z częściową izomeryzacją. Tak właśnie podczas tylko częściowego uwodornienia tłuszczu, z kwasów tłuszczowych cis powstają kwasy trans. (podczas całkowitego uwodornienia także wiązania trans ulegają uwodornieniu i znikają).
Izomeryzacja trwalszego kwasu fumarowego w mniej trwały maleinowy następuje w reakcji rodnikowej z bromem lub w stężonych kwasach.








Pozdrawiam!
OdpowiedzUsuńI jakie proste wytłumaczenie zjawiska widzenia...
OdpowiedzUsuń