Złamanie stuletniego prawa naukowego to coś, co nie przydarza się często. Choć też zazwyczaj są to mniej ostre przypadki - znalezienie ogólnej zasady umożliwiającej wyjątki i wykazanie, że prawo jest ograniczone do części przypadków i nadal działa. Tak jest z ostatnim doniesieniem o syntezie olefin anty-bredtowskich.
Wiązania pojedyncze w cząsteczkach zwykle pozostawiają pewną swobodę rotacyjną. O ile grupom po obu stronach nie przeszkadzają w tym inne zazębiające się przestrzennie atomy, lub nie jest to wiązanie będące częścią pierścienia, dwie części cząsteczki wokół pojedynczego wiązania mogą się obracać. W przypadku wiązań podwójnych lub potrójnych nie ma takiej swobody. Występuje opór i do przekręcenia części cząsteczki potrzebna jest dodatkowa energia lub specyficzne warunki. W zabawkowych modelach tworzonych z kulek i prętów jest to zobrazowane tym, że wiązanie podwójne to dwa pręty osadzone osobno w atomach po obu stronach, w związku z czym obrót wokół jednego jest hamowany przez mocowanie drugiego.
W ujęciu chemii kwantowej są to jednak chmury elektronowe różnego kształtu osadzone także w chmurach elektronowych powłok wokół atomów, więc ograniczenie rotacji wynika z reguł kształtu orbitali i zachowania pewnej korzystnej energetycznie geometrii. Dla wiązania podwójnego korzystna geometria to płaskie ustawienie wiązań - dwa wiązania odchodzące od obu atomów węgla przy wiązaniu podwójnym są ustawione w tej samej płaszczyźnie i odchylone od siebie i wiązania podwójnego o 120 stopni.
 |
| Model cząsteczki etylenu jako stereogram |
Ta skłonność cząsteczek do utrzymywania pewnej geometrii powoduje, że kształty odbiegające od najbardziej korzystnych są nietrwałe, a same cząsteczki bardziej reaktywne. Czasem nietrwałość pewnego układu jest tak duża, że dana cząsteczka się podczas reakcji nie tworzy a przebieg reakcji odbiega od teoretycznych możliwości, jakie można rozpisać na papierze. W końcu przy wyjątkowo niekorzystnych układach możemy dojść do wniosku, że taka cząsteczka jest niemożliwa do zaistnienia, bo natychmiast by się rozpadła. Tak było z alkenami badanymi na początku XX wieku przez niemieckiego chemika Juliusa Bredta.
Zajmował się on cyklicznymi terpenoidami i przykładowo jako pierwszy poprawnie określił strukturę kamfory. Terpenoidy zwykle są związkami nasyconymi, ulegającymi reakcjom podstawienia i eliminacji. Podczas eliminacji odejmującej dwa sąsiednie atomy, na przykład dehydratacji (utrata wodoru i grupy hydroksylowej) między atomami powstaje wiązanie podwójne. Do niego można następnie dołączyć kolejne grupy więc ten rodzaj przekształcenia jest wygodny do otrzymania różnych pochodnych. Pracując z różnymi typami cząsteczek Bredt zauważył, że pewnych możliwych produktów nie dało mu się otrzymać.
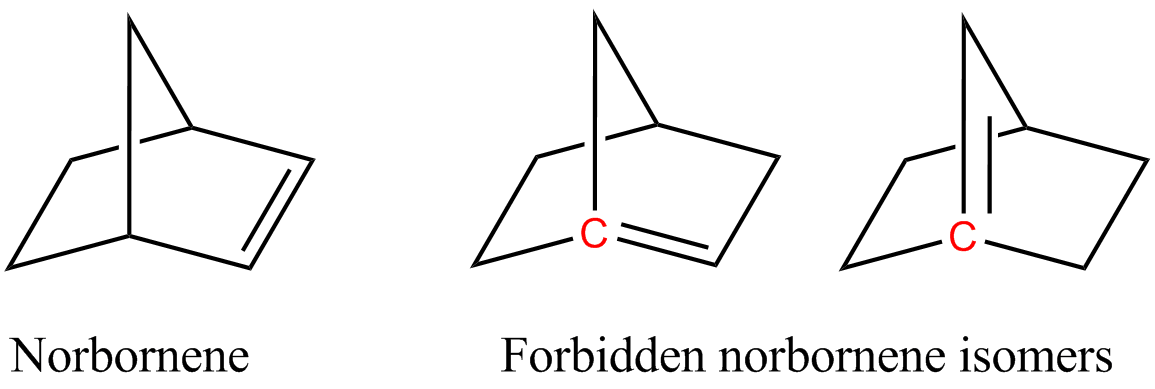
W związkach bicyklicznych dwa pierścienie łączą się na atomie nazywanym zwornikowym, od którego odchodzą trzy wiązania tworzące dalej pierścienie. I o ile reakcje prowadzące do powstania wiązania podwójnego gdzieś z boku, na dalszych częściach pierścienia, zachodziły z mniejszą lub większą łatwością, jaką można było można było wyjaśnić znanymi regułami - to gdy to wiązanie podwójne miało łączyć się z atomem zwornikowym, to związek nie chciał powstać. Albo któryś pierścień pękał, albo wiązanie podwójne powstawało w innym miejscu, omijając ten punkt. Wyglądało zatem, że jakieś powody uniemożliwiają powstawanie takich układów. A skoro tak, to zaproponowano aby nazwać tą zasadę regułą Bredta.
Dalsze badania nad regułą pokazały, że za nietrwałość brakujących izomerów odpowiada skręcenie wiązania podwójnego. Popatrzmy na rysunki - w niedozwolonych formach dalsza część cząsteczki po jednej stronie wiązania podwójnego jest przekręcona w bok a po drugiej stronie do góry i nie tworzą razem jednej płaszczyzny. Im mniejszy jest pierścień tym większe musi być to odchylenie. Reguła Bredta dotyczyła więc klasy cząsteczek, w których klatkowata forma zawiera fragmenty, których nie da się tak przekręcić, żeby trzy kolejne wiązania leżały na tej samej płaszczyźnie. Jeśli cząsteczka ma takie fragmenty, to nie może w nich powstać wiązanie podwójne, bo byłoby to niekorzystne. W przypadku niektórych podczas tworzenia w takim fragmencie wiązania podwójnego, reszta cząsteczki ulega zdeformowaniu, umożliwiając wypłaszczenie otoczenia wiązania.
Mimo że reguła przyjęła się i przydała się do wyjaśnienia niektórych mechanizmów, podejmowano próby syntezy związków z nią sprzecznych. Nieliczne wyjątki obejmowały cząsteczki o dużych pierścieniach, gdzie stopień skręcenia wiązania nie był duży. Związek naturalny krispolid, składnik wrotyczu, ma wiązanie podwójne przy atomie zwornikowym układu bicyklicznego, ale drugi pierścień jest bardzo duży i tak skręcony, że otoczenie wiązania jest niemal płaskie.
W publikacji "Rozwiązanie problemu syntezy olefin anty-bredtowskich" grupa badawcza z USA donosi o znalezieniu ogólnej metody wytwarzania zabronionych alkenów zwornikowych. Zastosowano układ w którym przy zwornikowym węglu znajdowała się dobra grupa opuszczająca - reszta kwasu triflatowego. Przy sąsiednim natomiast grupa silanowa. Jako czynnik promujący eliminację zastosowano źródło aktywnego fluoru. Fluor ma dość dużą skłonność do łączenia się z krzemem i to napędza reakcję. Po odszczepieniu silanu, grupa przy węglu zwornikowym odchodziła i powstawało wiązanie podwójne - w tym właśnie zabronionym miejscu. Jednak tej cząsteczki nie dało się wyizolować, szybko ulegała przegrupowaniom. Aby udowodnić, że w ogóle powstaje, dodano do mieszaniny czynnik, który powinien zareagować z pośrednią olefiną dając charakterystyczne produkty. W przypadku pokazanym na poniższym rysunku jest to antracen. Cząsteczka ta ma reaktywność dienu i reaguje z dienofilową olefiną w addycji Dielsa Adlera, dając produkt, którego struktura wskazuje, że musiało tutaj znajdować się wiązanie podwójne.
Reakcję powtórzono dla kilkunastu pochodnych norbornenu oraz dla kilku cząsteczek sprzegających, uzyskując wydajności dochodzące do 90%. Pozbycie się tego pokręconego, naprężonego stanu dawało taki wkład energetyczny w reakcje, że udawało się uzyskać cykloaddycję 2+2, rzadko osiąganą bez udziału światła. Tym samym stworzona została ogólna metoda syntezy olefin niezgodnych z regułą Bredta, przynajmniej jako związków pośrednich.
https://www.science.org/doi/10.1126/science.adq3519
Żeby jednak nie było tak słodko, przeglądając publikacje innych badaczy o wyjątkach od prawa Bendta zastanawiam się na czym właściwie polega nowość w tej publikacji. Na ogłoszeniu, że się je złamało? Znalezienie ogólnego typu reakcji, który można zastosować w wielu układach jest odkryciem, ale przykłady reakcji, w których takie stany pośrednie musiały powstać, na co wskazują produkty dalszych przemian, były już wcześniej opisywane. W pracy z roku 2015 Khan i współpracownicy donoszą o takiej ogólnej reakcji umożliwiającej utworzenie zwornikowego alkoholu z pochodnych norbornenu. Podobnie jak w omawianej tu publikacji, anty-brendtowski związek pośredni nie był izolowany tylko wnioskowano o nim ze skutków
https://chemistry-europe.onlinelibrary.wiley.com/doi/abs/10.1002/chem.201500131
W komentarzu pod artykułem Reinhard Keese zauważa ze zdziwieniem, że zacytowana została jego stara praca sprzed 50 lat jako dowód powszechnego uznawania alkenów anty-bendtowskich za niemożliwe, tymczasem powinny być łatwe do znalezienia inne publikacje jego zespołu, w których wykazali, że muszą one powstawać w reakcjach. "Rozwiązaliśmy problem zwornikowych wiązań podwójnych już 50 lat temu".
Więc - to złamanie starego prawa nauki, znalezienie szczególnego przypadku, czy powtórzenie wyników, które już istniały, ale nie były ogłaszane od taką szumną nazwą?

Brak komentarzy:
Prześlij komentarz