Kontynuując tematykę atomową, która okazała się całkiem popularna, spróbuję odpowiedzieć na pytanie, które już parę razy mi zadawano - jak wygląda atom i czy kiedykolwiek zrobiono mu zdjęcie?
Głównym problemem w kwestii oglądania atomu, jest to, że jest on bardzo mały. I jest to problemem na trzy różne sposoby: po pierwsze, potrzebny jest układ który ten bardzo drobny sygnał wychwyci, wzmocni i powiększy aby stał się dostępny naszym oczom. Przeciętny mikrofon używany na koncertach i uroczystościach, zbiera dźwięki nawet o głośności szeptu, zaś szereg wzmacniaczy może zwiększyć jego siłę na tyle, aby był słyszalny nawet z drugiego końca sali. Bzycząca tuż przy mikrofonie pszczoła mogłaby być słyszalna. Ale już próba użycia tego mikrofonu, aby uchwycić dźwięk, jaki z pewnością wydaje spadające na ziemię ziarenko maku, jest skazana na niepowodzenie, odgłos jest bowiem tak nikły i słaby, że odbiorniki nie zareagują.
Podobnie jest z próbami zarejestrowania odbicia światła od atomu. W końcu przecież fotony, zarówno gdy uznamy je za cząstki jak i przy
interpretacji jako pęczki falowe, same są bardzo drobne a w strumieniu
światła w skali nanometrowej nie osiągają zbyt dużego zagęszczenia.
Jeśli zaczniemy zliczać sygnały pochodzące od pojedynczego atomu może
się okazać, że w czasie wykonywania zdjęcia dostał 15 fotonami, z czego 4
odbiły się w naszą stronę.
Drugi problem dotyczy natomiast proporcji między działaniem zmierzającym do otrzymania sygnału a zachodzącymi procesami - ze względu na rozmiar, nawet bardzo małe działanie, polegające na zalaniu atomu światłem, może się okazać zbyt duże aby móc otrzymać jakiś sensowny obraz. Fotony z zakresu widzialnego mogą wzbudzać elektrony atomu, a nawet je odrywać. Rzecz zatem w tym, aby zadziałać na tyle mocno aby zarejestrować jakieś szczegóły, a na tyle słabo aby nie zniszczyć obserwowanego.
Trzecim zaś problemem jest to, że rozmiar fali światła jest w większości zakresów wielokrotnie większy od samego atomu, a to ogranicza naszą rozdzielczość.
Rozdzielczość
Rozdzielczością w układach optycznych nazywamy minimalną odległość między dwoma punktami, przy jakiej da się jeszcze dostrzec między nimi różnicę - poniżej tej wartości będą widziane jako jeden punkt. Jest ona ograniczona nie tylko przez czysto techniczne aspekty, w rodzaju mocy soczewek, refrakcję czy wielkość obiektywu. W przypadku bardzo małych punktów świetlnych wytwarzanych przez układ skupiający, znaczenia nabiera też dyfrakcja światła. Dwie plamki, leżące zbyt blisko siebie, zaczną się zlewać za sprawą interferencji nawet jeśli wydawałoby się, że ich obrysy jeszcze się nie stykają.
Granicę dla danej długości fali światła z którego stworzony jest obraz, wyznacza warunek Rayleigha, mówiący jaki jest minimalny kąt przy jakim rozróżniane będą promienie światła o danej długości fali. Im krótsza fala promieniowania, tym większa rozdzielczość. Dla światła fioletowego w standardowych mikroskopach optycznych, minimalna rozdzielczość liniowa to około 200 nm. Atomy są około tysiąc razy mniejsze od tej wartości.
Można próbować omijać te problemy zmniejszając długość fali, czyli brnąć poza zakres widzialny. W tym przypadku tysiąckrotne zmniejszenie długości fali da nam promieniowanie rentgenowskie. Bardzo przenikliwe, trudne do zogniskowania przy pomocy jakichś soczewek, w dodatku jonizujące. W taki sposób klasycznego mikroskopu się nie zrobi
Jeśli nie światło to coś innego
Skoro światło jest ograniczane przez prawa fizyki, to może spróbujmy otrzymać obraz przy pomocy czegoś zupełnie innego? Na przykład rejestracji bardzo drobnych cząstek.
Pierwszym takim pomysłem był mikroskop polowy, oparty o rejestrację elektronów emitowanych przez atomy umieszczone w bardzo silnym polu elektrycznym. Elektrony są bardzo małe (nie zdołano określić średnicy), a długość odpowiadającej im wedle praw fizyki kwantowej fali de Brogile'a jest w sam raz na tyle krótka, aby możliwe było ich użycie do obrazowania poniżej możliwości światła.
Pomysł na mikroskop był bardzo prosty. Wiadomo było, że metale mogą emitować elektrony pod wpływem przyłożonego dużego napięcia. W zasadzie więc można powiedzieć, że w takich warunkach "świecą" elektronami, czerpiąc je wciąż z przyłożonego prądu, i emitując w próżnię pod wpływem pola. Elektrony od miejsca uwolnienia do drugiej elektrody poruszają się po liniach prostych, zgodnie z liniami pola. Miejscem na powierzchni metalu, z którego elektrony są wyświecane najchętniej, są oczywiście atomy bo tam skupia się największe ich zagęszczenie, emisja z przestrzeni pomiędzy, bezpośrednio z wiązań, jest mało prawdopodobna. Z przyczyn geometrycznych najłatwiej emitują elektrony atomy znajdujące się na lokalnych krawędziach, a więc na końcach ostrzy, w mniejszej skali na końcach nierówności, w jeszcze mniejszej na krawędziach warstw w jakie ułożone są atomy w krysztale metalu.
Możliwe jest zatem zbudowanie układu, w którym końcówka ostrza emituje elektrony, a te rozbiegają się po linii prostej dążąc do dużej anody i utrwalając się na błonie fotograficznej utworzą powiększony aż do "naszych" wymiarów obraz ułożenia atomów na końcówce ostrza. Pierwszą taką próbę przeprowadzono już w 1936 roku. Typowy obraz z mikroskopu polowego wygląda następująco:
Atomy to te jasne kropki, z których ułożony jest wzór. Ciemne obszary to płaskie wnętrza warstw, atomy wewnątrz warstwy prawie nie emitują elektronów. Widoczne są więc same krawędzie. Zdjęcie pokazuje nam w istocie trójwymiarowy obraz końcówki kryształu, zwróconej w naszą stronę.
Nie bardzo to widzicie? To zobaczcie model podobnej powierzchni, wykonany z małych kulek i oświetlony z boku:
Właśnie coś takiego pokazują takie obrazy. A każdy świetlny punkt budujący wzór, to jeden atom.
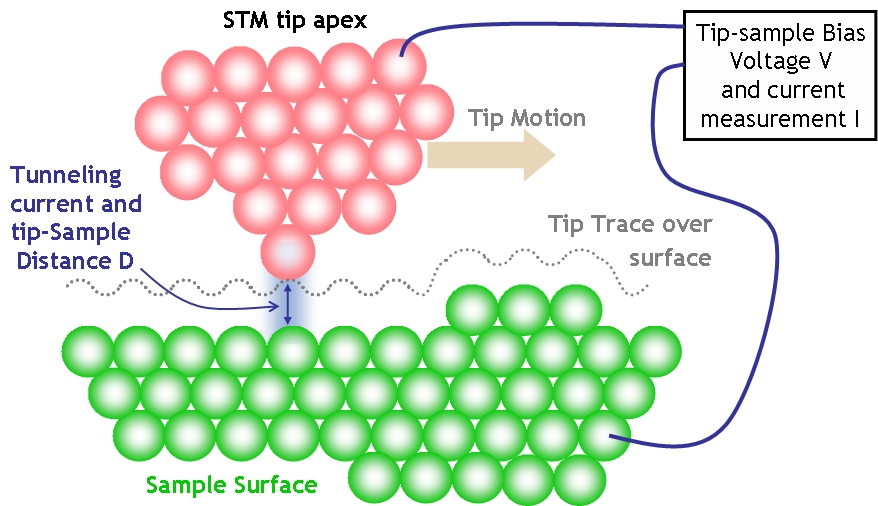
Z tego pomysłu wypączkował kolejny, mający zobrazować większe powierzchnie. W pewnym stopniu rzecz polega na odwróceniu sytuacji - sygnał zbierany jest ostrzem igły a elektrony emituje powierzchnia. Sygnałem zbieranym nie jest jednak obraz uderzających elektronów, a wartość prądu w danym punkcie, dlatego dla uzyskania obrazu powierzchni, trzeba ją całą punkt po punkcie przejechać z bliska igłą, czyli przeskanować. Stąd nazwa - skaningowa mikroskopia atomowa (STM).
Wykorzystuje się tutaj prawa fizyki - końcówka igły jest bardzo blisko badanej powierzchni, nie dalej niż parę średnic atomów. Przyłożone napięcie jest duże, ale jednak zbyt małe aby elektron z metalu wyrwać. Czyli właściwie prąd nie powinien płynąć. Jednak efekty kwantowe umożliwiają tak zwane przejście tunelowe, to jest przeniknięcie cząsteczki przez stawiającą jej opór barierę sił, mimo posiadania zbyt małej energii. Elektron znika ze swojego atomu i pojawia się na ostrzu elektrody, mimo energii pola za małej aby go po prostu zjonizować.
Czuły układ elektroniczny rejestruje płynący prąd. W przypadku tak małej skali natężenie prądu tunelowego zależy wprost od rzeczywistej odległości między atomem powierzchni a atomem ostrza, a różnice są na tyle duże, że już w zakresie odległości rzędu jednej średnicy atomu różnica staje się zauważalna. Gdy ostrze przesuwa się nad powierzchnią, w położeniu dokładnie nad atomem prąd jest większy a w położeniu pomiędzy atomami, nad leżącym bardziej wgłąb wiązaniem, jest słabszy.
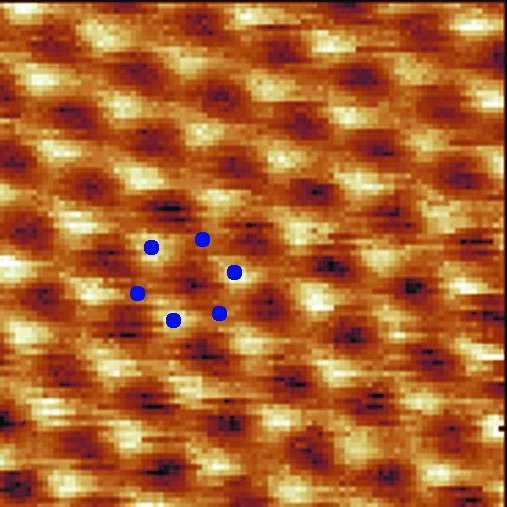
Po nałożeniu siły sygnału na mapę przesunięć ostrza otrzymujemy obraz badanej powierzchni w skali atomowej. Na przykład obraz powierzchni grafitu:
Trochę bardziej wyrafinowana modyfikacja polega na utrzymywaniu stałej wartości prądu tunelowego przez regulowanie odległości, sygnałem jest więc wielkość odsunięcia. Ma to tą zaletę, że pozwala na obrazowanie bardziej różnorodnych powierzchni i nie ma ryzyka, że koniec igły zahaczy o nierówność.
Skanowanie wymaga bardzo precyzyjnego sterowania ruchem igły, używa się tu odpowiednich przetworników piezoelektrycznych. Ponadto sama igła musi być odpowiednio wykończona, tak aby jej szpic był najostrzejszy na świecie i kończył się pojedynczym atomem. W praktyce igłą jest drucik wolframowy ostrzony przy pomocy elektrochemicznego wytrawiania:
Metoda ta ma jednak istotne ograniczenie - można badać nią powierzchnie wykonane z materiałów przewodzących prąd. Aby móc badać inne materiały, wymyślono technikę jeszcze bardziej wyrafinowaną - mikroskopię sił atomowych (AFM).
W takim urządzeniu przemiatamy badaną powierzchnię umieszczoną bardzo blisko zaostrzoną sondą, umieszczoną na długim i elastycznym pręciku. Wskutek sił przyciągania pomiędzy atomami sonda przybliża się do powierzchni. Teraz trzeba tylko zmierzyć jak bardzo zmieniło się położenie sondy, można użyć czujników laserowych opartych o zmianę położenia odbicia promienia, ale widziałem także rozwiązania niejako dubletowe, w których przesunięcie sondy AFM badano sondą mikroskopii tunelowej rejestrując zmiany prądu tunelowego. Sonda najsilniej jest przyciągana gdy znajdzie się najbliżej atomu, a słabiej gdy w linii prostej od niej znajdzie się przestrzeń między atomami.
Dokładność obrazowania jest równie dobra jak w STM
Tutaj zobrazowano cząsteczkę pentacenu:
Obie techniki mają swoje ograniczenia. W praktyce można tak przeskanować tylko bardzo mały fragment powierzchni. Badana próbka musi być silnie schłodzona, aby obrazu nie rozmywały drgania termiczne, i utrzymywania w próżni. Jednym z głównych problemów technicznych są w obu technikach drgania zewnętrzne. Nie dość, że przeszkadzają drgania od ruchu ulicznego czy stąpania laboranta, ale też ponoć już takie źródła jak woda kapiąca z dachu na parapet czy po prostu wiatr tak bardzo rzucają igłą sondy na prawo i lewo, że nie da się zarejestrować sygnału. W zasadzie sonda umieszczona na stałe nad płaską powierzchnią byłaby niezłym sejsmometrem.
A może jednak światłem?
Tyle już się tu naopowiadałem o wadach światła do obrazowania w tak małej skali, że wypadałoby jednak wspomnieć o pewnym wyjątku. Zespół z Griffith University donosił kilka lat temu o rejestracji cienia pojedynczego atomu [1].
Atom iterbu został umieszczony w pułapce magnetycznej i oświetlony skupionym strumieniem światła w częstotliwości silnie przez ten pierwiastek adsorbowanej. Strumień światła przy pomocy soczewek skupiono tak, że przed atomem w zasadzie rozszerzał się, przez co cień atomu został poszerzony. Dalszy układ soczewek skupił obraz na matrycy mikroskopijnych detektorów. Otrzymany w ten sposób cień miał już kilka mikrometrów średnicy.
Warunek Rayleigha nie został jednak całkowicie pominięty - nie jest to właściwie cień lecz plamka Airy'ego powstała wskutek dyfrakcji światła, z ciemnym środkiem wskutek wygaszania faz i coraz słabszymi pierścieniami wokół:
Zdjęcie atomu i jego powłok elektronowych
Na koniec dochodzimy do przypadku chyba najbardziej wyrafinowanego - zdjęcia pojedynczych, samotnych atomów, z rozdzielczością umożliwiającą określenie kształtu i wielkości poszczególnych powłok elektronowych!
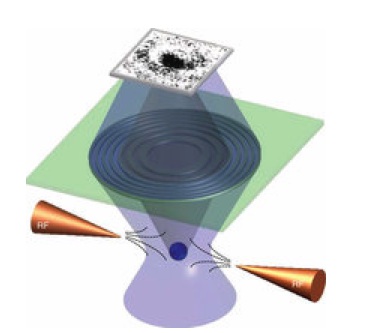
Pomysł na "mikroskopię kwantową" jest ponownie bardzo prosty i sprytny, ale dodatkowo odwołuje się do już omówionych technik.
Obrazowanie zachodzi następująco: umieszczamy obojętne pary pierwiastka w próżni i przykładamy do nich bardzo silne pole elektryczne. W pewnym punkcie umieszczamy laser, który tworzy krótkie impulsy, na tyle drobne aby trafiały na raz tylko w jeden atom. Atom naświetlony laserem wchodzi w stan wzbudzony, jako tzw. atom Rydbergowski. W takim stanie elektron jest z nim słabo związany i łatwo ulega oderwaniu przez zewnętrzne pole elektryczne. Po zjonizowaniu, elektron trafia na elektryczny układ soczewkujący, który ma za zadanie powiększyć obraz oraz odfiltrować elektrony wybiegające tylko z jednego określonego miejsca w komorze badawczej. Detektor rejestruje jeden punkt. Potem strzelamy drugi raz laserem i wzbudzamy następny atom. I tak po kolei, punkt po punkcie [2].
Prawdopodobieństwo emisji elektronu z przestrzeni wokół jądra, jest największe tam, gdzie największe jest zagęszczenie ładunku, to jest w powłokach elektronowych. W miejscach powierzchni węzłowych funkcji falowej jest dokładnie zerowe. Zarazem jednak to z którego konkretnie punktu orbitala strzeli elektron, jest zupełnie przypadkowe. Po wzbudzeniu tysięcy atomów jeden po drugim w tym samym punkcie komory, otrzymamy jako sumę obraz przedstawiający statystyczny rozkład prawdopodobieństwa emisji, to jest rozkład zagęszczenia ładunku wokół jądra, czyli właśnie powłokę elektronową. Pierwszy taki obraz dla wodoru potwierdził, że orbitale podpowłok s mają kształt sferyczny:
----------
* https://pl.wikipedia.org/wiki/Zdolno%C5%9B%C4%87_rozdzielcza
* https://en.wikipedia.org/wiki/Angular_resolution#Explanation
* https://en.wikipedia.org/wiki/Diffraction-limited_system
* https://en.wikipedia.org/wiki/Scanning_tunneling_microscope
* https://en.wikipedia.org/wiki/Field_ion_microscope
* https://en.wikipedia.org/wiki/Atomic_force_microscopy
[1] Erik W. Streed, Andreas Jechow, Benjamin G. Norton & David Kielpinski, Absorption imaging of a single atom, Nature Communications 3, Article number: 933 (2012)[2] A. S. Stodolna, A. Rouzée, F. Lépine, S. Cohen, F. Robicheaux, A. Gijsbertsen, J. H. Jungmann, C. Bordas, and M. J. J. Vrakking; Hydrogen Atoms under Magnification: Direct Observation of the Nodal Structure of Stark States, Phys. Rev. Lett. 110, 213001
informacje
środa, 30 sierpnia 2017
piątek, 25 sierpnia 2017
Jaki może być największy atom?
Jak duży maksymalnie może być atom? Czy możliwe jest aby powiększyć go tak bardzo, że stanie się niemal widoczny gołym okiem?
Atom to zgodnie z definicjami układ składający się z elektronów krążących wokół jądra, zawierającego protony oraz neutrony (wyjątek - wodór-1 mający tylko proton). Ze względu na efekty kwantowe to w jaki sposób elektrony są wokół atomu rozmieszczone, jest dość skomplikowane, ale dla uproszczenia przyjmijmy znany wszystkim model planetarny, w którym elektrony krążą po prostu po kolistych orbitach.
Atomy są bardzo małe. Naprawdę bardzo. Ich średnice mierzymy w Angstremach, stanowiących jednostki o długości 10−10 metra, czyli obrazowo jest to 0,0000000001 metra. Ludzie właściwie nie ogarniają takich skal, bo nigdy nie stykają się takimi krotnościami wśród obiektów materialnych. Człowiek o wysokości 1,75 m jest w stosunku do Ziemi o średnicy 12 740 km zaledwie 7,3 miliona razy mniejszy, co stanowi różnicę o sześć rzędów wielkości. Tymczasem atomy są od człowieka o dziesięć rzędów wielkości mniejsze.
I choć są tak małe, atomy składają się ze składników jeszcze mniejszych. Większość ich masy jest zawarta w centralnym jądrze. Budujące jądro neutrony i protony są od elektronów 1839 razy cięższe. Jądro ma też niezwykle małą średnicę, jeśli porównać ją z rozmiarem orbity na której znajdują się elektrony, jest bowiem około sto tysięcy razy mniejsze. W zasadzie większość objętości atomu to pustka przez którą przebiegają silne oddziaływania elektryczne. Gdybyśmy powiększyli atom do średnicy Ziemi, jądro miałoby około 120 metrów średnicy.
Jako wielkość danego atomu przyjmujemy wielkość najdalszej orbity jego elektronów. Najmniejszy atom wodoru ma zaledwie 0,53 A średnicy, największy atom cezu ma średnicę 2,32 A, czyli jest tylko 5 razy większy. No chyba że weźmiemy pod uwagę szczególny stan atomu, a konkretnie jego elektronów.
Elektrony grupują się w powłokach elektronowych, przy czym w danej powłoce mieścić się może tylko pewna ich liczba. Ponieważ układ taki dąży do stanu o najniższej energii, elektrony wypełniają najbliższe możliwe orbity względem jądra. Siła przyciągania elektronu z jądrem zależy od tego jak blisko niego krąży; standardowo wyraża się ją w energii jonizacji, to jest takiej porcji która jest w stanie całkowicie oderwać elektron i utworzyć jon. Jest to energia potrzebna na to aby odchylić elektron z położenia równowagowego i oddalić go w "nieskończoność".
A co jeśli dostarczymy elektronowi nieco mniej energii? Otóż zacznie przeskakiwać na następną, wyższą energetycznie orbitę. W jego własnym miejscu zrobi się wakat, a układ w atomie stanie się niestabilny. Mówimy wtedy o stanie wzbudzonym. Zaraz więc ten sam lub inny elektron z wyższej powłoki, powróci w to miejsce, wypromieniowując kwant energii w postaci światła odpowiedniej długości fali. Na tych zjawiskach opiera się absorpcja i emisja światła, decydująca na przykład o kolorach materii czy płomieni.
Zastanówmy się jak to wygląda, na przykładzie najprostszego atomu - wodoru. Wodór ma tylko jeden elektron, na podpowłoce 1s, to jest na najbliższej orbicie. Wzbudzenie go porcją energii spowoduje że przeskoczy on na następną potencjalnie możliwą orbitę, na podpowłokę 2s. Kolejna porcja przesunie go na podpowłokę 2p a następna na 3s. Kolejność podpowłok zmienia się wedle rosnących energii wedle pewnego wzoru, zwykle rysowanego jak deszczyk na tabelce:
Jak możemy zobaczyć, po 11 przeskokach dzięki coraz większym porcjom energii, elektron znajdzie się na podpowłoce 6s, czyli znajdzie się w takim położeniu, w jakim znajdowałby się zewnętrzny elektron atomu Cezu. To już dosyć daleko. Co jednak stanie się, jeśli będziemy mu dodawać następne porcje energii, ale zbyt małe aby go po prostu zjonizować? Będzie przeskakiwał na kolejne i kolejne, aż znajdzie się na egzotycznych podpowłokach w rodzaju 17s które nie występują w żadnym istniejącym pierwiastku. Zaś wraz z kolejnymi przeskokami, rosnąć będzie też wielkość orbity, czyli odległość od jądra.
Przypomnijmy sobie teraz definicję atomu, jako układu dodatnio naładowanego jądra i krążących wokół elektronów. Atom z bardzo wzbudzonym, bardzo odległym elektronem, nadal jest formalnie atomem. A skoro tak, to jego średnica, która jest liczona jako średnica najdalszej orbity elektronowej, jest teraz bardzo duża. Tak bardzo duża, że w ekstremalnych przypadkach ze skali nano zbliża się do dużo lepiej nam znanych skal ułamków milimetra.
Tego typu atomy wzbudzone niemal do granicy jonizacji, nazywamy atomami Rydberga, wzięły nazwę od wzoru Rydberga opisującego długości fal w widmie emisyjnym wodoru. Wodór poddany działaniu wysokiej temperatury lub prądu elektrycznego, zaczyna emitować światło zawierające wiele serii pasm emisyjnych. Rydberg empirycznie opisał wszystkie te serie jednym wzorem, gdy jeszcze nie było wiadomo z czego wynikają. Gdy już ustalono model atomu, dla wszystkich stało się jasne, że bardziej oddalone serie emisyjne są wynikiem spadania na najbliższą jądru orbitę elektronu bardzo silnie wzbudzonego.
Rozmiar
Wraz ze stopniem wzbudzenia, bardzo szybko wzrasta promień orbity. Dla n=10 to jest dla dziesiątego poziomu energetycznego, średnica wzbudzonego atomu wodoru jest 200 razy większa niż w stanie podstawowym .
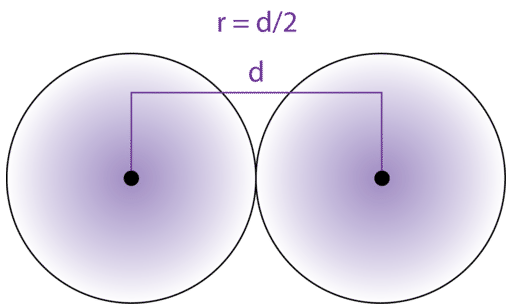
Przy bardzo silnym wzbudzeniu atom powiększa się tysiące a nawet miliony razy. Jednym z takich przypadków jest opisana w 2009 roku cząsteczka dwóch ultrachłodnych atomów rubidu, które po silnym wzbudzeniu utworzyły wiązanie o długości 100 nanometrów. Atomy połączone wiązaniem kowalencyjnym zatrzymują się w optymalnej odległości w której ich zewnętrzne powłoki stykają się ze sobą,zatem promień każdego z atomów wynosił 50 nm i był 25 razy większy niż normalnie.[1]
Ale to jeszcze nic. Niedawno doniesiono o zaobserwowania cząsteczki dwóch atomów cezu wzbudzonych do 44 poziomu energetycznego. Cząsteczka ta ma wielkość 1 mikrometra, co oznacza że jest większa niż wiele bakterii.[2]
Obliczenia pokazują, że w ekstremalnych przypadkach około 1000 poziomu energetycznego, średnica atomu osiąga około 1 mm.
Trwałość
Atomy wzbudzone energetycznie są generalnie nietrwałe - układ elektronowy będzie dążył do stanu podstawowego, toteż wybity daleko skrajny elektron "spadnie" z orbity możliwie najbliżej, emitując światło o długości fali odpowiadającej różnicy energii. Czas trwania takiego stanu jest zazwyczaj skrajnie krótki, w przejściach odpowiedzialnych za fluorescencje są to czasy rzędu nanosekund i krótsze. Jeśli jednak wzbudzenie jest duże, stan przedłuża się. Wynika to z prawdopodobieństwa przejścia energetycznego - im większa jest energia przejścia, tym mniejsze jest prawdopodobieństwo zajścia. Średni czas trwania stanu wzbudzonego w badanych laboratoryjnie atomach rydbergowskich, jest rzędu od milisekund do niemal sekundy. Wystarcza to aby zbadać ich właściwości, oraz aby ich obecność miała wpływ na procesy fizyczne.
Z drugiej jednak strony, takie silnie wzbudzone atomy są bardzo wrażliwe. Znacznie oddalony elektron jest już dosyć słabo związany z jądrem atomowym, i niewiele potrzeba mu energii aby odpadł całkowicie. Wystarczać mogą zderzenia z innymi atomami, foton światła czy własne drgania termiczne. Charakterystyczną cechą takich układów jest też łatwa jonizacja pod wpływem pola elektrycznego czy magnetycznego. Dlatego zazwyczaj stan ten jest badany w wysokiej próżni i w bardzo niskich temperaturach.
Całkiem niezłe warunki do trwania takiego stanu istnieją w otwartej przestrzeni kosmicznej. Próżnia międzygwiezdna jest dużo doskonalsza od otrzymywanej w ziemskich laboratoriach, atom może przebyć w przestrzeni wiele kilometrów zanim zderzy się z innym. Jest tam też dosyć chłodno, średnia temperatura wszechświata to zaledwie kilka kelwinów. Dlatego atomy rydbergowskie o bardzo wysokich poziomach energetycznych, rzędu n=300 i więcej, mogą trwać w kosmosie tak długo, aż nie dojdzie do spontanicznego przejścia energetycznego, a to może potrwać zaskakująco długo. Ich obecność w kosmosie jest trudna do wykrycia, możliwe więc, że da się przy ich pomocy wyjaśnić choć część niedomkniętego bilansu materii we wszechświecie.
Z powodu tej delikatności trudno byłoby jednak "zobaczyć" atom rydbergowski, nawet przy użyciu mikroskopu świetlnego. Nasze działania polegające na zalaniu go strumieniem światła mogą po prostu spowodować jego rozpad. W praktyce obserwuje się je pośrednio. Możemy zaczekać aż spontanicznie powróci do stanu podstawowego i zarejestrować kwant światła o wysokiej energii. Możemy też podziałać na niego bardzo słabym polem elektrycznym. Wykrycie jonizacji, to jest pojawienia się elektronu i kationu, w sytuacji gdy działające pole było bardzo słabe, dowodzi istnienia stanu silnie wzbudzonego, w którym to słabe pole było wystarczająco silne aby elektron oderwać ostatecznie.
Materia rydbergowska
Jedną z ciekawych właściwości wysoce wzbudzonych atomów jest dość wysoki moment dipolowy. Elektron krąży bowiem tak daleko i na tyle wolno, że w skończonym czasie uwidacznia się wyróżniony wektor elektryzacji. Fakt ten powoduje, że wzbudzone atomy mają skłonność do "sklejania" się w większe grupy. Chwilowe, ukierunkowane momenty dipolowe generują między nimi odpowiednik sił Londona. Ze względu na słabe przyciąganie, w grupkach wielu atomów rydberga elektrony mogą przeskakiwać z jednego na drugi, tworząc uśredniony stan podobny do wiązania metalicznego, co dodatkowo stabilizuje układ. Tak powstałe klastry tworzą nowy stan materii, który trudno nazwać ciałem stałym, gazem czy cieczą, oraz na pewno nie plazmą, bo mimo wszystko elektrony wciąż są z jądrami związane.
Co ciekawe, klastry takie są dużo trwalsze od osobnych wzbudzonych atomów, następuje interferencja ich funkcji falowych i uwspólnienie stanu, możliwe też że wiązanie "rydbergometaliczne" tworzy mały dołek na wykresie energetycznym utrudniając elektronom powrót do stanu podstawowego jeszcze troszeczkę. Dla klastrów 12 atomowych czas życia to już około 25 sekund. Grupki po kilkadziesiąt atomów mogłyby mieć średni czas trwania rzędu minut lub godzin, o ile oczywiście udałoby się je odizolować od zewnętrznych wpływów na tak długo. Na razie otrzymujemy klastry w formie płaskich warstw na podłożu, z którym słabo oddziałują, największy zgłoszony składał się z 91 atomów. Są pewne teoretyczne ograniczenia wielkości, związane z tym że jądra atomów są sklejane przez gaz elektronowy, który uśrednia się w czasie na tyle, iż działa jak równomierna siła. Problem pojawia się jednak gdy elektronów nie ma wcale tak dużo, a sam klaster jest ogromny.
Dla układu atomów na setnym poziomie energetycznym, odległości między nimi są już większe niż 1000 nanometrów. Jeśli grupa jest więc duża to biorąc pod uwagę, że elektron nie może przekraczać prędkości światła, może się zdarzyć że w wyniku przypadkowych fluktuacji lokalnie ładunek elektronów zwiększy się w pewnym miejscu, a bardziej osamotniony atom z brzegu będzie odczuwał zbyt słabe przyciąganie i oderwie się, zaś potrzebne do jego związania elektrony zwyczajnie nie nadążą. Klaster będzie się wówczas rozpadał i jonizował.
Otrzymywanie
Znanych jest kilka metod otrzymywania takich atomów. W każdym chodzi o to aby wzbudzać atomy silnie ale jednak precyzyjnie, poniżej progu jonizacji. Jednym ze sposobów jest bombardowanie atomów elektronami przyspieszonymi w polu elektrycznym. Energia elektronów zależy wtedy od przyłożonego potencjału i można ją z dużą dokładnością określić, stąd możliwość przekazania atomom konkretnej jej porcji.
Inny sposób to zderzanie obojętnego atomu z jonem. Zachodzi wtedy między nimi wymiana elektronu. Zostaje on wzbudzony za sprawą energii kinetycznej zderzanych jąder.
Obecnie najbardziej badanym sposobem jest jednak wzbudzanie elektronów światłem - pochłonięcie przez atom kwantu światła wzbudza jego zewnętrzne elektrony do stanu o dokładnie takiej energii jaką miał tamten foton. Precyzyjnie dobierając długość fali można zatem otrzymać atom na takim poziomie energetycznym jaki jest nam potrzebny.
Zastosowanie
Czy atomy rydbergowskie, to tylko taka sobie ciekawostka, bez praktycznych zastosowań? Wprawdzie jest to stan dość egzotyczny i nietrwały, ale w niektórych sytuacjach okazuje się idealny. Przede wszystkim są idealnym obiektem do badań fizycznych, mogących potwierdzić przewidywania co do oddziaływań fizycznych w zwyczajnych atomach. Bardziej jednak interesującym zastosowaniem, jest użycie ich jako qubitów w komputerach kwantowych. Stany kwantowe wzbudzonych atomów można zmieniać przy pomocy odpowiednio dobranych impulsów światła bez jonizacji Ponieważ zaś stany takie trwają w tym przypadku dosyć długo, można zdążyć wykonać kwantowe obliczenia zanim układ się rozpadnie.
W zeszłorocznym artykule z Nature Communications donoszono o przeprowadzeniu obliczeń na układzie 40 atomów rydbergowskich, co stanowi jeden z największych zbudowanych układów.[3]
---------
* https://en.wikipedia.org/wiki/Rydberg_atom
* http://www.princeton.edu/~mlittman/SciAmer.pdf
* https://en.wikipedia.org/wiki/Rydberg_matter
[1] Vera Bendkowsky, Bjorn Butscher, Johannes Nipper, James P. Shaffer, Robert Low & Tilman Pfau. "Observation of ultralong-range Rydberg molecules." Nature, Vol 458, 23 April 2009, doi:10.1038/nature07945.
[2] Heiner Saßmannshausen et al. Observation of Rydberg-Atom Macrodimers: Micrometer-Sized Diatomic Molecules, Physical Review Letters (2016). DOI: 10.1103/PhysRevLett.117.083401
[3] https://www.nature.com/articles/ncomms13449
Atom to zgodnie z definicjami układ składający się z elektronów krążących wokół jądra, zawierającego protony oraz neutrony (wyjątek - wodór-1 mający tylko proton). Ze względu na efekty kwantowe to w jaki sposób elektrony są wokół atomu rozmieszczone, jest dość skomplikowane, ale dla uproszczenia przyjmijmy znany wszystkim model planetarny, w którym elektrony krążą po prostu po kolistych orbitach.
I choć są tak małe, atomy składają się ze składników jeszcze mniejszych. Większość ich masy jest zawarta w centralnym jądrze. Budujące jądro neutrony i protony są od elektronów 1839 razy cięższe. Jądro ma też niezwykle małą średnicę, jeśli porównać ją z rozmiarem orbity na której znajdują się elektrony, jest bowiem około sto tysięcy razy mniejsze. W zasadzie większość objętości atomu to pustka przez którą przebiegają silne oddziaływania elektryczne. Gdybyśmy powiększyli atom do średnicy Ziemi, jądro miałoby około 120 metrów średnicy.
Jako wielkość danego atomu przyjmujemy wielkość najdalszej orbity jego elektronów. Najmniejszy atom wodoru ma zaledwie 0,53 A średnicy, największy atom cezu ma średnicę 2,32 A, czyli jest tylko 5 razy większy. No chyba że weźmiemy pod uwagę szczególny stan atomu, a konkretnie jego elektronów.
Elektrony grupują się w powłokach elektronowych, przy czym w danej powłoce mieścić się może tylko pewna ich liczba. Ponieważ układ taki dąży do stanu o najniższej energii, elektrony wypełniają najbliższe możliwe orbity względem jądra. Siła przyciągania elektronu z jądrem zależy od tego jak blisko niego krąży; standardowo wyraża się ją w energii jonizacji, to jest takiej porcji która jest w stanie całkowicie oderwać elektron i utworzyć jon. Jest to energia potrzebna na to aby odchylić elektron z położenia równowagowego i oddalić go w "nieskończoność".
A co jeśli dostarczymy elektronowi nieco mniej energii? Otóż zacznie przeskakiwać na następną, wyższą energetycznie orbitę. W jego własnym miejscu zrobi się wakat, a układ w atomie stanie się niestabilny. Mówimy wtedy o stanie wzbudzonym. Zaraz więc ten sam lub inny elektron z wyższej powłoki, powróci w to miejsce, wypromieniowując kwant energii w postaci światła odpowiedniej długości fali. Na tych zjawiskach opiera się absorpcja i emisja światła, decydująca na przykład o kolorach materii czy płomieni.
Zastanówmy się jak to wygląda, na przykładzie najprostszego atomu - wodoru. Wodór ma tylko jeden elektron, na podpowłoce 1s, to jest na najbliższej orbicie. Wzbudzenie go porcją energii spowoduje że przeskoczy on na następną potencjalnie możliwą orbitę, na podpowłokę 2s. Kolejna porcja przesunie go na podpowłokę 2p a następna na 3s. Kolejność podpowłok zmienia się wedle rosnących energii wedle pewnego wzoru, zwykle rysowanego jak deszczyk na tabelce:
Jak możemy zobaczyć, po 11 przeskokach dzięki coraz większym porcjom energii, elektron znajdzie się na podpowłoce 6s, czyli znajdzie się w takim położeniu, w jakim znajdowałby się zewnętrzny elektron atomu Cezu. To już dosyć daleko. Co jednak stanie się, jeśli będziemy mu dodawać następne porcje energii, ale zbyt małe aby go po prostu zjonizować? Będzie przeskakiwał na kolejne i kolejne, aż znajdzie się na egzotycznych podpowłokach w rodzaju 17s które nie występują w żadnym istniejącym pierwiastku. Zaś wraz z kolejnymi przeskokami, rosnąć będzie też wielkość orbity, czyli odległość od jądra.
Przypomnijmy sobie teraz definicję atomu, jako układu dodatnio naładowanego jądra i krążących wokół elektronów. Atom z bardzo wzbudzonym, bardzo odległym elektronem, nadal jest formalnie atomem. A skoro tak, to jego średnica, która jest liczona jako średnica najdalszej orbity elektronowej, jest teraz bardzo duża. Tak bardzo duża, że w ekstremalnych przypadkach ze skali nano zbliża się do dużo lepiej nam znanych skal ułamków milimetra.
Tego typu atomy wzbudzone niemal do granicy jonizacji, nazywamy atomami Rydberga, wzięły nazwę od wzoru Rydberga opisującego długości fal w widmie emisyjnym wodoru. Wodór poddany działaniu wysokiej temperatury lub prądu elektrycznego, zaczyna emitować światło zawierające wiele serii pasm emisyjnych. Rydberg empirycznie opisał wszystkie te serie jednym wzorem, gdy jeszcze nie było wiadomo z czego wynikają. Gdy już ustalono model atomu, dla wszystkich stało się jasne, że bardziej oddalone serie emisyjne są wynikiem spadania na najbliższą jądru orbitę elektronu bardzo silnie wzbudzonego.
Rozmiar
Wraz ze stopniem wzbudzenia, bardzo szybko wzrasta promień orbity. Dla n=10 to jest dla dziesiątego poziomu energetycznego, średnica wzbudzonego atomu wodoru jest 200 razy większa niż w stanie podstawowym .
Przy bardzo silnym wzbudzeniu atom powiększa się tysiące a nawet miliony razy. Jednym z takich przypadków jest opisana w 2009 roku cząsteczka dwóch ultrachłodnych atomów rubidu, które po silnym wzbudzeniu utworzyły wiązanie o długości 100 nanometrów. Atomy połączone wiązaniem kowalencyjnym zatrzymują się w optymalnej odległości w której ich zewnętrzne powłoki stykają się ze sobą,zatem promień każdego z atomów wynosił 50 nm i był 25 razy większy niż normalnie.[1]
Ale to jeszcze nic. Niedawno doniesiono o zaobserwowania cząsteczki dwóch atomów cezu wzbudzonych do 44 poziomu energetycznego. Cząsteczka ta ma wielkość 1 mikrometra, co oznacza że jest większa niż wiele bakterii.[2]
Obliczenia pokazują, że w ekstremalnych przypadkach około 1000 poziomu energetycznego, średnica atomu osiąga około 1 mm.
Trwałość
Atomy wzbudzone energetycznie są generalnie nietrwałe - układ elektronowy będzie dążył do stanu podstawowego, toteż wybity daleko skrajny elektron "spadnie" z orbity możliwie najbliżej, emitując światło o długości fali odpowiadającej różnicy energii. Czas trwania takiego stanu jest zazwyczaj skrajnie krótki, w przejściach odpowiedzialnych za fluorescencje są to czasy rzędu nanosekund i krótsze. Jeśli jednak wzbudzenie jest duże, stan przedłuża się. Wynika to z prawdopodobieństwa przejścia energetycznego - im większa jest energia przejścia, tym mniejsze jest prawdopodobieństwo zajścia. Średni czas trwania stanu wzbudzonego w badanych laboratoryjnie atomach rydbergowskich, jest rzędu od milisekund do niemal sekundy. Wystarcza to aby zbadać ich właściwości, oraz aby ich obecność miała wpływ na procesy fizyczne.
Z drugiej jednak strony, takie silnie wzbudzone atomy są bardzo wrażliwe. Znacznie oddalony elektron jest już dosyć słabo związany z jądrem atomowym, i niewiele potrzeba mu energii aby odpadł całkowicie. Wystarczać mogą zderzenia z innymi atomami, foton światła czy własne drgania termiczne. Charakterystyczną cechą takich układów jest też łatwa jonizacja pod wpływem pola elektrycznego czy magnetycznego. Dlatego zazwyczaj stan ten jest badany w wysokiej próżni i w bardzo niskich temperaturach.
Całkiem niezłe warunki do trwania takiego stanu istnieją w otwartej przestrzeni kosmicznej. Próżnia międzygwiezdna jest dużo doskonalsza od otrzymywanej w ziemskich laboratoriach, atom może przebyć w przestrzeni wiele kilometrów zanim zderzy się z innym. Jest tam też dosyć chłodno, średnia temperatura wszechświata to zaledwie kilka kelwinów. Dlatego atomy rydbergowskie o bardzo wysokich poziomach energetycznych, rzędu n=300 i więcej, mogą trwać w kosmosie tak długo, aż nie dojdzie do spontanicznego przejścia energetycznego, a to może potrwać zaskakująco długo. Ich obecność w kosmosie jest trudna do wykrycia, możliwe więc, że da się przy ich pomocy wyjaśnić choć część niedomkniętego bilansu materii we wszechświecie.
Z powodu tej delikatności trudno byłoby jednak "zobaczyć" atom rydbergowski, nawet przy użyciu mikroskopu świetlnego. Nasze działania polegające na zalaniu go strumieniem światła mogą po prostu spowodować jego rozpad. W praktyce obserwuje się je pośrednio. Możemy zaczekać aż spontanicznie powróci do stanu podstawowego i zarejestrować kwant światła o wysokiej energii. Możemy też podziałać na niego bardzo słabym polem elektrycznym. Wykrycie jonizacji, to jest pojawienia się elektronu i kationu, w sytuacji gdy działające pole było bardzo słabe, dowodzi istnienia stanu silnie wzbudzonego, w którym to słabe pole było wystarczająco silne aby elektron oderwać ostatecznie.
Materia rydbergowska
Jedną z ciekawych właściwości wysoce wzbudzonych atomów jest dość wysoki moment dipolowy. Elektron krąży bowiem tak daleko i na tyle wolno, że w skończonym czasie uwidacznia się wyróżniony wektor elektryzacji. Fakt ten powoduje, że wzbudzone atomy mają skłonność do "sklejania" się w większe grupy. Chwilowe, ukierunkowane momenty dipolowe generują między nimi odpowiednik sił Londona. Ze względu na słabe przyciąganie, w grupkach wielu atomów rydberga elektrony mogą przeskakiwać z jednego na drugi, tworząc uśredniony stan podobny do wiązania metalicznego, co dodatkowo stabilizuje układ. Tak powstałe klastry tworzą nowy stan materii, który trudno nazwać ciałem stałym, gazem czy cieczą, oraz na pewno nie plazmą, bo mimo wszystko elektrony wciąż są z jądrami związane.
Co ciekawe, klastry takie są dużo trwalsze od osobnych wzbudzonych atomów, następuje interferencja ich funkcji falowych i uwspólnienie stanu, możliwe też że wiązanie "rydbergometaliczne" tworzy mały dołek na wykresie energetycznym utrudniając elektronom powrót do stanu podstawowego jeszcze troszeczkę. Dla klastrów 12 atomowych czas życia to już około 25 sekund. Grupki po kilkadziesiąt atomów mogłyby mieć średni czas trwania rzędu minut lub godzin, o ile oczywiście udałoby się je odizolować od zewnętrznych wpływów na tak długo. Na razie otrzymujemy klastry w formie płaskich warstw na podłożu, z którym słabo oddziałują, największy zgłoszony składał się z 91 atomów. Są pewne teoretyczne ograniczenia wielkości, związane z tym że jądra atomów są sklejane przez gaz elektronowy, który uśrednia się w czasie na tyle, iż działa jak równomierna siła. Problem pojawia się jednak gdy elektronów nie ma wcale tak dużo, a sam klaster jest ogromny.
Dla układu atomów na setnym poziomie energetycznym, odległości między nimi są już większe niż 1000 nanometrów. Jeśli grupa jest więc duża to biorąc pod uwagę, że elektron nie może przekraczać prędkości światła, może się zdarzyć że w wyniku przypadkowych fluktuacji lokalnie ładunek elektronów zwiększy się w pewnym miejscu, a bardziej osamotniony atom z brzegu będzie odczuwał zbyt słabe przyciąganie i oderwie się, zaś potrzebne do jego związania elektrony zwyczajnie nie nadążą. Klaster będzie się wówczas rozpadał i jonizował.
Otrzymywanie
Znanych jest kilka metod otrzymywania takich atomów. W każdym chodzi o to aby wzbudzać atomy silnie ale jednak precyzyjnie, poniżej progu jonizacji. Jednym ze sposobów jest bombardowanie atomów elektronami przyspieszonymi w polu elektrycznym. Energia elektronów zależy wtedy od przyłożonego potencjału i można ją z dużą dokładnością określić, stąd możliwość przekazania atomom konkretnej jej porcji.
Inny sposób to zderzanie obojętnego atomu z jonem. Zachodzi wtedy między nimi wymiana elektronu. Zostaje on wzbudzony za sprawą energii kinetycznej zderzanych jąder.
Obecnie najbardziej badanym sposobem jest jednak wzbudzanie elektronów światłem - pochłonięcie przez atom kwantu światła wzbudza jego zewnętrzne elektrony do stanu o dokładnie takiej energii jaką miał tamten foton. Precyzyjnie dobierając długość fali można zatem otrzymać atom na takim poziomie energetycznym jaki jest nam potrzebny.
Zastosowanie
Czy atomy rydbergowskie, to tylko taka sobie ciekawostka, bez praktycznych zastosowań? Wprawdzie jest to stan dość egzotyczny i nietrwały, ale w niektórych sytuacjach okazuje się idealny. Przede wszystkim są idealnym obiektem do badań fizycznych, mogących potwierdzić przewidywania co do oddziaływań fizycznych w zwyczajnych atomach. Bardziej jednak interesującym zastosowaniem, jest użycie ich jako qubitów w komputerach kwantowych. Stany kwantowe wzbudzonych atomów można zmieniać przy pomocy odpowiednio dobranych impulsów światła bez jonizacji Ponieważ zaś stany takie trwają w tym przypadku dosyć długo, można zdążyć wykonać kwantowe obliczenia zanim układ się rozpadnie.
W zeszłorocznym artykule z Nature Communications donoszono o przeprowadzeniu obliczeń na układzie 40 atomów rydbergowskich, co stanowi jeden z największych zbudowanych układów.[3]
---------
* https://en.wikipedia.org/wiki/Rydberg_atom
* http://www.princeton.edu/~mlittman/SciAmer.pdf
* https://en.wikipedia.org/wiki/Rydberg_matter
[1] Vera Bendkowsky, Bjorn Butscher, Johannes Nipper, James P. Shaffer, Robert Low & Tilman Pfau. "Observation of ultralong-range Rydberg molecules." Nature, Vol 458, 23 April 2009, doi:10.1038/nature07945.
[2] Heiner Saßmannshausen et al. Observation of Rydberg-Atom Macrodimers: Micrometer-Sized Diatomic Molecules, Physical Review Letters (2016). DOI: 10.1103/PhysRevLett.117.083401
[3] https://www.nature.com/articles/ncomms13449
sobota, 5 sierpnia 2017
Kiedyś w laboratorium (57.)
Wielokrotnie w różnych wpisach pokazywałem wygodną i szybką metodę sprawdzania składu mieszanin poreakcyjnych, czyli chromatografią cienkowarstwową na wycinanej z arkusza płytce:
Jest prosta, pozwala dobrać skład eluentów, oraz często oddzielone składniki są bardzo ostro widoczne. Niemniej powtórzenie tego samego procesu z identycznym eluentem na kolumnie, często nie daje tak ładnych rezultatów. Oddzielone porcje podróżując wzdłuż kolumny rozmywają się i czasem zaczynają wtórnie na siebie zachodzić. Rozdział nie jest więc tak dobry jak to wyglądało na płytce.
Jednym z pomysłów na to jak rozwiązać ten problem, jest wykonanie rozdziału na bardzo dużej płytce - w systemie TLC preparatywnej:
Taka płytka ma formę szklanej tafli o boku kilku lub kilkunastu centymetrów z nałożoną dość grubą warstwą podłoża rozdzielającego. Przy pomocy kapilarki lub pipetki nad dolną krawędzią płytki nakłada się poziomą krechę mieszaniny rozdzielanej, wielokrotnie powtarzają nakładanie. Następnie tak samo jak w małych płytkach, dolną krawędź zanurza się w eluencie. Potrzebna jest do tego odpowiednio duża komora, ja w jednym takim przypadku użyłem komory wielkości małego akwarium. Gdy płytka nasiąknie, krecha mieszaniny rozdziela się na długie pasy, zawierające oddzielone składniki. Aby je teraz ostatecznie oddzielić, bierze się nożyk lub szpatułkę o ostrym brzegu, i wydłubuje ten składnik, o jaki nam chodzi, zdrapując go ze szkła wraz z podłożem:
Zdrapiny zalewa się następnie jakimś mocnym eluentem aby wymyć oddzieloną frakcję. Można w ten sposób rozdzielać do około 0,5-1 g mieszaniny poreakcyjnej.
Ponoć można zdrapywać też plamki ze zwykłych, małych płytek, do celu badań jakąś bardzo czułą metodą analityczną, gdy dysponujemy małą ilością mieszaniny, wtedy do rozdziału wystarcza jedna kropla. Sam nigdy tego nie robiłem, ale słyszałem, że niektórzy się tak bawią.
Jest prosta, pozwala dobrać skład eluentów, oraz często oddzielone składniki są bardzo ostro widoczne. Niemniej powtórzenie tego samego procesu z identycznym eluentem na kolumnie, często nie daje tak ładnych rezultatów. Oddzielone porcje podróżując wzdłuż kolumny rozmywają się i czasem zaczynają wtórnie na siebie zachodzić. Rozdział nie jest więc tak dobry jak to wyglądało na płytce.
Jednym z pomysłów na to jak rozwiązać ten problem, jest wykonanie rozdziału na bardzo dużej płytce - w systemie TLC preparatywnej:
 |
| Rozdzielony wyciąg z liści, widoczne pasma chlorofilu, karotenoidów i fityn |
Zdrapiny zalewa się następnie jakimś mocnym eluentem aby wymyć oddzieloną frakcję. Można w ten sposób rozdzielać do około 0,5-1 g mieszaniny poreakcyjnej.
Ponoć można zdrapywać też plamki ze zwykłych, małych płytek, do celu badań jakąś bardzo czułą metodą analityczną, gdy dysponujemy małą ilością mieszaniny, wtedy do rozdziału wystarcza jedna kropla. Sam nigdy tego nie robiłem, ale słyszałem, że niektórzy się tak bawią.
niedziela, 9 lipca 2017
Chemiczne wieści (11.)
Dwie wody
Woda to jedna z najprostszych substancji na naszej planecie, złożona z jednych z najlżejszych pierwiastków - i paradoksalnie właśnie dlatego skomplikowana. Duża elektroujemność tlenu w połączeniu z faktem że wodór ma najmniejszy atom z wszystkich pierwiastków powodują, że po spolaryzowaniu wiązania atomy wodoru stają się bardzo skoncentrowanymi punktami dodatniego ładunku. Między nimi a pełnymi elektronów bardzo elektroujemnymi niemetalami mogą powstawać słabe oddziaływania elektrostatyczne, to jest wiązania wodorowe. Ze względu na budowę, cząsteczka wody może utworzyć aż cztery takie połączenia, z czego skwapliwie korzysta.
Tworzenie się takich oddziaływań między cząsteczkami wody, które w przeciętnych temperaturach mimo wszystko szybko się zrywają, na tyle "skleja" cząsteczki, że woda wykazuje anomalnie wysoką temperaturę wrzenia i krzepnięcia. W przypadku pozostałych niemetali obowiązuje prosta zasada - im lżejszy główny atom tym niższe są te graniczne temperatury. Siarczek wodoru, mający dwa razy cięższy atom centralny, jest już gazem o niskiej temperaturze wrzenia. Gdyby zasada obowiązywała do końca, woda byłaby gazem o temperaturze skraplania około -100 stopni.
Z faktu tworzenia takich wiązań wynika też kilka innych nietypowych własności, lecz szczegóły molekularne nie zostały jeszcze do końca poznane. Najnowsza publikacja dorzuca jedno ciekawe rozwiązanie, i zarazem nową zagadkę - otóż jak się okazuje pewne zachowania bardzo wyziębionej wody daje się wytłumaczyć przy założeniu, że tak na prawdę mamy do czynienia z mieszaniną dwóch różnych wód.
Oprócz kilkunastu odmian krystalicznych lodu, znamy też formy amorficzne, otrzymane przez bardzo szybkie schłodzenie wody, co nie pozwala cząsteczkom uporządkować się w kryształy. Zależnie od warunków przeprowadzenia procesu, można otrzymać dwie fazy szkliste różniące się gęstością, z różnym upakowaniem. Podczas badań przemian fazowych tych form stwierdzono, że podczas topnienia zamieniają się w ciecz, której właściwości zależą od tego z jakiej formy amorficznego lodu powstała.
Dla ciał szklistych, a więc nieuporządkowanych, nie ma właściwie klasycznego topnienia. Zwiększanie temperatury powoduje mięknięcie materiału następujące w pewnym przedziale, w wyniku którego najpierw otrzymuje się ciało bardzo plastyczne, mogące pod wpływem sił płynąć, a potem dopiero ciecz.
W przypadku amorficznego lodu stwierdzono, że na powierzchni ogrzewanych bryłek pojawia się faza płynna, mogąca występować w dwóch formach: wysokiej gęstości i niskiej gęstości. Fazy te są metastabilne w danych warunkach. Mowa o temperaturach rzędu 100 K czyli -170 C, znacznie poniżej temperatur zamarzania. W tak niskiej temperaturze powstająca ciecz pozostaje płynna, bo brakuje dodatkowej energii potrzebnej na uporządkowanie cząsteczek w krystaliczny lód.
Powstałe dwie fazy wody mogą przechodzić jedna w drugą ale istnieje pomiędzy nimi granica. W obserwowanym przypadku w cienkiej warstwie na powierzchni lodu szklistego istniały osobne domeny jednej z faz. Fazy różnią się gęstością i lepkością. Sądzi się, że może to wytłumaczyć niektóre nietypowe własności przechłodzonej wody - nieliniowa zmiana parametrów fizycznych to wynik powstawania wskutek fluktuacji obszarów zawierających w istocie dwie różne fazy ciekłe.[1]
Spirala hydratacyjna
Cząsteczki wody z powodu silnego momentu dipolowego zwykły otaczać rozpuszczane cząsteczki przylegającą powłoką hydratacyjną. Niedawne badania rentgenowskie cząsteczek DNA pokazały, że na łańcuchu powłoka ta przybiera ciekawą formę. Podstawowe domeny DNA to zasady purynowe, między którymi oddziaływania łączą nici, następnie cukier deoksyryboza i dalej reszta fosforanowa. Nici są skręcone w helisę, to jest formę przypominającą skręconą drabinę. Ponieważ cząstki deoksyrybozy są przestrzennie dość duże, w modelu DNA pojawiają się dwie szczeliny skręcone tak samo jak nici.
No i otóż jak stwierdzono, w wyniku hydratacji w tą szczelinę wchodzą cząsteczki wody tworząc spiralną strukturę, która podobnie jak samo DNA jest chiralna, ale zarazem na tyle trwałą że da się ją zaobserwować spektroskopowo.
Ma to o tyle znaczenie, że pewne leki (ale też toksyny) działają poprzez przyłączanie się do łańcucha DNA. Jeśli woda tworzy wyraźną strukturę w samym rowku helisy, to zbliżające się cząsteczki muszą ją wypychać. Uwzględniając ten efekt można zaprojektować cząsteczki łatwiej wpasowujące się w szczelinę.[2]
Oszacować czas zbrodni
Po opuszczeniu ciała, krew podlega różnego rodzaju przemianom chemicznym i fizycznym. Najpierw krzepnie i wysycha, następnie pod wpływem tlenu, światła i wilgoci pewne składniki mogą ulegać rozkładowi. Bardzo stara plama krwi może wyglądać jak złożona z brudu, mieć kolor brązowy, brudnożółty czy nawet zielonkawy. Jak niedawno odkryto powolne zachodzenie tego typu przemian można zbadać i na tej podstawie z całkiem niezłą dokładnością oszacować jak stara jest plama. Co z pewnością znajdzie zastosowanie w kryminalistyce.
Zastosowaną techniką była w tym przypadku spektroskopia Ramanowska. W tym typie bada się widmo światła rozproszonego przez próbkę. Jeśli oświetlimy ją światłem o pewnej konkretnej częstotliwości fali, w widmie światła rozproszonego pojawią się dodatkowe sygnały o innych częstotliwościach. Ich źródłem są drgające fragmenty cząsteczek, podlegające zmianom długości i położenia wiązań. W istocie technika ta bada podobne zjawiska jak w spektroskopii w podczerwieni.
Ze złożenia informacji o tym, że w badanej substancji znajdują się konkretne fragmenty dające konkretne przesunięte sygnały, można wywnioskować z czym mamy do czynienia.
W tym przypadku próbki krwi rozmazanej na powierzchniach poddano naturalnemu starzeniu przez okres do dwóch lat. Co pewien czas badano widmo próbek. W trakcie starzenia, pewne sygnały zanikały, zaś inne pojawiały się tam gdzie ich nie było, świadcząc o przemianach chemicznych w próbce. Na podstawie wielu porównań możliwe było określenie zmian w sygnałach pojawiających się już po upływie kilku godzin od pobrania krwi. Bazując na tak powstałej skali badacze byli w stanie określić przybliżony wiek plamy krwi z dokładnością do 70%. [3]
http://www.sciencedirect.com/science/article/pii/S2468170917300218
--------
[1] Anders Nilsson et al. Diffusive dynamics during the high-to-low density transition in amorphous ice. PNAS, June 26, 2017 DOI: 10.1073/pnas.1705303114
[2] 1. M L McDermott, H Vanselous, S A Corcelli and P B Petersen, ACS Centr. Sci., 2017, DOI: 10.1021/acscentsci.7b00100
Woda to jedna z najprostszych substancji na naszej planecie, złożona z jednych z najlżejszych pierwiastków - i paradoksalnie właśnie dlatego skomplikowana. Duża elektroujemność tlenu w połączeniu z faktem że wodór ma najmniejszy atom z wszystkich pierwiastków powodują, że po spolaryzowaniu wiązania atomy wodoru stają się bardzo skoncentrowanymi punktami dodatniego ładunku. Między nimi a pełnymi elektronów bardzo elektroujemnymi niemetalami mogą powstawać słabe oddziaływania elektrostatyczne, to jest wiązania wodorowe. Ze względu na budowę, cząsteczka wody może utworzyć aż cztery takie połączenia, z czego skwapliwie korzysta.
Tworzenie się takich oddziaływań między cząsteczkami wody, które w przeciętnych temperaturach mimo wszystko szybko się zrywają, na tyle "skleja" cząsteczki, że woda wykazuje anomalnie wysoką temperaturę wrzenia i krzepnięcia. W przypadku pozostałych niemetali obowiązuje prosta zasada - im lżejszy główny atom tym niższe są te graniczne temperatury. Siarczek wodoru, mający dwa razy cięższy atom centralny, jest już gazem o niskiej temperaturze wrzenia. Gdyby zasada obowiązywała do końca, woda byłaby gazem o temperaturze skraplania około -100 stopni.
Z faktu tworzenia takich wiązań wynika też kilka innych nietypowych własności, lecz szczegóły molekularne nie zostały jeszcze do końca poznane. Najnowsza publikacja dorzuca jedno ciekawe rozwiązanie, i zarazem nową zagadkę - otóż jak się okazuje pewne zachowania bardzo wyziębionej wody daje się wytłumaczyć przy założeniu, że tak na prawdę mamy do czynienia z mieszaniną dwóch różnych wód.
Oprócz kilkunastu odmian krystalicznych lodu, znamy też formy amorficzne, otrzymane przez bardzo szybkie schłodzenie wody, co nie pozwala cząsteczkom uporządkować się w kryształy. Zależnie od warunków przeprowadzenia procesu, można otrzymać dwie fazy szkliste różniące się gęstością, z różnym upakowaniem. Podczas badań przemian fazowych tych form stwierdzono, że podczas topnienia zamieniają się w ciecz, której właściwości zależą od tego z jakiej formy amorficznego lodu powstała.
Dla ciał szklistych, a więc nieuporządkowanych, nie ma właściwie klasycznego topnienia. Zwiększanie temperatury powoduje mięknięcie materiału następujące w pewnym przedziale, w wyniku którego najpierw otrzymuje się ciało bardzo plastyczne, mogące pod wpływem sił płynąć, a potem dopiero ciecz.
W przypadku amorficznego lodu stwierdzono, że na powierzchni ogrzewanych bryłek pojawia się faza płynna, mogąca występować w dwóch formach: wysokiej gęstości i niskiej gęstości. Fazy te są metastabilne w danych warunkach. Mowa o temperaturach rzędu 100 K czyli -170 C, znacznie poniżej temperatur zamarzania. W tak niskiej temperaturze powstająca ciecz pozostaje płynna, bo brakuje dodatkowej energii potrzebnej na uporządkowanie cząsteczek w krystaliczny lód.
Powstałe dwie fazy wody mogą przechodzić jedna w drugą ale istnieje pomiędzy nimi granica. W obserwowanym przypadku w cienkiej warstwie na powierzchni lodu szklistego istniały osobne domeny jednej z faz. Fazy różnią się gęstością i lepkością. Sądzi się, że może to wytłumaczyć niektóre nietypowe własności przechłodzonej wody - nieliniowa zmiana parametrów fizycznych to wynik powstawania wskutek fluktuacji obszarów zawierających w istocie dwie różne fazy ciekłe.[1]
Spirala hydratacyjna
Cząsteczki wody z powodu silnego momentu dipolowego zwykły otaczać rozpuszczane cząsteczki przylegającą powłoką hydratacyjną. Niedawne badania rentgenowskie cząsteczek DNA pokazały, że na łańcuchu powłoka ta przybiera ciekawą formę. Podstawowe domeny DNA to zasady purynowe, między którymi oddziaływania łączą nici, następnie cukier deoksyryboza i dalej reszta fosforanowa. Nici są skręcone w helisę, to jest formę przypominającą skręconą drabinę. Ponieważ cząstki deoksyrybozy są przestrzennie dość duże, w modelu DNA pojawiają się dwie szczeliny skręcone tak samo jak nici.
No i otóż jak stwierdzono, w wyniku hydratacji w tą szczelinę wchodzą cząsteczki wody tworząc spiralną strukturę, która podobnie jak samo DNA jest chiralna, ale zarazem na tyle trwałą że da się ją zaobserwować spektroskopowo.
Ma to o tyle znaczenie, że pewne leki (ale też toksyny) działają poprzez przyłączanie się do łańcucha DNA. Jeśli woda tworzy wyraźną strukturę w samym rowku helisy, to zbliżające się cząsteczki muszą ją wypychać. Uwzględniając ten efekt można zaprojektować cząsteczki łatwiej wpasowujące się w szczelinę.[2]
Oszacować czas zbrodni
Po opuszczeniu ciała, krew podlega różnego rodzaju przemianom chemicznym i fizycznym. Najpierw krzepnie i wysycha, następnie pod wpływem tlenu, światła i wilgoci pewne składniki mogą ulegać rozkładowi. Bardzo stara plama krwi może wyglądać jak złożona z brudu, mieć kolor brązowy, brudnożółty czy nawet zielonkawy. Jak niedawno odkryto powolne zachodzenie tego typu przemian można zbadać i na tej podstawie z całkiem niezłą dokładnością oszacować jak stara jest plama. Co z pewnością znajdzie zastosowanie w kryminalistyce.
Zastosowaną techniką była w tym przypadku spektroskopia Ramanowska. W tym typie bada się widmo światła rozproszonego przez próbkę. Jeśli oświetlimy ją światłem o pewnej konkretnej częstotliwości fali, w widmie światła rozproszonego pojawią się dodatkowe sygnały o innych częstotliwościach. Ich źródłem są drgające fragmenty cząsteczek, podlegające zmianom długości i położenia wiązań. W istocie technika ta bada podobne zjawiska jak w spektroskopii w podczerwieni.
Ze złożenia informacji o tym, że w badanej substancji znajdują się konkretne fragmenty dające konkretne przesunięte sygnały, można wywnioskować z czym mamy do czynienia.
W tym przypadku próbki krwi rozmazanej na powierzchniach poddano naturalnemu starzeniu przez okres do dwóch lat. Co pewien czas badano widmo próbek. W trakcie starzenia, pewne sygnały zanikały, zaś inne pojawiały się tam gdzie ich nie było, świadcząc o przemianach chemicznych w próbce. Na podstawie wielu porównań możliwe było określenie zmian w sygnałach pojawiających się już po upływie kilku godzin od pobrania krwi. Bazując na tak powstałej skali badacze byli w stanie określić przybliżony wiek plamy krwi z dokładnością do 70%. [3]
http://www.sciencedirect.com/science/article/pii/S2468170917300218
--------
[1] Anders Nilsson et al. Diffusive dynamics during the high-to-low density transition in amorphous ice. PNAS, June 26, 2017 DOI: 10.1073/pnas.1705303114
[2] 1. M L McDermott, H Vanselous, S A Corcelli and P B Petersen, ACS Centr. Sci., 2017, DOI: 10.1021/acscentsci.7b00100
[3] Kyle C. Doty, Claire K. Muro, Igor K. Lednev; Predicting the time of the crime: Bloodstain aging estimation for up to two years, Forensic Chemistry Volume 5, September 2017, Pages 1–7
Etykiety:
DNA,
spektroskopia,
wieści,
woda
Subskrybuj:
Komentarze (Atom)