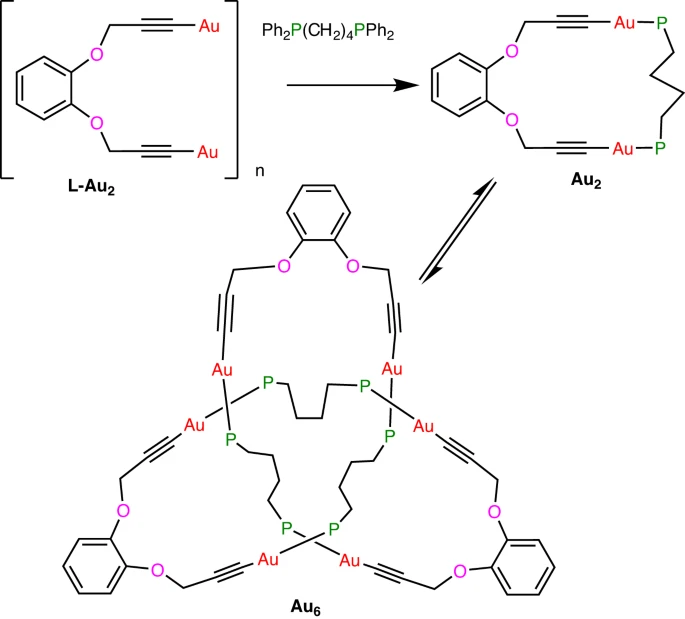
Metalowe fullereny
Znane szerzej jako jedna z odmian węgla fullereny, są klatkowatymi cząsteczkami złożonymi z atomów węgla, układającego się w różnej wielkości puste kule. Prototypowa cząsteczka C60 kształtem przypominała kopuły geodezyjne, projektowane w tym czasie przez Buckminstera Fullera, stąd pomysł nazwania cząsteczki fuller-en. Są związkami nienasyconymi, z atomami węgla Sp2, które w związku z tym wymagają utworzenia tylko trzech wiązań, dlatego po utworzeniu cienkiej warstwy sfery nie potrzebują łączyć się jeszcze z wodorem. Trochę podobne poliedrany z węglem Sp3 są już węglowodorami.
Tworzono już analogi z niektórymi atomami węgla zastąpionymi czymś innym, oraz znano klatkowe jony tlenków, ale cząsteczka otrzymana przez chińsko-chilijski zespół jest w całości zbudowana z metali. Badacze próbowali otrzymać jony związków międzymetalicznych, łącząc ze sobą związki Zintla - są to związki między metalami przejściowymi a metalami alkalicznymi, które mają wyraźniejszy charakter jonowych soli niż stopów międzymetalicznych. Często w ich budowie pojawiają się skomplikowane jony polimetaliczne o różnorodnej strukturze. Badacze więc oczekiwali, że powstaną im interesujące połączenia, ale nie sądzili, że będzie to aż tak duża i regularna struktura.
Jednym związkiem reagującym była faza K8SnSb4 , a drugim fosfinowy kompleks złota. W takiej sytuacji możliwe było powstanie związku czterometalicznego. Zamiast tego powstała faza zawierająca klatkowe jony[K@Au12Sb20]5− w formie regularnych dwunastościanów, o pięciobocznych ścianach, w których narożach lokowały się atomy antymonu, zaś pośrodku każdej ze ścian umiejscawiał się atom złota. Wewnątrz takiej klatki znajduje się jeden kation potasu, który oddziałuje z tą klatką.
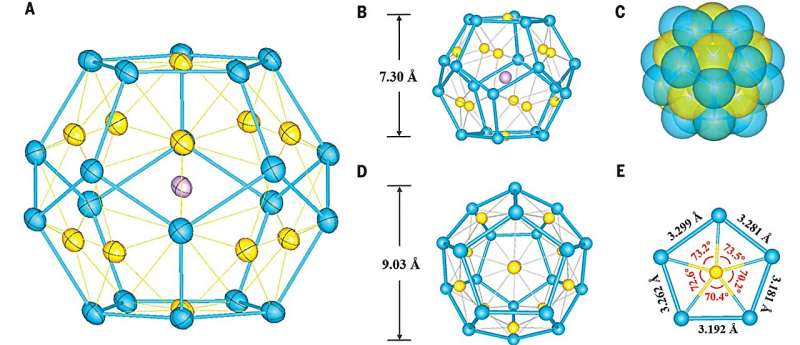 |
| Credit: Science (2023) DOI: 10.1126/science.adj6491 |
Prawdopodobnie ten konkretny związek nie znajdzie zastosowania, ale jest to coś czego jeszcze z tymi metalami nie widzieliśmy.
*https://www.science.org/doi/10.1126/science.adj6491
Najmniejszy molekularny węzeł
Otrzymano najmniejszy rozpoznany węzeł, w formie koniczynki. Całą pętlę z trzema skrzyżowaniami tworzą 54 atomy. I to także było odkrycie w dużej mierze przypadkowe. Celem autorów było otrzymywanie liniowych acetylenków złota, zabezpieczonych na jednym końcu grupą pirokatechiny a na drugim pewną difosfiną. Miały więc powstawać wydłużone pierścienie. Nieoczekiwanie z mieszaniny zaczęły wypadać kryształy kompleksu, którego masa wskazywała że jest to najwyraźniej trimer najmniejszego pierścienia. Wśród możliwości był pierścień złożony z trzech jednostek, pierścienie łączące się pojedynczym wiązaniem, lub struktury przeplatających się pierścieni. Aby to zweryfikować zbadano strukturę kompleksu technikami rentgenowskimi. Okazało się, że trzy jednostki utworzyły zamknięty pierścień, zwinięty w węzeł.
Jest to jeden z najmniejszych teoretycznie możliwych węzłów tego kształtu - węzły mające poniżej 50 atomów nie miały by miejsca na przeplot.
To, że podczas reakcji następuje jakaś forma samoorganizacji prowadzącej do takiej struktury, jest interesujące, bo to jednak dość skomplikowany kształt. Węzeł z trzema skrzyżowaniami, nazywany trójlistnym (trefoil), ma charakter chiralny - wersja, w której w stosunku do pionowej płaszczyzny linia była trzy razy przepleciona w prawo, nie da się samymi obrotami przekręcić do wersji z trzema przeplotami w lewo; zarazem obie wersje wyglądają jak lustrzane odbicia. To zaś wpływa na to jak węzeł o danej skrętności oddziałuje z otoczeniem. Reakcja prowadząca wydajnie i przewidywalnie do molekularnego węzła może więc znaleźć zastosowanie przy produkcji chiralnych metamateriałów, czy sztucznych receptorów.
W ostatnich latach tego typu przewodzące cząsteczki chiralnych węzłów są testowane jako materiały służące do filtrowania spinów, dzięki czemu można w prądzie przepływających pojedynczo ładunków oddzielić od siebie elektrony o spinie +1/2 i -1/2, a to już umożliwia zakodowanie w impulsach dodatkowej warstwy informacji, oprócz kodowania przez brak sygnału 0 i sygnał 1. Spintronika być może więc okaże się w przyszłości nową technologią informatyczną, a wtedy chiralne materiały do filtrowania spinów będą cenne.
Pozostaje pytanie, czy da się tak zmodyfikować reakcję aby zamiast racematu powstawały węzły o określonej chiralności, na przykład przez użycie zamiast pirokatechiny chiralnej cząstki BINOL
* https://www.nature.com/articles/s41467-023-44302-y
Wyjątkowo gęste magazynowanie wodoru
Wodór jest obiecującym paliwem przyszłości, możliwym do użycia zarówno w sposób konwencjonalny, w silniku cieplnym, jak i jako paliwo do ogniw paliwowych wytwarzających prąd. Potencjalnie więc wymiana w samochodzie lub napełnianie zbiornika z wodorem byłyby sposobem na dużo szybsze ładowanie samochodów elektrycznych, niż umożliwiają nawet najlepsze ładowarki. Jednak przechowywanie wodoru w dostatecznie gęsty sposób, który byłby też opłacalny, jest trudne. Może być sprężony, ale w normalnej temperaturze nie ulega skropleniu. Aby zgromadzić w zbiorniku jego sensowną ilość, trzeba użyć potężnego ciśnienia, i tu zbiorniki wytrzymujące to ciśnienie zaczynają się robić ciężkie. W obniżonej temperaturze wodór się skrapla i wtedy jest gęsty, nie potrzebuje dużego ciśnienia. Ale znów temperatura potrzebna do utrzymania go w stanie ciekłym jest skrajnie niska i tu pojawia się problem z chłodzeniem.
Dlatego też prowadzone są badania na temat technik przechowywania wodoru i co roku pojawia się na ten temat wiele publikacji. Ta, którą chcę omówić, jest bardzo interesująca, choć trudno ocenić na ile przekłada się na praktykę.
Magazynowanie wodoru w wodorkach, w związkach boru czy w porowatych metalach było już badane. Tutaj badacze otrzymali materiał będący w zasadzie połączeniem wodorku boru i wodorku magnezu, tworząc luźną strukturę z molekularnymi klatkami działającymi jak nanopory. Ogółem struktura trochę przypomina mi zeolity. Kwestią badaną było to na ile chłonny wobec gazów będzie ten materiał, oraz jak ułożone są atomy pochłoniętego gazu w tych porach. Gdy proszek nasycono azotem, badania krystalografii rentgenowskiej pokazały, że do poru wchodzi jedna cząsteczka. Gdy natomiast użyto wodoru, sytuacja wyglądała bardzo interesująco. W porze zmieściło się aż pięć cząsteczek wodoru, opakowanych bardzo ciasno w klaster, utrzymywany oddziaływaniami ze ścianami. Cztery były usadowione nieruchomo, w dość trwałą strukturę, piąta u wylotu miała większą swobodę rotacyjną, ale nie wypadała z poru tak łatwo. Odległości między cząsteczkami skazywały na sytuację, w której atomy "przylegają" do siebie bardzo ściśle, bardziej niż w wyniku luźnego oddziaływania między cząsteczkami w innych sytuacjach. Po maksymalnym napakowaniu materiału w warunkach kriogenicznych i wysokim ciśnieniu, maksymalny poziom nawodorowania był utrzymywany do temperatury pokojowej.
Gęstość upakowania tych cząsteczek w porze jest nietypowa - jak wyliczają autorzy, gdyby zsumować objętości porów w większej partii materiału, to litr objętości porów mieści 144 g wodoru. To dwa razy więcej niż gdyby nieoddziałujące pory były zalane ciekłym wodorem (gęstość 70 g/l) a nawet więcej niż masa litra stałego pierwiastka. Jest to więc najgęstsze upakowanie wodoru w materiale chłonnym i potencjalnie przełom w magazynowaniu.
Przyczyną tak efektywnej absorpcji są zdaniem autorów oddziaływania między atomami wodoru połączonymi z borem, które ze względu na elektroujemność mają charakter anionów wodorkowych, z elektronami cząsteczki wodoru. Jeden atom w cząsteczce oddziałuje z dwoma końcami wodorkowymi ściany poru; drugi atom także, więc sumarycznie w strukturze oddziaływań bierze udział sześć atomów wodoru. W zasadzie jest to nietypowa forma wiązania wodorowego o sile 8,5 kj/mol.
Z drugiej jednak strony - w porowatej strukturze materiału, najmniejsze nanopory, w których zaobserwowano taką adsorpcję, stanowią niewielką część. Do nich prowadzą większe kanały i szczeliny, w których pochłonięcie nie jest tak efektywne. Przeliczanie objętości najmniejszych porów i masy związanego gazu nie przekłada się więc tak wprost na masę gazu związanego przez materiał jako całość. To jak zebranie z drzewa liści, zmielenia ich i wyliczanie zawartości powiedzmy gramów glukozy na litr objętości tkanki liściowej. Która stanowi niewielką część w uśrednionym litrze korony drzewa.
Na użyteczność materiału do magazynowania wpływ będzie miał też proces desorpcji - na ile łatwo będzie można odzyskać pochłonięty gaz, czy nie będzie to wymagało nadmiernej ilości energii cieplnej, czy materiał będzie się dał odzyskiwać, ile wytrzyma cykli sorpcja-desorpcja zachowując strukturę. Czy podczas zmian zachowuje nadaną formę czy zmienia objętość i zamienia w proszek zatykający kanały doprowadzające. Wszystko to może spowodować, że tego konkretnie materiału nie zobaczymy w przyszłości w magazynach wodoru, pomimo tych wszystkich obiecujących właściwości. Ale zarazem wskazuje on na nowy mechanizm pochłaniania, który może uda się jeszcze ulepszyć. Tak czy siak, to bardzo ważne odkrycie.
* https://www.nature.com/articles/s41557-024-01443-x
Jak rodzaj filiżanki wpływa na herbatę
Nie jest to tak całkiem news, doniesienie prasowe opublikowano w sierpniu, ale praca wydała mi się ciekawa. Japońscy naukowcy stosunkowo często zajmują się badaniami herbaty, chyba ścigają się z chińczykami. I sprawdzono już tyle kombinacji wpływu na właściwości naparu rodzaju wody, temperatury, sposobu zaparzania, technik tradycyjnego rytuału itd. że została już tylko ta możliwość nie zweryfikowana - a jak na herbatę wpływa naczynie? W tradycyjnych naczyniach ceramicznych, wypalona glina pokryta jest szkliwem, będącym mieszanką krzemionki z tlenkami różnych metali. A akurat tlenki metali znane są jako stałe katalizatory powierzchniowe, które przyspieszają różne reakcje. Potencjalnie więc mogą jakoś wpływać na skład naparu.
Przygotowano kilka porcji naparu zielonej herbaty parzonego w temperaturze 80 stopni; zmieszano z proszkiem glazury z czterech często spotykanych typów i zostawiono na 6 godzin aby zaszła reakcja. Po tym czasie mieszaninę odsączono i zbadano zmiany w składzie. Okazało się, że glazura przyspieszyła reakcje utleniania polifenoli herbacianych. Część z nich uległa rozkładowi, inne utlenieniu i kondensacji w procesie podobnym do brązowienia liści herbacianych. Przez to jasnożółty napar stał się brązowy jakby był robiony z herbaty czarnej. Spadła ilość poszczególnych składników a konkretny efekt zależał od rodzaju szkliwa. Glazura zawierająca jony żelaza, miedzi i magnezu zmniejszała ilość wszystkich głównych polifenoli, a ta z tytanem selektywnie rozkładała galusan epigallokatechinowy ECG; produktami były skomplikowane teaflawiny.
Wnioskiem badaczy było więc to, że rodzaj użytego naczynia wpływa na właściwości zdrowotne herbaty.
Ale co innego tak poprowadzony eksperyment, co innego życie. Przypuszczam, że proszek glazury może mieć wyższą aktywność katalityczną niż wnętrze dzbanka z herbatą, ze względu na większą powierzchnię i lepsze mieszanie. Proces był prowadzony w temperaturze 80 stopni przez 6 godzin w fiolkach wytrząsanych aby cały czas się mieszały. Na szybkość procesu z pewnością wpływa temperatura. W większości przypadków, herbata zostawiona w dzbanku po pewnym czasie robi się zimna, a ścianki pokrywają się warstwą zaadsorbowanych garbników, i oba te efekty znacznie hamują reakcje. W dodatku stosunek herbaty do ilości szkliwa był trudny do odtworzenia w domowych warunkach - 15 ml herbaty reagowało z 0,15 g proszku, co oznacza, że ilość szkliwa z jakim kontaktował się napar stanowiła 10% jego masy. W litrowym dzbanku z herbatą musiałoby się znajdować 100g startej na proszek glazury.
Poza tym w pozostawionym naparze, który ma kontakt z powietrzem, i tak zachodzą powolne procesy utleniania i ciemnienia a jony wymienionych w badaniu metali są naturalnie zawarte w wodzie wodociągowej i w samej herbacie, więc nie ma tak, że tam zaszły reakcje jakie w innym naczyniu by w ogóle nie nastąpiły. Moim wnioskiem jest więc: ciekawy efekt, ale nie ma praktycznego znaczenia i nie wpływa w zauważalnym stopniu na jakość herbaty pitej z filiżanki.
* https://www.nature.com/articles/s41598-023-37480-8