Media donoszą ostatnio często o wycofaniu żywności z powodu zanieczyszczenia tlenkiem etylenu - wypada więc coś o nim napisać, bo to pod względem chemicznym bardzo ciekawy związek.
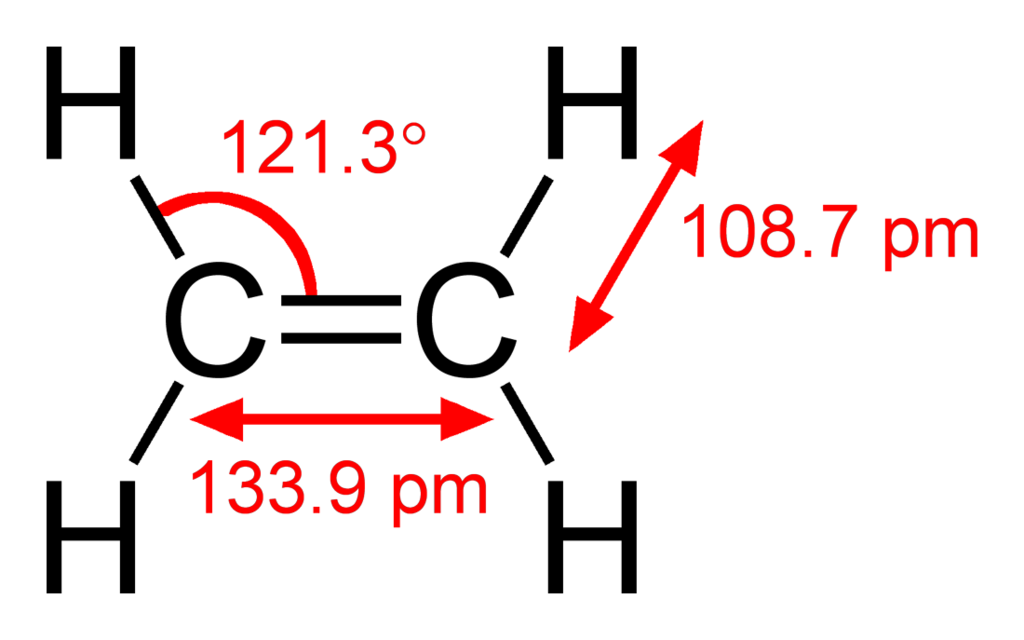
Zacznijmy może od etylenu. To najprostszy węglowodór nienasycony. Zawiera tylko dwa węgle połączone wiązaniem podwójnym.
Przy pomocy odpowiednich warunków można jedno z tych wiązań rozerwać a wolne końcówki podstawić wodorem. Powstanie wtedy etan, który ze względu na maksymalne uwodorowanie (bez odrywania węgli całkiem) jest wtedy nazywany związkiem nasyconym. Podobna reakcja może zajść z innymi czynnikami, dlatego węglowodory z przynajmniej jednym wiązaniem podwójnym, alkeny, są bardziej reaktywne od tych z samymi pojedynczymi. Mogą uleć chlorowaniu z chlorem, polimeryzacji do polietylenu czy przyłączyć wodę i zamienić się w alkohole.
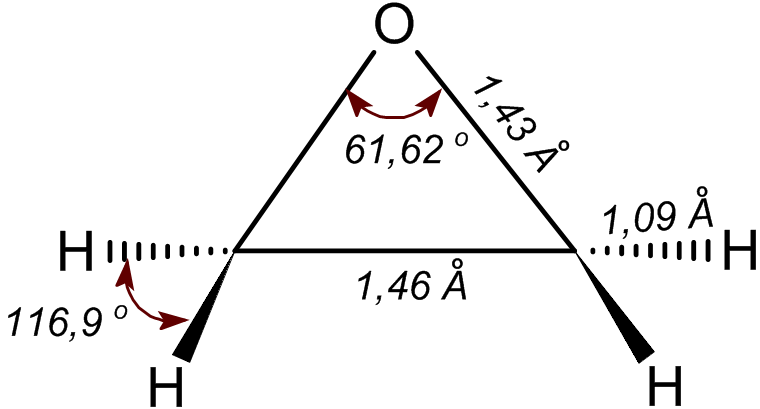
No i oczywiście mogą łączyć się z tlenem. Etylem jest gazem palnym i zależnie od dostępu tlenu spala się bądź całkowicie do dwutlenku węgla i pary wodnej, lub kopcąc z ubocznym węglem. Ale nie o taki rodzaj reakcji z tlenem chodzi przy powstawaniu tlenku etylenu. W bardzo specyficznych warunkach etylen przyjmuje jeden atom tlenu bez niszczenia struktury i bez oddawania wodorów. Służy do tego katalizator z metalicznego srebra. Wiązanie podwójne pęka, a brakujące końcówki łączą się z tlenem tak, że jest połączony z obydwoma. Powstaje bardzo ciekawa trójkątna cząsteczka.
Już ta narysowana struktura powinna coś podpowiadać co do właściwości związku. Wiązania między atomami nie przebiegają zupełnie dowolnie, lecz są rozłożone w przestrzeni w pewnym układzie zależnym od struktury elektronowej atomu. Tlen nie ma zbyt wielu możliwości i zwykle przyjmuje układ, w którym jego dwa wiązania są zagięte pod kątem 105 stopni. Tak to wygląda w wodzie. Znamy związki, w których tlen jest połączony po obu stronach z jakąś częścią węglowodorową, to tak zwane etery, gdzie kąt zwykle jest nieco większy, w znanym ze zdolności usypiania eterze dietylowym jest to kąt 111 stopni.
A tutaj mamy 60. Trochę mało. W zasadzie w cząsteczce o formie trójkąta z bokami o podobnej długości nie ma za wielu możliwości, kąty powinny być zbliżone do tej wartości. Ale z drugiej strony wiemy, że gdyby grupy na końcu wiązań nie były tak blisko połączone, to tlen wolałby mieć je nieco szerzej. Tutaj więc wiązania są nagięte do innego kąta nieco na siłę, z pewną dodatkową energią potrzebną do ich utrzymania. A skoro tak, to cząsteczka jest trochę mniej stabilna i chętnie by z czymś zareagowała otwierając pierścień.
Związki o takiej budowie, z mostkiem tlenu zamiast wiązania podwójnego, będące najkrótszymi możliwymi eterami pierścieniowymi, nabierają przez to szczególnej reaktywności i zaczęły być wyróżniane jako osobna grupa związków. Oficjalna polska nazwa chemiczna to epitlenki, ale dużo lepiej znane są pod nazwą epoksydów, będącą kalką z angielskiego epoxide.
O tym jak bardzo reaktywne są epoksydy przekonał się każdy, kto używał szybkoschnących klejów i przezroczystych żywic epoksydowych, gdzie pewne liniowe cząsteczki zawierające na końcach aktywne trójkąty epoksydowe reagują z innymi liniowymi cząsteczkami, mającymi na końcu grupy z którymi epoksydy chętnie reagują, tworząc ostatecznie usieciowaną, twardą masę plastyczną.
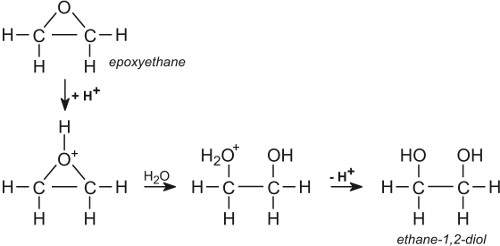
Tlenek etylenu jest tu o tyle wyjątkowy, że będąc bardzo prostą i małą cząsteczką, w normalnych warunkach jest gazem łatwo rozpuszczalnym w wodzie i bardzo łatwo wchodzi w różnorodne reakcje. Podczas takiej reakcji najczęściej jedna grupa chemiczna przyłącza się do tlenu. Powstaje trójwiązalny tlen, będący kationem, tak zwany związek oksoniowy. Ładunek dodatni na tlenie indukuje cząstkowe ładunki ujemne na węglach, do których jest przyłączony. Stają się one łatwymi miejscami ataku nukleofilów, a tymi przy takim dużym energetycznym potencjale cząsteczki może zostać cokolwiek w otoczeniu.
W wodnych roztworach po zakwaszeniu reakcja najpierw z protonem a potem cząsteczką wody daje z glikol etylenowy i jest to jedna z głównych reakcji do jakich się go wykorzystuje. Spośród produkowanych co roku milionów ton tego tlenku 75% zużywa się od razu na wytworzenie glikolu, triglikolu, poliglikolu i związków z grupami PEG
W reakcji z alkoholami, które są słabymi nukleofilami, powstają estry glikolu etylenowego, będące często plastyfikatorami. Z amoniakiem powstaje aminoetanol, zużywany potem do produkcji środków czyszczących. Reaguje też z dwutlenkiem węgla tworząc węglan etylenu, rozpuszczalnik o wysokiej polarności używany w akumulatorach litowo-jonowych. Takie reakcje są badane jako jedna z metod usuwania dwutlenku węgla z gazów poprocesowych.
Skoro tlenek etylenu tak chętnie i łatwo z wszystkim reaguje, to powinno być jasne, że jest związkiem toksycznym dla organizmów żywych. W każdym organizmie jest bowiem pod dostatkiem amin, alkoholi i innych substancji, z którymi może wejść w reakcje, zmieniając białka, enzymy, metabolity wtórne i ostatecznie też podstawiając i unieczynniając składowe DNA i RNA. Dlatego już dawno temu znalazł zastosowanie w chemicznej, niskotemperaturowej dezynfekcji. Wciąż jest jednym z najczęściej używanych związków do sterylizacji sprzętu medycznego, który nie może być autoklawowany - głównie przedmiotów i pojemników z tworzyw sztucznych, które w wysokiej temperaturze by się stopiły lub skurczyły. Dezaktywuje bakterie, pierwotniaki, drobne pasożyty a nawet wirusy.
Dzięki gazowej postaci w normalnych warunkach może być stosowany w komorach, w których przedmiot jest owiewany tym środkiem, co pozwala mu wniknąć do drobnych porów i szczelin bez żadnych rozpuszczalników. Ponieważ jest też bardzo silnie toksyczny dla owadów może być stosowany do niszczenia korników, moli i drobnych roztoczy w na przykład zabytkowych meblach, książkach, tkaninach i różnych obiektach muzealnych.
Niestety szkodzi też większym organizmom. U ludzi narażonych na jego opary działa toksycznie na drogi oddechowe. Już stężenie 200 ppm powoduje podrażnienie błoń śluzowych nosa i gardła. Zapach związku staje się wyczuwalny dopiero w wyższych stężeniach, od 250-300 ppm, jest słodkawy, podobny do eteru. Wraz ze wzrostem ilości w powietrzu narasta działanie drażniące. Następuje uszkodzenie tchawicy i oskrzeli; dochodzi do zwężenia i zatkania drobnych oskrzelików czy uszkodzenia pęcherzyków płucnych. Stężenia przekraczające 800 ppm są już uważane za bezpośrednio groźne dla życia. Wydaje się, że szczury i myszy są bardziej wrażliwe od człowieka. Efekty uszkodzenia płuc nie są widoczne od razu, rozwijają się w ciągu kilkudziesięciu godzin od narażenia.
Część związku ulega wchłonięciu do organizmu dając niespecyficzne objawy nawet przy niskich dawkach. Narażeni zgłaszają bóle głowy, nudności i wymioty. Substancja wydaje się mieć powinowactwo do układu nerwowego. Osoby przewlekle narażone na niskie dawki (już 3 ppm w czasie pracy) doświadczały neuropatii odwodowych, gorszej koordynacji ruchowej i pogorszenia pamięci.
Skutkiem narażenia jakie jest najbardziej interesujące i wywołuje najczęściej alarm, jest jednak rakotwórczość. Każdy związek, który jest na tyle reaktywny, że jest w stanie utlenić, halogenować a zwłaszcza alkilować struktury biologiczne, w tym DNA, będzie doprowadzać do mutacji i zagrożenia nowotworami. A tlenek etylenu jest akurat na tyle silnym środkiem alkilującym, równocześnie jednak nie rozkładającym się natychmiast po rozpuszczeniu w wodzie i przez to mogącym działać na organizm także poza płucami. U szczurów przewlekła, ciągła ekspozycja na dawki poniżej wywołujących podrażnienia zwiększa częstość takich nowotworów jak międzybłoniak, białaczka czy guzy mózgu. U ludzi narażonych zawodowo na ten związek efekty są bardziej subtelnie i nie takie bardzo silne. W analizie podgrup widać nieco większą częstość nowotworów piersi u kobiet, guzów limfoidalnych u mężczyzn i nowotworów kości ogółem. Zarazem jednak wiele analiz nie wykazuje aby generalnie zwiększało to śmiertelność z powodu nowotworów.
Wyniki te doprowadziły do ostrego wyśrubowania norm narażenia na związek. Na przykład w Unii Europejskiej tlenek nie może być używany do odkażania żywności ani do zabijania owadów we wnętrzach budynków. Ostatnie przypadki wycofania żywności, takiej jak nasiona sezamu czy mleko w proszku to zapewne wynik fumigacji tlenkiem magazynów w Indiach, w których przechowywano te produkty. Jeden z ostatnich takich przypadków to wycofanie lodów, zawierających jako zagęstnik mączkę chleba świętojańskiego, w której wykryto tlenek etylenu na niskich poziomach. Stało się to zresztą powodem sporu między różnymi instytucjami regulującymi. Proponowano dopuszczenie do obrotu produktów zawierających tlenek w ilościach wykrywalnych ale niemożliwych do oznaczenia ilościowego (ilość tak mała, że z powodu ograniczonej czułości metody nie da się powiedzieć dokładnie ile, a jedynie, że jest). Ostatecznie po alarmach organizacji konsumenckich przyjęto zasadę, że każda wykrywalna ilość dyskwalifikuje żywność, bo nie da się ustalić bezpiecznej dawki.[f] Kwestią sporną jest, czy można to stosować do żywności, w której surowiec z przekroczoną normą został już przetworzony i w ostatecznym produkcie zanieczyszczenie przestaje być wykrywalne bo być może się rozłożyło.[b]
-------------------------------------
Źródła:
[b] https://www.brusselstimes.com/news/belgium-all-news/181057/not-all-recalls-for-ethylene-oxide-are-necessary-warns-belgiums-food-safety-agency/
[f] https://www.foodwatch.org/en/news/2021/toxic-ethylene-oxide-in-foods/?cookieLevel=not-set
https://www.epa.gov/sites/default/files/2016-09/documents/ethylene-oxide.pdf
https://www.ciop.pl/CIOPPortalWAR/file/89150/2019121311453&Tlenek-etylenu.pdf
https://en.wikipedia.org/wiki/Ethylene_oxide