Niebieski
Gdy pies nasika chemikowi na ścianę...
Pittakall to prawdopodobnie pierwszy syntetyczny barwnik organiczny*, jaki pojawił się w handlu, choć nie zdobył zbyt dużej popularności i dość szybko zarzucono jego produkcję. Jego przypadkowym odkrywcą był niemiecki chemik Karl Reichenbach. Na początku XIX wieku zarządzając małą fabryką chemiczną zajął się badaniem produktów suchej destylacji drewna, węgla i szczątków organicznych. To on wydzielił ze smoły różne wartościowe frakcje, w tym kreozot, parafinę czy fenol, a także pierwszy olej opałowy nazwany eupinonem.
Kreozot, będący frakcją smoły z drewna drzew liściastych, miał dość charakterystyczną, silną woń oraz dobre właściwości konserwujące, dlatego chemik zaczął stosować go do impregnowania drewna. Do dziś zresztą jest częstym składnikiem impregnatów, na przykład do podkładów kolejowych.
Postanowił wypróbować go także w zastosowaniu dużo bardziej przyziemnym - przeszkadzało mu, że psy sikają mu zewnętrzną ścianę domu, więc posmarował ją kreozotem aby zapach je odstraszał. Psom najwyraźniej było wszystko jedno, bardzo lubiły tam stawać i podnosić nogę, lejąc bezczelnie po wysmarowanej ścianie. Cóż, widocznie nie było to dobry środek na psy.
Przyglądając się ich działalności zauważył jednak ciekawą rzecz - w miejscu gdzie stały plamy moczu, na ziemi pojawiło się wyraźne, niebieskie zabarwienie. A ponieważ był człowiekiem bardzo praktycznym, zaczął czynić próby powtórzenia reakcji. Szybko wykrył, że mocz nie jest w jej potrzebny, stanowił jedynie alkaliczny reagent. Prowadząc destylację surowej smoły stwierdził, że frakcja o temperaturze wrzenia wyższej niż kreozot, po wprowadzeniu do wody wapiennej lub roztworu wodorotlenku baru, po pewnym czasie zamienia się w ciemnogranatowy proszek.
Wprowadził go na rynek jako pigment nadający się do farbowania po rozpuszczeniu w alkaliach. Najwyraźniej jednak nie miał zbyt dobrych właściwości i po pewnym czasie przestał być używany, pojawiając się jedynie od czasu do czasu w historycznych spisach barwników. Dopiero pod koniec XIX wieku ustalono, że jest to związek będący produktem kondensacji pirogallolu, o strukturze podobnej do barwników trifenylometylenowych. W formie anionowej przybierał intensywny kolor. Pigment Reichenbacha był laką, to jest nierozpuszczalną solą barową lub wapniową.
Pittakall jest dziś w zasadzie historyczną ciekawostką. Mam wrażenie, że od ponad stu lat nikt go nie otrzymywał, bo poza wzmiankami w pracach o historii barwników nie znalazłem o nim żadnej dalszej informacji ani tym bardziej zdjęcia próbki. Ponoć miał dość ciemny odcień niebieskiego.[1]
Ftalocyjanina
Kolejny niebieski barwnik także został odkryty niezamierzenie, podczas otrzymywania czegoś innego, i to dwa razy.
W 1927 roku szwajcarscy chemicy Henri Diesbach i Edmond von de Weid zajmowali się znalezieniem lepszej niż już znane metody otrzymywania ftalonitrylu, to jest pochodnej benzenu z dwiema grupami -CN. Znana była już w tym czasie reakcja Sandmeyera, polegająca na podstawieniu soli diazoniowych, gdzie grupa -NN była łatwo zamieniana na inne. Przy jej pomocy otrzymywano ftalonitryl z o-aminobenzonitrylu (a ten z rozkładu termicznego amidu kwasu antranilowego).
Badacze postanowili spróbować nieco innej metody, której substrat był bardziej stabilny i łatwiejszy w otrzymaniu. Była to reakcja Rosenmunda-von Brauna (nie mylić z reakcją Rosenmunda samego, czyli redukcją kwasów do aldehydów) polegająca na podstawieniu halogenku przy pierścieniu aromatycznym, przez anion cyjankowy z cyjanku miedzi.[2]
Jako substratu użyli 1,2-dibromobenzenu. Pomysł był w istocie dosyć prosty, reakcja powinna przebiegać w taki oto sposób:
Produktem powinna być bezbarwna lub nieco żółtawa krystaliczna substancja. Jakież więc było zdziwienie chemików, gdy po reakcji znaleźli w kolbie osad intensywnie niebieski.
Produkt był bardzo trwały, nierozpuszczalny w wodzie i dość trudno w innych rozpuszczalnikach. Po wyznaczeniu przez analizę elementarną składu C26H18N6Cu uznali, że prawdopodobnie mają do czynienia ze związkiem kompleksowym ftalonitrylu i pirydyny, zawierającym jeden atom miedzi i po dwie cząsteczki tych związków [3]. Ale mylili się.
Drugimi odkrywcami byli chemicy w fabryce Scottish Dyes (dziś ICI), którzy w 1928 roku analizowali metodę przemysłowego otrzymywania ftalimidu. Bezwodnik ftalowy był w tej syntezie poddawany reakcji z amoniakiem w stężonym roztworze wodnym, zaś jako reaktorów używano emaliowanych żeliwnych kotłów. Mechaniczne mieszadło powodowało, że emalia z czasem się zdzierała, zaś pilnujący procesu technolodzy zauważyli, że partie produktu z tych najbardziej wytartych kotłów były zanieczyszczone drobnym, niebieskawym osadem. Było zresztą zauważalne, że na niebieskawy kolor zabarwił się odsłonięty metal.
Po zebraniu większej ilości zanieczyszczenia, pracownicy fabryki zdali sobie sprawę z tego, że potencjalnie mógłby to być niezły pigment, miał bowiem niską rozpuszczalność i bardzo dużą siłę barwiącą. Kolejną więc syntezę przeprowadzono dodając do masy wiórki żelazne, był to jednak proces mało wydajny. Należało odpowiedzieć na pytanie, co właściwie zachodzi w reaktorze i jaki związek otrzymano.
Po wpływem silnych alkaliów związek tracił metal, powstała wolna forma nadal była niebieska ale o dużo słabszym odcieniu. Można było połączyć ją z innymi metalami, zwłaszcza ze szczególnie chętnie wiązaną miedzią, tworząc kompleksy bardzo trwałe i intensywnie zabarwione. Analizy pokazały, że związek ma charakter aromatyczny i być może zawiera układ skumulowanych pierścieni. Dopiero w 1933 roku Patrick Linstead zaproponował dla związku budowę makrocykliczną, podobną do porfiryny, z czterema fragmentami benzopirolu połączonymi przez mostkowe azoty, co potwierdziły potem badania rentgenowskie.
Firma ICI zaczęła produkować pigment w 1934 roku po udoskonaleniu metod pod nazwą Monastral Blue, lub błękit ftalocyjaninowy. Był wielkim osiągnięciem. Niebieskich pigmentów było w tym czasie niewiele, w zasadzie istniały tylko nieorganiczne oparte o sole miedzi i ultramarynę, oraz indygo i jego pochodne. Błękit ftalocyjaninowy miał tą zaletę, że będąc barwnikiem organicznym posiadał wysoką odporność na blaknięcie, miał dużą siłę barwiącą, był na tyle słabo rozpuszczalny że nie migrował do innych warstw malarskich, oraz był dosyć odporny na czynniki fizyczne i chemiczne. Związek ten rozkłada się dopiero w temperaturze 600 stopni.
Do dziś jest jednym z najczęściej wykorzystywanych barwników, zwłaszcza do farb do metalu, ale też atramentów czy tuszu do długopisów. Jest na przykład składnikiem standardowego tuszu niebieskiego do drukarek, a ze względu na znikomą toksyczność także pigmentów do tatuażu.
Niezamierzony niebieski pigment
To odkrycie także miało pewien element przypadkowości.
Zespół profesora Subramaniana, na uniwersytecie stanowym w Oregonie, zajmował się badaniami tlenkowych materiałów ceramicznych z solami ziem rzadkich, które mogłyby potencjalnie znaleźć zastosowanie w elektronice. Niektóre mogłyby okazać się magnesami stałymi, inne nadprzewodnikami niskotemperaturowymi, ferroelektrykami czy superopornikami. Studenci profesora biorący udział w pracach testowali więc różne mieszanki tlenków i chlorków metali, które po wymieszaniu w młynie kulowym na bardzo drobny proszek wypalano w odpowiedniej temperaturze.
Doktorant Andrew E. Smith spróbował pewnego razu nietypowej mieszanki tlenku itru, indu i manganu VI. Dwutlenek manganu jest intensywnie czarny, dlatego po zmieleniu uzyskał ciemnoszary proszek. Następnie wsadził go na chwilkę do pieca aby się wygrzał. Temperatura szybko osiągnęła prawie 1100 stopni, a tlenki przereagowały ze sobą, tworząc nowe połączenie. Akurat to konkretne nie miało szczególnie ciekawych własności elektrycznych czy magnetycznych, lecz jedna właściwość rzucała się w oczy od razu po wyjęciu z pieca - otrzymany proszek okazał się niesamowicie niebieski.[4]
Gdy profesor zobaczył próbkę od razu przyszło mu do głowy, że to może znaleźć zastosowanie. Właściwie jeszcze przed publikacją na temat związku zaczęto starania nad komercjalizacją.
Jak się okazało podczas wyprażania powstaje związek zawierający warstwy tlenku manganu o nietypowej koordynacji w formie bipiramidy trygonalnej. W każdej takiej jednostce atom manganu otoczony jest przez pięć atomów tlenu, w tym trzy w płaszczyźnie warstwy i po jednym nad i pod nią. W takim położeniu oddziaływanie ligandów powoduje rozszczepienie poziomów energetycznych orbitali d manganu w taki sposób, że związek pochłania światło czerwone i zielone dając w efekcie niebieski kolor.
Wcześniej znany był pigment oparty o manganian baru, ale miał małą stabilność, nowy pigment nazwany YInMn nie tylko jest odporny na utlenienie czy redukcję, ale też zachowuje kolor w bardzo wysokich temperaturach i nie blaknie pod wpływem wilgoci. Szybko okazało się, że dobrze nadaje się zarówno do farb olejowych jak i wodnych, a także jako pigment do barwienia mas plastycznych. W tych zastosowaniach ważną własnością jest też jego nietoksyczność. Inne pigmenty nieorganiczne podobnej trwałości zwykle zawierają sole rakotwórczego kobaltu lub sole miedzi.
Podczas dalszych badań stwierdzono, że choć związek silnie pochłania światło czerwone, to zarazem silnie odbija podczerwień, osiągając jeden z najwyższych współczynników odbicia dla materiałów niemetalicznych (srebro odbija niemal 100% podczerwieni). Dzięki temu powierzchnie pomalowane farbą z tym pigmentem bardzo mało się nagrzewają, co miałoby znaczenie w przypadku na przykład dachów w cieplejszych krajach
Obecnie pigment zaczyna powoli wchodzić na rynek, niedawno producent kredek świecowych i pasteli Crayola ogłosił wprowadzenie kredki z YInMn, trwa konkurs na wymyślenie nazwy [5].
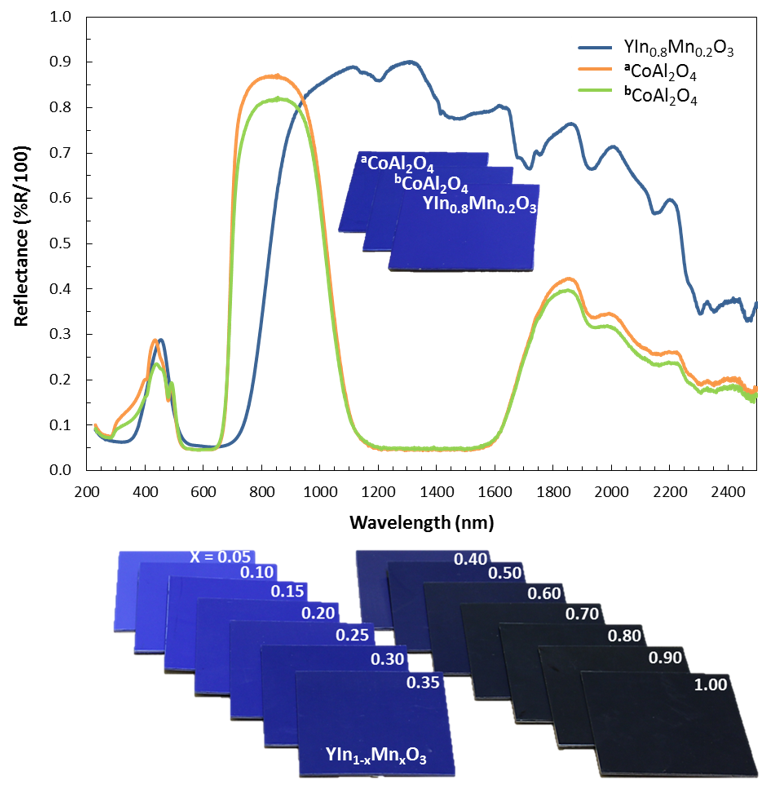
Jednak wbrew temu co piszą media, pigment nie posiada nowego, dopiero teraz odkrytego odcienia niebieskiego. W najbardziej optymalnym składzie YIn0.8Mn0.2O3 , związek ma kolor błękitu kobaltowego lub nieco cieplejszy, mimo zupełnie różnego przebiegu krzywej absorpcji:
Odcień może płynnie zmieniać się w zależności od stosunku itru do manganu. Dodatek innych metali, na przykład tytanu czy cynku może natomiast zmienić kolor na zielony lub fioletowy.[6]
W zespole prof. Subramaniana trwają prace nad uzyskaniem pigmentu czerwonego o odcieniu i intensywności nie stosowanych dziś z powodu toksyczności pigmentów rtęciowych jak cynober.
Może jeszcze kiedyś napiszę coś o projektowaniu barwników aby pokazać, jak takie rzeczy otrzymuje się planowo, bez czekania na szczęśliwy przypadek.
-------
* Aczkolwiek wcześniej niż Pittakall bo w XVIII wieku stworzono kwas pikrynowy, przez pewien czas używany do farbowania wełny, zastosowanie jako barwnik znalazł jednak dużo później. Półsyntetyczny był natomiast otrzymany w podobnym czasie indygokarmin, znany jako błękit saksoński, pozyskiwany przez traktowanie indygo dymiącym kwasem siarkowym.
[1] George B. Kauffman, Pittacal - The first synthetic dyestuff, Journal of Chemical Education (12) 1977 str. 753
[2] Sandmeyer-von Braun reaction
[3] De Diesbach, Henri; von Der Weid, Edmond (1927). "Quelques sels complexes des o-dinitriles avec le cuivre et la pyridine". Helvetica Chimica Acta. 10: 886.
[4] http://oregonstate.edu/ua/ncs/archives/2009/nov/accidental-discovery-produces-durable-new-blue-pigment-multiple-applications-0
[5] http://oregonstate.edu/ua/ncs/archives/2017/may/pigment-discovered-oregon-state-university-inspires-new-crayola-crayon-color
[6] http://chemistry.oregonstate.edu/content/story-yinmn-blue
informacje
Pokazywanie postów oznaczonych etykietą kolory. Pokaż wszystkie posty
Pokazywanie postów oznaczonych etykietą kolory. Pokaż wszystkie posty
piątek, 19 maja 2017
sobota, 18 października 2014
Liście jesienne
Złota jesień w pełni, wypadałoby więc napisać, skąd to przebarwianie się liści bierze się.
Podstawowym barwnikiem nadającym liściom roślin kolor, jest oczywiście chlorofil, którego zadaniem jest transformacja energii świetlnej w chemiczną, prowadząca do fotosyntezy. Jest to ciekawy związek oparty na pierścieniu pochodnej porfiryny, z przyłączonym długim łańcuchem węglowodoru i z jonem magnezu wewnątrz pierścienia, uchwyconym przez cztery azoty w mocny kompleks.
Ponadto w roślinach występuje w dwóch odmianach, jako chlorofil a i chlorofil b różniących się bocznymi grupami i odcieniem.
Ten długi ogon dzięki lipofilowości pozwala zakotwiczyć się cząsteczce w błonie tylakoidu, właściwego reaktywnego ciałka chloroplastu. W centrum reaktywnym odpowiedzialnym za pochłanianie i przetwarzanie energii, dwie cząsteczki chlorofilu oplecione są cząsteczką specyficznego białka. Kompleksy złożone z tych białek, chlorofilu i karotenoidów, tak zwane układy antenowe, połączone z błoną i centrum reaktywnym, tworzą fotoukład, będący molekularną maszyną rozkładającą wodę na tlen i wydzielającej chemiczne nośniki energii.
Chlorofil pochłania część światła w zakresie czerwonym i fioletowo-niebieskim, stąd wypadkowy kolor zielony, dosyć chłodny. Pochłonięcie kwantu światła powoduje wzbudzenie elektronowe cząsteczki. Zwykle w chloroplastach cząsteczki pigmentu tworzą agregaty, dzięki czemu szansa że w stosie jakaś cząsteczka pochłonie kwant jest większa. Energia tego wzbudzenia przekazywana jest skokami poprzez kilka cząsteczek aż do centrum reakcyjnego, gdzie od cząsteczki chlorofilu związanej z białkiem, odrywany jest elektron. Dzięki niemu wytwarzane są protony, jedne cząsteczki są utleniane a inne redukowane, aż wreszcie po rozłożeniu wody i wydzieleniu tlenu powstaje ATP będąca chemicznym nośnikiem tej właśnie pochodzącej od światła energii, wykorzystywane przez roślinę do przerobu dwutlenku węgla na więcej rośliny.
Oczywiście upraszczam, ale tak wygląda początkowy etap fotosyntezy, i do tego roślinom potrzebne są pigmenty.
Ale chlorofil to nie jedyny pigment w liściach. Całkiem spory udział mają też karoteny i karotenoidy, a więc cząsteczki z długim łańcuchem węglowodorowym z układem sprzężonych wiązań podwójnych. Mają kolory od żółtozielonego, przez żółty do pomarańczowego jak marchew, w której korzeniu wszakże występują. To one powodują, że kolor liści jest soczystszy i jaśniejszy - oba chlorofile same w sobie mają raczej chłodny odcień.
Dla rośliny karoteny w pewnym stopniu uzupełniają wady chlorofilu, który pochłania trochę światła czerwonego i trochę niebieskiego, zaś pomiędzy tymi zakresami zieje szeroka dziura mieszcząca w sobie światło zielone, którego w widmie słonecznym jest najwięcej.
Różne roślinne karotenoidy pochłaniają też światło z tego szerokiego zakresu:
Każdy taki barwnik po pochłonięciu kwantu światła przechodzi na krótko w stan wzbudzony. Jeśli będzie zawieszony w roztworze to albo wytraci energię poprzez ciepło, albo wypromieniuje jako światło, a wiele karotenów może też zmienić konfigurację cząsteczki.
Inaczej jest jednak, gdy karotenoid znajdzie się tuż przy cząsteczce chlorofilu w centrum reakcyjnym fotosyntezy - może wtedy nastąpić bezpromieniste przekazanie energii i jej wykorzystanie. Dzięki temu z jednej strony rośliny rośliny mogą lepiej wykorzystać energię światła, a z drugiej mogą przy pomocy wolnych karotenów chronić się przed nadmiernym naświetleniem.
Co takiego dzieje się jesienią? Drzewa i rośliny wieloletnie wycofują z liścia cenne składniki, głównie cukry i aminokwasy. Chlorofil zimą jest niepotrzebny, dlatego nie ma potrzeby dalej go produkować. Przez cały rok w liściach działają zarówno enzymy wytwarzające chlorofil jak i enzymy degradujące, zahamowanie produkcji powoduje, że te drugie z czasem, powoli, rozłożą chlorofil na cząsteczki bezbarwne. Reakcja zaczyna się od uszkodzenia białkowego kompleksu. Potem chlorofil jest odłączany od swego "ogona" przez hydrolizujący enzym chlorofilazę. Powstający chlorofilid ma nieco słabszą, ale wciąż zieloną barwę. Potem z kompleksu usuwany jest magnez, tworząc feoforbid o szarozielonkawej barwie. Na koniec ostatni enzym utlenia cząsteczkę, rozrywając pierścień, tworząc bezbarwny produkt końcowy.
Co to powoduje?
Z liści znika zieleń, i ujawniają się dotychczas niewidoczne karoteny i karotenoidy, a liście stają się żółte i pomarańczowe. To one odpowiadają za złoty kolor. W tym miejscu rodzi się więc pytanie - a skąd czerwień?
Za czerwony kolor liści odpowiadają antocyjany, barwniki, które muszą zostać specjalnie wytworzone. Jest to grupa barwników roślinnych odpowiadających za kolor wielu owoców, w tym truskawek, czarnych jagód, a także czerwonej kapusty. Zastanawiające jest natomiast, po co roślinom wytwarzać czerwony barwnik w liściach, z których właśnie wycofywane są składniki odżywcze, i których przeznaczeniem jest odpaść od rośliny.
W pewnym stopniu antocyjany są obroną rośliny przed nadmiernym nasłonecznieniem. Powstają w młodych listkach, dopiero co wychylających się z pąków, ale potem zanikają. Następnie pod koniec lata zaczynają być wytwarzane ponownie, głownie w szczytowych liściach. To dlatego u wielu drzew i krzewów liście na samym szczycie, na które pada najwięcej słońca, zaczerwieniają się na brzegach. W podobny sposób zaczerwieniają się rośliny zielne w szczycie okresu letniego.
Niemniej nie dotyczy to jesieni, gdy słońca jest już mało.
Być może w jakimś stopniu ułatwiają roślinie wycofanie pewnych składników w okresie chłodów, ale jak się wydaje głównym powodem czerwienienia jesiennych liści jest ochrona przed owadami. Jak wykazały badania na krzewach różnych odmian, te o liściach zielonych są częściej atakowane przez mszyce i inne szkodniki niż te o liściach czerwonych cały rok. Warto przy tym pamiętać, że jesienią, wiele szkodników stara się przygotować na zimę, toteż bądź składają jajeczka, bądź hibernują w warstwie liści, i robią to w pobliżu zaatakowanego drzewa. Oznacza to, że drzewa które swym kolorem odstraszyły szkodniki jesienią, będą mniej atakowane wiosną. Dlatego opłaca im się specjalnie wytworzyć czerwony barwnik, który pozostanie w liściach nawet gdy opadną.
A teraz przypomnę chromatografię, aby pokazać jak wyglądają wszystkie barwniki zawarte w liściach, gdy są jeszcze zielone:
Żółta plamka na samej górze, to karoteny. Szare pasmo poniżej to feofityny, produkt rozpadu chlorofilu, niżej są żółtawe ksantofile, następnie ciemnozielony chlorofil b i jaśniejszy chlorofil a. na samym dole ślady innych produktów rozpadu chlorofilu.
------
Źródła:
* http://en.wikipedia.org/wiki/Chlorophyll
* http://en.wikipedia.org/wiki/Photosystem
* http://en.wikipedia.org/wiki/Anthocyanin
* http://en.wikipedia.org/wiki/Autumn_leaf_color
*http://en.wikipedia.org/wiki/Chlorophyllase
Podstawowym barwnikiem nadającym liściom roślin kolor, jest oczywiście chlorofil, którego zadaniem jest transformacja energii świetlnej w chemiczną, prowadząca do fotosyntezy. Jest to ciekawy związek oparty na pierścieniu pochodnej porfiryny, z przyłączonym długim łańcuchem węglowodoru i z jonem magnezu wewnątrz pierścienia, uchwyconym przez cztery azoty w mocny kompleks.
Ponadto w roślinach występuje w dwóch odmianach, jako chlorofil a i chlorofil b różniących się bocznymi grupami i odcieniem.
Ten długi ogon dzięki lipofilowości pozwala zakotwiczyć się cząsteczce w błonie tylakoidu, właściwego reaktywnego ciałka chloroplastu. W centrum reaktywnym odpowiedzialnym za pochłanianie i przetwarzanie energii, dwie cząsteczki chlorofilu oplecione są cząsteczką specyficznego białka. Kompleksy złożone z tych białek, chlorofilu i karotenoidów, tak zwane układy antenowe, połączone z błoną i centrum reaktywnym, tworzą fotoukład, będący molekularną maszyną rozkładającą wodę na tlen i wydzielającej chemiczne nośniki energii.
Chlorofil pochłania część światła w zakresie czerwonym i fioletowo-niebieskim, stąd wypadkowy kolor zielony, dosyć chłodny. Pochłonięcie kwantu światła powoduje wzbudzenie elektronowe cząsteczki. Zwykle w chloroplastach cząsteczki pigmentu tworzą agregaty, dzięki czemu szansa że w stosie jakaś cząsteczka pochłonie kwant jest większa. Energia tego wzbudzenia przekazywana jest skokami poprzez kilka cząsteczek aż do centrum reakcyjnego, gdzie od cząsteczki chlorofilu związanej z białkiem, odrywany jest elektron. Dzięki niemu wytwarzane są protony, jedne cząsteczki są utleniane a inne redukowane, aż wreszcie po rozłożeniu wody i wydzieleniu tlenu powstaje ATP będąca chemicznym nośnikiem tej właśnie pochodzącej od światła energii, wykorzystywane przez roślinę do przerobu dwutlenku węgla na więcej rośliny.
Oczywiście upraszczam, ale tak wygląda początkowy etap fotosyntezy, i do tego roślinom potrzebne są pigmenty.
Ale chlorofil to nie jedyny pigment w liściach. Całkiem spory udział mają też karoteny i karotenoidy, a więc cząsteczki z długim łańcuchem węglowodorowym z układem sprzężonych wiązań podwójnych. Mają kolory od żółtozielonego, przez żółty do pomarańczowego jak marchew, w której korzeniu wszakże występują. To one powodują, że kolor liści jest soczystszy i jaśniejszy - oba chlorofile same w sobie mają raczej chłodny odcień.
Dla rośliny karoteny w pewnym stopniu uzupełniają wady chlorofilu, który pochłania trochę światła czerwonego i trochę niebieskiego, zaś pomiędzy tymi zakresami zieje szeroka dziura mieszcząca w sobie światło zielone, którego w widmie słonecznym jest najwięcej.
Różne roślinne karotenoidy pochłaniają też światło z tego szerokiego zakresu:
Każdy taki barwnik po pochłonięciu kwantu światła przechodzi na krótko w stan wzbudzony. Jeśli będzie zawieszony w roztworze to albo wytraci energię poprzez ciepło, albo wypromieniuje jako światło, a wiele karotenów może też zmienić konfigurację cząsteczki.
Inaczej jest jednak, gdy karotenoid znajdzie się tuż przy cząsteczce chlorofilu w centrum reakcyjnym fotosyntezy - może wtedy nastąpić bezpromieniste przekazanie energii i jej wykorzystanie. Dzięki temu z jednej strony rośliny rośliny mogą lepiej wykorzystać energię światła, a z drugiej mogą przy pomocy wolnych karotenów chronić się przed nadmiernym naświetleniem.
Co takiego dzieje się jesienią? Drzewa i rośliny wieloletnie wycofują z liścia cenne składniki, głównie cukry i aminokwasy. Chlorofil zimą jest niepotrzebny, dlatego nie ma potrzeby dalej go produkować. Przez cały rok w liściach działają zarówno enzymy wytwarzające chlorofil jak i enzymy degradujące, zahamowanie produkcji powoduje, że te drugie z czasem, powoli, rozłożą chlorofil na cząsteczki bezbarwne. Reakcja zaczyna się od uszkodzenia białkowego kompleksu. Potem chlorofil jest odłączany od swego "ogona" przez hydrolizujący enzym chlorofilazę. Powstający chlorofilid ma nieco słabszą, ale wciąż zieloną barwę. Potem z kompleksu usuwany jest magnez, tworząc feoforbid o szarozielonkawej barwie. Na koniec ostatni enzym utlenia cząsteczkę, rozrywając pierścień, tworząc bezbarwny produkt końcowy.
Co to powoduje?
Z liści znika zieleń, i ujawniają się dotychczas niewidoczne karoteny i karotenoidy, a liście stają się żółte i pomarańczowe. To one odpowiadają za złoty kolor. W tym miejscu rodzi się więc pytanie - a skąd czerwień?
Za czerwony kolor liści odpowiadają antocyjany, barwniki, które muszą zostać specjalnie wytworzone. Jest to grupa barwników roślinnych odpowiadających za kolor wielu owoców, w tym truskawek, czarnych jagód, a także czerwonej kapusty. Zastanawiające jest natomiast, po co roślinom wytwarzać czerwony barwnik w liściach, z których właśnie wycofywane są składniki odżywcze, i których przeznaczeniem jest odpaść od rośliny.
W pewnym stopniu antocyjany są obroną rośliny przed nadmiernym nasłonecznieniem. Powstają w młodych listkach, dopiero co wychylających się z pąków, ale potem zanikają. Następnie pod koniec lata zaczynają być wytwarzane ponownie, głownie w szczytowych liściach. To dlatego u wielu drzew i krzewów liście na samym szczycie, na które pada najwięcej słońca, zaczerwieniają się na brzegach. W podobny sposób zaczerwieniają się rośliny zielne w szczycie okresu letniego.
Niemniej nie dotyczy to jesieni, gdy słońca jest już mało.
Być może w jakimś stopniu ułatwiają roślinie wycofanie pewnych składników w okresie chłodów, ale jak się wydaje głównym powodem czerwienienia jesiennych liści jest ochrona przed owadami. Jak wykazały badania na krzewach różnych odmian, te o liściach zielonych są częściej atakowane przez mszyce i inne szkodniki niż te o liściach czerwonych cały rok. Warto przy tym pamiętać, że jesienią, wiele szkodników stara się przygotować na zimę, toteż bądź składają jajeczka, bądź hibernują w warstwie liści, i robią to w pobliżu zaatakowanego drzewa. Oznacza to, że drzewa które swym kolorem odstraszyły szkodniki jesienią, będą mniej atakowane wiosną. Dlatego opłaca im się specjalnie wytworzyć czerwony barwnik, który pozostanie w liściach nawet gdy opadną.
A teraz przypomnę chromatografię, aby pokazać jak wyglądają wszystkie barwniki zawarte w liściach, gdy są jeszcze zielone:
Żółta plamka na samej górze, to karoteny. Szare pasmo poniżej to feofityny, produkt rozpadu chlorofilu, niżej są żółtawe ksantofile, następnie ciemnozielony chlorofil b i jaśniejszy chlorofil a. na samym dole ślady innych produktów rozpadu chlorofilu.
------
Źródła:
* http://en.wikipedia.org/wiki/Chlorophyll
* http://en.wikipedia.org/wiki/Photosystem
* http://en.wikipedia.org/wiki/Anthocyanin
* http://en.wikipedia.org/wiki/Autumn_leaf_color
*http://en.wikipedia.org/wiki/Chlorophyllase
czwartek, 17 kwietnia 2014
Barwniki do jaj - chemicznie ujmując
Dwa lata temu opisałem w wielkanocnym wpisie jakie są naturalne metody barwienia pisanek i jakie związki za to odpowiadają. W tym roku zatem opiszę te sztuczne barwniki.
Wprawdzie różni producenci produkują tego typu barwniki, ale jak zauważyłem, praktycznie wszyscy używają tych samych, więc opis na podstawie składu barwników które mam w domu, powinien być reprezentatywny.
Czerwony
W moim zestawie za czerwień odpowiada E 124 czyli czerwień koszenilowa. To dość skomplikowany związek:
Dwie cząsteczki pochodnych naftalenu połączone grupą azową -N=N-. Grupa ta jest silnym chromoforem, a więc ugrupowaniem nadającym barwę, a jej kolor wzmacniają duże cząsteczki aromatyczne.
Wszystkie barwniki azowe mogą wywoływać uczulenia, u osób nadwrażliwych na salicylany zwiększają objawy a u astmatyków zwiększają wydzielanie histaminy. Z tego powodu ich użycie w żywności jest coraz bardziej ograniczane a normy zawartości systematycznie obniżane.
Różowy
W niektórych zestawach kolor różowy jest otrzymywany przez dodatek amarantu czyli E-123, kolejnego barwnika azowego. Ze względu na częste doniesienia o reakcjach nadwrażliwości jest coraz rzadziej używany w przemyśle spożywczym, podbarwia kawior, galaretki w proszku i napoje alkoholowe. Jest podejrzewany o rakotwórczość ale nie potwierdzono tego u ludzi.
Żółty
W moim zestawie znajdują się dwa żółte barwniki. Pierwszy to żółcień pomarańczowa czyli E 110 o kolorze bliższym pomarańczy, także będąca barwnikiem azowym:
Podobnie jak inne tego typu związki może wywoływać uczulenia i pokrzywki, u nadwrażliwych na salicylany daje reakcję. Jest podejrzewana o rakotwórczość ale nie wykazano tego u ludzi, mimo tego wiele krajów jej nie stosuje. Używa się jej do podbarwiania słodyczy i żywności która musi być podgrzewana, jednak coraz rzadkiej. Kiedyś była często stosowana do dożółcania margaryny.
Znalazłem informację, że stężone roztwory wodne przybierają w pewnych temperaturach formę ciekłego kryształu.
Drugi barwnik to tartrazyna, czyli E 102, mająca dość ciekawą budowę:
Jest to także barwnik azowy z grupami aromatycznymi, ale także pierścieniem diazolowym. Charakteryzuje się dużą siłą barwiącą. Pojawia się w szerokiej gamie produktów, zwłaszcza napojach i słodyczach, choć w ostatnich latach jest wycofywania. Używa się jej też w kosmetykach i jako barwnika do wełny.
Może wywoływać te same problemy zdrowotne jak i pozostałe barwniki azowe - pokrzywki, uczulenia, nadwrażliwość itp ale też migreny. Wydaje się, że u pewnych ludzi występuje specyficzna nadwrażliwość konkretnie na tą substancję, także u tych którzy nie wykazują objawów na inne barwniki azowe.
Z tego co czytałem, niektóre zestawy zawierają jeszcze żółć chinolinową czyli E 104, także barwnik azowy, inne też kurkuminę.
Niebieski
Niebieskim barwnikiem jest tu błękit brylantowy, czyli E 133, nie jest to tym razem barwnik azowy:
Jednak grupy sulfonowe przy pierścieniach aromatycznych powodują, że także może wywoływać nadwrażliwość. Uważany jednak za bezpieczny z powodu bardzo nikłego wchłaniania. Jest często stosowany w napojach i słodyczach.
Możliwy do stosowania jest też indygokarmin E 132, pochodna pigmentu indygo (tego od dżinsów), kiedyś o nim pisałem. Nie jest barwnikiem azowym, nie wywołuje uczuleń i należy do najmniej szkodliwych substancji barwiących, jest bowiem bardzo szybko wydalany - na tyle szybko, że może zabarwić mocz na niebiesko.
Nie wiem natomiast czy w zestawach używa się czerni brylantowej - barwnika o intensywnym, niebiesko-fioletowym kolorze
Zielony
Mój zestaw nie zawierał żadnego specyficznego barwnika zielonego. Zielony był zapewne otrzymany ze zmieszania błękitu brylantowego i tartrazyny. W zasadzie możliwe jest użycie w niektórych zestawach E140 czyli chlorofilu lub lepiej rozpuszczalnej E 141 czyli chlorofiliny miedziowej, barwników pochodzenia naturalnego które spotykałem w zestawach barwników spożywczych do deserów.
Jak zatem widzicie, barwniki do jaj to kawał chemii. Czy wobec tego są groźne? Raczej nie - nie wnikają do wnętrza jajka, lecz pozostają związane w skorupce - a tą zdejmujemy i wyrzucamy. Jeśli zaś ktoś ma obawy to powinien od teraz pamiętać, by niezużytych barwników do jaj nie używać do innych rzeczy - a już parę razy czytałem o barwieniu nimi domowych ciast i lukrów, które się przecież spożywa w całości.
Post scriptum:
Znalazłem wynik ciekawego badania - analitycy ze Zgierza przebadali w 2009 roku komercyjne zestawy do barwienia przy pomocy chromatografii cienkowarstwowej. Wykazali, że na 9 przebadanych zestawów, trzy nie zawierały deklarowanych barwników, bądź zawierały w śladowych ilościach, a głównymi składnikami barwiącymi były barwniki do wełny, niedopuszczone do barwienia żywości. Opis badań jest dosyć przystępny:
http://zgierz.impib.pl/images/pdf/181.pdf
Wprawdzie różni producenci produkują tego typu barwniki, ale jak zauważyłem, praktycznie wszyscy używają tych samych, więc opis na podstawie składu barwników które mam w domu, powinien być reprezentatywny.
Czerwony
W moim zestawie za czerwień odpowiada E 124 czyli czerwień koszenilowa. To dość skomplikowany związek:
Dwie cząsteczki pochodnych naftalenu połączone grupą azową -N=N-. Grupa ta jest silnym chromoforem, a więc ugrupowaniem nadającym barwę, a jej kolor wzmacniają duże cząsteczki aromatyczne.
Wszystkie barwniki azowe mogą wywoływać uczulenia, u osób nadwrażliwych na salicylany zwiększają objawy a u astmatyków zwiększają wydzielanie histaminy. Z tego powodu ich użycie w żywności jest coraz bardziej ograniczane a normy zawartości systematycznie obniżane.
Różowy
W niektórych zestawach kolor różowy jest otrzymywany przez dodatek amarantu czyli E-123, kolejnego barwnika azowego. Ze względu na częste doniesienia o reakcjach nadwrażliwości jest coraz rzadziej używany w przemyśle spożywczym, podbarwia kawior, galaretki w proszku i napoje alkoholowe. Jest podejrzewany o rakotwórczość ale nie potwierdzono tego u ludzi.
Żółty
W moim zestawie znajdują się dwa żółte barwniki. Pierwszy to żółcień pomarańczowa czyli E 110 o kolorze bliższym pomarańczy, także będąca barwnikiem azowym:
Podobnie jak inne tego typu związki może wywoływać uczulenia i pokrzywki, u nadwrażliwych na salicylany daje reakcję. Jest podejrzewana o rakotwórczość ale nie wykazano tego u ludzi, mimo tego wiele krajów jej nie stosuje. Używa się jej do podbarwiania słodyczy i żywności która musi być podgrzewana, jednak coraz rzadkiej. Kiedyś była często stosowana do dożółcania margaryny.
Znalazłem informację, że stężone roztwory wodne przybierają w pewnych temperaturach formę ciekłego kryształu.
Drugi barwnik to tartrazyna, czyli E 102, mająca dość ciekawą budowę:
Jest to także barwnik azowy z grupami aromatycznymi, ale także pierścieniem diazolowym. Charakteryzuje się dużą siłą barwiącą. Pojawia się w szerokiej gamie produktów, zwłaszcza napojach i słodyczach, choć w ostatnich latach jest wycofywania. Używa się jej też w kosmetykach i jako barwnika do wełny.
Może wywoływać te same problemy zdrowotne jak i pozostałe barwniki azowe - pokrzywki, uczulenia, nadwrażliwość itp ale też migreny. Wydaje się, że u pewnych ludzi występuje specyficzna nadwrażliwość konkretnie na tą substancję, także u tych którzy nie wykazują objawów na inne barwniki azowe.
Z tego co czytałem, niektóre zestawy zawierają jeszcze żółć chinolinową czyli E 104, także barwnik azowy, inne też kurkuminę.
Niebieski
Niebieskim barwnikiem jest tu błękit brylantowy, czyli E 133, nie jest to tym razem barwnik azowy:
Jednak grupy sulfonowe przy pierścieniach aromatycznych powodują, że także może wywoływać nadwrażliwość. Uważany jednak za bezpieczny z powodu bardzo nikłego wchłaniania. Jest często stosowany w napojach i słodyczach.
Możliwy do stosowania jest też indygokarmin E 132, pochodna pigmentu indygo (tego od dżinsów), kiedyś o nim pisałem. Nie jest barwnikiem azowym, nie wywołuje uczuleń i należy do najmniej szkodliwych substancji barwiących, jest bowiem bardzo szybko wydalany - na tyle szybko, że może zabarwić mocz na niebiesko.
Nie wiem natomiast czy w zestawach używa się czerni brylantowej - barwnika o intensywnym, niebiesko-fioletowym kolorze
Zielony
Mój zestaw nie zawierał żadnego specyficznego barwnika zielonego. Zielony był zapewne otrzymany ze zmieszania błękitu brylantowego i tartrazyny. W zasadzie możliwe jest użycie w niektórych zestawach E140 czyli chlorofilu lub lepiej rozpuszczalnej E 141 czyli chlorofiliny miedziowej, barwników pochodzenia naturalnego które spotykałem w zestawach barwników spożywczych do deserów.
Jak zatem widzicie, barwniki do jaj to kawał chemii. Czy wobec tego są groźne? Raczej nie - nie wnikają do wnętrza jajka, lecz pozostają związane w skorupce - a tą zdejmujemy i wyrzucamy. Jeśli zaś ktoś ma obawy to powinien od teraz pamiętać, by niezużytych barwników do jaj nie używać do innych rzeczy - a już parę razy czytałem o barwieniu nimi domowych ciast i lukrów, które się przecież spożywa w całości.
Post scriptum:
Znalazłem wynik ciekawego badania - analitycy ze Zgierza przebadali w 2009 roku komercyjne zestawy do barwienia przy pomocy chromatografii cienkowarstwowej. Wykazali, że na 9 przebadanych zestawów, trzy nie zawierały deklarowanych barwników, bądź zawierały w śladowych ilościach, a głównymi składnikami barwiącymi były barwniki do wełny, niedopuszczone do barwienia żywości. Opis badań jest dosyć przystępny:
http://zgierz.impib.pl/images/pdf/181.pdf
Subskrybuj:
Komentarze (Atom)