Wpis początkowo mający być migawką z tego co też zdarzyło mi się kiedyś w laboratorium nieco mi się poszerzył, dlatego będzie ogólnie o jodzie i jego analityce.Na początek opowiem o pewnej często stosowanej próbie analitycznej.
Dla wykrycia w badanym roztworze jodków, za pomocą klasycznej "próbówkowej" analizy jakościowej, zazwyczaj dodaje się do niego wody chlorowej i wytrząsa z chloroformem. Chloroform nie miesza się z wodą i osiada przy dnie jako odrębna warstewka, która po wytrząśnięciu z roztworem zawierającym jod, zabarwia się na różowo:
Dla wykrycia w badanym roztworze jodków, za pomocą klasycznej "próbówkowej" analizy jakościowej, zazwyczaj dodaje się do niego wody chlorowej i wytrząsa z chloroformem. Chloroform nie miesza się z wodą i osiada przy dnie jako odrębna warstewka, która po wytrząśnięciu z roztworem zawierającym jod, zabarwia się na różowo:
W tym przypadku roztwór był dosyć stężony, więc kolor jest bardzo wyraźny. Widać też różnicę między kolorem wodnego i organicznego roztworu jodu. W wodzie, w której rozpuszcza się słabo, daje zabarwienie brunatne, z pomarańczowym odcieniem. Skąd ta różnica?
Aby wyjaśnić takie zachowanie trzeba zacząć od przyczyny fioletowej barwy pierwiastka, widocznej w stanie gazowym. W stanie stały większe grudki przypominają grafit o niebieskawym odcieniu, dopiero w drobnych, prześwitujących ziarnach lub właśnie oparach, widać dobrze intensywny fiolet.
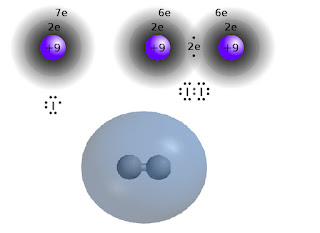
Jod tworzy cząsteczki dwuatomowe, między którymi istnieje wiązanie kowalencyjne. Wiązanie tego typu polega na połączeniu w parę po jednym wolnym elektronie z łączących się pierwiastków i umieszczeniu jej w przestrzeni między atomami. Ta "wiążące para elektronowa" oddziałuje wespół zespół z obydwoma atomami, dlatego jest dla nich "uwspólniona", zaś każdy uzyskuje w ten sposób wrażenie oktetu - najtrwalszej konfiguracji elektronów w otoczeniu. Jednakowoż jeśli opiszemy rzecz metodami mechaniki kwantowej, widzącej elektrony raczej jako rozmyte chmurki aniżeli kulki na orbitach, to rzecz stanie się nieco bardziej zawikłana.
W kwantowym modelu atomu zamiast mknących kulek mamy jak rzekłem chmurkę - a właściwie przestrzeń nazywaną orbitalem. Wiemy że elektron jest w tej przestrzeni, ale z różnym prawdopodobieństwem, co w istocie przekłada się na różne rozłożenie jego ładunku. Wiązanie pomiędzy atomami jodu tworzą zewnętrzne elektrony sigma, których orbitale są kuliste, i przez ich nakładanie się powstaje wspólny orbital molekularny obejmujący całą cząsteczkę z grubsza na kształt piłki do rugby:
Jednak sposobów łączenia się orbitali jest znacznie więcej, każdemu zaś odpowiada nieco inna energia. W tym przypadku najwyższemu rzeczywistemu orbitalowi sigma (HOMO) towarzyszy leżący nad nim najniższy potencjalny orbital (LUMO) nie zapełniony. Poziomy energetyczne tych orbitali leżą na tyle blisko, że stan elektronu może przechodzić z jednej możliwości w drugą, musi jedynie mieć dostarczoną ściśle określoną porcję energii. Na przykład może pochłonąć kwant światła odpowiadający konkretnej barwie.
Jeśli z białego światła, będącego mieszaniną wszystkich kolorów, wyciąć jakiś jeden, to suma reszty będzie widoczna jako kolor przeciwny. W tym przypadku intensywne pochłanianie zieleni, powoduje powstanie koloru fioletowego swobodnych par tego pierwiastka. Nieco inaczej rzecz przedstawia się w roztworach.
Już tu kiedyś pisałem, że w dydaktyce szkolnej opis rozpuszczania przedstawia ten proces tak, jakby zachodził w próżni, w rzeczywistości bowiem rozpuszczalnik zawsze w jakimś stopniu oddziałuje z cząsteczkami rozpuszczanych substancji. Niejednokrotnie cząsteczka zostaje otoczona warstewką silnie przyciągniętych cząsteczek rozpuszczalnika, co nie pozostaje bez wpływu na jej właściwości.
W przypadku Jodu rozpuszczalniki polarne oddziałują na tyle silnie, że tworzą kompleks, przenosząc część ładunku na jod. Poziomy energetyczne orbitali molekularnych rzeczywistego i potencjalnego rozsuwają się, jod zaczyna pochłaniać inną długość fali i zmienia kolor w stronę brunatnej czerwieni. Dlatego w wodzie i acetonie tworzy roztwory o takiej barwie. W rozpuszczalnikach słabiej oddziałujących, jak dichlorometan, jest intensywnie czerwony. W jeszcze słabszych, jak chloroform czy benzen jest różowy, a w najsłabiej oddziałujących jak heksan, tworzy roztwór fioletowy, tak jak w powietrzu. Jest to jeden z najwyraźniejszych przykładów solwatochromizmu.
Tak więc wyjaśniłem już o co chodzi w opisywanej próbie analitycznej. Nie jest ona zbytnio czuła i ma raczej znaczenie historyczne. Jest jednak jeszcze inna próba, bardziej dokładna i nadająca się do wykrywania śladowych ilości - mianowicie reakcja ze skrobią.
Skrobia, jak to już niedawno tłumaczyłem, jest naturalnym polimerem złożonych z połączonych w długie łańcuchy cząsteczek glukozy. Zależnie od typu łańcucha wyróżniamy prostą amylozę i rozgałęzioną amylopektynę - w przypadku tej ostatniej oddziaływania powodują, że łańcuchy te skręcają się w sprężynki.
Jod rozpuszcza się w wodzie bardzo słabo, chyba że obecne będą w niej jony jodkowe - łączy się wówczas w jony trójjodkowe, będące cząsteczkami wydłużonymi. Roztwór taki nazywa się płynem Lugola (natomiast klasyczna jodyna to roztwór w alkoholu). Tak się akurat składa, że rozmiar "sprężynki" amylozy, pasuje do wielkości cząsteczki trójjodkowej, toteż wpasowuje się ona między skręcone zwoje, tworząc dosyć trwały kompleks o intensywnym, granatowym zabarwieniu.
Barwa kompleksu zależy w pewnym stopniu od stężenia jodu - dla bardzo małych, jest granatowy, dla większych staje się brunatny do czerwonego. Barwa jest zauważalna już dla ilości 0,00002 mol/l jodu w roztworze. Tą samą metodą można wykryć jodki - same co prawda nie reagują ze skrobią, ale mogą być przeprowadzone w jod przez utlenienie. Jeśli do badanego roztworu dodamy zawiesinę skrobi i na przykład wodę chlorowa, to część jodków utleni się i powstający kompleks to uwidoczni.
Nie trudno zgadnąć, że skoro możemy skrobią wykryć jod, to i jodem możemy wykryć skrobię - i rzeczywiście, próba jodowa jest używana do sprawdzenia ilości i rozkładu skrobi w roślinach i pożywieniu. Tak można testować na przykład stopień dojrzałości jabłek - młode owoce zawierają głównie skrobię i kwasy owocowe, skąd cierpki smak młodych jabłuszek; w miarę rozwoju skrobia jest zużywana a w jej miejsce pojawia się coraz więcej cukrów, które maskują kwaśny posmak. Po przekrojeniu owocu polewa się powierzchnię płynem Lugola - zależnie od wielkości i rozmieszczenia zabarwienia przypisuje się owocom różną dojrzałość. W ten sposób można też wykryć obecność skrobi (również jej modyfikowanych chemicznie pochodnych, o których pisałem) tam gdzie znaleźć się nie powinna - na przykład przetworach mlecznych co do których producent nie deklaruje dodatków. Opisał to pięknie Stobiński w "Chemii i życiu".
Ale to nie koniec - wiemy że do reakcji potrzebne są na przykład jodki, skrobia i utleniacze, zatem mając te dwa pierwsze, możemy wykryć ten trzeci składnik.
Mogą to być gazy będące silnymi utleniaczami, jak chlor i brom, czy też ozon. Papierek jodoskrobiowy, zawierający jodki i skrobię, po zwilżeniu i przyłożeniu do wylotu próbówki z której jak sądzimy ulatniają się te gazy, pociemnieje. Profesjonalne paski testowe mają często skalę na której można w pewnym zakresie wyznaczać stężenie utleniaczy - w ten sposób sprawdza się na przykład czy ilość chloru w wodzie pitnej i kąpielowej nie przekracza norm.
Mogą to być silne utleniacze w roztworze, na przykład chlorany czy nadtlenek wodoru, tu jednak przy większych ilościach barwa może pojawić się na krótko - wydzielony jod jest dalej utleniony do bezbarwnych jodanów. Mogą to być nawet słabsze utleniacze, jeśli tylko ulegają odpowiedniej reakcji - na przykład azotyny (azotany III), w odróżnieniu od azotanów V. Reakcji z wydzieleniem jodu ulegają też niektóre metale - na przykład kationy miedzi II i żelaza III, będące raczej słabymi utleniaczami - toteż można by zapewne użyć papierków do wykrycia tych metali, ale dla nich znamy inne testy. Tą trójkę powiązaną możliwościami analitycznymi przedstawiłem na grafice:
Tak więc wiemy już jak wykryć jod i co wykryć można za jego pomocą, jest jednak jeszcze jedno zastosowanie jodu w analityce - mianowicie analiza ilościowa za pomocą miareczkowania jodometrycznego.
Cały pomysł polega na prostej zasadzie - pierwiastkowy jod łatwo redukuje się do jodków. Jeśli będziemy miareczkować jego roztwór przy pomocy roztworu reduktora o znanym stężeniu aż do zaniku barwy, to będziemy mogli ze zużytej objętości wyliczyć stężenie analitu, czyli zawartość jodu. Jeśli zaś mamy roztwór substancji reagującej z jodem o nieznanym stężeniu, to możemy dodać do niej znaną ilość jodu tak aby był to nadmiar, i zmiareczkować pozostały jod. wiedząc ile ubyło z pierwotnej ilości dodanego jodu, możemy wyliczyć ile musiało być w roztworze reagującej substancji.
Odwrotny przypadek to sytuacja gdy mamy nieoznaczony roztwór substancji mogącej utlenić jodki do wolnego jodu - dodajemy wówczas znaną ilość jodków i odmiareczkowujemy jod powstały w reakcji.
Jako reduktora zazwyczaj używa się tiosiarczanu sodu, który reaguje szybko wedle reakcji:
I3- + 2 S2O32- → S4O62- + 3 I-
Co zaś można oznaczać? W sposób bezpośredni siarczyny, siarczki, arsen III, glukozę i kwas askorbinowy, w pośredni wolny chlor, chlorany, azotyny, sole miedzi II i żelaza III.Tak się akurat składa, że spośród filmów miareczkowań jakie zrobiłem, najwięcej jest miareczkowań jodometrycznych i jeden z nich niedawno udostępniłem. Wykonałem go podczas praktyk w Siedleckim LOŚP, zaś analizowanym roztworem był wzorzec siarczynów:
Jest to właściwie najistotniejsza minuta miareczkowania. Ilość jodu słabnie a wraz z nią odcień roztworu. Gdy roztwór jest już słomkowy dodaję zawiesinę skrobi - dzięki temu łatwiej będzie mi uchwycić punkt końcowy, gdy zanikają ostatnie tony zabarwienia.
Ot, i tyle.




Jak się przemysłowo pozyskuje jod?
OdpowiedzUsuńZnalazłem nowego bloga o chemii:
OdpowiedzUsuńhttp://superchemia.wordpress.com/
Super, jeszcze tylko ze 30 takich i będzie o czym czytać.
Znam go, powstał niedawno ale wygląda obiecująco, jedynie zbyt skrótowe "telegraficzne" notki nie pozwalają się głębiej wczytać.
Usuń