Jeśli pryskamy się czymś na komary, to jaka w tym siedzi chemia? I czy można ją zastąpić czymś naturalnym?
DEET
N,N-dimetylo-m-toluamid to stosunkowo prosty związek chemiczny, będący najpopularniejszym i prawdopodobnie najdłużej działającym odstraszaczem komarów.

Wynaleziony w latach 40. z myślą o ochronie żołnierzy walczących w warunkach tropikalnych, wprowadzony do cywilnego obrotu w latach 50. Patenty na różne metody syntezy dawno wygasły, dlatego produkuje go wiele firm i stanowi podstawowy składnik wielu środków na odstraszanie komarów, moskitów, gzów i kleszczy, a nawet pcheł i innych owadów gryzących.
Mechanizm działania nie jest do końca jasny. W wysokich stężeniach działa jak środek owadobójczy, ale nie tłumaczy to odstraszania. Sądzono, że blokuje u komarów wyczuwanie dwutlenku węgla lub innych substancji zapachowych skóry, po których wyczuwają one swe ofiary. Wyniki eksperymentów na owadach są niespójne - w jednych stwierdzono, że DEET zmniejsza lotność skórnych substancji zapachowych, ale są też eksperymenty wskazujące na to, że u części gatunków komarów środek ten jest wyczuwany jako nieprzyjemnie, drażniąco pachnący, i skłania do odlatywania dalej od opryskanych miejsc. Część gatunków prawdopodobnie jest jedynie zniechęcana do żerowania podczas kontaktu z pokrytymi środkiem powierzchniami, a więc tracą ochotę na gryzienie gdy usiądą na opryskanym miejscu.
Niemniej eksperymenty potwierdzają, że DEET zapobiega ugryzieniom komarów i innych owadów niezależnie od mechanizmu. Czas ochrony zależy od warunków, rodzaju powierzchni i stężenia środka z preparacie. Przy stężeniach 50% i większych czas ochrony skóry to nawet 12 godzin, niższe skracają ten czas do około 3 godzin przy stężeniu 20%.
Jeśli chodzi o szkodliwość, to substancja jest stosunkowo bezpieczna. Wchłanianie przez skórę nie jest zbyt szybkie. Dawka wywołująca toksyczność ostrą LD50 to 1100 mg/kg m.c. w zasadzie więc poza przypadkami niezamierzonego lub celowego wypicia preparatu nie obserwuje się ciężkich zatruć. Efekty częstego narażenia na dawki typowe przy zwykłym zastosowaniu są bardziej subtelne i czasem trudno określić co właściwie jest ich przyczyną. Przykładem może być często cytowane badanie na temat pracowników Parku Narodowego Everglades, na bagiennych terenach Florydy, którzy stosując repelenty zawierające DEET codziennie podczas pracy, zgłaszali takie objawy jak senność, bóle głowy, podrażnienia skóry. Kwestią sporną jest w tym przypadku to, że repelenty zawierają jeszcze inne substancje, niż ta główna czynna i objawy równie dobrze mogą wynikać z innych przyczyn niż samo DEET. Częściej rejestruje się negatywne skutki przy niewłaściwym stosowaniu. Producenci odstraszaczy zwykle radzą aby napryskiwać preparat na dłonie i rozsmarowywać na odsłonięte części ciała. Pryskanie bezpośrednio na twarz lub opryskiwanie całego ciała w pomieszczeniach, narażają użytkowników na wdychanie aerozolu i lotnych rozpuszczalników.
Nie wykazano, żeby związek działał mutagennie czy rakotwórczo. Analiza związku wykrytego stężenia we krwi na czynniki zapalne nie wykazała wpływu.
https://pmc.ncbi.nlm.nih.gov/articles/PMC7410448/
Jedną z wad DEET jest też pozostawianie tłustej warstwy oraz działanie jak rozpuszczalnik niektórych tworzyw sztucznych. Zgłaszano już rozpuszczanie szkiełek zegarkowych, okularków pływackich, uszkadzanie lakierów czy przedmiotów z polistyrenu (sprzęt turystyczny, styropianowe opakowania na żywność). Zastosowany na odzież może osłabić materiał ze sztucznej wiskozy, stroje sportowe lycra/spandex. Jest to jednak problem, który pojawia się też u niektórych alternatyw, olejki eteryczne z cytrusów także dobrze rozpuszczają polistyren i różne lakiery.
Ikarydyna
Kolejny syntetyczny środek, stosunkowo nowy - wprowadzony na rynek europejski w 2001 roku, dlatego mniej popularny. W odróżnieniu od DEET ma dużo mniejsze wchłanianie przezskórne oraz słabsze działanie podrażniające, dlatego jest uważany za bezpieczniejszy przy użyciu bezpośrednio na ciało. Substancja prawdopodobnie blokuje u komarów odczuwanie zapachu, przez co nie może on namierzyć ofiar. Ma też pewien stopień odstraszania gzów, kleszczy.

W testach porównujących DEET i Ikarydyne w stężeniu 20% nie było różnicy w działaniu. DEET wygrywał w preparatach o wyższym stężeniu, ale te są mniej popularne. Preparaty z tą substancją nie powinny rozpuszczać tworzyw sztucznych.
IR3535
Pod względem chemicznym to bardzo prosta cząsteczka - butylo-acetylo-aminopropionian etylu
Jest to więc amina trzeciorzędowa, w której do atomu azotu podłączone są trzy grupy: czterowęglowa butylowa, acetylowa czyli reszta kwasu octowego i ester etylowy kwasu propionowego. Można go też traktować jak pochodną aminokwasu beta alaniny.
Prawdopodobnie działa jako zapach nieprzyjemny dla komarów. Przy stężeniu 20% działa do 5 godzin. Dla ludzi jest prawie bezwonny. Ma szerokie spektrum działania, oprócz typów komarów roznoszących choroby, działa też na kleszcze, meszki i wszy. Prawdopodobnie to najmniej toksyczny repelent. Jest słabo ale jednak rozpuszczalny z wodzie, więc w wilgotnych warunkach lub pod wpływem potu może się szybciej zmywać.
Za zaletę uznaje się też to, że w środowisku łatwo ulega biodegradacji, więc nie staje się kumulującym zanieczyszczeniem.
Złocień, pyretoidy i spirale
Znane wszystkim spiralne kadzidełka przeciwko komarom to wynalazek japoński, który co ciekawe często produkowany jest z roślin.
Od wieków na bliskim wschodzie znane były owadobójcze właściwości pyretrum - wyciągu otrzymywanego z drobnej rośliny z rodziny astrowatych, której klasyfikacja botaniczna zmieniała się kilka razy. W języku polskim najlepiej znana jest jako złocień dalmatyński, czasem jako chryzantema , w nowszych ujęciach opisuje się ją jako wrotycz starcolistny. Roślina była palona cała aby okadzać pomieszczenia, a proszek z niej używany do wcierania i przesypywania ubrań przeciwko pchłom i wszom. Najwięcej toksyn zawierają nasiona, z których możliwe jest wyekstrahowanie brunatnej oleożywcy. Przez długi czas pyrethrum było głównym towarem eksportowym Kenii, gdzie prowadzono duże uprawy.

W XIX wieku w Japonii znane było kadzidło oparte o proszek pyrethrum, trociny i różne dodatki, formowane w różne kształty. Jeden z wytwórców takich kadzideł, Eiichro Ueyama, skupiał się na otrzymaniu produktu palącego się możliwie jak najdłużej. Dodawał do masy dodatki spowalniające palenie, zwiększał grubość pałeczki i wydłużał ją aż niestety rozmiar stał się niewygodny. Pracująca z nim żona Yuki zaproponowała w końcu, że długie pałki kadzidła będą się mieściły w mniejszej przestrzeni jeśli się je skręci w kółko. Dalsze próby i testy doprowadziły do powstania kadzidełka w formie spirali, który to kształt otrzymywano skręcając wilgotny pręcik ręcznie. Pierwsze ich spirale na komary pojawiły się na rynku w 1902 roku.
Głównymi substancjami czynnymi pyrethrum są podobne związki Pyretryna, Cyneryna i Jasmolina o bardzo podobnej budowie, z charakterystycznym motywem trójkątnego pierścienia cyklopropanowego połączonego z resztą cząsteczki przez wiązanie estrowe:
Są to środki owadobójcze działające na układ nerwowy. W mniejszych stężeniach działają na owady drażniąco i odstraszają je od pomieszczeń. W wyższych stężeniach działają porażająco, w mniejszym stopniu zabijająco. Działanie na układ nerwowy ssaków jest dużo słabsze ze względu na szybki metabolizm. Naturalne pyretryny mają niską trwałość, rozkładają się pod wpływem światła słonecznego, wilgoci i bakterii glebowych - co w pewnych zastosowaniach jest zaletą - przez co czas działania nie jest długi. Aby poprawić ich właściwości zaczęło tworzyć związki syntetyczne o podobnej budowie, Pyretroidy. I często to one, obok mniejszej domieszki naturalnego pyrethrum, są dziś składnikami spiral na komary, sprejów i nasączanych moskitier.
Najszerzej stosowana jest chyba permetryna, stosowana w sprejach, wkładkach zapachowych, dtfuzorach, maściach, szamponach i innych preparatów. Pojawia się w preparatach leczniczych ze względu na działanie na świerzb i wszy. Moskitiery są czasem nią nasączane. Pojawia się w obrożach przeciw pchłom u psów. Stanowiąca jeden z pierwszych pyretroidów alletryna jest dziś znana też jako główny składnik spreju Raid. Metoflutryna została dopuszczona w UE jako składnik waporyzatorów elektrycznych wkładanych do gniazdka. W opryskach do stosowania wokół domu, na trawę i ściany, na komary, meszki i wszy pojawia się często Cyflutryna,

Syntetyczne pyretroidy nie działają przez odstraszenie owada - działają na niego szkodliwie, może poczuć wpływ po dotknięciu spryskanej powierzchni lub wskutek par w powietrzu. Mniejsze dawki dezorientują owada, są odbierane nieprzyjemnie, zniechęcają do żerowania. większe porażają układ nerwowy - ale jeśli owad spadnie na podłogę i nie zostanie wymieciony, po jakimś czasie się ocknie. Odpowiednio duże stężenia działają owadobójczo.
Pyretroidy choć zwykle szybko metabolizowane, nie są zupełnie obojętne. Narażenie na preparaty do oprysków z wyższym stężeniem mogą powodować pieczenie i podrażnienie skóry, wdychanie aerozolu może wywołać nudności i zwroty głowy, rzadziej duszności czy osłabienie. Fenotryna będąca składnikiem preparatów na wszy działa antyandrogennie, co może być czasem kłopotliwe przy wysokim narażeniu. Zanotowano wyraźnie zwiększoną częstość ginekomastii, spadku libido i zmian owłosienia u migrantów z Thaiti, którzy byli traktowani w ośrodkach dla uchodźców szamponem przeciw wszom, oraz regularnie spryskiwani po ciele i po pościeli sprejem o takim działaniu - oba środki zawierały ten sam składnik czynny. Może to mieć znaczenia o osób o już niskim wyjściowo poziomie testosteronu. Przypadkowe wypicie preparatów może wywołać ostre zatrucie, z wymiotami, drżeniem mięśni, śpiączką, obrzękami
Na różnego typu pyretroidy szczególnie wrażliwe są koty. Zdarzały się przypadki śmiertelnego zatrucia po założeniu kotu obroży przeciw pchłom dla psów. U większości ssaków związki tego typu są metabolizowane i usuwane dzięki enzymowi glukuronylotransferazie, który u kotów zwykle nie działa lub ma niska aktywność; dlatego środki na komary kumulują się w ich organizmie i wywołują porażenie układu nerwowego (ten sam brak enzymu powoduje nadwrażliwość na paracetamol).
https://en.wikipedia.org/wiki/Mosquito_coil
Eukaliptus cytrynowy
Olejek eteryczny z liści australijskiego drzewa
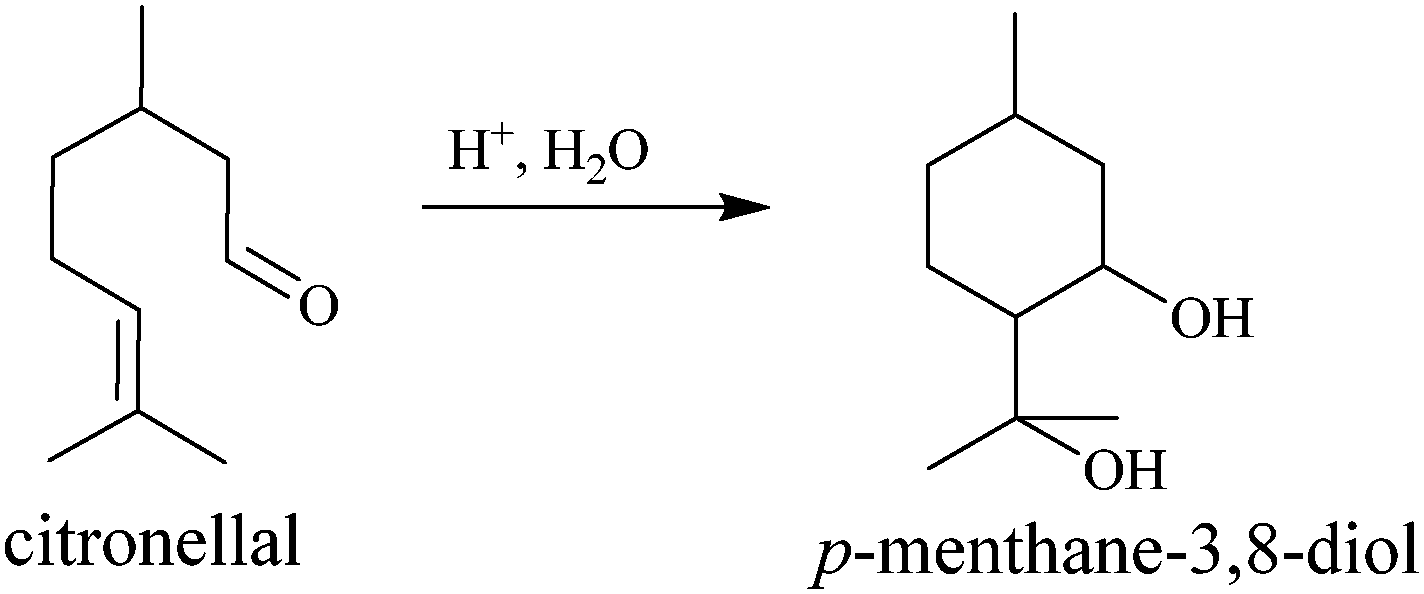
Corymbia citrodora, nazywanego eukaliptusem cytrynowym, często wymieniany jest jako trzeci polecany środek, zaraz po wymienianych tu syntetykach. Jego skuteczność i trwałość jest dosyć wysoka. Olejek z liści jest bogaty w cytronellol, związek o zapachu cytrynowym, który już sam w sobie odstrasza komary. Odkryto jednak, że głównym składnikiem czynnym jest występujący w zaledwie kilku procentach para-mentano-3,8-diol czyli PMD (czasem stosowana jest nazwa dihydroksycytrol). W handlu dostępny jest olejek rafinowany o zawartości PMD do 70%. Czysta substancja czynna ma zapach miętowy.
Skuteczność odstraszania komarów jest wysoka. Przy stężeniach rzędu 20-30% chroni skórę przed większością gatunków komarów, zależnie od warunków i obecności w preparacie utrwalaczy zmniejszających lotność, nawet do 4 godzin.
Mechanizm działania nie jest jasny, w jakiś sposób PMD zniechęca komary do żerowania nawet jeśli usiądą na skórze, natomiast raczej nie odstrasza ich, co zresztą sam na sobie obserwowałem (gryzły tylko w miejsca nieposmarowane). Owady narażone na ten związek były mniej chętne żerować
https://www3.epa.gov/pesticides/chem_search/reg_actions/registration/fs_PC-011550_01-Apr-00.pdf
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6023277/
Czyli środki z PMD to zamienniki syntetycznych, i są preparatami zawierającymi w pełni naturalną substancję czynną? Cóż, trochę tu się przyczepię. Na opakowaniach preparatów można znaleźć dość skomplikowaną formułę, mówiącą o olejku eterycznym cyklizowanym, zgodnie ze zmienionym nazewnictwem. Jeśli coś zostało cyklizowane, to znaczy że coś bez pierścieni zamieniło się w coś z pierścieniami. A zatem została dokonana jakaś przemiana.
Rzecz w tym, że stanowiący główny składnik olejku cytronellol może w warunkach kwaśnych ulegać cyklizacji z wytworzeniem właśnie PMD. I taka reakcja następuje biochemicznie w eukaliptusie, gdzie jednak przemianie ulega tylko kilka procentów. Dlatego można olejek docyklizować dalej poddając go reakcji z jakimś kwasem. Powstały produkt jest więc przetworzony dla zwiększenia zawartości cennego składnika, ale nie został wcześniej oczyszczony. Olejek cyklizowany jest więc w najlepszym razie surowcem pół-syntetycznym.
P
Olejki i zioła
Substancji aromatycznych mogących przydać się przeciwko komarom jest wiele, ale nie każda jest tak samo dobra. Popularne portale przypisują jak widzę zdolność odstraszania komarów dowolnym roślinom o wyraźnym zapachu, często bez dowodów lub z dowodami anegdotycznymi. Niektóre substancje jedynie zabijają zapach naszego ciała, inne wykazują bardziej specyficzne działanie, różne dla różnych komarów.
W analizie aktywności składników kopru włoskiego stwierdzono, że 5% fenchol wykazuje aktywność odstraszającą na poziomie 82-94% działania DEET w podobnym stężeniu, przy czym fenchol działał na skórze przez pół godziny a DEET przez godzinę. Zwiększenie stężenia DEET pozostawiało olejek daleko w tyle. [f] Pewien stopień odstraszania wywoływały olejki z kocimiętki, bazylii, rozmarynu, mirtu cytrynowego, niepokalanka, pieprzu czarnego czy kurkumy, z czasem działania wahającym się od 1 do 3 godzin zależnie od stężenia i formy preparatu.
Wanilina, składnik ekstraktów z wanilii, ma pewien stopień działania, ale zwykle dość krótki. Dodana do innych olejków lub do syntetycznych repelentów zwiększa ich skuteczność.
Cytronellal, Cytronellol, Geraniol Trzy podobne do siebie, i często współwystępujące składniki olejków eterycznych, które też wykazują pewien stopień odstraszania komarów, działają na skórze do 3-4 godzin. Ponieważ są odbierane jako przyjemne zapachy, są częstym składnikiem antykomarowych opasek, świec i kadzidełek. . Najbardziej obfitują w nie olejek geraniowy, z trawy cytrynowej, z limonki, palmorozowy, różany, neroli, w mniejszym stopniu cytrynowy ze skórki
Witamina B.
Witamina B1 czyli tiamina ma charakterystyczny zapach, przez wielu kojarzony z zapachem "leków w aptece". Po zażyciu większej dawki witaminy, zapach może być wyczuwalny w pocie. To też spowodowało, że według reguły "cokolwiek co pachnie" zaczęto polecać nacieranie się roztworem witaminy przeciwko komarom.
Przegląd badań z 2022 roku pokazuje jednak, że to mit - witamina B nie odstrasza komarów
https://pubmed.ncbi.nlm.nih.gov/35199632/
----
[f] https://pubs.acs.org/doi/10.1021/jf020504b




















_(17161279802).jpg)