Kilka miesięcy temu w czasopiśmie Nature Materials ukazała się ciekawa publikacja niemieckich naukowców "Kondensacja bozonowa ekscytono-polarytonów w krysztale grubości atomu" [1], opisująca jak to przy pomocy egzotycznego stanu kwantowego otrzymano kondensat Bosego-Einsteina z polarytonów, a w efekcie doprowadzono w nich do akcji laserowej.
Brzmi to bez wątpienia bardzo egzotycznie. I trochę mało zrozumiale. Więc już tłumaczę co w tym jest takiego ciekawego.
Atomy i cząsteczki są w stanie pochłonąć energię z promieniowania
elektromagnetycznego o pewnej dostrojonej częstotliwości, w związku z
tym ich elektrony wchodzą w stan o wyższej energii. Jest on nietrwały,
dlatego po pewnym czasie elektrony pozbywają się energii
wypromieniowując fotony o pewnej określonej częstotliwości. Czasem
emitowane promieniowanie ma inną częstotliwość niż to pochłonięte - na
tej zasadzie działają farby fluoryzujące oraz świetlówki, wewnątrz
których wytworzony jest ultrafiolet, a ten pochłania farba pokrywająca
szklaną rurkę, emitująca z powrotem światło widzialne. Ale może być też
tak, że emitowane jest takie samo światło jak to pochłonięte. Wtedy
światło wyemitowane przez jedną partię materiału jest pochłaniane przez
następną, mającą taką samą zdolność do pochłaniania tej właśnie fali.
Skończony czas trwania stanu wzbudzonego powoduje, że światło jest
rozpraszane, część energii zamienia się w ciepło, a materiał staje się
nieprzezroczysty dla tej wzbudzającej go fali.
Jeśli stan kwantowy, w którym dochodzi to tych pochłonięć i emisji jest
odpowiednio na to czuły, możliwa jest emisja wymuszona - uderzenie
fotonu w atom lub cząsteczkę, która już nieco wcześniej pochłonęła inny
foton i znalazła się w stanie wzbudzonym, wytrąca ją z tego stanu i
wymusza wyemitowanie fotonu wcześniej. Teraz przez przestrzeń lecą dwa fotony. Tym rasem taki wymuszony foton
ma taki sam kierunek i zwrot co foton wymuszający, nie dochodzi do
rozpraszania w różnych kierunkach. Po tym procesie oba fotony, wymuszający i wymuszony, mają taką samą długość fali i kierunek
Akcja laserowa to sytuacja, gdy materiał czuły na takie procesy
pochłaniania i emisji, zostanie na tyle mocno naświetlony, że bardzo
duża ilość jego cząstek/miejsc pochłaniających znajduje się teraz
właśnie w stanie wzbudzonym. Taki materiał jest "nasycony" energią
światła i niewiele trzeba aby go z tego stanu wytrącić. Jeśli zarazem
ten uzyskany stan jest czuły na emisję wymuszoną, a my stworzymy układ
optyczny, w którym fotony poruszają się przede wszystkim w pewnym
określonym kierunku, może dojść do akcji laserowej. Po przekroczeniu
pewnego zagęszczenia poruszających się w tym samym kierunku fotonów, i
miejsc wzbudzonych, czułych na emisję wymuszoną, następuje kaskadowe
wymuszenie wypromieniowania światła z całej objętości materiału i
powstaje impuls spójnej wiązki światła o tej samej częstotliwości,
kierunku i zwrocie. Cała nagromadzona podczas naświetlana energia
zostaje uwolniona w krótkim impulsie, stąd duża jasność wiązki laserowej.
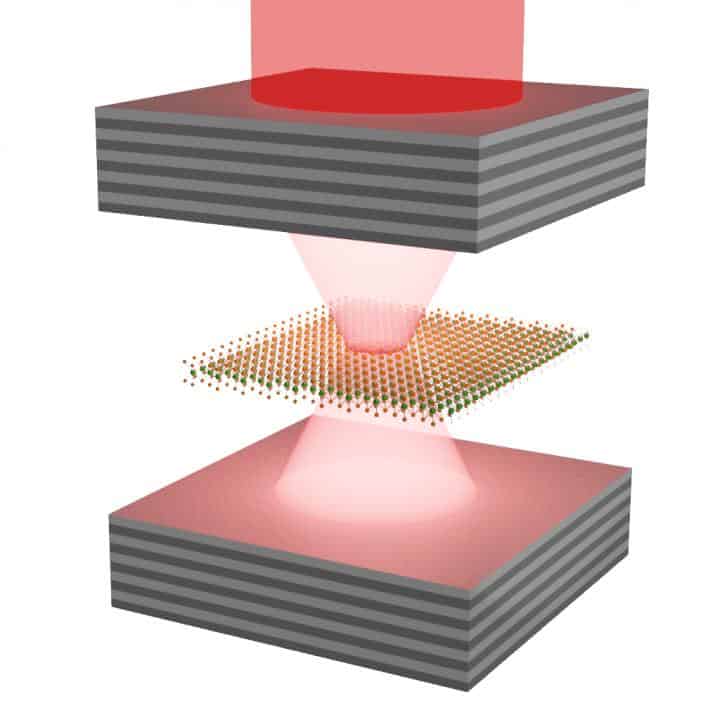
W publikacji omawianej tutaj opisywany jest przypadek wytworzenia
takiej sytuacji w materiale półprzewodnikowym o grubości jednego atomu.
Warstwę diselenku molibdenu umieszczono między warstwami tlenku krzemu i
tytanu. Tlenek ten jest bardzo połyskliwy i odbija wiele fotonów do
wnętrza wnęki, choć wciąż jest na tyle przezroczysty, że półprzewodnik
między warstwami można manipulować. Był on naświetlany laserem o takiej
częstotliwości, aby wytworzyć w nim wzbudzone stany elektronowe w sieci
krystalicznej tej monowarstwy.
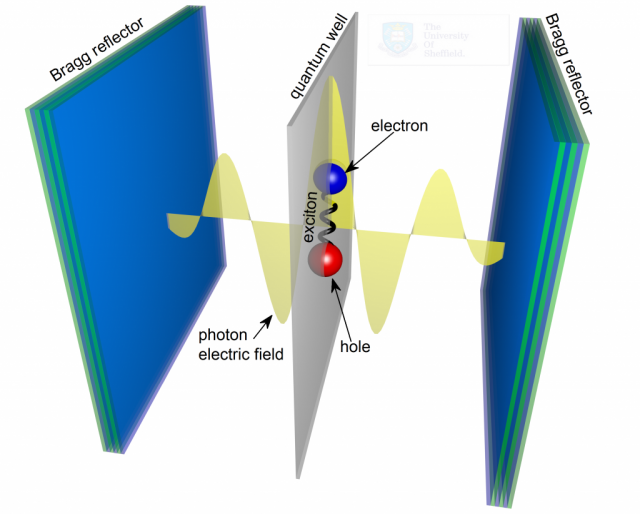
Wytworzono w ten sposób szczególny stan polarytonów ekscytono-fotonowych.
Ekscyton to kwant wzbudzenia elektronowego w materiale - pewien elektron
zostaje wyrwany z poziomu podstawowego, w którym nie może być
przewodzony przez półprzewodnik i nabiera takiej energii, że możliwe
jest dla niego swobodne przewodzenie. Mówi się wtedy, że przeszedł on do
"pasma przewodnictwa". W obrębie grupy elektronów o stanie podstawowym
pozostaje po nim dziura, zachowująca się jak cząstka o ładunku dodatnim.
Skoro te dwa stany w różnych poziomach energetycznych mają różne
ładunki, to mogą utworzyć w materiale układ związany, podobny do
miniaturowego atomu - dziura elektronowa, w pobliżu której krąży
elektron wzbudzony. Stan taki można w pewnych sytuacjach traktować jak
bardzo lekką cząstkę, stąd określenie ekscyton.
Ekscyton ten oddziałuje z polem elektromagnetycznym, a w czasie ruchu i
drgania może je sam wytwarzać, bo jest w końcu układem związanym ładunków
a ruch ładunków emituje promieniowanie. Ekscyton może nawet pochłaniać
energię promieniowania, co ma decydujące znaczenie w pewnych procesach
przewodzenia i rozpraszania energii. Gdy rozpatrujemy cały proces w
skali kwantowej okazuje się, że ekscyton reagujący z polem przyjmuje
określone, kwantowane stany energetyczne i powiązany jest z kwantem pola
elektromagnetycznego - fotonem. Taki stan nazywany jest polarytonem
ekscytonowo-fotonowym. Może być on traktowany jak coś w rodzaju cząstki o
określonych stanach kwantowych. Jest to wtedy kwazicząstka, złożona z fotonu i kwazicząstki ekscytonu, będącej stanem związanym elektronu z dziurą, czyli... też kwazicząstką. Taka "jakby cząstka" do sześcianu, ale ostatecznie w świecie kwantowym sytuacja ta generuje bardzo konkretne i możliwe do zmierzenia efekty.
Skoro polarytony mogą być traktowane jak cząstki z możliwością
przebywania w różnych stanach kwantowych, to powinny podlegać w ramach
tego ujęcia różnych kolektywnym zjawiskom. W normalnej sytuacji
sąsiadujące ze sobą polarytony powinny mieć różne stany. Ale przy
odpowiednim zagęszczeniu, wyrównaniu poziomów energetycznych i bardzo
niskiej temperaturze, w której drgania materiału nie wybijają cząstek równowagi, możliwe jest otrzymanie sytuacji, w którym wszystkie cząstki
w danym obszarze nabierają tego samego stanu kwantowego. Skoro tak, to
przestają być od siebie wzajemnie odróżnialne i dla obserwatora,
próbującego wykonać na nich pomiar, zachowują się jak jedna masa lub jak
rozciągnięta w przestrzeni jedna cząstka. Nazywa się to kondensatem
Bosego-Einsteina i otrzymywano już takie stany w chmurze bardzo
schłodzonych gazów, gdzie cząstkami o zrównanych stanach energetycznych były normalne atomy..
Stan wzbudzony ekscytonu nie jest bardzo trwały, w końcu następuje
połączenie dziury ze wzbudzonym elektronem. Musi się więc w tym procesie
uwolnić energia, i może być uwolniona jako światło. Z kolei utworzony z niego polaryton sam w sobie może znajdować się w wysokoenergetycznym stanie i schodząc do stanu o niższej energii emitować foton.
W tym kontekście zrozumiałe staje się co takiego zrobili naukowcy -
wywołali w warstwie półprzewodnika powstanie polarytonów. Te naświetlano tak, aby weszły w wyższy stan energetyczny. Po chwili obniżając energię wydzielały fotony, a te odbijały się od otaczających warstw
tlenku i wzbudzały kolejne polarytony. Gdy w wyniku bardzo ostrożnych
manipulacji energetycznych udało się uzyskać odpowiednio duże nasycenie
materiału wzbudzonymi polarytonami, w dobrze dobranych warunkach wszystkie
wyrównały stan kwantowy, utworzyły kondensat Bosego-Einsteina z
polarytonów. Zarazem stan energetyczny tych wyjściowych polarytonów jest
wrażliwy na emisję wymuszoną, więc w układzie równoległych warstw
odbijających dużo fotonów, w którym światło osiągnęło odpowiednią
gęstość, doszło do równoczesnej wymuszonej emisji światła w tym samym
kierunku i fazie z wszystkich polarytonów tworzących kondensat. Warstwa
złożona z pojedynczych atomów zadziałała jak laser i wytworzyła wiązkę
światła.
Po co było się tak męczyć? Potwierdza to rozważania teoretyczne, że
powinien być możliwy do utworzenia kondensat z takich złożonych
kwazicząstek - można więc przetestować różne dodatkowe szczegóły aby
lepiej zrozumieć zjawiska zachodzące z kolektywnym oddziaływaniem
kwazicząstek, a to zapewne rozwiąże niektóre niejasności w fizyce ciał
stałych, od której zależy działanie elektroniki i wielu urządzeń.
Obecnie bardzo obiecującym rozwiązaniem technicznym wydaje się
opto-elektronika, w której układy scalone działałyby dzięki
odpowiedniemu przesyłania światła a nie elektronów, co zwiększa szybkość
działania. Po drugie daje to możliwość stworzenia najmniejszych
możliwych źródeł światła o laserowych właściwościach, a to jest
potrzebne w pewnych układach badawczych. Kolejny kierunek to wytworzenie
tego stanu w wyższych temperaturach, bo eksperymentalna temperatura 4K
jest ciężka do osiągnięcia w domowych warunkach. Stąd testy z uzyskania
tego stanu na warstwach innych chalkogenów o podobnych właściwościach
elektronowych, jak cięższy analog diselenek wolframu.
Gdyby zaś udało się wytworzyć taki stan w wysokich temperaturach, to kto
wie, czy następną rewolucją w oświetleniu nie będą "żarówki
polarytonowe".
(całe to objaśnienie napisałem kilka miesięcy temu jako komentarz na Wykopie, a teraz uznałem, że ponieważ porządnie się wtedy napracowałem aby przystępnie wyjaśnić, to warto jest dać tekst i tutaj)
--------
[1] https://www.nature.com/articles/s41563-021-01000-8