Na pierwszym roku studiów, na przedmiocie chemia nieorganiczna, omawialiśmy reakcje związków fluorowców. Oto co się stało, gdy wrzuciłem grudkę jodanu sodowego do próbówki z kwasem siarkowym:
Powstały jod spienił się po wpływem pary wodnej i wypełzł z próbówki.
-----
Ps. To mój setny opublikowany post. Oby tak dalej.
informacje
Pokazywanie postów oznaczonych etykietą sole nieorganiczne. Pokaż wszystkie posty
Pokazywanie postów oznaczonych etykietą sole nieorganiczne. Pokaż wszystkie posty
środa, 27 lutego 2013
sobota, 19 stycznia 2013
Sól na lód
Temat bardzo zimowy a w pewnym stopniu wiążący się z wcześniejszym wpisem o mieszaninach ogrzewających i krystalizacji. Teraz bowiem będzie nie tylko o topieniu lodu ale i dla równowagi o mieszaninach ochładzających.
Gdy zimą chodniki, drogi, ulice i resztę świata pokrywa śnieg, w miejscach bardziej zdeptanych przeradzający się w lód lub śniegowe błoto, doprawdy bardzo trudno jest się poruszać. Ślizgawica na chodnikach to jeszcze pół biedy, ale na drogach jest nie do pomyślenia. Więc trzeba ten lód rozpuścić. Więc trzeba go posypać solą. Ale dlaczego solą i dlaczego sam piasek nie wystarczy, nie każdy wie.
Topnienie lodu jest przemianą fazową. Faza stała zamienia się bądź to w fazę ciekłą bądź to gazową. Zależy to akurat od warunków - w niskich temperaturach lód może parować w suchym powietrzu, przez co teoretycznie da się wysuszyć pranie na mrozie (tylko kto by tyle czekał?). To w jaki sposób i w jakich warunkach przebiegają przemiany z fazy do fazy, określają równowagi fazowe.
Na to jaka faza, lub układ faz jest akurat trwały, wpływają głównie takie czynniki jak temperatura i ciśnienie - w wysokiej temperaturze lód topnieje, ale pod wysokim ciśnieniem może ponownie zamarznąć. To zrozumiałe. Tak samo jak zrozumiałe jest, że skład substancji wpływa na przebieg równowag - przykładowo woda morska zamarza w zdecydowanie niższej temperaturze.
Teraz na chwilkę się zastanówmy - morze zaczyna zamarzać i na jego powierzchni pojawia się lód. Dla wody w oceanach następuje to w temperaturze -1,9° C. A teraz powiedzmy że temperatura nieco rośnie, do -0,5° C. Pamiętamy że lód topi się w temperaturze 0 stopni. Jest jeszcze za zimno więc - myślimy sobie - lód powinien pozostawać. Tymczasem lód się topi.
Znana nam temperatura topnienia lodu - 0° C - nie jest niczym innym jak temperaturą ustalenia się pewnej równowagi fazowej. W tej temperaturze lód i woda znajdują się w równowadze. Dostarczanie energii zmniejsza ilość fazy stałej, zaś jej odbieranie zmniejsza ilość fazy ciekłej, i tak to trwa aż do zaniku jednej z nich - czyli całkowitego stopienia lub całkowitego zamarznięcia. Tyle tylko, że jest to temperatura równowagi dla faz: Lód/woda. Natomiast w morzu lub w kubku ze słoną wodą mamy do czynienia z fazami: Lód/słona woda - a to już całkiem inna sytuacja.
Ogólnie rzecz biorąc substancje rozpuszczone w wodzie obniżają temperaturę jej topnienia - chyba że same krzepną w wyższych od wody temperaturach. Dla przykładu 40% roztwór alkoholu zamarza przy ok. -35-40° C (czysty etanol zamarza dopiero przy -114). Równowagi fazowe przesuwają się zatem w stronę niższych temperatur. Dla układu lód/nasycony roztwór soli temperatura równowagi to ok. -20° C. Skoro tak, łatwo jest już chyba domyśleć się co zachodzi na naszych chodnikach.
Gdy posypiemy lód solą, jej część rozpuści się od samego zetknięcia. Powstanie roztwór soli, który stykając się z lodem stworzy nasz układ. W takim układzie lód może trwale przebywać w zetknięciu z roztworem w temperaturze -18 czy -20 stopni. Jeśli zatem jest -11 czy -5 to dla takiego układu jest za ciepło. Lód będzie się rozpuszczał, uwalniając chodniki i drogi ze swych węgorzych okowów. Dla bardziej rozcieńczonych roztworów takie błoto może jednak zamarzać już przy mniejszych mrozach.
Pojawia się tu jednak szczególne zjawisko - gdy lód się rozpuszcza, cała mieszanka zaczyna wyraźnie się ochładzać. Dla odpowiednich mieszanek soli z lodem spadek temperatury może sięgać -20 czy -22 stopni, co wykorzystuje się niekiedy do chłodzenia. Jeśli więc mieszanka ochładza się aż do temperatury w której mimo to krzepnie, to dlaczego chodnik posypany solą nie zamarza ponownie po chwili?
A no dlatego, że przecież jest za ciepło. Gdybyśmy naszą chłodzącą mieszankę dobrze odizolowali, to miałaby szansę zamarznąć od samego swojego chłodzenia, ale przecież wciąż jest w kontakcie z za ciepłym otoczeniem. Dlatego nie osiąga tego stanu i cały lód topi się. Wszystko to dobrze działa do momentu, gdy mrozy nie są jeszcze zbyt silne, gdy jednak przekraczają tą temperaturę graniczną, zwykła sól nie wystarcza.
Dlaczego jednak taka mieszanina ochładza się?
Lód, topiąc się, pobiera na ten proces dosyć dużo ciepła, wystarczająco aby ochłodzić całość do niskiej temperatury. Tego typu mieszanki są niekiedy używane do chłodzenia. Dla mieszaniny lody i soli w stosunku 2/1 minimalna temperatura to ok. -20 stopni. Dla mieszanki uwodnionego chlorku wapnia z lodem w ilości 1/0,8 można osiągnąć do -40 stopni. Aby osiągać jeszcze niższe temperatury należy użyć suchego lodu, pozwalającego otrzymać temperatury aż do -78 stopni (z acetonem). W mieszance z eterem dietylowym pozwala na osiągnięcie -100 stopni. Dla jeszcze niższych temperatur używa się ciekłego azotu.
Jeżeli temperatura równowagowa innych soli z lodem jest jeszcze niższa niż dla soli kuchennej, to znaczy, że nadają się i one do odladzania. I faktycznie - chlorek wapnia i magnezu są używane do odladzania podczas silnych mrozów. Jeśli zastosuje się związki bezwodne to podczas rozpuszczania będą wytwarzały dość dużo ciepła, jak to już objaśniałem przy mieszaninach ogrzewających, dając dodatkową korzyść.
Jednak wymienione sole, w odróżnieniu od chlorku sodu, są droższe. Chlorek sodu bądź wydobywa się z kopalń, bądź wyodrębnia z zasolonych wód, że zaś w kraju mamy całkiem przyzwoite złoża, jest to materiał tani - Kłodawa sprzedaje ją za 220-280 zł za tonę netto, oferty które znalazłem podawały ceny rzędu 1500-1800 zł/t dla chlorku wapnia i 2200-2500 zł/t dla chlorku magnezu. Dlatego tego typu środki stosuje się u nas głównie w przypadku silnych mrozów.
Używanie soli do odmrażania ma jednak dość istotne wady - po rozpuszczeniu śniegu pozostaje roztwór solanki, który wnika z podłoże. Zasolenie gleby w miastach jest często tak duże, że nic większego od miniaturowych krzaczków nie chce tam rosnąć. Sól wnikająca w drobne pory betonu i asfaltu osłabia ich strukturę gdy w suchszym okresie zaczyna krystalizować, rozsadzając pory. W przypadku betonu prowadzi to do powstawania odprysków i "łuszczenia się" wierzchniej warstwy. W przypadku asfaltu sprzyja pękaniu. Wnikając w elementy żelazobetonu przyspiesza korozję prętów zbrojeniowych, osłabiając konstrukcje. Z tego samego powodu szkodzi samochodom. Pozostawia także osady na nawierzchni i na butach, a wnikając w skórę buta sprzyja jej pękaniu. W dodatku drogowcy sypią sól bardzo hojnie, czasem wręcz można mieć wrażenie, że wolą posypać niż zgarnąć śnieg. Dlatego od dawna szuka się jej zastępstw.
Wspomniane chlorki wapnia i magnezu są dobrymi alternatywami - są mniej korozyjne i zużywa się ich mniej, co przekłada się na mniejsze stężenie w glebie. Niestety również pozostawiają osady i mimo to nadal wzbogacają ziemię w chlorki. stąd też szybko pojawiły się pomysły zastąpienia chlorków zupełnie innymi solami, znacznie mniej szkodliwymi dla środowiska. Próbowano tutaj stosować preparaty na bazie mocznika, wykazujące działanie do -10 stopni, te jednak dla odmiany mogłyby wywołać przenawożenie gleb, a ponadto zbytnio zalkalizować środowisko.Bardzo ciekawym pomysłem jest preparat Safecoat produkowany z melasy. Przy produkcji białego cukru, po wykrystalizowaniu go z zalkalizowanego zagęszczonego soku, pozostaje odpadowa melasa. Oczyszczone frakcje znajdują zastosowanie w browarnictwie, zaś z pozostałym szlamem, zawierającym chlorek wapnia i inne sole oraz różne substancje organiczne, nie bardzo jest co robić. Amerykanie wpadli na pomysł aby zmieszać te melasowe odpady z solą i wysypywać na drogi; testuje się ten system w niektórych miejscach [1], podobno rezultaty są nie najgorsze. Byłoby bardo ciekawie wprowadzić to u nas - produkuje się u nas bardzo dużo cukru, a melasy eksportujemy do innych krajów najwięcej w europie, z pewnością więc materiał powinien być wyjątkowo tani.
Ciekawym pomysłem są sole prostych kwasów organicznych - octowego i mrówkowego - które łatwo utleniają się i są rozkładane w środowisku. Najpowszechniejszy jest tu octan wapniowo-magnezowy (CMA) powstający przez rozpuszczenie dolomitu w kwasie octowym. Nie zawiera jonów chlorkowych i nie jest tak agresywny korozyjnie; działa do temperatury -12° C, a więc jest prawie tak dobry jak zwykła sól. Stosowanie ogranicza niestety cena - jest prawie 20 razy droższy, głównie z powodu kosztów produkcji kwasu octowego. Mniej stosowany jest octan potasu (KAc), także mało agresywny i niestety drogi, ale mający tą zaletę, że działa dobrze aż do -26° C, w mieszance z mocznikiem jest używany do odladzania pasów startowych lotnisk. W Finlandii stosuje się do tego mrówczanu potasu, w dodatku zalecając używać go na drogach przebiegających przez cenne przyrodniczo obszary i rezerwaty, łatwo bowiem rozkłada się, nawet w niskich temperaturach, a więc nie zanieczyszcza środowiska. Nie znalazłem niestety informacji do jakich temperatur działa, ale musi być dobry skoro sprawdza się w Finlandii.
Wszystkie te alternatywy są niestety droższe, być może postępy biotechnologii pozwolą taniej produkować kwas octowy i mrówkowy na skalę przemysłową, co zmniejszy koszty. Stosunkowo nie najgorszym zastępstwem może być popiół drzewny lub powęglowy, choć działa głównie przez polepszenie przyczepności. No i można jeszcze sypać piaskiem.
Z własnych doświadczeń na ośnieżonym parapecie wynikło mi, że pewne słabe właściwości topienia ma kwasek cytrynowy a nawet cukier puder.
Zajmę się tu jeszcze jedną kwestią, która mnie zafrapowała, gdy szukałem jak to jest z dostępem do tych alternatyw. Często natykałem się na artykuły wychwalające Ekologiczną Sól Drogową , mającą być bardziej wydajną i nieszkodliwą, testowaną w wielu częściach kraju a nawet uznawaną przez ministerstwo ochrony środowiska za bezpieczny zamiennik*. Rzecz oczywista zacząłem szukać składu ale nic nie znalazłem, niektóre artykuły stwierdzały wręcz że skład jest zastrzeżony i opatentowany i dlatego producent nie chce go zdradzać. W zamian za to znalazłem długą listę korzyści, niektóre wydawały się wątpliwe (na przykład pisanie, że zwykła sól przestaje działać przy -6 stopniach) ale pozostałe całkiem uzasadnione. Niektóre artykuły marketingowe wspominają tylko, że nie jest to chlorek wapnia ani potasu. Tylko w kilku miejscach jest wspomniane, że zawiera magnez i potas. Więc może to po prostu mieszanka chlorków tych pierwiastków? Niestety znajduję i takie reklamy, w których twierdzi się, że sól nie zawiera chlorku magnezu. No cóż, zajrzałem więc na jednego z oficjalnych blogów firny, i tam jak byk znajduję ogłoszenia o sprzedaży przez tego samego dostawcę... technicznego chlorku magnezu. Lista zalet przy odladzaniu identyczna.
Zaglądam więc na informację techniczną[2]. Składu brak, tylko wzmianka o obniżonej zawartości "związków chlorku" i informacja że jest biodegradowalna co nie jest zbyt zręcznym określeniem** Przy okazji podano takie dane techniczne, jak masa cząsteczkowa (92,21 g/mol) temperaturę topnienia (708° C) i wrzenia (1412° C) na podstawie których, zaglądając do tablic chemicznych, mogę zidentyfikować związek jako stary, dobrze znany chlorek magnezu.
No to się wyjaśniło. Pozostaje tylko pytanie po co robić marketingową tajemnicę ze składu, skoro można się go domyśleć? Skoro podobno jest zastrzeżony i opatentowany, to można to robić, ale skoro chlorek magnezu już jest używany do tego celu przez różne firmy, obawa o ukradzenie pomysłu na jaką powołuje się producent, jest płonna jak musztarda po obiedzie
------
* Jedynym dokumentem na ten temat jaki znalazłem, była interpelacja poselska, w odpowiedzi na którą ministerstwo stwierdziło, że wykorzystanie ESD leży w gestii zarządcy drogi. To chyba nie to samo co poparcie przez ministerstwo.
** Biodegradacja to rozkład w środowisku związków organicznych. Nie dotyczy soli nieorganicznych i nie jest to to samo co nieszkodliwość.
http://en.wikipedia.org/wiki/De-ice
http://de.wikipedia.org/wiki/Schmelzpunkterniedrigung
http://en.wikipedia.org/wiki/Calcium_Magnesium_Acetate
[1] http://news.bbc.co.uk/local/wiltshire/hi/people_and_places/newsid_9185000/9185244.stm
[2] Informacja techniczna: Ekologiczna Sól Drogowa
 |
| Ziarenko soli drogowej w wytopionej przez siebie jamce |
Topnienie lodu jest przemianą fazową. Faza stała zamienia się bądź to w fazę ciekłą bądź to gazową. Zależy to akurat od warunków - w niskich temperaturach lód może parować w suchym powietrzu, przez co teoretycznie da się wysuszyć pranie na mrozie (tylko kto by tyle czekał?). To w jaki sposób i w jakich warunkach przebiegają przemiany z fazy do fazy, określają równowagi fazowe.
Na to jaka faza, lub układ faz jest akurat trwały, wpływają głównie takie czynniki jak temperatura i ciśnienie - w wysokiej temperaturze lód topnieje, ale pod wysokim ciśnieniem może ponownie zamarznąć. To zrozumiałe. Tak samo jak zrozumiałe jest, że skład substancji wpływa na przebieg równowag - przykładowo woda morska zamarza w zdecydowanie niższej temperaturze.
Teraz na chwilkę się zastanówmy - morze zaczyna zamarzać i na jego powierzchni pojawia się lód. Dla wody w oceanach następuje to w temperaturze -1,9° C. A teraz powiedzmy że temperatura nieco rośnie, do -0,5° C. Pamiętamy że lód topi się w temperaturze 0 stopni. Jest jeszcze za zimno więc - myślimy sobie - lód powinien pozostawać. Tymczasem lód się topi.
Znana nam temperatura topnienia lodu - 0° C - nie jest niczym innym jak temperaturą ustalenia się pewnej równowagi fazowej. W tej temperaturze lód i woda znajdują się w równowadze. Dostarczanie energii zmniejsza ilość fazy stałej, zaś jej odbieranie zmniejsza ilość fazy ciekłej, i tak to trwa aż do zaniku jednej z nich - czyli całkowitego stopienia lub całkowitego zamarznięcia. Tyle tylko, że jest to temperatura równowagi dla faz: Lód/woda. Natomiast w morzu lub w kubku ze słoną wodą mamy do czynienia z fazami: Lód/słona woda - a to już całkiem inna sytuacja.
Ogólnie rzecz biorąc substancje rozpuszczone w wodzie obniżają temperaturę jej topnienia - chyba że same krzepną w wyższych od wody temperaturach. Dla przykładu 40% roztwór alkoholu zamarza przy ok. -35-40° C (czysty etanol zamarza dopiero przy -114). Równowagi fazowe przesuwają się zatem w stronę niższych temperatur. Dla układu lód/nasycony roztwór soli temperatura równowagi to ok. -20° C. Skoro tak, łatwo jest już chyba domyśleć się co zachodzi na naszych chodnikach.
Gdy posypiemy lód solą, jej część rozpuści się od samego zetknięcia. Powstanie roztwór soli, który stykając się z lodem stworzy nasz układ. W takim układzie lód może trwale przebywać w zetknięciu z roztworem w temperaturze -18 czy -20 stopni. Jeśli zatem jest -11 czy -5 to dla takiego układu jest za ciepło. Lód będzie się rozpuszczał, uwalniając chodniki i drogi ze swych węgorzych okowów. Dla bardziej rozcieńczonych roztworów takie błoto może jednak zamarzać już przy mniejszych mrozach.
Pojawia się tu jednak szczególne zjawisko - gdy lód się rozpuszcza, cała mieszanka zaczyna wyraźnie się ochładzać. Dla odpowiednich mieszanek soli z lodem spadek temperatury może sięgać -20 czy -22 stopni, co wykorzystuje się niekiedy do chłodzenia. Jeśli więc mieszanka ochładza się aż do temperatury w której mimo to krzepnie, to dlaczego chodnik posypany solą nie zamarza ponownie po chwili?
A no dlatego, że przecież jest za ciepło. Gdybyśmy naszą chłodzącą mieszankę dobrze odizolowali, to miałaby szansę zamarznąć od samego swojego chłodzenia, ale przecież wciąż jest w kontakcie z za ciepłym otoczeniem. Dlatego nie osiąga tego stanu i cały lód topi się. Wszystko to dobrze działa do momentu, gdy mrozy nie są jeszcze zbyt silne, gdy jednak przekraczają tą temperaturę graniczną, zwykła sól nie wystarcza.
Dlaczego jednak taka mieszanina ochładza się?
Lód, topiąc się, pobiera na ten proces dosyć dużo ciepła, wystarczająco aby ochłodzić całość do niskiej temperatury. Tego typu mieszanki są niekiedy używane do chłodzenia. Dla mieszaniny lody i soli w stosunku 2/1 minimalna temperatura to ok. -20 stopni. Dla mieszanki uwodnionego chlorku wapnia z lodem w ilości 1/0,8 można osiągnąć do -40 stopni. Aby osiągać jeszcze niższe temperatury należy użyć suchego lodu, pozwalającego otrzymać temperatury aż do -78 stopni (z acetonem). W mieszance z eterem dietylowym pozwala na osiągnięcie -100 stopni. Dla jeszcze niższych temperatur używa się ciekłego azotu.
Jeżeli temperatura równowagowa innych soli z lodem jest jeszcze niższa niż dla soli kuchennej, to znaczy, że nadają się i one do odladzania. I faktycznie - chlorek wapnia i magnezu są używane do odladzania podczas silnych mrozów. Jeśli zastosuje się związki bezwodne to podczas rozpuszczania będą wytwarzały dość dużo ciepła, jak to już objaśniałem przy mieszaninach ogrzewających, dając dodatkową korzyść.
Jednak wymienione sole, w odróżnieniu od chlorku sodu, są droższe. Chlorek sodu bądź wydobywa się z kopalń, bądź wyodrębnia z zasolonych wód, że zaś w kraju mamy całkiem przyzwoite złoża, jest to materiał tani - Kłodawa sprzedaje ją za 220-280 zł za tonę netto, oferty które znalazłem podawały ceny rzędu 1500-1800 zł/t dla chlorku wapnia i 2200-2500 zł/t dla chlorku magnezu. Dlatego tego typu środki stosuje się u nas głównie w przypadku silnych mrozów.
Używanie soli do odmrażania ma jednak dość istotne wady - po rozpuszczeniu śniegu pozostaje roztwór solanki, który wnika z podłoże. Zasolenie gleby w miastach jest często tak duże, że nic większego od miniaturowych krzaczków nie chce tam rosnąć. Sól wnikająca w drobne pory betonu i asfaltu osłabia ich strukturę gdy w suchszym okresie zaczyna krystalizować, rozsadzając pory. W przypadku betonu prowadzi to do powstawania odprysków i "łuszczenia się" wierzchniej warstwy. W przypadku asfaltu sprzyja pękaniu. Wnikając w elementy żelazobetonu przyspiesza korozję prętów zbrojeniowych, osłabiając konstrukcje. Z tego samego powodu szkodzi samochodom. Pozostawia także osady na nawierzchni i na butach, a wnikając w skórę buta sprzyja jej pękaniu. W dodatku drogowcy sypią sól bardzo hojnie, czasem wręcz można mieć wrażenie, że wolą posypać niż zgarnąć śnieg. Dlatego od dawna szuka się jej zastępstw.
Wspomniane chlorki wapnia i magnezu są dobrymi alternatywami - są mniej korozyjne i zużywa się ich mniej, co przekłada się na mniejsze stężenie w glebie. Niestety również pozostawiają osady i mimo to nadal wzbogacają ziemię w chlorki. stąd też szybko pojawiły się pomysły zastąpienia chlorków zupełnie innymi solami, znacznie mniej szkodliwymi dla środowiska. Próbowano tutaj stosować preparaty na bazie mocznika, wykazujące działanie do -10 stopni, te jednak dla odmiany mogłyby wywołać przenawożenie gleb, a ponadto zbytnio zalkalizować środowisko.Bardzo ciekawym pomysłem jest preparat Safecoat produkowany z melasy. Przy produkcji białego cukru, po wykrystalizowaniu go z zalkalizowanego zagęszczonego soku, pozostaje odpadowa melasa. Oczyszczone frakcje znajdują zastosowanie w browarnictwie, zaś z pozostałym szlamem, zawierającym chlorek wapnia i inne sole oraz różne substancje organiczne, nie bardzo jest co robić. Amerykanie wpadli na pomysł aby zmieszać te melasowe odpady z solą i wysypywać na drogi; testuje się ten system w niektórych miejscach [1], podobno rezultaty są nie najgorsze. Byłoby bardo ciekawie wprowadzić to u nas - produkuje się u nas bardzo dużo cukru, a melasy eksportujemy do innych krajów najwięcej w europie, z pewnością więc materiał powinien być wyjątkowo tani.
Ciekawym pomysłem są sole prostych kwasów organicznych - octowego i mrówkowego - które łatwo utleniają się i są rozkładane w środowisku. Najpowszechniejszy jest tu octan wapniowo-magnezowy (CMA) powstający przez rozpuszczenie dolomitu w kwasie octowym. Nie zawiera jonów chlorkowych i nie jest tak agresywny korozyjnie; działa do temperatury -12° C, a więc jest prawie tak dobry jak zwykła sól. Stosowanie ogranicza niestety cena - jest prawie 20 razy droższy, głównie z powodu kosztów produkcji kwasu octowego. Mniej stosowany jest octan potasu (KAc), także mało agresywny i niestety drogi, ale mający tą zaletę, że działa dobrze aż do -26° C, w mieszance z mocznikiem jest używany do odladzania pasów startowych lotnisk. W Finlandii stosuje się do tego mrówczanu potasu, w dodatku zalecając używać go na drogach przebiegających przez cenne przyrodniczo obszary i rezerwaty, łatwo bowiem rozkłada się, nawet w niskich temperaturach, a więc nie zanieczyszcza środowiska. Nie znalazłem niestety informacji do jakich temperatur działa, ale musi być dobry skoro sprawdza się w Finlandii.
Wszystkie te alternatywy są niestety droższe, być może postępy biotechnologii pozwolą taniej produkować kwas octowy i mrówkowy na skalę przemysłową, co zmniejszy koszty. Stosunkowo nie najgorszym zastępstwem może być popiół drzewny lub powęglowy, choć działa głównie przez polepszenie przyczepności. No i można jeszcze sypać piaskiem.
Z własnych doświadczeń na ośnieżonym parapecie wynikło mi, że pewne słabe właściwości topienia ma kwasek cytrynowy a nawet cukier puder.
Zajmę się tu jeszcze jedną kwestią, która mnie zafrapowała, gdy szukałem jak to jest z dostępem do tych alternatyw. Często natykałem się na artykuły wychwalające Ekologiczną Sól Drogową , mającą być bardziej wydajną i nieszkodliwą, testowaną w wielu częściach kraju a nawet uznawaną przez ministerstwo ochrony środowiska za bezpieczny zamiennik*. Rzecz oczywista zacząłem szukać składu ale nic nie znalazłem, niektóre artykuły stwierdzały wręcz że skład jest zastrzeżony i opatentowany i dlatego producent nie chce go zdradzać. W zamian za to znalazłem długą listę korzyści, niektóre wydawały się wątpliwe (na przykład pisanie, że zwykła sól przestaje działać przy -6 stopniach) ale pozostałe całkiem uzasadnione. Niektóre artykuły marketingowe wspominają tylko, że nie jest to chlorek wapnia ani potasu. Tylko w kilku miejscach jest wspomniane, że zawiera magnez i potas. Więc może to po prostu mieszanka chlorków tych pierwiastków? Niestety znajduję i takie reklamy, w których twierdzi się, że sól nie zawiera chlorku magnezu. No cóż, zajrzałem więc na jednego z oficjalnych blogów firny, i tam jak byk znajduję ogłoszenia o sprzedaży przez tego samego dostawcę... technicznego chlorku magnezu. Lista zalet przy odladzaniu identyczna.
Zaglądam więc na informację techniczną[2]. Składu brak, tylko wzmianka o obniżonej zawartości "związków chlorku" i informacja że jest biodegradowalna co nie jest zbyt zręcznym określeniem** Przy okazji podano takie dane techniczne, jak masa cząsteczkowa (92,21 g/mol) temperaturę topnienia (708° C) i wrzenia (1412° C) na podstawie których, zaglądając do tablic chemicznych, mogę zidentyfikować związek jako stary, dobrze znany chlorek magnezu.
No to się wyjaśniło. Pozostaje tylko pytanie po co robić marketingową tajemnicę ze składu, skoro można się go domyśleć? Skoro podobno jest zastrzeżony i opatentowany, to można to robić, ale skoro chlorek magnezu już jest używany do tego celu przez różne firmy, obawa o ukradzenie pomysłu na jaką powołuje się producent, jest płonna jak musztarda po obiedzie
------
* Jedynym dokumentem na ten temat jaki znalazłem, była interpelacja poselska, w odpowiedzi na którą ministerstwo stwierdziło, że wykorzystanie ESD leży w gestii zarządcy drogi. To chyba nie to samo co poparcie przez ministerstwo.
** Biodegradacja to rozkład w środowisku związków organicznych. Nie dotyczy soli nieorganicznych i nie jest to to samo co nieszkodliwość.
http://en.wikipedia.org/wiki/De-ice
http://de.wikipedia.org/wiki/Schmelzpunkterniedrigung
http://en.wikipedia.org/wiki/Calcium_Magnesium_Acetate
[1] http://news.bbc.co.uk/local/wiltshire/hi/people_and_places/newsid_9185000/9185244.stm
[2] Informacja techniczna: Ekologiczna Sól Drogowa
piątek, 21 grudnia 2012
Mieszaniny ogrzewające
Bezpośrednią inspiracją do artykułu, była informacja prasowa o tym, jak to polskie wojsko wprowadziło do wyposażenia "bezpłomieniowy palnik", ogrzewający racje żywnościowe za pomocą pewnej reakcji chemicznej. Tego typu zestawy znane są już na świecie, jednak u nas jest to traktowane jak rewolucja. Relacjonująca sprawę prasa ustrzeliła przy tym takiego oto babola:
Soda... jaka? Zapewne redaktorom chodziło o sodę kalcynowaną, tym samym jednak błąd jaki popełnili jest podwójny, gdyż soda kalcynowana, to inaczej węglan sodu. Nieco później opisując skład racji żywnościowych podają błędną nazwę słodzika "xyliton" zamiast "ksylitol" co tylko potwierdza, że dziennikarze nie przywiązują wielkiej wagi do nazw chemicznych, wychodząc z założenia że jakby co, to i tak nikt z czytelników nie zauważy.
Abstrahując jednak od tych gaf, sama idea mieszanin ogrzewających i podgrzewaczy chemicznych, jest o tyle ciekawa, że warta szerszego omówienia na blogu takim jak ten.
Podczas wojny w warunkach polowych, ale też często podczas podróży po bezdrożach, wypraw wysokogórskich i w warunkach ekstremalnych, ciepły posiłek przyda się bardzo, nie zawsze jednak głodny osobnik może sobie pozwolić na zapalenie małej butli z gazem, czy choćby prymusa. Czasem może w tym przeszkadzać chęć niezdradzania swej pozycji* , czasem warunki atmosferyczne jak silny wiatr i deszcz, a czasem niezbyt właściwe do kucharzenia miejsce, jak ciasny schron czy kabina pojazdu. Stąd też pomysł, aby podgrzewać jedzenie w jakiś inny sposób. Gdy dostępny jest prąd, wystarczy grzałka elektryczna lub mikrofalówka, gdy zaś dostępu do sieci nie ma, zdawać się trzeba na takie właśnie wynalazki.
Każdy taki zestaw zasadniczo działa tak samo - jedzenie w zamkniętych opakowaniach wsadza się do woreczka lub kubełka i dolewa wody do zewnętrznego płaszcza. Pod wpływem wody substancja w tymże płaszczu czy woreczku zaczyna wydzielać na tyle dużo ciepła, aby móc zagotować wodę i podgrzać jedzenie wystarczająco, aby móc uzyskać gorący posiłek. Zestawy tego typu od dawna są znane w wojsku na zachodzie (np. MRE). Awaryjne podgrzewacze można także kupić w odpowiednich firmach, jako zestaw dla turystów. Zastanawia jednak, jakie to reakcje mogą wytworzyć aż tyle ciepła?
Na początek powiem może coś ogółem na temat ciepła w reakcjach chemicznych. Każda przemiana chemiczna, polegająca na zrywaniu lub powstawaniu wiązań chemicznych, albo zmianie ich konformacji, jest w istocie przemianą energetyczną - jedne cząsteczki wydzielają energię zaś inne ją pobierają, podlegając zmianom tak, aby dotrzeć do stanu termodynamicznie najtrwalszego w danych warunkach. Czasem reakcje przebiegają samorzutnie, czasem należy im w reagowaniu pomagać dostarczając energię. Ogólna zasada mówi, że energia nigdy nie ginie - może jedynie uciekać z układu lub ulegać zamianie na inną formę. Całkowita zawartość ciepła w danym układzie, to entalpia. Jej zmiany podczas reakcji objawiają się tym, że układ bądź pobiera bądź oddaje ciepło do otoczenia. Jeśli reakcja jest odwracalna, to ilość energii, jaką należy dostarczyć, aby zaszła w jedną stronę, jest równa ilości wydzielającej się gdy biegnie w drugą stronę, i to nie zależnie od tego jaką drogą się to odbywa.
Nam akurat zależy na oddawaniu, dlatego należy poszukać takich reakcji, których substraty są otrzymywane przy zużyciu dużej ilości ciepła. Taką wysoce energochłonną reakcją jest rozkład wapieni.
Węglan wapnia występuje w przyrodzie bardzo często, zaś otrzymywany z niego tlenek wapnia - czyli wapno palone - jest bardzo przydatny do tynkowania czy wytwarzania zaprawy wapiennej. Niestety, aby dokonać przemiany wapieni w wapno należy wypalać je w temperaturze 800 stopni przez kilka godzin. Na wypalenie tony wapna z ok. 1,7-2 t wapienia, potrzeba ok.4-5 kubików drewna opałowego w specjalnych piecach[2], a w stosach jak to robiono dawniej, z pewnością jeszcze więcej. Otrzymany tlenek wapnia chętnie łączy się z wodą dając wodorotlenek (wapno gaszone) i wydzielając bardzo dużo ciepła. W zasadzie więc, sprowadza się to do takiej reakcji:
Jeśli mamy do czynienia z metalem reaktywnym, to stan metaliczny jest dla niego nietrwały. Aby wytopić taki metal z rudy, należy przy pomocy dużej ilości ciepła rozłożyć jego związki, głównie tlenki lub siarczki. Skoro tak, to zgodnie z tym co powiedziałem, przemiana odwrotna powinna przebiegać z wydzielaniem ciepła. I rzeczywiście - gdyby dokładnie rzecz zmierzyć okazałoby się, że żelazo rdzewiejąc odrobinkę się grzeje, jednak powolność procesu powoduje, że ilość ciepła wydzielanego w jednostce czasu, jest niewielka. Gdybyśmy mogli przyspieszyć ten proces, żelazo wyraźnie grzałoby się. Spektakularnym tego przykładem są "zimne ognie" gdzie w spalającej się masie utleniane żelazo rozgrzewa się do temperatury białego żaru.
Chemiczne ogrzewacze używane w wojsku bazują właśnie na tej właściwości aktywnych metali.
Najczęściej zestawy takie zawierają mieszankę pyłu magnezowego, opiłków żelaza, soli kuchennej i innych dodatków, zależnie od producenta. Po dodaniu wody do takiej mieszanki, rozpuszczamy sól tworząc elektrolit. W tym elektrolicie zawieszone są dwa różne metale - żelazo i magnez - toteż cały układ staje się czymś w rodzaju zmielonego ogniwa galwanicznego.
Potencjał standardowy układu metal/kationy jest dla żelaza wyższy, niż dla magnezu, przez co w tak stworzonym układzie żelazo staje się dodatnią katodą, zaś magnez ujemną anodą. W takim układzie to metal anody jest utleniany, zgodnie z reakcją:
A jakie sole mogą dawać taki efekt? Najczęściej używa się tiosiarczanu sodu - krystalizacja stężonego roztworu może podnieść temperaturę z 25 do 50-55 stopni C. Jest to znany odczynnik chemiczny, dawniej też utrwalacz fotograficzny. Jednak zdecydowanie łatwiej dostępny jest octan sodu, który można przygotować roztwarzając sodę oczyszczoną w occie spożywczym. Tu temperatura może się podnieść do 40-50 stopni C, więc przy odrobinie chęci można sobie samemu skonstruować takie ogrzewacze do rękawiczek (nie omieszkam spróbować).
Dostępne w handlu kompresy oparte na tej zasadzie mają postać szczelnie zamkniętych woreczków. Zapoczątkowanie reakcji odbywa się w ciekawy sposób - wewnątrz woreczka znajduje się kawałeczek wklęsłego metalu. Naciskając na niego możemy go niejako wywrócić na drugą stronę czyli odgiąć. Odbywa się to bardzo szybkim szarpnięciem. Wprawdzie nie znalazłem dokładnego opisu, ale podejrzewam że wibracje przy powierzchni metalu są na tyle silne, że wywołują miejscową kawitację w roztworze - między węzłami fal dźwiękowych na moment ciśnienie spada na tyle, aby roztwór mógł na chwilkę odparować, przez co powstaje trochę zarodków i dalej proces przebiega samoistnie. Po wykorzystaniu woreczek z kryształami odgrzewa się w gorącej wodzie do rozpuszczenia, zostawia gdzieś do ochłodzenia i można go znów wykorzystać.
-------
* Czytelnicy Potopu być może przypomną sobie jak to podczas oblężenia Jasnej Góry, oblegani strzelali nocą do Szwedów gdy tylko zobaczyli płomienie, świadczące o tym, że ktoś chciał sobie zrobić kolację.
[1] http://www.rp.pl/artykul/962780.html?print=tak&p=0
[2] http://www.lhoist.pl/html/firma/historia/lhoist_bukowa.html
[3] http://nsrdec.natick.army.mil/media/fact/food/hrh.htm
- http://www.mreinfo.com/us/mre/frh.html
- http://www.thestreet.com/story/10689212/1/alumifuel-power-inc-provides-update-on-its-flameless-ration-heater-initiatives.html
W urządzeniu zachodzi reakcja chemiczna, która podnosi temperaturę.Saszetki nasączone są m.in. węglanem sodu, proszkiem glinu i sodą kolcynowaną.[1]
Soda... jaka? Zapewne redaktorom chodziło o sodę kalcynowaną, tym samym jednak błąd jaki popełnili jest podwójny, gdyż soda kalcynowana, to inaczej węglan sodu. Nieco później opisując skład racji żywnościowych podają błędną nazwę słodzika "xyliton" zamiast "ksylitol" co tylko potwierdza, że dziennikarze nie przywiązują wielkiej wagi do nazw chemicznych, wychodząc z założenia że jakby co, to i tak nikt z czytelników nie zauważy.
Abstrahując jednak od tych gaf, sama idea mieszanin ogrzewających i podgrzewaczy chemicznych, jest o tyle ciekawa, że warta szerszego omówienia na blogu takim jak ten.
Podczas wojny w warunkach polowych, ale też często podczas podróży po bezdrożach, wypraw wysokogórskich i w warunkach ekstremalnych, ciepły posiłek przyda się bardzo, nie zawsze jednak głodny osobnik może sobie pozwolić na zapalenie małej butli z gazem, czy choćby prymusa. Czasem może w tym przeszkadzać chęć niezdradzania swej pozycji* , czasem warunki atmosferyczne jak silny wiatr i deszcz, a czasem niezbyt właściwe do kucharzenia miejsce, jak ciasny schron czy kabina pojazdu. Stąd też pomysł, aby podgrzewać jedzenie w jakiś inny sposób. Gdy dostępny jest prąd, wystarczy grzałka elektryczna lub mikrofalówka, gdy zaś dostępu do sieci nie ma, zdawać się trzeba na takie właśnie wynalazki.
Każdy taki zestaw zasadniczo działa tak samo - jedzenie w zamkniętych opakowaniach wsadza się do woreczka lub kubełka i dolewa wody do zewnętrznego płaszcza. Pod wpływem wody substancja w tymże płaszczu czy woreczku zaczyna wydzielać na tyle dużo ciepła, aby móc zagotować wodę i podgrzać jedzenie wystarczająco, aby móc uzyskać gorący posiłek. Zestawy tego typu od dawna są znane w wojsku na zachodzie (np. MRE). Awaryjne podgrzewacze można także kupić w odpowiednich firmach, jako zestaw dla turystów. Zastanawia jednak, jakie to reakcje mogą wytworzyć aż tyle ciepła?
Na początek powiem może coś ogółem na temat ciepła w reakcjach chemicznych. Każda przemiana chemiczna, polegająca na zrywaniu lub powstawaniu wiązań chemicznych, albo zmianie ich konformacji, jest w istocie przemianą energetyczną - jedne cząsteczki wydzielają energię zaś inne ją pobierają, podlegając zmianom tak, aby dotrzeć do stanu termodynamicznie najtrwalszego w danych warunkach. Czasem reakcje przebiegają samorzutnie, czasem należy im w reagowaniu pomagać dostarczając energię. Ogólna zasada mówi, że energia nigdy nie ginie - może jedynie uciekać z układu lub ulegać zamianie na inną formę. Całkowita zawartość ciepła w danym układzie, to entalpia. Jej zmiany podczas reakcji objawiają się tym, że układ bądź pobiera bądź oddaje ciepło do otoczenia. Jeśli reakcja jest odwracalna, to ilość energii, jaką należy dostarczyć, aby zaszła w jedną stronę, jest równa ilości wydzielającej się gdy biegnie w drugą stronę, i to nie zależnie od tego jaką drogą się to odbywa.
Nam akurat zależy na oddawaniu, dlatego należy poszukać takich reakcji, których substraty są otrzymywane przy zużyciu dużej ilości ciepła. Taką wysoce energochłonną reakcją jest rozkład wapieni.
Węglan wapnia występuje w przyrodzie bardzo często, zaś otrzymywany z niego tlenek wapnia - czyli wapno palone - jest bardzo przydatny do tynkowania czy wytwarzania zaprawy wapiennej. Niestety, aby dokonać przemiany wapieni w wapno należy wypalać je w temperaturze 800 stopni przez kilka godzin. Na wypalenie tony wapna z ok. 1,7-2 t wapienia, potrzeba ok.4-5 kubików drewna opałowego w specjalnych piecach[2], a w stosach jak to robiono dawniej, z pewnością jeszcze więcej. Otrzymany tlenek wapnia chętnie łączy się z wodą dając wodorotlenek (wapno gaszone) i wydzielając bardzo dużo ciepła. W zasadzie więc, sprowadza się to do takiej reakcji:
CaO + H2O  Ca(OH)2
Ca(OH)2
Na każdy mol reagującego tlenku, czyli 65 g, wydziela się 63 kcal ciepła, mniej więcej tyle co spalenie 6 g propanu. Podczas gaszenia wapna temperatura mieszaniny może przekraczać 100 stopni C, co wystarcza do podgrzania niedużej porcji. Tego typu podgrzewacze były stosowane podczas I wojny światowej. Znacznie jednak większą ilość ciepła można uzyskać podczas przyspieszonego utleniania metali.Jeśli mamy do czynienia z metalem reaktywnym, to stan metaliczny jest dla niego nietrwały. Aby wytopić taki metal z rudy, należy przy pomocy dużej ilości ciepła rozłożyć jego związki, głównie tlenki lub siarczki. Skoro tak, to zgodnie z tym co powiedziałem, przemiana odwrotna powinna przebiegać z wydzielaniem ciepła. I rzeczywiście - gdyby dokładnie rzecz zmierzyć okazałoby się, że żelazo rdzewiejąc odrobinkę się grzeje, jednak powolność procesu powoduje, że ilość ciepła wydzielanego w jednostce czasu, jest niewielka. Gdybyśmy mogli przyspieszyć ten proces, żelazo wyraźnie grzałoby się. Spektakularnym tego przykładem są "zimne ognie" gdzie w spalającej się masie utleniane żelazo rozgrzewa się do temperatury białego żaru.
Chemiczne ogrzewacze używane w wojsku bazują właśnie na tej właściwości aktywnych metali.
Najczęściej zestawy takie zawierają mieszankę pyłu magnezowego, opiłków żelaza, soli kuchennej i innych dodatków, zależnie od producenta. Po dodaniu wody do takiej mieszanki, rozpuszczamy sól tworząc elektrolit. W tym elektrolicie zawieszone są dwa różne metale - żelazo i magnez - toteż cały układ staje się czymś w rodzaju zmielonego ogniwa galwanicznego.
Potencjał standardowy układu metal/kationy jest dla żelaza wyższy, niż dla magnezu, przez co w tak stworzonym układzie żelazo staje się dodatnią katodą, zaś magnez ujemną anodą. W takim układzie to metal anody jest utleniany, zgodnie z reakcją:
Mg + 2 H2O → Mg(OH)2 + H2
Wprawdzie reakcja sproszkowanego metalu z wodą zachodzi i bez tego, ale dosyć wolno. Stworzenie ogniwa w tak wybitnie sprzyjających warunkach powoduje, że metal może całkowicie przereagować w ciągu kilkunastu minut, po czym reakcja zostaje przerwana a zestaw trzyma ciepło stopniowo się ochładzając. Ilość ciepła wydzielanego podczas reakcji to 351 kJ/mol, zatem prawie sześć razy więcej niż przy gaszeniu wapna. Właśnie tego typu mieszaniny są używane w wojskowych zestawach.
Nieco wolniejsza reakcja, pozwalająca trzymać ciepło przez kilka godzin, bazuje na utlenieniu żelaza. Tutaj drugą elektrodę stanowi grafit. Mieszanina grafitu, opiłków żelaza i minerałów ilastych pomagających utrzymać ciepło, po zwilżeniu wodą rozgrzewa się zależnie od składu do 30-50 stopni. Tego typu zestawy używane są we wkładkach do butów i rozgrzewających kompresach.
Zestaw polskiej armii bazuje zapewne na podobnej reakcji, z wykorzystaniem tańszego glinu i tej nieszczęsnej sody. Nie sądzę aby użyto tam wodorotlenku sodu, bo wówczas w razie pęknięcia torby, mieszanina mogłaby popatrzyć nie tylko termicznie. Mieszaniny tego typu już istnieją, więc nie wiem co to za wielka innowacja.
Mieszaniny oparte na utlenianiu metali mają jednak jedną podstawową wadę - podczas reakcji wydzielają dosyć dużo wodoru, więc siłą rzeczy palenie papierosów podczas nagrzewania zestawu niewskazane. Wlanie do worków zbyt dużej ilości wody może wywołać wykipienie. No i zestaw można użyć tylko jeden raz. Wad tych pozbawione są mieszaniny, że tak powiem "hydratacyjne", niewydzielające wodoru (hydrogen-free ration heater - HRH). Aby jednak objaśnić, na czym polega ich działanie znów zboczę w dygresję.
Jak to już tłumaczyłem, sposób w jaki zazwyczaj w nauce szkolnej rozpisuje się dysocjację soli nie jest dokładny, gdyż przedstawia go jakby zachodził w próżni a nie w wodzie. W rzeczywistości bowiem, rozpuszczana substancja zawsze jakoś oddziałuje z cząsteczkami rozpuszczalnika za sprawą powstającego między nimi oddziaływania, czy to sił Londona, czy Van deer Walsa czy też w przypadku jonów, oddziaływania elektrostatycznego. Te oddziaływania dosłownie wyrywają cząstki z fazy stałej, co jednak nie może odbyć się bez kosztów - na każdą pracę potrzebna jest energia. Może to być energia cieplna czy w pewnym stopniu mechaniczna, co tłumaczy skuteczność mieszania i podgrzewania w rozpuszczaniu substancji. Cząstki ciała stałego są utrzymywane w fazie przez silne oddziaływania - i podobnież mogą to być oddziaływania międzycząsteczkowe dla kryształów molekularnych, wiązania wodorowe czy oddziaływania jonowe. Takim oddziaływaniom odpowiada pewna wartość energii, jaką należy przekazać cząstce, aby mogła wyrwać się do roztworu.
Zarazem, gdy cząstka rozpuszczona wyrwie się (a w zasadzie już w trakcie) zostaje otoczona przez cząsteczki rozpuszczalnika. Siły przyciągające mają to do siebie, ze układ przyciągających się ciał pobiera energię, gdy się je odrywa i wydziela gdy pozwala się im zbliżyć. Tak samo jest z grawitacją - aby rzucić kamień w górę należy się trochę wysilić, lecz spadając kamień uderzy o ziemię z taką samą siłą jak ta, z jaką go rzuciliśmy, może jedynie ostrzejszym kantem. W przypadku jonów rozpuszczających się w wodzie jej cząsteczki, będące dipolami, są przyciągane elektrostatycznie przez ładunek jonu i przez analogię "spadając" na jon w polu elektrostatycznym, wydzielają pewną energię. Jeśli energia sieci krystalicznej jest większa od energii hydratacji, to brakująca jej ilość zostanie wzięta z energii cieplnej wody - roztwór taki ochładza się, niejednokrotnie dość znacznie (rozpuszczanie lodu i soli w stężonym roztworze daje temperaturę do -35 C).
W przeciwnym przypadku, gdy energia hydratacji jest większa, zostaje ona wydzielona, a nasz roztwór ociepla się.
W nieutleniających mieszaninach ogrzewających używa się soli o wysokiej energii hydratacji, na przykład bezwodnego chlorku glinu czy chlorku wapnia. Zestaw taki można poddać recyklingowi po prostu odparowując roztwór do sucha. Znalazłem też zestawy oparte na wodorotlenkach metali alkalicznych - wodorotlenek sodu i potasu bardzo silnie nagrzewają roztwór podczas rozpuszczania, przy nieumiejętnym rozpuszczaniu nawet do wrzenia. Ciepło rozpuszczenia zasady potasowej jest prawie takie samo jak gaszenia wapna. Takie zestawy są bardzo niebezpieczne ze względu na powstające żrące ługi, jednak te, które znalazłem stosują tu sprytną sztuczkę - w zestawie oprócz wodorotlenku jest jeszcze substancja kwaśna, jak sądzę stały kwas organiczny, więc po rozpuszczeniu zasady następuje jej zobojętnienie, które zresztą też powoduje wydzielenie pewnej ilości energii[3]
Jest jeszcze jedna grupa ogrzewaczy chemicznych, które właściwie należałoby nazwać fizycznymi, czy też krystalitowymi. Wiecie już, że zrywając wiązania w krysztale wydatkujemy na to pewną energię. Jeśli połączycie to z zasadą, iż proces odwrotny wywoła taki sam, ale przeciwny do kierunku skutek energetyczny, to łatwo będzie się domyśleć, że krystalizacja substancji, która rozpuszczana pochłaniała energię, będzie przebiegała z wydzieleniem tejże. Po prostu energia wydzielająca się podczas tworzenia sieci krystalicznej jest wtedy większa od zużywanej na oderwanie od jonu zsolwatowanych cząsteczek wody. Jednak, aby powstające ciepło podwyższyło temperaturę w możliwie krótkim czasie, krystalizacja musi przebiegać szybko - stąd wykorzystanie substancji dających roztwory przechłodzone.
Oziębiając roztwór soli zmniejszamy rozpuszczalność, co dla stężonych roztworów musi się skończyć wydzieleniem nadmiaru substancji. Jednak zorganizowanie się bezładnych cząsteczek substancji w uporządkowany kryształ jest samo w sobie mało prawdopodobne, toteż jeśli roztwór jest bardzo czysty to mimo oziębiania nie wytworzą się w nim zarodki krystalizacji na tyle duże i liczne, aby proces zaczął zachodzić samorzutnie. W efekcie bardzo czyste roztwory soli można przechładzać bez krystalizacji, podobnie jak bardzo czystą wodę można przechłodzić do temperatur ujemnych bez zamarzania. Małe zaburzenie tej nietrwałej równowagi, poprzez dodanie stałej substancji, zanieczyszczeń, materiału porowatego czy nawet silne wytrząsanie, wywołuje bardzo szybką krystalizację, niejednokrotnie wywołujące skrzepnięcie roztworu w kilkanaście sekund.
Jeśli więc uda się nam to zrobić z roztworem substancji, wydzielającej ciepło podczas krystalizacji, to otrzymamy bardzo dobrą fizyczną grzałkę. Tego typu urządzenia, mające postać woreczków lub buteleczek, mają od bardzo dawna zastosowanie jako samogrzejące kompresy czy ogrzewacze do rąk. Taki pojemnik zanurza się w gorącej wodzie aż kryształy wewnątrz całkowicie się rozpuszczą, po cym odstawia w chłodne miejsce. Chcąc ich użyć wstrząsa się nimi lub w inny sposób wywołuje krystalizację - kryształy w krótkim czasie zarastają pojemnik, który robi się bardzo ciepły. Przykład takiej krystalizacji:
To na prawdę nie jest przyspieszony film.Nieco wolniejsza reakcja, pozwalająca trzymać ciepło przez kilka godzin, bazuje na utlenieniu żelaza. Tutaj drugą elektrodę stanowi grafit. Mieszanina grafitu, opiłków żelaza i minerałów ilastych pomagających utrzymać ciepło, po zwilżeniu wodą rozgrzewa się zależnie od składu do 30-50 stopni. Tego typu zestawy używane są we wkładkach do butów i rozgrzewających kompresach.
Zestaw polskiej armii bazuje zapewne na podobnej reakcji, z wykorzystaniem tańszego glinu i tej nieszczęsnej sody. Nie sądzę aby użyto tam wodorotlenku sodu, bo wówczas w razie pęknięcia torby, mieszanina mogłaby popatrzyć nie tylko termicznie. Mieszaniny tego typu już istnieją, więc nie wiem co to za wielka innowacja.
Mieszaniny oparte na utlenianiu metali mają jednak jedną podstawową wadę - podczas reakcji wydzielają dosyć dużo wodoru, więc siłą rzeczy palenie papierosów podczas nagrzewania zestawu niewskazane. Wlanie do worków zbyt dużej ilości wody może wywołać wykipienie. No i zestaw można użyć tylko jeden raz. Wad tych pozbawione są mieszaniny, że tak powiem "hydratacyjne", niewydzielające wodoru (hydrogen-free ration heater - HRH). Aby jednak objaśnić, na czym polega ich działanie znów zboczę w dygresję.
Jak to już tłumaczyłem, sposób w jaki zazwyczaj w nauce szkolnej rozpisuje się dysocjację soli nie jest dokładny, gdyż przedstawia go jakby zachodził w próżni a nie w wodzie. W rzeczywistości bowiem, rozpuszczana substancja zawsze jakoś oddziałuje z cząsteczkami rozpuszczalnika za sprawą powstającego między nimi oddziaływania, czy to sił Londona, czy Van deer Walsa czy też w przypadku jonów, oddziaływania elektrostatycznego. Te oddziaływania dosłownie wyrywają cząstki z fazy stałej, co jednak nie może odbyć się bez kosztów - na każdą pracę potrzebna jest energia. Może to być energia cieplna czy w pewnym stopniu mechaniczna, co tłumaczy skuteczność mieszania i podgrzewania w rozpuszczaniu substancji. Cząstki ciała stałego są utrzymywane w fazie przez silne oddziaływania - i podobnież mogą to być oddziaływania międzycząsteczkowe dla kryształów molekularnych, wiązania wodorowe czy oddziaływania jonowe. Takim oddziaływaniom odpowiada pewna wartość energii, jaką należy przekazać cząstce, aby mogła wyrwać się do roztworu.
Zarazem, gdy cząstka rozpuszczona wyrwie się (a w zasadzie już w trakcie) zostaje otoczona przez cząsteczki rozpuszczalnika. Siły przyciągające mają to do siebie, ze układ przyciągających się ciał pobiera energię, gdy się je odrywa i wydziela gdy pozwala się im zbliżyć. Tak samo jest z grawitacją - aby rzucić kamień w górę należy się trochę wysilić, lecz spadając kamień uderzy o ziemię z taką samą siłą jak ta, z jaką go rzuciliśmy, może jedynie ostrzejszym kantem. W przypadku jonów rozpuszczających się w wodzie jej cząsteczki, będące dipolami, są przyciągane elektrostatycznie przez ładunek jonu i przez analogię "spadając" na jon w polu elektrostatycznym, wydzielają pewną energię. Jeśli energia sieci krystalicznej jest większa od energii hydratacji, to brakująca jej ilość zostanie wzięta z energii cieplnej wody - roztwór taki ochładza się, niejednokrotnie dość znacznie (rozpuszczanie lodu i soli w stężonym roztworze daje temperaturę do -35 C).
W przeciwnym przypadku, gdy energia hydratacji jest większa, zostaje ona wydzielona, a nasz roztwór ociepla się.
W nieutleniających mieszaninach ogrzewających używa się soli o wysokiej energii hydratacji, na przykład bezwodnego chlorku glinu czy chlorku wapnia. Zestaw taki można poddać recyklingowi po prostu odparowując roztwór do sucha. Znalazłem też zestawy oparte na wodorotlenkach metali alkalicznych - wodorotlenek sodu i potasu bardzo silnie nagrzewają roztwór podczas rozpuszczania, przy nieumiejętnym rozpuszczaniu nawet do wrzenia. Ciepło rozpuszczenia zasady potasowej jest prawie takie samo jak gaszenia wapna. Takie zestawy są bardzo niebezpieczne ze względu na powstające żrące ługi, jednak te, które znalazłem stosują tu sprytną sztuczkę - w zestawie oprócz wodorotlenku jest jeszcze substancja kwaśna, jak sądzę stały kwas organiczny, więc po rozpuszczeniu zasady następuje jej zobojętnienie, które zresztą też powoduje wydzielenie pewnej ilości energii[3]
Jest jeszcze jedna grupa ogrzewaczy chemicznych, które właściwie należałoby nazwać fizycznymi, czy też krystalitowymi. Wiecie już, że zrywając wiązania w krysztale wydatkujemy na to pewną energię. Jeśli połączycie to z zasadą, iż proces odwrotny wywoła taki sam, ale przeciwny do kierunku skutek energetyczny, to łatwo będzie się domyśleć, że krystalizacja substancji, która rozpuszczana pochłaniała energię, będzie przebiegała z wydzieleniem tejże. Po prostu energia wydzielająca się podczas tworzenia sieci krystalicznej jest wtedy większa od zużywanej na oderwanie od jonu zsolwatowanych cząsteczek wody. Jednak, aby powstające ciepło podwyższyło temperaturę w możliwie krótkim czasie, krystalizacja musi przebiegać szybko - stąd wykorzystanie substancji dających roztwory przechłodzone.
Oziębiając roztwór soli zmniejszamy rozpuszczalność, co dla stężonych roztworów musi się skończyć wydzieleniem nadmiaru substancji. Jednak zorganizowanie się bezładnych cząsteczek substancji w uporządkowany kryształ jest samo w sobie mało prawdopodobne, toteż jeśli roztwór jest bardzo czysty to mimo oziębiania nie wytworzą się w nim zarodki krystalizacji na tyle duże i liczne, aby proces zaczął zachodzić samorzutnie. W efekcie bardzo czyste roztwory soli można przechładzać bez krystalizacji, podobnie jak bardzo czystą wodę można przechłodzić do temperatur ujemnych bez zamarzania. Małe zaburzenie tej nietrwałej równowagi, poprzez dodanie stałej substancji, zanieczyszczeń, materiału porowatego czy nawet silne wytrząsanie, wywołuje bardzo szybką krystalizację, niejednokrotnie wywołujące skrzepnięcie roztworu w kilkanaście sekund.
Jeśli więc uda się nam to zrobić z roztworem substancji, wydzielającej ciepło podczas krystalizacji, to otrzymamy bardzo dobrą fizyczną grzałkę. Tego typu urządzenia, mające postać woreczków lub buteleczek, mają od bardzo dawna zastosowanie jako samogrzejące kompresy czy ogrzewacze do rąk. Taki pojemnik zanurza się w gorącej wodzie aż kryształy wewnątrz całkowicie się rozpuszczą, po cym odstawia w chłodne miejsce. Chcąc ich użyć wstrząsa się nimi lub w inny sposób wywołuje krystalizację - kryształy w krótkim czasie zarastają pojemnik, który robi się bardzo ciepły. Przykład takiej krystalizacji:
A jakie sole mogą dawać taki efekt? Najczęściej używa się tiosiarczanu sodu - krystalizacja stężonego roztworu może podnieść temperaturę z 25 do 50-55 stopni C. Jest to znany odczynnik chemiczny, dawniej też utrwalacz fotograficzny. Jednak zdecydowanie łatwiej dostępny jest octan sodu, który można przygotować roztwarzając sodę oczyszczoną w occie spożywczym. Tu temperatura może się podnieść do 40-50 stopni C, więc przy odrobinie chęci można sobie samemu skonstruować takie ogrzewacze do rękawiczek (nie omieszkam spróbować).
Dostępne w handlu kompresy oparte na tej zasadzie mają postać szczelnie zamkniętych woreczków. Zapoczątkowanie reakcji odbywa się w ciekawy sposób - wewnątrz woreczka znajduje się kawałeczek wklęsłego metalu. Naciskając na niego możemy go niejako wywrócić na drugą stronę czyli odgiąć. Odbywa się to bardzo szybkim szarpnięciem. Wprawdzie nie znalazłem dokładnego opisu, ale podejrzewam że wibracje przy powierzchni metalu są na tyle silne, że wywołują miejscową kawitację w roztworze - między węzłami fal dźwiękowych na moment ciśnienie spada na tyle, aby roztwór mógł na chwilkę odparować, przez co powstaje trochę zarodków i dalej proces przebiega samoistnie. Po wykorzystaniu woreczek z kryształami odgrzewa się w gorącej wodzie do rozpuszczenia, zostawia gdzieś do ochłodzenia i można go znów wykorzystać.
-------
* Czytelnicy Potopu być może przypomną sobie jak to podczas oblężenia Jasnej Góry, oblegani strzelali nocą do Szwedów gdy tylko zobaczyli płomienie, świadczące o tym, że ktoś chciał sobie zrobić kolację.
[1] http://www.rp.pl/artykul/962780.html?print=tak&p=0
[2] http://www.lhoist.pl/html/firma/historia/lhoist_bukowa.html
[3] http://nsrdec.natick.army.mil/media/fact/food/hrh.htm
- http://www.mreinfo.com/us/mre/frh.html
- http://www.thestreet.com/story/10689212/1/alumifuel-power-inc-provides-update-on-its-flameless-ration-heater-initiatives.html
sobota, 17 listopada 2012
Co nieco o Jodzie
Wpis początkowo mający być migawką z tego co też zdarzyło mi się kiedyś w laboratorium nieco mi się poszerzył, dlatego będzie ogólnie o jodzie i jego analityce.Na początek opowiem o pewnej często stosowanej próbie analitycznej.
Dla wykrycia w badanym roztworze jodków, za pomocą klasycznej "próbówkowej" analizy jakościowej, zazwyczaj dodaje się do niego wody chlorowej i wytrząsa z chloroformem. Chloroform nie miesza się z wodą i osiada przy dnie jako odrębna warstewka, która po wytrząśnięciu z roztworem zawierającym jod, zabarwia się na różowo:
Dla wykrycia w badanym roztworze jodków, za pomocą klasycznej "próbówkowej" analizy jakościowej, zazwyczaj dodaje się do niego wody chlorowej i wytrząsa z chloroformem. Chloroform nie miesza się z wodą i osiada przy dnie jako odrębna warstewka, która po wytrząśnięciu z roztworem zawierającym jod, zabarwia się na różowo:
W tym przypadku roztwór był dosyć stężony, więc kolor jest bardzo wyraźny. Widać też różnicę między kolorem wodnego i organicznego roztworu jodu. W wodzie, w której rozpuszcza się słabo, daje zabarwienie brunatne, z pomarańczowym odcieniem. Skąd ta różnica?
Aby wyjaśnić takie zachowanie trzeba zacząć od przyczyny fioletowej barwy pierwiastka, widocznej w stanie gazowym. W stanie stały większe grudki przypominają grafit o niebieskawym odcieniu, dopiero w drobnych, prześwitujących ziarnach lub właśnie oparach, widać dobrze intensywny fiolet.
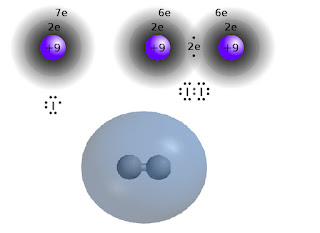
Jod tworzy cząsteczki dwuatomowe, między którymi istnieje wiązanie kowalencyjne. Wiązanie tego typu polega na połączeniu w parę po jednym wolnym elektronie z łączących się pierwiastków i umieszczeniu jej w przestrzeni między atomami. Ta "wiążące para elektronowa" oddziałuje wespół zespół z obydwoma atomami, dlatego jest dla nich "uwspólniona", zaś każdy uzyskuje w ten sposób wrażenie oktetu - najtrwalszej konfiguracji elektronów w otoczeniu. Jednakowoż jeśli opiszemy rzecz metodami mechaniki kwantowej, widzącej elektrony raczej jako rozmyte chmurki aniżeli kulki na orbitach, to rzecz stanie się nieco bardziej zawikłana.
W kwantowym modelu atomu zamiast mknących kulek mamy jak rzekłem chmurkę - a właściwie przestrzeń nazywaną orbitalem. Wiemy że elektron jest w tej przestrzeni, ale z różnym prawdopodobieństwem, co w istocie przekłada się na różne rozłożenie jego ładunku. Wiązanie pomiędzy atomami jodu tworzą zewnętrzne elektrony sigma, których orbitale są kuliste, i przez ich nakładanie się powstaje wspólny orbital molekularny obejmujący całą cząsteczkę z grubsza na kształt piłki do rugby:
Jednak sposobów łączenia się orbitali jest znacznie więcej, każdemu zaś odpowiada nieco inna energia. W tym przypadku najwyższemu rzeczywistemu orbitalowi sigma (HOMO) towarzyszy leżący nad nim najniższy potencjalny orbital (LUMO) nie zapełniony. Poziomy energetyczne tych orbitali leżą na tyle blisko, że stan elektronu może przechodzić z jednej możliwości w drugą, musi jedynie mieć dostarczoną ściśle określoną porcję energii. Na przykład może pochłonąć kwant światła odpowiadający konkretnej barwie.
Jeśli z białego światła, będącego mieszaniną wszystkich kolorów, wyciąć jakiś jeden, to suma reszty będzie widoczna jako kolor przeciwny. W tym przypadku intensywne pochłanianie zieleni, powoduje powstanie koloru fioletowego swobodnych par tego pierwiastka. Nieco inaczej rzecz przedstawia się w roztworach.
Już tu kiedyś pisałem, że w dydaktyce szkolnej opis rozpuszczania przedstawia ten proces tak, jakby zachodził w próżni, w rzeczywistości bowiem rozpuszczalnik zawsze w jakimś stopniu oddziałuje z cząsteczkami rozpuszczanych substancji. Niejednokrotnie cząsteczka zostaje otoczona warstewką silnie przyciągniętych cząsteczek rozpuszczalnika, co nie pozostaje bez wpływu na jej właściwości.
W przypadku Jodu rozpuszczalniki polarne oddziałują na tyle silnie, że tworzą kompleks, przenosząc część ładunku na jod. Poziomy energetyczne orbitali molekularnych rzeczywistego i potencjalnego rozsuwają się, jod zaczyna pochłaniać inną długość fali i zmienia kolor w stronę brunatnej czerwieni. Dlatego w wodzie i acetonie tworzy roztwory o takiej barwie. W rozpuszczalnikach słabiej oddziałujących, jak dichlorometan, jest intensywnie czerwony. W jeszcze słabszych, jak chloroform czy benzen jest różowy, a w najsłabiej oddziałujących jak heksan, tworzy roztwór fioletowy, tak jak w powietrzu. Jest to jeden z najwyraźniejszych przykładów solwatochromizmu.
Tak więc wyjaśniłem już o co chodzi w opisywanej próbie analitycznej. Nie jest ona zbytnio czuła i ma raczej znaczenie historyczne. Jest jednak jeszcze inna próba, bardziej dokładna i nadająca się do wykrywania śladowych ilości - mianowicie reakcja ze skrobią.
Skrobia, jak to już niedawno tłumaczyłem, jest naturalnym polimerem złożonych z połączonych w długie łańcuchy cząsteczek glukozy. Zależnie od typu łańcucha wyróżniamy prostą amylozę i rozgałęzioną amylopektynę - w przypadku tej ostatniej oddziaływania powodują, że łańcuchy te skręcają się w sprężynki.
Jod rozpuszcza się w wodzie bardzo słabo, chyba że obecne będą w niej jony jodkowe - łączy się wówczas w jony trójjodkowe, będące cząsteczkami wydłużonymi. Roztwór taki nazywa się płynem Lugola (natomiast klasyczna jodyna to roztwór w alkoholu). Tak się akurat składa, że rozmiar "sprężynki" amylozy, pasuje do wielkości cząsteczki trójjodkowej, toteż wpasowuje się ona między skręcone zwoje, tworząc dosyć trwały kompleks o intensywnym, granatowym zabarwieniu.
Barwa kompleksu zależy w pewnym stopniu od stężenia jodu - dla bardzo małych, jest granatowy, dla większych staje się brunatny do czerwonego. Barwa jest zauważalna już dla ilości 0,00002 mol/l jodu w roztworze. Tą samą metodą można wykryć jodki - same co prawda nie reagują ze skrobią, ale mogą być przeprowadzone w jod przez utlenienie. Jeśli do badanego roztworu dodamy zawiesinę skrobi i na przykład wodę chlorowa, to część jodków utleni się i powstający kompleks to uwidoczni.
Nie trudno zgadnąć, że skoro możemy skrobią wykryć jod, to i jodem możemy wykryć skrobię - i rzeczywiście, próba jodowa jest używana do sprawdzenia ilości i rozkładu skrobi w roślinach i pożywieniu. Tak można testować na przykład stopień dojrzałości jabłek - młode owoce zawierają głównie skrobię i kwasy owocowe, skąd cierpki smak młodych jabłuszek; w miarę rozwoju skrobia jest zużywana a w jej miejsce pojawia się coraz więcej cukrów, które maskują kwaśny posmak. Po przekrojeniu owocu polewa się powierzchnię płynem Lugola - zależnie od wielkości i rozmieszczenia zabarwienia przypisuje się owocom różną dojrzałość. W ten sposób można też wykryć obecność skrobi (również jej modyfikowanych chemicznie pochodnych, o których pisałem) tam gdzie znaleźć się nie powinna - na przykład przetworach mlecznych co do których producent nie deklaruje dodatków. Opisał to pięknie Stobiński w "Chemii i życiu".
Ale to nie koniec - wiemy że do reakcji potrzebne są na przykład jodki, skrobia i utleniacze, zatem mając te dwa pierwsze, możemy wykryć ten trzeci składnik.
Mogą to być gazy będące silnymi utleniaczami, jak chlor i brom, czy też ozon. Papierek jodoskrobiowy, zawierający jodki i skrobię, po zwilżeniu i przyłożeniu do wylotu próbówki z której jak sądzimy ulatniają się te gazy, pociemnieje. Profesjonalne paski testowe mają często skalę na której można w pewnym zakresie wyznaczać stężenie utleniaczy - w ten sposób sprawdza się na przykład czy ilość chloru w wodzie pitnej i kąpielowej nie przekracza norm.
Mogą to być silne utleniacze w roztworze, na przykład chlorany czy nadtlenek wodoru, tu jednak przy większych ilościach barwa może pojawić się na krótko - wydzielony jod jest dalej utleniony do bezbarwnych jodanów. Mogą to być nawet słabsze utleniacze, jeśli tylko ulegają odpowiedniej reakcji - na przykład azotyny (azotany III), w odróżnieniu od azotanów V. Reakcji z wydzieleniem jodu ulegają też niektóre metale - na przykład kationy miedzi II i żelaza III, będące raczej słabymi utleniaczami - toteż można by zapewne użyć papierków do wykrycia tych metali, ale dla nich znamy inne testy. Tą trójkę powiązaną możliwościami analitycznymi przedstawiłem na grafice:
Tak więc wiemy już jak wykryć jod i co wykryć można za jego pomocą, jest jednak jeszcze jedno zastosowanie jodu w analityce - mianowicie analiza ilościowa za pomocą miareczkowania jodometrycznego.
Cały pomysł polega na prostej zasadzie - pierwiastkowy jod łatwo redukuje się do jodków. Jeśli będziemy miareczkować jego roztwór przy pomocy roztworu reduktora o znanym stężeniu aż do zaniku barwy, to będziemy mogli ze zużytej objętości wyliczyć stężenie analitu, czyli zawartość jodu. Jeśli zaś mamy roztwór substancji reagującej z jodem o nieznanym stężeniu, to możemy dodać do niej znaną ilość jodu tak aby był to nadmiar, i zmiareczkować pozostały jod. wiedząc ile ubyło z pierwotnej ilości dodanego jodu, możemy wyliczyć ile musiało być w roztworze reagującej substancji.
Odwrotny przypadek to sytuacja gdy mamy nieoznaczony roztwór substancji mogącej utlenić jodki do wolnego jodu - dodajemy wówczas znaną ilość jodków i odmiareczkowujemy jod powstały w reakcji.
Jako reduktora zazwyczaj używa się tiosiarczanu sodu, który reaguje szybko wedle reakcji:
I3- + 2 S2O32- → S4O62- + 3 I-
Co zaś można oznaczać? W sposób bezpośredni siarczyny, siarczki, arsen III, glukozę i kwas askorbinowy, w pośredni wolny chlor, chlorany, azotyny, sole miedzi II i żelaza III.Tak się akurat składa, że spośród filmów miareczkowań jakie zrobiłem, najwięcej jest miareczkowań jodometrycznych i jeden z nich niedawno udostępniłem. Wykonałem go podczas praktyk w Siedleckim LOŚP, zaś analizowanym roztworem był wzorzec siarczynów:
Jest to właściwie najistotniejsza minuta miareczkowania. Ilość jodu słabnie a wraz z nią odcień roztworu. Gdy roztwór jest już słomkowy dodaję zawiesinę skrobi - dzięki temu łatwiej będzie mi uchwycić punkt końcowy, gdy zanikają ostatnie tony zabarwienia.
Ot, i tyle.
Subskrybuj:
Posty (Atom)